24 липня, 2021
Оптимізація результатів лікування мієломи даратумумабом
Загальновідомими фактами є те, що кількість пацієнтів з мієломою, яким призначають другу або наступну лінію терапії, неухильно зменшується, і що рівень та тривалість відповіді на лікування з часом також зменшуються. Однак схвалення даратумумабу для лікування мієломи сприяло зміні ситуації. Відповідно до оновлених даних дослідження POLLUX, у якому даратумумаб використовували у поєднанні з леналідомідом і дексаметазоном для лікування рецидивної/рефрактерної мієломи, результати були набагато кращими, ніж можна було очікувати порівняно з результатами другої лінії терапії в клінічній практиці.
Подовження виживаності без відповіді на лікування
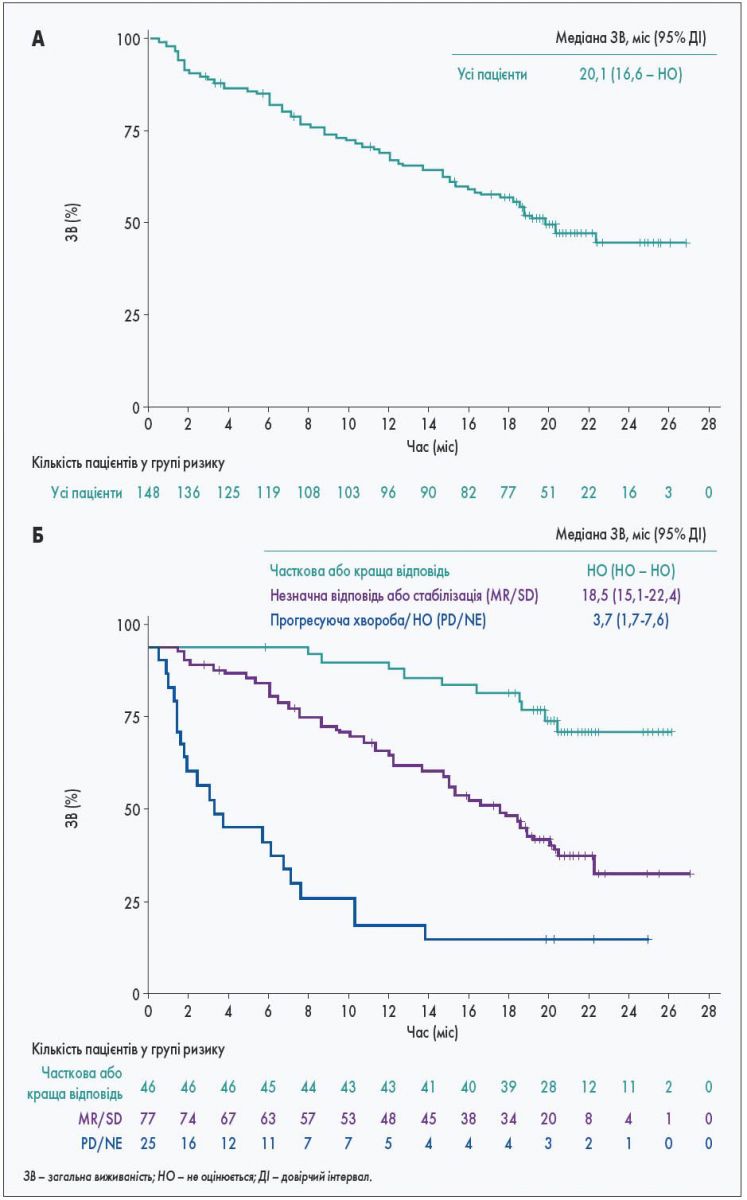
Великий інтерес викликали результати перших клінічних досліджень (GEN501 та SIRIUS), у яких вивчали даратумумаб як монотерапію при рецидивній/рефрактерній мієломі. Рівень відповіді 31% був вражаючим для пацієнтів із поширеною мієломою, і можливість отримати такий ефект за допомогою лікування антитілами стала проривом у терапії мієломи. Медіана загальної виживаності 20,1 міс була більш ніж удвічі більшою за 9 міс, що можна було очікувати на той час для пацієнтів із рецидивом після лікування бортезомібом та імуномодулюючим препаратом.
Можливо, ще більший інтерес викликала інформація, що у пацієнтів, у яких не досягнута відповідь на лікування згідно з критеріями Міжнародної робочої групи з мієломи (International Myeloma Working Group; 52% від загальної кількості досліджуваних), істотно подовжилася загальна виживаність (медіана 18,5 міс). Щоб зрозуміти цей висновок, слід взяти до уваги багато важливих механізмів дії, які приписували даратумумабу. Імуноопосередковане знищення клітин мієломи шляхом комплементзалежної цитотоксичності (Complement Dependent Cytotoxicity, CDC), антитілозалежної клітинної цитотоксичності (Antibody Dependent Cellular Cytotoxicity, ADCC) та антитілозалежного клітинного фагоцитозу (Antibody Dependent Cellular Phagocytosis, ADCP), можливо, призведе до зменшення маркерів активної мієломи і, таким чином, вимірюваної відповіді. Крім того, застосування даратумумабу може сприяти перепрограмуванню імунної системи пацієнта й модулювати мікросередовище кісткового мозку таким чином, що прогресування мієломи затримається, а виживаність подовжиться навіть без значного знищення клітин мієломи. Було продемонстровано кілька способів дії даратумумабу, включаючи інгібування вироблення імунодепресивного аденозину, пригнічення адгезії клітин мієломи до строми кісткового мозку, інгібування утворення нанотрубок, які переносять мітохондрії з клітин строми в мієломні клітини та активізують їх, пряму стимуляцію Т-клітинної опосередкованої цитотоксичності, пригнічення експресії імунодепресивного PD-L1 шляхом антигенпрезентаційних клітин та елімінація регуляторних клітин системи Т-, В- та моноцитів/макрофагів, що інгібують цитотоксичні Т-клітини.
Концепція високої експресії CD38
Ретельний аналіз результатів перших клінічних досліджень монотерапії даратумумабом з приводу рецидивної/рефрактерної мієломи показав, що пацієнти з високою експресією CD38 клітинами мієломи мають більше шансів досягти позитивної відповіді на лікування. Це спостереження сприяло припущенню, що висока експресія CD38 корисна для відповіді на лікування даратумумабом. Хоча автори оригінальної публікації зазначали, що отримання тривалого контролю захворювання за допомогою даратумумабу може відрізнятися за вимогами від швидкої початкової реакції, яка, швидше за все, залежить від знищення клітин мієломи механізмами CDC, ADCC та ADCP. У результаті було запропоновано кілька стратегій збільшення експресії CD38 клітинами мієломи у пацієнтів із прогресуванням захворювання на тлі терапії даратумумабом, таких як фармакологічне втручання з ATRA чи панобіностатом або переривання терапії для забезпечення спонтанного відновлення експресії CD38 з очікуваним покращенням відповіді на лікування даратумумабом. Насправді висока експресія CD38 не корелювала з виживаністю (виживаністю без прогресування та загальною виживаністю), лише з відповіддю на лікування у дослідженні монотерапії даратумумабом.
Терапія даратумумабом: повторне лікування чи безперервна терапія?
Імовірним поясненням успішного лікування мієломи даратумумабом може бути те, що CD38 є фактором росту та виживання клітин мієломи, і що зменшення експресії CD38 та підтримка її низького рівня в будь-який час може інгібувати проліферацію та виживання клітин мієломи. Однак це дискусійне питання, все ще існують прихильники підходу повторного лікування після відновлення експресії CD38 клітинами мієломи під час перерви у лікуванні, на відміну від постійної терапії даратумумабом протягом декількох ліній терапії. Клінічних досліджень, які можуть покласти край цій дискусії, все ще не достатньо, хоча було розпочато дослідження, присвячене повторному лікуванню даратумумабом (NCT03871829), а також дослідження поєднаної терапії з ATRA з метою збільшення експресії CD38 клітинами мієломи і таким чином підвищення їх чутливості до деяких механізмів дії даратумумабу (CDC, ADCC, ADCP; NCT02751255).
Слабкість як клінічна проблема
З роками все більше уваги було спрямовано на важливість фактора слабкості з огляду на ефективність терапії мієломи. У багатьох пацієнтів мієломна хвороба діагностується у старшому віці, в той момент життя, коли старіння та супутні захворювання можуть створювати значні труднощі для лікування мієломи. Однак даратумумаб характеризується низькою токсичністю, особливо при використанні в комбінації з іншими протимієломними препаратами.
Лікування мієломи як двоетапний процес
Лікування мієломи може розглядатися як двоступеневий процес із початковим знищенням клітин мієломи з подальшою зміною мікросередовища кісткового мозку та перепрограмуванням імунної системи пацієнта, що дозволяє проводити імуноопосередкований контроль мієломи. Даратумумаб може як вбивати клітини мієломи за допомогою CDC, ADCC та ADCP, так і перепрограмувати імунну систему пацієнта і змінювати мікросередовище кісткового мозку. Таким чином даратумумаб може сприяти обом важливим складовим успішного лікування мієломи.
Найважливішими способами дії, за допомогою яких даратумумаб сприяє початковому знищенню клітин мієломи, можуть бути CDC, ADCC та ADCP. Під час подальшого лікування даратумумабом усуваються регуляторні клітини Т-, В- та мієлоїдного фенотипу, відбувається пряма стимуляція цитотоксичних Т-клітин, інгібування утворення імунодепресивного аденозину, пригнічення утворення нанотрубок із супутнім перенесенням мітохондрій зі стромальних клітин у клітини мієломи, інгібування адгезії клітин мієломи до стромальних клітин і пригнічення регуляції PD-L1, індуковане хіміотерапією на антигенпрезентаційних клітинах. Плейотропні способи дії, які реалізує даратумумаб, ускладнюють розуміння того, що пацієнти можуть стати справді рефрактерними до всіх механізмів впливу даратумумабу. У більшості випадків даратумумаб не можна розглядати як препарат для монотерапії, його ефективність значною мірою залежить від одночасного застосування відповідних симультанних препаратів.
Рис. Загальна виживаність хворих на мієлому, які отримували монотерапію даратумумабом: A – усі пацієнти; Б – пацієнти, стратифіковані за реакцією як респонденти (часткова або краща відповідь; незначна відповідь або стабілізація (MR/SD) чи прогресуюча хвороба/не оцінюється (PD/NE))x
За матеріалами Plesner T. Optimizing the Outcome of Anti-Myeloma Treatment with Daratumumab. J. Clin. Med. 2021; 10: 1002. https://doi.org/10.3390/jcm10051002.
Переклав з англ. Назар Лукавецький
CP-237394
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 3 (70) 2021 р