30 жовтня, 2021
Леналідомід і помалідомід у лікуванні пацієнтів з множинною мієломою
 Множинна мієлома (ММ) – B-клітинна злоякісна пухлина, морфологічним субстратом якої є плазматичні клітини, що продукують моноклональний імуноглобулін. ММ є другим за поширеністю гематологічним злоякісним новоутворенням у Європі, де вона зустрічається із частотою 4,5-6,0
Множинна мієлома (ММ) – B-клітинна злоякісна пухлина, морфологічним субстратом якої є плазматичні клітини, що продукують моноклональний імуноглобулін. ММ є другим за поширеністю гематологічним злоякісним новоутворенням у Європі, де вона зустрічається із частотою 4,5-6,0
Якщо раніше лікування пацієнтів з ММ обмежувалося трансплантацією гемопоетичних стовбурових клітин (ТГСК), застосуванням алкілувальних агентів і кортикостероїдів, то сучасна стратегія лікування ММ доповнилася новими лікарськими засобами, які істотно покращили виживаність таких хворих.
Про роль леналідоміду та помалідоміду у лікуванні ММ у рамках вебінару розповів міжнародний експерт, професор Ягеллонського університету (м. Краків, Польща) Артур Юрчишин.
– Основною метою лікування ММ є досягнення якомога глибшої відповіді, що дозволить подовжити життя пацієнтів (P. Kapoor et al., 2013). Ретроспективний аналіз даних 1175 хворих продемонстрував, що повна відповідь (ПВ) корелює з тривалою виживаністю без прогресування (ВБП) та загальною виживаністю (ЗВ) у пацієнтів із вперше виявленою ММ незалежно від віку. Так, при медіані спостереження 29 міс трирічна ВБП та ЗВ становили 67 і 27% (відносний ризик – ВР – 0,16; р <0,001) у пацієнтів, у яких було досягнуто ПВ, та 91 і 70% (ВР 0,15; р <0,001) у тих, хто досяг дуже хорошої часткової відповіді (ЧВ; F. Gay et al., 2011).
Вагомий вплив на результати лікування ММ має відсутність мінімальної залишкової хвороби (МЗХ). Так, доведено, що повна ремісія при ММ за відсутності досягнення МЗХ-негативного статусу не сприяє подовженню ВБП та ЗВ порівняно з майже повною або частковою відповіддю (медіана ВБП склала 27; 27 та 29 міс, а медіана ЗВ – 59; 64 та 65 міс відповідно). Натомість МЗХ-негативний статус асоціюється із тривалою ВБП (медіана ВБП склала 63 міс; р <0,001) та ЗВ (медіана ЗВ не досягнута; р <0,001) у всіх підгрупах, незалежно від виду лікування та групи ризику пацієнта (J. Lahuerta et al., 2017).
Імуномодулювальні препарати сьогодні є основою лікування хворих із ММ і застосовуються при вперше встановленому діагнозі ММ як підтримуюча терапія після аутологічної ТГСК та при рефрактерній/рецидивуючій ММ (ррММ).
Леналідомід у першій лінії терапії
Обов’язковою опцією лікування хворих молодого віку із вперше діагностованою ММ є підтримуюча терапія після аутологічної ТГСК, а у старших хворих – тривала терапія. Тривала безперервна терапія ММ забезпечує більш обнадійливі результати виживаності хворих, ніж фіксована схема лікування. Зокрема, в об’єднаному аналізі трьох великих рандомізованих досліджень ІІІ фази, які включали осіб із вперше діагностованою ММ, вища ВБП та ЗВ були зафіксовані у групі хворих, які отримували пролонговане лікування, ніж у пацієнтів, що перебували на терапії з фіксованою тривалістю. Так, медіана ВБП склала 32 проти 16 міс (ВР 0,47; p <0,001), медіана часу до наступного прогресування (ВБП2) – 55 проти 40 міс (ВР 0,61; p=0,001), а 4-річна ЗВ – 69 проти 60% відповідно (ВР 0,69; p=0,003; A. Palumbo et al., 2015).
Стандартами терапії хворих на ММ, які не є кандидатами на ТГСК, є схеми бортезоміб/мелфалан/преднізон (VMP; J.F. San Miguel et al., 2013) та леналідомід у поєднанні з низькими дозами дексаметазону (Rd; L. Benboubker et al., 2014). Ефективність леналідоміду у пацієнтів, які не є кандидатами на проведення ТГСК, була продемонстрована у дослідженні FIRST. Так, у його учасників, які тривалий час отримували терапію за схемою Rd, ЗВ була істотно більшою порівняно хворими, що лікувалися за аналогічною схемою з обмеженою тривалістю – 18 міс (Rd18) чи схемою MPT (мелфалан/преднізолон/талідомід): 4-річна ЗВ становила 59% у групі Rd, 56% – Rd18, 51% – МРТ (ВР 0,78; 95% ДІ 0,67-0,92; p=0,0023; L. Benboubker et al., 2014). У 2018 р. отримані оновлені дані дослідження FIRST, згідно з якими пролонгована терапія за схемою Rd знижувала ризик прогресування ММ на 31% та ризик смерті на 22% порівняно зі схемою MPT. Так, 4-річна ВБП становила 32,6% у групі Rd, 14,3% у групі Rd18 та 13,6% у групі МРТ, а 4-річна ЗВ – 59,0; 58,0 та 51,7% відповідно (T. Facon et al., 2018).
Пролонгована терапія за схемою Rd знижувала ризик прогресування та смерті порівняно зі схемою MPT на 36% у пацієнтів віком ≤75 років (ВР 0,64; 95% ДІ 0,53-0,77; р <0,001) та на 20% – в осіб віком ≥75 років (ВР 0,80; 95% ДІ 0,62-1,03; р=0,084; C. Hulin et al., 2017). При підгруповому аналізі за цитогенетичними параметрами пролонгована терапія за схемою Rd виявилась найефективнішою для пацієнтів групи невисокого ризику та знижувала ризик смерті на 34% порівняно зі схемою МРТ (H. Avet-Loiseau et al., 2015).
Серед хворих, які перебували на пролонгованій терапії Rd, лише 37% осіб віком ≤75 років та 44% – віком ≥75 років потребували зниження дози препарату внаслідок розвитку побічних проявів. Найчастішими гематологічними побічними проявами 3-4 ступеня були нейтропенія й анемія. Частота нейтропенії 3-4 ступеня була вищою у пацієнтів, які отримували терапію за схемою МРТ, ніж Rd та Rd18, незалежно від віку. Серед негематологічних побічних проявів 3-4 ступеня, що виникали при прийомі леналідоміду в обох групах (Rd та Rd18), найчастіше реєстрували інфекції незалежно від віку (C. Hulin et al., 2017).
Метааналіз 5 рандомізованих клінічних досліджень підтвердив вищу ефективність пролонгованої терапії Rd порівняно зі схемами бортезоміб/мелфалан/преднізон, мелфалан/преднізолон (MP) та MPT, про що свідчив нижчий ризик прогресування або смерті та вища ЗВ (K. Weisel et al., 2017).
Які фактори впливають на вибір першої лінії лікування при ММ?
Схема Rd є опцією вибору у випадках, коли перевага надається пероральному застосуванню лікарських засобів та у першій лінії терапії для пацієнтів, які не є кандидатами на аутологічну ТГСК. Схеми, що містять бортезоміб, залишаються основними в лікуванні пацієнтів з мієломною нефропатією. Схема VMP може мати перевагу у разі необхідності досягнення тривалішого інтервалу без лікування, проте пролонгована терапія Rd сприяє подовженню часу до наступної лінії терапії порівняно із схемою VMP: медіана часу до наступної лінії терапії склала 36,7 міс (T. Facon et al., 2018) проти 30,7 міс (J.F. San Miguel et al., 2013). VMP є схемою вибору для пацієнтів групи високого цитогенетичного ризику (P. Sonneveld et al., 2016).
Підтримуюча терапія з використанням леналідоміду
Метааналіз результатів 3 досліджень III фази продемонстрував, що при застосуванні леналідоміду для підтримуючої терапії після аутологічної ТГСК спостерігалося зниження ризику смерті на 26% та подовження медіани ЗВ на 2,5 року. Семирічна ЗВ становила 50% у контрольній групі та 62% у групі хворих, які отримували підтримуючу терапію леналідомідом. Медіана ЗВ склала 86 міс у контрольній групі та не була досягнута у групі леналідоміду (ВР 0,74; 95% ДІ 0,62-0,89; p=0,001; McCarthy et al., 2017).
Леналідомід у лікуванні ррММ
Ефективність і безпеку застосування леналідоміду в комбінації з дексаметазоном (Len + Dex) та монотерапії дексаметазоном у пацієнтів з ррММ порівнювали у двох багатоцентрових рандомізованих плацебо-контрольованих дослідженнях III фази – MM‑009 та ММ‑010. До дослідження залучали пацієнтів з ррММ, які попередньо отримали не більше трьох схем хіміотерапії. Леналідомід призначали у дозі 25 мг/добу в 1-21-й дні 28-денного циклу. Додатково в обох групах призначали високі дози дексаметазону (40 мг/добу) в 1-4-й, 9-12-й та 17-20-й дні кожного циклу. Після чотирьох циклів лікування продовжували до прогресування захворювання, але дозу дексаметазону знижували до 40 мг/добу в 1-4-й дні кожного 28-денного циклу. Частота об’єктивної відповіді у групах Len + Dex склала 61,0 (MM‑009) та 60,2% (ММ‑010) проти 19,9% (MM‑009) і 24,0% (MM‑010) при монотерапії дексаметазоном (p <0,001). При аналізі виживаності у дослідженнях MM‑009 і ММ‑010 було виявлено, що час до прогресування був достовірно більшим у групах пацієнтів, котрі отримували лікування за схемою Len + Dex, ніж у групах хворих, які приймали дексаметазон і плацебо (медіана склала 13,4 проти 4,6 міс;
Кращі результати було отримано у пацієнтів, яким леналідомід призначали після першого рецидиву ММ, порівняно з тими, хто отримував дві або більше лінії протипухлинного лікування. Так, медіана часу до прогресування склала 17,1 міс у групі хворих, які отримували леналідомід при першому рецидиві, проти 10,6 міс для пацієнтів, котрим препарат призначали після наступних рецидивів ММ (р=0,026), а медіана ЗВ – 42,0 проти 35,8 міс відповідно (р=0,041). У групі пацієнтів, які отримували леналідомід при першому рецидиві, частота об’єктивної відповіді (ОВ) склала 66,9 проти 56,8% у групі хворих, які отримували препарат у наступних лініях лікування (р=0,06). При цьому ПВ та дуже хороша ЧВ були також значно вищими при першому рецидиві (20,3 та 19,5% проти 11,8 та 15,9% відповідно; р=0,025; E.A. Stadtmauer et al., 2009).
Таким чином, комбінація Len + Dex найбільш ефективна при її ранньому призначенні (одна попередня лінія лікування) та може застосовуватись незалежно від виду попереднього лікування (аутологічна ТГСК, бортезоміб чи талідомід) із дещо нижчою ефективністю у пацієнтів, рефрактерних до талідоміду (M.A. Dimopoulos et al., 2011; E.A. Stadtmauer et al., 2009; M. Wang et al., 2008).
У ретроспективному аналізі даних досліджень MM‑009 та ММ‑010 було з’ясовано, що 50,5% пацієнтів, у яких первинно досягнуто ЧВ, при подальшому лікуванні леналідомідом демонстрували ПВ або дуже хорошу ЧВ. При тривалому спостереженні впродовж 48 міс більші медіана тривалості відповіді, час до прогресування та ЗВ були отримані у пацієнтів з ПВ або дуже хорошою ЧВ, ніж у пацієнтів із ЧВ (24,0 проти 8,3 міс; р <0,001; 27,7 проти 12,0 міс; р<0,001; не досягнуто проти 44,2 міс; р=0,021 відповідно), незалежно від часу, коли ПВ або дуже хороша ЧВ були досягнуті (J.L. Harousseau et al., 2010).
Отже, у пацієнтів, які відповіли на терапію Len + Dex, лікування у найкращій переносимій дозі кожного засобу слід продовжувати до прогресування захворювання; такий підхід може застосовуватися і до пацієнтів зі стабілізацією захворювання, коли немає інших варіантів лікування (M.A. Dimopoulos et al., 2011).
У пацієнтів, які продовжували терапію Len + Dex, спостерігалася тенденція до тривалішої медіани ЗВ (50,9 проти 35,0 міс; р=0,0594) незалежно від кількості попередніх ліній лікування, рівня
Як відомо, леналідомід виводиться нирками, тому його ефективність прямо залежить від їх функції. Аналіз ефективності досліджуваних режимів лікування в пацієнтів із нирковою недостатністю показав, що статистичних відмінностей у досягненні ОВ між хворими з різними стадіями ниркової недостатності не було. У пацієнтів із нирковою недостатністю частіше виникала тромбоцитопенія, що потребувала зниження дози чи тимчасової відміни препарату, а ЗВ була нижчою порівняно з такою в осіб із нормальною чи незначно зниженою швидкістю клубочкової фільтрації (р=0,006). У 72% пацієнтів функція нирок на фоні прийому леналідоміду покращувалась (M.A. Dimopoulos et al., 2010).
При призначенні леналідоміду необхідно пам’ятати про вплив цитогенетичних порушень на результати лікування. Дослідження MM016 включало 159 пацієнтів із ррММ, з них у 54 було виявлено del(13q), у 28 – t(4;14) та у 12 – del(17p13). Всі хворі отримували лікування комбінацією Len + Dex. ОВ була досягнута у 83,1% пацієнтів, при цьому у 13,1% отримали майже ПВ чи ПВ. ОВ була нижчою у пацієнтів з аномаліями del(13q) та del(17p13), проте не з аномалією t(4;14) (частота ОВ склала 77,8; 58,3 та 78,5% відповідно). Час до прогресування захворювання та ЗВ у пацієнтів з аномаліями del(13q) та t(4;14) був зіставним із таким у пацієнтів без вказаних аномалій. Проте у пацієнтів з аномалією del(17p13) спостерігали зменшення часу до прогресування й ЗВ до 2,2 та 4,7 міс відповідно. Окрім цього, прогресування швидше відбувалося у хворих, які попередньо отримували терапію із включенням талідоміду.
Яку схему лікування обрати при другому та наступних рецидивах?
Широке використання леналідоміду зумовлює розвиток рефрактерності до цього лікарського засобу у частини пацієнтів з ММ. Одним з ефективних препаратів для терапії ррММ є помалідомід. Ефективність помалідоміду підтверджена результатами багатоцентрового рандомізованого дослідження STRATUS, у яке було включено 682 пацієнти з ррММ, у 80,2% з них виявляли подвійну рефрактерність – до леналідоміду і бортезомібу. Отримані дані продемонстрували клінічно значущі переваги режиму. Так, при медіані спостереження 16,8 міс медіана ВБП і ЗВ у пацієнтів досягли 4,6 та 11,9 міс відповідно, частота ОВ – 32,6%, а тривалість відповіді – 7,4 міс.
У 2019 р. були опубліковані результати великого рандомізованого дослідження III фази OPTIMISMM, у якому порівнювали ефективність двох схем терапії у 559 пацієнтів з ррММ, котрі раніше отримували щонайменше 2 курси терапії леналідомідом: схема 1 (n=281) – потрійна терапія (помалідомід/бортезоміб/дексаметазон – PVd), схема 2 (n=278) – терапія без помалідоміду (бортезоміб/дексаметазон – Vd). Усього було передбачено проведення 21 циклу терапії. 70% пацієнтів були рефрактерними до леналідоміду. Первинною кінцевою точкою дослідження була ВБП. Медіана тривалості терапії становила 8,8 міс у групі PVd та 4,9 міс у групі Vd. Лікування за схемою PVd сприяло зниженню ризику прогресування хвороби та смерті на 39% порівняно з Vd. У групі PVd медіана ВБП була значно більшою, ніж у групі Vd: 11,2 (95% ДІ 9,66-13,73) та 7,1 міс (95% ДІ 5,88-8,48) відповідно (рис. 1).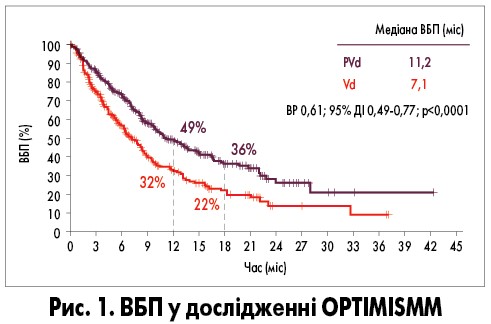
Медіана ВБП у пацієнтів, котрі отримали 1 попередню лінію терапії, становила 20,73 міс у групі PVd та 11,63 міс – Vd. Ризик прогресування хвороби або смерті при застосуванні схеми PVd був на 46% нижчим порівняно з Vd. Пацієнти, котрі отримували PVd, також мали значно вищу ОВ (82,2% при лікуванні PVd та 50,0% – Vd; рис. 2).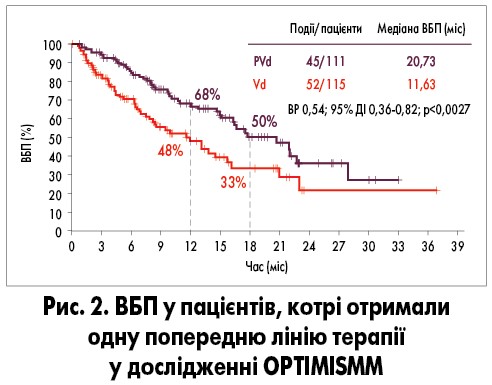
Найпоширенішими гематологічними побічними явищами 3-4 ступеня на тлі лікування помалідомідом та без нього були нейтропенія (42 проти 9%) і тромбоцитопенія (27 проти 29%). Безпека помалідоміду залишалася керованою відповідно до профілю токсичності (P.G. Richardson et al., 2019).
Таким чином, доведено ефективність схеми Rd у лікуванні пацієнтів із вперше виявленою ММ, які не є кандидатами на ТГСК. У цьому аспекті найкращих результатів вдається досягти завдяки пролонгованому лікуванню за схемою Rd. Перевагу схеми Rd було продемонстровано у пацієнтів різних вікових груп і хворих із легкою та помірною нирковою недостатністю. Підтримуюча терапія леналідомідом показана усім пацієнтам після аутологічної ТГСК. Одним із рекомендованих варіантів лікування ррММ є схема Len + Dex, ефективність якої є найвищою у разі її призначення після першого рецидиву. Тривала терапія ММ забезпечує більш обнадійливі результати виживаності хворих порівняно з фіксованою схемою лікування, а керований профіль токсичності леналідоміду – тривалу гематологічну відповідь при хорошій переносимості препарату. Помалідомід – це ефективний базовий компонент терапії порятунку пацієнтів з рефрактерною до леналідоміду ММ, який у комбінації з дексаметазоном і бортезомібом дозволяє досягти хорошої та стійкої відповіді.
Підготувала Ольга Нестеровська
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 4 (71) 2021 р.



