22 грудня, 2021
Льодяники для горла з фіксованою комбінацією цетилпіридинію хлориду і бензидаміну гідрохлориду чинять пряму віруліцидну дію на SARS-CoV-2
Інфекції респіраторного тракту (ІРТ) є найбільш поширеними захворюваннями і мають типові симптоми, такі як риніт, кашель, підвищена температура і біль у горлі. Найбільш частими збудниками запалення в порожнині рота і горла є віруси. Бактеріальні ІРТ зустрічаються рідше і часто розвиваються після вірусної інфекції. Найбільш поширеними вірусами, що викликають розвиток ІРТ, є пікорнавіруси (риновіруси людини, HRV), коронавіруси (загальний коронавірус людини (hCoV) OC43, 229E, NL63, HKU1), орто- і параміксовіруси (віруси грипу, парагрипу (PIV1-4) і респіраторно-синцитіальний вірус), респіраторні аденовіруси тощо [1].
Багато патогенних вірусів вкриті подвійним ліпідним шаром та інфікують клітини-мішені, індукуючи злиття вірусної оболонки з клітинною мембраною. Багато класів вірусів, які мають оболонку, є патогенами для людини, включаючи респіраторні віруси, такі як вірус грипу (4 роди в сімействі Orthomyxovirus: грип A, B, C і D), респіраторно-синцитіальний вірус (RSV, сімейство Pneumoviridae), коронавіруси (сімейство Coronaviridae) та інші [2].
Коронавіруси людини є поширеними циркулюючими вірусами і вважаються другими за поширеністю збудниками, відповідальними за 10-15% усіх випадків інфекцій верхніх дихальних шляхів (ІВДХ) у людей [3]. Вони розмножуються в носоглотці і в основному викликають легкі ІВДХ, що проходять без лікування, з коротким інкубаційним періодом, хоча іноді розвиваються також респіраторні інфекції нижніх відділів дихальних шляхів і пневмонія [4].
Після виникнення більш вірулентних коронавірусів, таких як тяжкий гострий респіраторний синдром (ТГРС)-(SARS)-CoV-1 у 2002 р. і близькосхідний респіраторний синдром (БСРС)-(MERS)-CoV у 2012 р., було встановлено, що коронавіруси також можуть викликати тяжкі пневмонії з більш тривалим періодом інкубації і часто з летальним результатом [5]. Наприкінці 2019 р. поява COVID-19, викликаної новим коронавірусом SARS-CoV-2, призвела до глобальної пандемії, у результаті якої було інфіковано понад 144 млн людей, померло понад 3 млн людей в усьому світі [6]. Симптоми COVID-19 можуть бути зовсім відсутні, а можуть бути такі прояви: підвищення температури, кашель, утруднене дихання. Крім того, захворювання може викликати серйозні розлади здоров’я і призвести до смерті [7, 8].
Респіраторні віруси в основному передаються повітряно-крапельним шляхом під час видиху у вигляді дрібних крапель, але було доведено, що інфекція розповсюджується непрямим контактом із контамінованими вірусом поверхнями. Зниження вірусного навантаження у вогнищі інфекції знижує ризик передачі обома способами й одночасно зменшує симптоми у пацієнтів і потенційне поширення інфекції на нижні дихальні шляхи [1].
Цетилпіридинію хлорид (ЦПХ), четвертинна амонієва сполука (ЧАС), є антисептиком, дія і застосування якого є типовим для катіонних поверхнево-активних речовин (сурфактантів). Крім емульгуючих і миючих властивостей, четвертинні амонієві сполуки мають також бактерицидну дію відносно грампозитивних бактерій, і у високих концентраціях також відносно деяких грамнегативних бактерій. Вони також володіють змінною протигрибковою дією й ефективні проти деяких вірусів [9, 10]. Повідомлення щодо їх віруліцидної активності відсутні, проте в літературі про дезінфекцію поверхонь є деякі дані про їхню дію на віруси з оболонкою [11]. Було показано, що ЦПХ активний відносно вірусів грипу як in vitro, так і in vivo, за допомогою прямого впливу на вірусну оболонку з EC50 in vitro 5-20 мкг/мл [12]. ЦПХ зазвичай використовується в лікарських ополіскувачах для порожнини рота, льодяниках для лікування горла і спреях.
У цьому дослідженні вивчалася віруліцидна активність ЦПХ in vitro у вигляді вільної активної речовини, комбінації бензидаміну гідрохлориду (БГ) і ЦПХ у вигляді вільної активної речовини і комбінації БГ і ЦПХ у вигляді льодяників для лікування горла.
За нашими даними, це перше дослідження, в якому вивчається віруліцидний ефект льодяників, що містять фіксовану комбінацію БГ і ЦПХ, на вірус SARS-CoV-2.
Матеріали та методи
Підготовка клітин
Семиденні клітини Vero E6 (засів 13-16) були трипсинізовані і ресуспендовані в мінімальному необхідному середовищі Dulbecco (DMEM) (Thermo Fisher Scientific, Waltham, MA), із додаванням 10% фетальної бичачої сироватки (ФБС) (Sigma-Aldrich, St. Louis, MO), щоб отримати кінцеву концентрацію 1×105 клітин/мл. У кожну ямку 96-ямкового планшета для культивування клітин переносять всього 100 мкл приготованої клітинної суспензії та інкубують протягом ночі за температури 37 °C і 5% CO2 для досягнення 80% злиття клітин, необхідного для кількісних тестів суспензії.
Виділення і кількісний аналіз вірусу
SARS-CoV-2 був виділений з мазка з горла пацієнта із діагнозом COVID-19, у клітинах Vero E6, культивований із DMEM і доповнений 10% ФБС. Вірус був пасерований 5 разів на Vero E6, розділений на аліквоти і збережений за температури -80 °C до подальшого використання.
Концентрація вірусу була визначена за допомогою аналізу кінцевого розведення і виражена як доза, інфікуюча 50% клітин культури тканини/мл (TCID50/мл), розрахована за методом Спірмена і Кербера. Вихідна концентрація, використана в усіх випробуваннях, становила 1,17×109 TCID50/мл.
Приготування реагентів
Усі випробовувані препарати були надані компанією «КРКА, д.д., Ново Мєсто» (Словенія), використані реагенти були приготовані в Інституті мікробіології та імунології (Любляна, Словенія). Інтерферуючу речовину було отримано шляхом розчинення 3 г бичачого альбуміну в 97 мл води. 97 мл приготованого і відфільтрованого розчину бичачого альбуміну потім змішували з 3 мл баранячих еритроцитів (BioSap SEA, BioGnost), щоб отримати остаточну форму інтерферуючої речовини, що використовується в наших експериментах. Жорстка вода була підготовлена в асептичних умовах у день проведення випробування відповідно до SIST EN 14476:2013 + A2:2019 «Хімічні дезінфікуючі та антисептичні засоби – Кількісний тест суспензії для оцінки віруліцидної активності в медичній галузі» (стандарт) і була використана протягом 12 годин [13].
Для кожної активної субстанції були приготовані 3 різні концентрації шляхом розчинення випробуваної субстанції в 4 мл (висока концентрація), 20 мл (середня концентрація) або 30 мл (низька концентрація) жорсткої води. Весь склад активної субстанції та експериментальні умови представлені в таблиці 1.
Кількісний тест суспензії для оцінки віруліцидної активності
Щоб імітувати фізико-хімічні властивості ротової порожнини людини, враховувалися кілька чинників, таких як температура, склад слини (інтерферуюча речовина) і кількість слини, що утворюється при розчиненні льодяників, динаміка розчинення льодяників (різний час контакту вірусу з речовиною). Методика експерименту відповідала стандартним вимогам. Активну речовину спочатку розчиняли у жорсткій воді, потім додавали до суспензії вірусу SARS-CoV-2 й інтерферуючої речовини у співвідношенні 1:10. Суміш витримували за температури 37 °C протягом різних періодів інкубації (1 хв, 5 хв, 15 хв). Наприкінці кожного часу експозиції аліквоту інкубованої суспензії розбавляли в крижаному підтримуючому середовищі DMEM з 2% ФБС для негайного пригнічення віруліцидної дії використовуваної активної субстанції.
Приготовані розведення (від 1:10 до 1:108) вихідної суспензії вірусу були перенесені на моношар клітин Vero E6 у 96-ямкових мікротитрувальних планшетах та інкубували протягом 7 днів при 37 °C і 5% CO2. Після інкубації планшети перевіряли на цитопатогенний ефект (ЦПЕ) і обчислювали вірусні титри методом Спірмена і Кербера [14].
Тест на титрування вірусу для кожної використовуваної аліквоти SARS-CoV-2 проводився відразу після відтаювання і ще через 15 хв, щоб оцінити вплив відтаювання на концентрацію вірусу і визначити точні робочі концентрації вірусу для кожного експерименту.
Контрольні експерименти
Крім експериментів для оцінки віруліцидної дії активної речовини на SARS-CoV-2, проводилися також контрольні експерименти відповідно до стандарту.
Кожен експеримент включав необроблені клітини, які служили як негативний контроль та надавали інформацію про життєздатність клітин протягом усього періоду інкубації.
Вивчення життєздатності вірусу проводилося для кожного кількісного тесту суспензії, для того щоб вивчити стабільність вірусу в підтримувальному середовищі й оцінити інфікуючу здатність вірусу в експериментальних умовах протягом усього часу контакту. Суміш 0,1 мл вірусної суспензії, 0,1 мл інтерферуючої речовини і 0,8 мл жорсткої води інкубували за температури 37 °C протягом 15 хв. Зразок об’ємом 0,1 мл був відібраний на початку і через 15 хв інкубації. Десятикратні серійні розведення були приготовані у мінімальному есенціальному середовищі Голка, модифікованому способом DMEM із додаванням 1% ФБС (фетальної бичачої сироватки), і по 100 мкл приготованих серійних розведень було додано в кожну ямку у восьми повторностях.
Щоб уникнути хибнопозитивних результатів через морфологічні зміни, викликані цитотоксичною дією активної речовини на клітини Vero E6 в експериментальних умовах, була визначена найбільш висока концентрація випробуваної субстанції, яка не викликає видимих морфологічних змін у клітинах. Десятикратні розведення випробуваної субстанції були приготовані в підтримувальному середовищі, потім 100 мкл кожного розведення були перенесені в моношар клітини у восьми повторностях. Клітини інкубували протягом 48 год і перевіряли на будь-які морфологічні зміни.
Одночасно визначали інгібуючий ефект крижаного середовища на віруліцидну активність випробуваного препарату. Була приготована суспензія з 0,1 мл інтерферуючої речовини, 0,1 мл підтримувального середовища і 0,8 мл випробовуваного препарату. Потім 0,1 мл приготованої суміші було перенесено в 0,8 мл крижаного підтримувального середовища і розміщено на 4 °C. Далі 0,1 мл вірусної суспензії було додано до крижаної суспензії й інкубовано на льоду протягом 15 хв. Після інкубації були приготовані серійні розведення і перенесені на культури клітин у восьми повторностях.
Щоб визначити вплив максимальної нецитотоксичної концентрації активної речовини на чутливість клітини до вірусу, приготували десятикратні розведення випробовуваної субстанції в підтримувальному середовищі, видалили живильне середовище і додали 100 мкл приготованого розчину активної речовини на моношарах клітин у восьми повторностях. Після 1 год інкубації при 37 °C і 5% CO2 видаляли супернатанти, промивали клітини підтримувальним середовищем та інокулювали з приготованими десятикратними серійними розведеннями SARS-CoV-2.
Усі контрольні експерименти проводилися одночасно й у тих же умовах, що і кількісні випробовування суспензії.
Електронна мікроскопія
За допомогою електронної мікроскопії додатково оцінювали вплив ЦПХ у вигляді вільної активної речовини і комбінації БГ/ЦПХ у вигляді льодяників на морфологію вірусу. Частки вірусу були візуалізовані під трансмісійним електронним мікроскопом після контакту з ЦПХ і БГ/ЦПХ льодяниками у висококонцентрованих суспензіях. Приготували 800 мкл суспензії випробовуваного препарату (або підтримувального середовища для негативного контролю) і додавали 100 мкл інтерферуючої речовини та 100 мкл суспензії вірусу. Після 15 хв впливу при 37 °C приготували зразки для електронної мікроскопії. Сітки для електронної мікроскопії (мідні сітки з 400 ланками, вкриті формваром і на вуглецевій основі) були приготовані за допомогою ультрацентрифугування в системі Airfuge. Підготовлені сітки з концентрованими вірусними частками негативно контрастували з 2% фосфорновольфрамовою кислотою і досліджували під трансмісійним електронним мікроскопом при збільшенні від 30 до 100 тис. разів.
Статистичний аналіз
Для оцінки впливу активних речовин на концентрацію й інфікуючу здатність вірусу SARS-CoV-2 порівнювали розраховані концентрації вірусу після усіх трьох періодів інкубації з різними активними субстанціями, з використанням незалежного t-тесту в програмному інструменті SPSS Statistics V26.
Результати
Результати контрольних процедур
Контроль клітин і вірусів. Контроль клітин і вірусів проводився постійно для кожного тесту. Всі результати контролю відповідали критеріям.
Контроль вірусу протягом усього часу контакту в ході тесту. Випробовувану суспензію вірусу інкубували протягом 15 хв, що є загальним часом інкубації в цьому методі дослідження. Це було проведено паралельно з кожним віруліцидним тестом. У період спостереження значного зниження концентрації інфекційного вірусу не відзначалося. У процесі тестування низької концентрації комбінації БГ і ЦПХ у вигляді вільної активної речовини і плацебо льодяників було досягнуто критичне зниження концентрації інфекційних вірусів (значення 1 логарифмічного рівня). Отримані результати представлені в таблиці 2.
Пригнічення активності випробовуваного препарату в крижаному середовищі. Тест був проведений для високої концентрації випробовуваного препарату. Отримані результати представлені в таблиці 3. Було продемонстровано інгібуючий вплив крижаного середовища на дію випробовуваного препарату, який використовується у високій концентрації, щодо інфікуючої здатності вірусу.
 Титр вірусу до і після впливу істотно не відрізнявся і не наближався до різниці в 1-log значення концентрації, заданого в якості граничного значення згідно зі стандартними рекомендаціями.
Титр вірусу до і після впливу істотно не відрізнявся і не наближався до різниці в 1-log значення концентрації, заданого в якості граничного значення згідно зі стандартними рекомендаціями.
Контроль втручання – контроль сприйнятливості клітин. Контроль втручання проводили двома окремими процедурами: спочатку для ЦПХ у вигляді вільної активної речовини і льодяників у комбінації БГ/ЦПХ, і потім для БГ/ЦПХ у вигляді вільної активної речовини і льодяників плацебо. Концентрація вірусу в заражених клітинах була трохи нижче, ніж у незаражених. Проте різниця все ще була прийнятною і не перевищувала 1-log. Результати показали, що випробовувані препарати не мали значного впливу на сприйнятливість клітин до вірусної інфекції.
Цитотоксичний ефект. Тестували розведення від 10-1 до 10-11 вихідної концентрації; цитотоксичний ефект (деформація клітин і руйнування моношару клітин) відзначався в розведеннях 10-1 і 10-2. Ефект поширення вірусу перевіряли тільки в клітинах, інокульованих із розведенням випробуваного розчину від 10-3 до 10-11. Дані спостереження розглядалися при інтерпретації результатів (цитотоксичний рівень). Рівень цитотоксичності щодо розведення вірусу становив 4,5 log10 (с) (TCID50/мл) для нерозведеної комбінації БГ/ЦПХ у вигляді вільної активної речовини, БГ/ЦПХ льодяника і льодяника плацебо. Для всіх інших випробовуваних препаратів у середній і низькій концентраціях і ЦПХ у вигляді вільної активної речовини у високій концентрації рівень цитотоксичності становив 3,5 log10 (c) (TCID50/мл).
Результати ефективності випробовуваного препарату на інактивацію вірусу
Вірус піддавався впливу кожної з трьох концентрацій випробовуваної субстанції протягом часу експозиції 1,5 та 15 хв. Кожен тест проводився у двох паралельних аналізах (його повторювали) у різні дні. Графічні результати експозиції SARS-CoV-2 суспензії випробовуваного препарату у високій концентрації та протягом тривалого часу впливу представлені на рис. 1.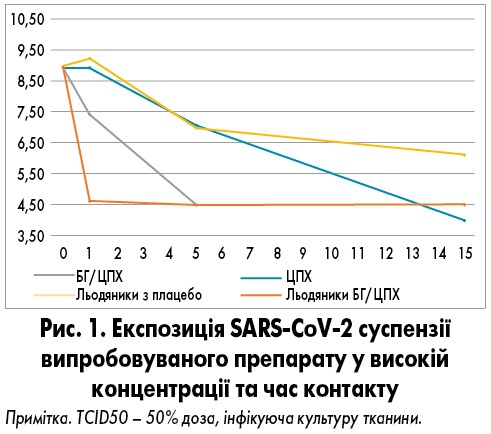
Чисельні результати та зниження представлені як середнє значення обох тестів у таблиці 4.
Вплив випробуваного препарату у високій концентрації. Вільна активна речовина: ЦПХ продемонстрував середнє log10 зниження вірусного титру на 0,00±1,06 через 1 хв, 1,88±0,96 через 5 хв та 4,94±0,75 log10 через 15 хв дії. БГ/ЦПХ продемонстрували середнє log10 зниження на 1,57±0,86, ≥4,49±0,67 та ≥4,49±0,67 через 1,5 та 15 хв впливу відповідно.
Льодяники: комбінація БГ/ЦПХ продемонструвала середнє log10 зниження вірусного титру на 4,32±0,82 вже на першій хвилині дії; через 5 та 15 хв впливу зниження становило ≥4,44±0,75.
Згідно з очікуваннями, льодяник плацебо продемонстрував значно менші зниження. На першій хвилині впливу відзначалося збільшення вірусного титру зі значеннями 0,25±1,01, потім зниження на 2,00±0,92 та 2,88±0,83 через 5 та 15 хв відповідно.
Негативний контроль не виявив жодних негативних впливів на вірусний титр.
Вплив випробовуваних препаратів у середній концентрації. Вільна активна речовина: ЦПХ у вигляді вільної активної речовини продемонстрував середнє log10 зниження на 0,06±0,99, 0,75±0,98 та 2,44±0,79 через 1,5 та 15 хв впливу відповідно. Значення БГ/ЦПХ становили 1,96±0,95, 3,30±0,96 та 5,63±0,77 через 1,5 та 15 хв впливу відповідно.
Льодяники: комбінація БГ/ЦПХ продемонструвала середнє log10 зниження на 1,69±0,96, 3,56±0,86 та 5,00±0,68 через 1,5 та 15 хв впливу відповідно. Льодяник плацебо продемонстрував зниження на 0,81±0,92, 1,06±0,98 та 0,65±1,05 через 1,5 та 15 хв впливу відповідно. Негативний контроль не виявив жодних негативних впливів на вірусний титр.
Вплив випробовуваних препаратів у низькій концентрації. Вільна активна речовина: ЦПХ продемонстрував log10 зниження на 0,32±1,08, 0,70±1,04 та 1,69±1,03 через 1,5 та 15 хв впливу відповідно. При комбінації БГ/ЦПХ зниження становило 0,89±1,03, 1,58±0,98 та 2,44±0,94.
Льодяники: комбінація БГ/ЦПХ продемонструвала середнє log10 зниження на 0,88±1,11, 1,19±1,03 та 3,01±1,05 через 1,5 та 15 хв впливу відповідно. Льодяник плацебо продемонстрував підвищення вірусного титру на 0,13±1,06 на першій хвилині впливу, потім зниження на 0,46±0,98 та 1,46±0,97 через 5 та 15 хв впливу відповідно. Негативний контроль не виявив жодних негативних впливів на вірусний титр.
Аналіз електронної мікроскопії
Проби негативного контролю, які спостерігаються під електронним мікроскопом, містили інтактні частки вірусу без видимих морфологічних змін або ушкоджень; були чітко виражені пепломери білка S (корона) і відзначалася інтактна вірусна оболонка (рис. 2А, Б). З іншого боку, у зразках під впливом високої концентрації випробовуваного препарату ЦПХ (у вигляді вільної активної речовини; рис. 2В, Г) або БГ/ЦПХ льодяники (рис. 2Д, Є) відзначається руйнування вірусної оболонки з нечітким утворенням пепломерів або навіть без пепломерів та оболонки. Вплив випробовуваних препаратів на вірус серйозно пошкодив зовнішній шар вірусної оболонки, що є найвірогіднішою причиною втрати інфікуючої здатності вірусу. При деяких пошкоджених вірусах видно внутрішній нуклеокапсид. Також відзначається руйнування оболонки вірусу із накопиченням контрастного засобу у внутрішній частині вірусу (чорний центр вірусу).
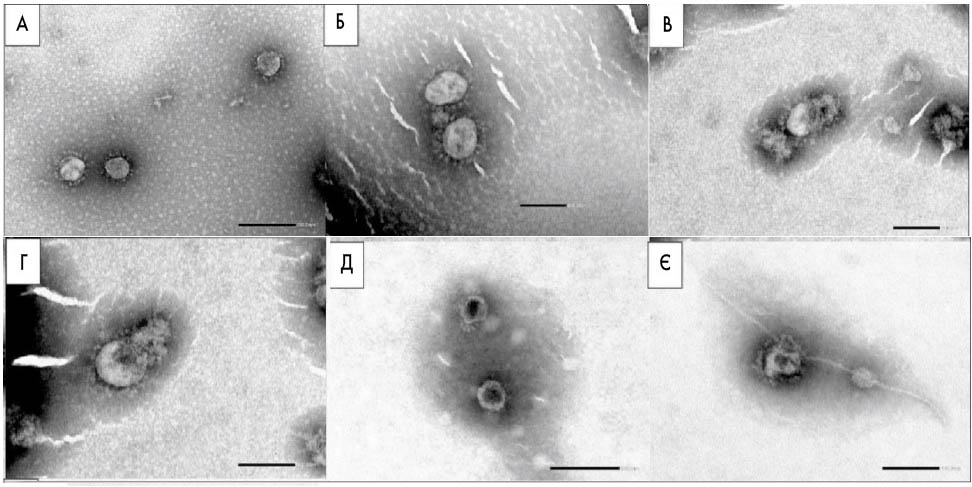 Рис. 2. Електронні мікрознімки вірусних часток після ультрацентрифугування та негативного контрастування. А, Б – вірусні частки у підтримувальному середовищі, які не піддавалися впливу випробовуваного препарату; збільшення у 50 тис. разів (A) та 80 тис. разів (Б); інтактні частки SARS-CoV-2 із пепломерами (корона). В, Г – 15-хвилинна дія високої концентрації ЦПХ (0,25 мг/мл); збільшення у 80 тис. разів (В) та 100 тис. разів (Г); пошкоджені вірусні частки, рідко видні пепломери, пошкоджена вірусна оболонка та незахищений внутрішній нуклеокапсид. Д, Є – 15-хвилинна дія високої концентрації БГ/ЦПХ льодяника (1 льодяник у 4 мл); збільшення у 60 тис. разів (Д) та 100 тис. разів (Є); пошкодження зовнішнього шару та накопичення негативного контрастного засобу всередині нуклеокапсиду (чорний центр вірусу), рідкісні пепломери, пошкодження зовнішнього шару та нуклеокапсиду (Є)
Рис. 2. Електронні мікрознімки вірусних часток після ультрацентрифугування та негативного контрастування. А, Б – вірусні частки у підтримувальному середовищі, які не піддавалися впливу випробовуваного препарату; збільшення у 50 тис. разів (A) та 80 тис. разів (Б); інтактні частки SARS-CoV-2 із пепломерами (корона). В, Г – 15-хвилинна дія високої концентрації ЦПХ (0,25 мг/мл); збільшення у 80 тис. разів (В) та 100 тис. разів (Г); пошкоджені вірусні частки, рідко видні пепломери, пошкоджена вірусна оболонка та незахищений внутрішній нуклеокапсид. Д, Є – 15-хвилинна дія високої концентрації БГ/ЦПХ льодяника (1 льодяник у 4 мл); збільшення у 60 тис. разів (Д) та 100 тис. разів (Є); пошкодження зовнішнього шару та накопичення негативного контрастного засобу всередині нуклеокапсиду (чорний центр вірусу), рідкісні пепломери, пошкодження зовнішнього шару та нуклеокапсиду (Є)
Обговорення
Віруліцидна активність ЦПХ щодо деяких вірусів, що мають оболонку, досліджена та підтверджена [12]. Дане дослідження in vitro продемонструвало віруліцидну дію ЦПХ та комбінації БГ і ЦПХ у вигляді вільної активної речовини та у формі льодяників на вірус SARS-CoV-2.
Віруліцидний тест, проведений у контрольованих лабораторних умовах на суспензії випробовуваних препаратів у високій концентрації, продемонстрував зниження концентрації інфекційного вірусу в 10 000 разів (99,99% зниження), тобто 4-log зниження, що є необхідним стандартом щодо віруліцидної активності.
Швидкість зниження інфекційних вірусів зменшується одночасно зі зниженням концентрації випробовуваного препарату. Було продемонстровано значну різницю між віруліцидною активністю БГ/ЦПХ льодяника та льодяника плацебо, особливо у високій та середній концентраціях суспензії випробовуваного препарату.
Комбінація БГ та ЦПХ у вигляді льодяника показала швидший віруліцидний ефект порівняно з ЦПХ у вигляді вільної активної речовини, оскільки достатнє 4-log зниження вірусної концентрації відзначалося через 1 хв впливу високої концентрації. Подібне зниження відзначалося тільки після 15 хв впливу ЦПХ у вигляді вільної активної речовини і між 5 та 15 хв впливу БГ/ЦПХ льодяника середньої концентрації (льодяник розчиняли в 20 мл), що є концентрацією, яка теоретично досягається при реальному використанні льодяника для лікування горла.
Якщо взяти до уваги швидкість слиновиділення (приблизно 4-5 мл/хв) під час їжі, жування та інших стимулюючих дій, наприклад, розсмоктування льодяника [15], та враховуючи час, необхідний для розчинення льодяника (в середньому 5 хв) та постійне вивільнення активних речовин з льодяника, то середня концентрація випробовуваних препаратів (суспендованих у 20 мл) гіпотетично може бути досягнута при фактичному розсмоктуванні льодяника в роті.
Проте льодяник, суспендований у 30 мл (низька концентрація), не досягав 4-log зниження протягом 15 хв. ЦПХ у вигляді вільної активної речовини також не продемонстрував 4-log зниження протягом 15 хв впливу в суспензії середньої та низької концентрації. Проте відзначалася чітка тенденція до зниження вірусу в усіх концентраціях випробовуваного препарату протягом 15 хв дії (за винятком льодяника плацебо).
Важливим є також додатковий висновок нашого дослідження – це високоефективна віруліцидна активність комбінації БГ/ЦПХ як у формі льодяника, так і у вигляді вільної активної речовини, яка має швидший ефект порівняно з тільки ЦПХ. Було встановлено, що БГ як додатковий компонент впливає на дестабілізацію та втрату інфікуючої здатності вірусних часток. Додатковим параметром суспензії льодяника, що впливає на динаміку віруліцидності, може бути екстремальне кислотне середовище. У суспензіях вільної активної речовини ЦПХ і БГ/ЦПХ рівень рН в усіх випробуваних концентраціях у середньому становив 7,65 і 7,78, що близько до нейтрального. Проте у БГ/ЦПХ льодянику рівень рН у середньому становив 3,9. Очевидно, що низьке значення рівня рН суспензії льодяника комбінації БГ/ЦПХ у нашому дослідженні може бути додатковим фактором, що має синергетичну дію і дуже прискорює втрату інфікуючої здатності вірусу. Дослідження також підтвердило, що значення рівня рН впливає на стабільність та інфікуючу здатність вірусу в навколишньому середовищі [16]. Як в екстремальному кислотному середовищі, так і в екстремальному лужному вірусні білки на поверхні незворотньо денатурували, що призвело до зниження інфікуючої здатності вірусу.
Віруліцидний ефект ЦПХ та льодяників у комбінації БГ/ЦПХ додатково відзначався при морфологічному аналізі вірусних часток. Після інкубації вірусу в суспензії ЦПХ у вигляді вільної активної речовини та комбінації БГ/ЦПХ у формі льодяника був відзначений подібний ефект, тобто порушення вірусної оболонки. При БГ/ЦПХ льодянику була відмічена дестабілізація нуклеокапсиду, яка може бути пов’язана з низьким рівнем рН навколишнього середовища, дії якого піддавався вірус [17].
Слід підкреслити, що місцем дії льодяників є слизова оболонка ротової порожнини і глотки, що тяжко змоделювати in vitro у лабораторних умовах. Додатковий момент, який слід враховувати, полягає в тому, що потенційною активністю in vivo льодяника є лише його вплив на віруси, які виділяються інфікованими клітинами, та віруси у слині. Результати попередніх досліджень показали, що концентрація вірусів у слині знаходиться в діапазоні 4-6 log10 копій геному на 1 мл [18-20], при цьому найвища концентрація спостерігається через 5-6 днів після появи симптомів. У цій процедурі дослідження концентрація вірусу була набагато більшою, між 8 і 10 log10 TCID50/мл.
Вірус SARS-CoV-2 переважно передається через респіраторні краплі, а вірусна частка залишається життєздатною в аерозолях протягом трьох годин [21, 22]. Профілактичні заходи, такі як гігієна рук, носіння маски для обличчя та соціальне дистанціювання, є основними засобами боротьби з інфекцією. Дотепер взаємозв’язок між вірусним навантаженням у легенях та горлі з точки зору тяжкості захворювання незрозумілий, а також невідомо, як зниження вірусного навантаження у горлі може вплинути на захворювання легень або передачу вірусу.
Якщо очікується, що більш висока концентрація вірусу в горлі може збільшити можливість зараження інших, тоді стратегія зниження кількості інфекційних вірусних часток слизової оболонки може сприяти зниженню ризику передачі інфекції. Тому, якщо припускаємо, що горло є основним місцем реплікації вірусу на ранніх стадіях, застосування місцевих засобів, які можуть пошкодити або зруйнувати ліпідну оболонку вірусу, може потенційно знизити вірусне навантаження в ротоглотці.
Декілька звітів про клінічні випадки також підтвердили ефективність полоскання порожнини рота у зниженні концентрації вірусу SARS-CoV-2 у слині [23-25].
Необхідно провести подальше розслідування механізму віруліцидної активності та клінічних ефектів льодяників з комбінацією БГ/ЦПХ для контролю інфекцій респіраторного тракту.
Висновки
Результати, представлені в цьому дослідженні, ґрунтуються на контрольованих та певних лабораторних умовах, що імітують фізіологічні умови ротової порожнини. Усі активні випробовувані препарати, тобто ЦПХ, БГ/ЦПХ у вигляді вільної активної речовини та БГ/ЦПХ у формі льодяника, продемонстрували важливу віруліцидну активність в умовах in vitro.
Дослідження додатково підтвердило значну різницю між льодяниками в комбінації БГ/ЦПХ і льодяниками плацебо, а також сильніший ефект комбінації БГ/ЦПХ або у формі льодяників, або у вигляді вільної активної речовини порівняно з тільки ЦПХ.
Список літератури знаходиться у редакції.
За сприяння компанії КРКА.
Steyer А., Marusic M., Kolenc M., Triglav T. A Throat Lozenge with Fixed Combination of Cetylpyridinium Chloride and Benzydamine Hydrochloride Has Direct Virucidal Effect on SARS-CoV-2. COVID, 2021, 1 (2), 435-446.
https://doi.org/10.3390/covid1020037 https://www.mdpi.com/2673-8112/1/2/37
Тематичний номер «Педіатрія» № 5 (61) 2021 р.