16 січня, 2022
Організм стягує «зимовий податок» на Т3, але не кожен може дозволити собі його сплачувати
У пацієнтів з порушенням функції щитоподібної залози (ЩЗ), особливо в хворих, які перебувають на замісній гормональній терапії, узимку спостерігається сезонне зниження рівня трийодтироніну (Т3). Цей «зимовий податок» на Т3 може мати негативні наслідки для здоров’я, а в пацієнтів із субклінічним гіпотиреозом за холодної пори року захворювання може переходити в клінічно маніфестну форму. Чому так відбувається і яке терапевтичне втручання необхідне таким пацієнтам? Спробуємо розібратися в цій статті.
Індивідуальна та сезонна варіабельність рівня тиреоїдних гормонів у здорових осіб
Згідно із сучасною парадигмою функціонування осі «гіпоталамус – гіпофіз – ЩЗ» рівень вільного сироваткового Т3 (FT3) є ключовим показником, стабільність якого організм намагається забезпечити насамперед (Abdalla, Bianco, 2014). Отже, концентрація саме цього тиреоїдного гормона найменше змінюється протягом дня та року в людини зі здоровою ЩЗ. Щоб підтримувати стабільний рівень FT3, організм коригує сироваткові рівні тиреотропного гормона (ТТГ) і тироксину (Т4), тому їхня концентрація може суттєвіше коливатися протягом доби та року.
Що стосується сезонності, то зимовий холодовий стрес збільшує потребу в Т3, який необхідний для термогенезу. Для цього організм посилює периферичну конверсію Т4-Т3 (за рахунок підвищення активності дейодиназ) і секрецію ТТГ та Т4. Корейське спостережне дослідження продемонструвало, що в здорових людей рівень ТТГ збільшується, коли середня місячна температура становить <10 °C, тоді як рівні загального Т4 та Т3 залишаються стабільними (Kim et al., 2014). Отже, в умовах помірної зими неуражена ЩЗ здатна підтримувати сталий рівень Т3, хоча при екстремальному холоді навіть у здорових осіб спостерігається зниження його концентрації (Hassi et al., 2001).
А що відбувається взимку в пацієнтів із порушеною функцією ЩЗ?
Фізіологічна потреба в підтриманні рівня FT3 у вузькому індивідуальному діапазоні не зникає у людей з вадами ЩЗ. Однак, на жаль, вони не здатні утримувати його так добре, як здорові люди. Навіть за теплої пори року при подібному рівні ТТГ в осіб із ураженою ЩЗ рівні Т3 є нижчими, ніж у здорових людей. Різниця посилюється взимку, коли збільшується потреба в Т3 для термогенезу. Для підтримання стабільного рівня Т3 підвищується периферична конверсія Т4-Т3 і збільшується секреція ТТГ, однак, на жаль, уражена ЩЗ не здатна секретувати достатню кількість Т4, щоб компенсувати периферичні втрати Т3. Ще гірша ситуація в осіб, котрі перенесли тотальну тиреоїдектомію, адже в них узагалі немає чим перекрити потребу в Т3, що зростає. Саме тому взимку в людей із гіпотиреозом, які за теплої пори року успішно утримують стан еутиреозу завдяки замісній гормональній терапії, рівень FT3 може вийти за межі терапевтичного вікна.
Зниження Т3 в зимовий сезон в осіб з гіпотиреозом добре задокументовано в клінічних дослідженнях. Так, ще в далекому 1984 році цей феномен виявили японські вчені (Hamada et al., 1984). Вони тривалий час спостерігали 7 пацієнток віком від 27 до 66 років із гіпотиреозом на тлі тиреоїдиту Хашимото, ідіопатичної мікседеми та після радіоактивного лікування хвороби Грейвса. Всі вони отримували адекватну замісну гормонотерапію L-тироксином. У 5 із 7 хворих спостерігалося зниження рівня загального Т3 на 10 нг/дл, T4 – на 0,2‑0,4 нг/дл узимку (порівняно з літом). Водночас, за даними цих авторів, здорові люди не мали значних сезонних відмінностей у жодному із цих показників тиреоїдного статусу. Вільний Т3 в цьому дослідженні не вимірювався. Крім того, в пацієнтів з гіпотиреозом базальна швидкість метаболізму знизилася з 11,2 влітку до -0,7% узимку, тоді як у здорових осіб вона збільшилася з 0,3 влітку до 19,0 взимку.
Важливо зазначити, що дозування L-тироксину в цьому випробуванні коригувалося не за показником ТТГ, а шляхом клінічної оцінки (усунення клінічних ознак і симптомів гіпотиреозу було метою терапії). У результаті пацієнти отримували достатньо високі дози L-тироксину – в середньому 2,09 мкг/кг/день. Для порівняння: середня доза складає 1,6 мкг/кг/день у людей з повною відсутністю функції ЩЗ, якщо переважною терапевтичною метою є нормалізація рівня ТТГ. Оскільки парадигма замісного лікування в дослідженні Hamada та співавт. була агресивнішою за прийняту сьогодні, а також у пацієнтів не спостерігалося чітких клінічних ознак або симптомів гіпотиреозу навіть узимку, коригування дози L-тироксину не було потрібне. Втім, автори зазначають, що сезонне підвищення дози гормона може бути рекомендоване для мешканців регіонів із різкими сезонними коливаннями температури чи для людей, які переїжджають до місцевості з іншим кліматом.
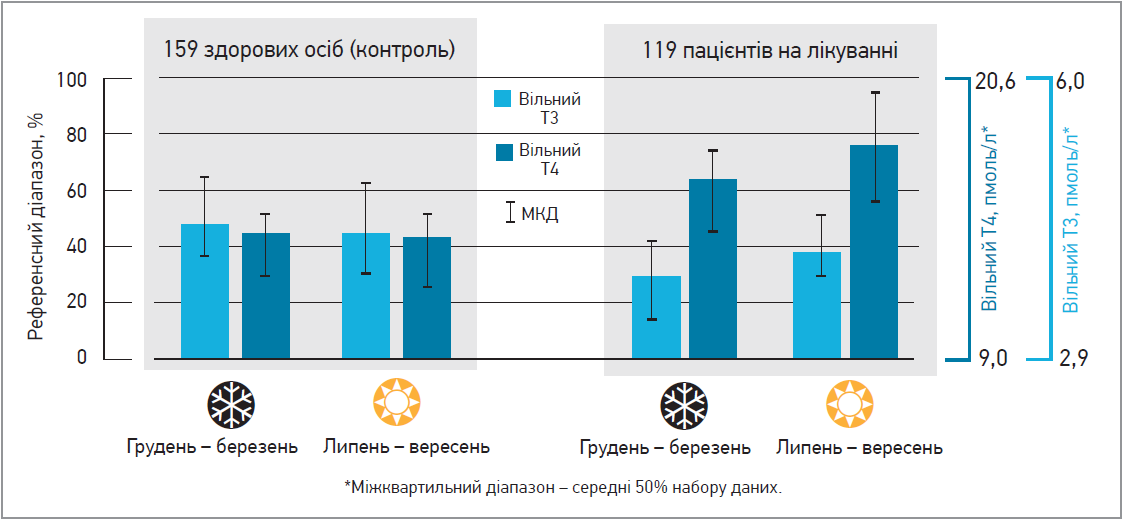
Досить масштабний ретроспективний аналіз, присвячений цій темі, декілька років тому провели італійські вчені (Gullo et al., 2017). Вони ретроспективно оцінили сезонну варіабельність рівнів ТТГ, FT4 та FT3 в пацієнтів з гіпотиреозом після тотальної тиреоїдектомії, а також у здорових добровольців, які мешкають на Сицилії. Виявилося, що в здоровій популяції спостерігається незначне підвищення рівня FT3 взимку, тоді як у пацієнтів з гіпотиреозом, котрі отримують фіксовану дозу L-тироксину протягом року, він знижувався (рис.). В хворих із гіпотиреозом спостерігалося підвищення рівня ТТГ, проте воно не компенсувало зниження вільного Т3.
Рис. Сезонна варіабельність рівня тиреоїдних гормонів у здорових осіб і пацієнтів із гіпотиреозом, котрі отримують замісну гормональну терапію (Gullo et al., 2017)
Примітка: МКД – міжквартильний діапазон.
Хто в групі найвищого ризику?
Три основні фактори визначають ризик сезонного зниження рівня Т3 в пацієнтів із гіпотиреозом – залишкова функція ЩЗ, терапевтична парадигма й ефективність периферичної конверсії Т4-Т3.
Найважливіша змінна в зимовій втраті Т3 – залишкова функція ЩЗ. Найуразливішими є пацієнти з повною відсутністю ЩЗ або вираженим зниженням її функції, а також особи з рівнем FT3 на нижній межі норми на початку зимового періоду; до таких хворих належать особи з гіпотиреозом, які мають супутні хронічні захворювання, як-от анемія, цукровий діабет або серцева недостатність.
Друга за важливістю змінна – терапевтична парадигма (схема лікування та терапевтичні цілі), яка може створити основу для цілорічного дефіциту Т3, а не лише зимового зниження. Більший ризик мають пацієнти, котрі отримують монотерапію L-тироксином, доза якого коригується за показником ТТГ. Менший ризик спостерігається в хворих, яких лікують комбінацією L-тироксину та Т3, а корекція дози здійснюється на основі декількох лабораторних параметрів (ТТГ, Т3, Т4), а також клінічної картини.
Третя змінна – ефективність периферичного перетворення Т4-Т3, яка дуже варіює як у здорових осіб, так і в людей з тотальною тиреоїдектомією (Midgley et al., 2015). Так, деякі хворі без ЩЗ мають дуже ефективний метаболізм гормона Т4 у Т3 і можуть мати кращі показники Т3, ніж інші хворі з автоімунним тиреоїдитом або частковою тиреоїдектомією. Однак, на жаль, методів рутинної оцінки периферичної конверсії Т4-Т3 наразі не існує.
Наскільки небезпечним є сезонне зниження Т3?
Як і загалом гіпотиреоз, сезонне зниження рівня Т3 може мати негативні наслідки для здоров’я, а насамперед для серцево-судинної та нервової систем (серцева недостатність, прискорене прогресування атеросклерозу, депресія, когнітивні порушення тощо).
При недіагностованому чи нелікованому тяжкому гіпотиреозі зниження Т3 в зимовий час узагалі може спричинити летальний наслідок. Тяжке ускладнення гіпотиреозу (мікседемна криза) характеризується високим рівнем смертності, що становить 25-60% (Mathew et al., 2011). Цікаво, що більшість випадків цього ускладнення припадає саме на зимові місяці в регіонах із холодними зимами (Wiersinga et al., 2018).
Навіть незначні зміни рівня FT3 в межах референтного діапазону можуть зумовити симптоми гіпотиреозу (Hoermann et al., 2019).
Шляхи вирішення проблеми
Найпростіше рішення, яке практично лежить на поверхні, – сезонна корекція дози L-тироксину в зимовий період; при цьому варто враховувати не лише показники ТТГ, а й рівні FT3 і FT4, а також клінічну картину, зокрема, такий важливий симптом, як переносимість холоду.
На жаль, незалежно від сезону монотерапія L-тироксином не завжди достатньо підвищує FT3 при дозуванні препарату, яке нормалізує рівень ТТГ. Це пов’язано з тим, що деякі пацієнти є «поганими перетворювачами» T4 (Midgley et al., 2015). Такі хворі потребують комбінованої терапії L-тироксином і ліотироніном (синтетичний аналог Т3) чи сухим екстрактом ЩЗ в зимовий період. На жаль, такі препарати не представлені на українському фармацевтичному ринку.
Натомість існує ще один фармацевтичний шлях підтримання тиреоїдного гомеостазу. Компенсувати «зимовий податок» на Т3 дозволяє адекватне забезпечення такими важливими для ЩЗ мікроелементами, як йод і селен.
Достеменно відомо, що недостатність селену зумовлює зниження синтезу селенопротеїнів, зокрема йодотироніндейодиназ, які відповідають за перетворення Т4 в біологічно активну форму Т3. Саме тому на тлі дефіциту селену погіршується функція тиреоїдних гормонів. Про зв’язок забезпечення селеном і функцією ЩЗ свідчать результати низки епідеміологічних досліджень. Зокрема, масштабне випробування Q. Wu та співавт. (2014), до якого залучили >6 тис. осіб, котрі проживали в регіонах з адекватним і недостатнім забезпеченням селеном, продемонструвало достовірну різницю між ними в поширеності захворювань ЩЗ (маніфестний та субклінічний гіпотиреоз, автоімунний тиреоїдит, зоб), при цьому середній рівень селену в сироватці крові між групами відрізнявся практично вдвічі.
Чеські дослідники також свідчать про статистично значимий зв’язок між забезпеченістю населення селеном, рівнем і функціональною активністю тиреоїдних гормонів. Особливо небезпечними вони вважають поєднаний дефіцит селену та йоду як ключових елементів у забезпеченні нормального функціонування ЩЗ (Kvícala J., Zamrazil V., 2003).
Про роль адекватного забезпечення йодом для функціонування ЩЗ годі й говорити. Оскільки йод входить до складу тиреоїдних гормонів, недостатнє надходження цього мікроелемента безпосередньо відображається у вигляді зниження функції ЩЗ. Наразі дефіцит йоду вважають основною причиною розвитку більшості захворювань ЩЗ.
Для забезпечення адекватного надходження йоду та селену до організму людини рекомендується приймати їх у вигляді комбінованих засобів. ЙоSен® поєднує у собі вищезазначені мікроелементи, сприяючи нормалізації функції ЩЗ, а також містить фізіологічну добову дозу йоду та селену в 1 таблетці – 150 і 75 мкг відповідно, що забезпечує зручність прийому й підвищення комплаєнсу.
Підготував В’ячеслав Килимчук