16 січня, 2022
Серцево-судинні захворювання та COVID-19: додаткові терапевтичні можливості
Вже достеменно відомо, що коронавірусна хвороба (COVID-19) може згубно впливати на серцево-судинну систему. Мікросудинні ураження, ендотеліальна дисфункція та тромбоз, які виникають унаслідок вірусної інфекції або опосередковано пов’язані з інтенсивними системними запальними й імунними реакціями, є характерними ознаками тяжкої форми COVID-19. Наявні серцево-судинні захворювання (ССЗ) та вірусне навантаження пов’язані з ураженням міокарда та гіршими результатами. Реакція судин на вироблення цитокінів і взаємодія між коронавірусом SARS-CoV-2 та рецептором ангіотензинперетворювального ферменту-2 (АПФ-2) може призвести до значного зниження скоротливості серця й подальшої дисфункції міокарда (Nalbandian A. et al., 2021). Крім того, значна частина пацієнтів, які були інфіковані SARS-CoV-2, не одужують повністю та продовжують відчувати велику кількість симптомів і постгострих ускладнень за відсутності вірусної інфекції, котру можна виявити. Цей стан, який часто називають «лонг-COVID-19», може мати кілька причин. Вірусні резервуари чи затримані фрагменти вірусної РНК або білків сприяють цьому стану. Системна запальна відповідь на COVID-19 здатна призвести до збільшення фіброзу міокарда, що своєю чергою може погіршити ремоделювання серця.
У грудні 2021 року було оприлюднено консенсусний документ Робочої групи Європейського товариства кардіологів (ESC) із коронарної патофізіології та мікроциркуляції, Робочої групи ESC із тромбозу й Асоціації гострої серцево-судинної допомоги (ACVC) у співпраці з Європейською асоціацією серцевого ритму (EHRA) «Серцево-судинні захворювання та COVID‑19» (Cenko E. et al., 2021), у яких підбиваються підсумки поточних даних про серцево-судинні ураження та постгострі наслідки COVID‑19. Оскільки пандемія триває та з’являються нові штами вірусу SARS-CoV‑2, лікарям-практикам потрібно розширювати знання про основні механізми патофізіології захворювання та його ускладнень. А визначення нових біомаркерів серцево-судинних ускладнень і розроблення ефективних методів лікування COVID‑19 мають вирішальне значення.
АПФ‑2 та серцево-судинні прояви
SARS-CoV‑2 є одноланцюговим вірусом РНК (Zhou P. et al., 2020). Структурний спайковий білок зовнішньої мембрани (S‑білок) вірусу має високу афінність і зв’язується з рецептором AПФ‑2. Після зв’язування S‑білок розщеплюється й таким чином активується для злиття мембрани трансмембранною протеазою серину‑2 (TMPRSS2) у процесі, що відомий як праймування S‑білка (Guzik T. J. et al., 2020; Hoffmann et al., 2020; Kreutz R. et al., 2020). Отже, SARS-CoV‑2 потребує співекспресії AПФ‑2 і TMPRSS2. Інтерналізація спайкового білка / AПФ‑2 сприяє зниженню регуляції AПФ‑2 на мембрані та зменшенню його поверхневої експресії (Kreutz R. et al., 2020).
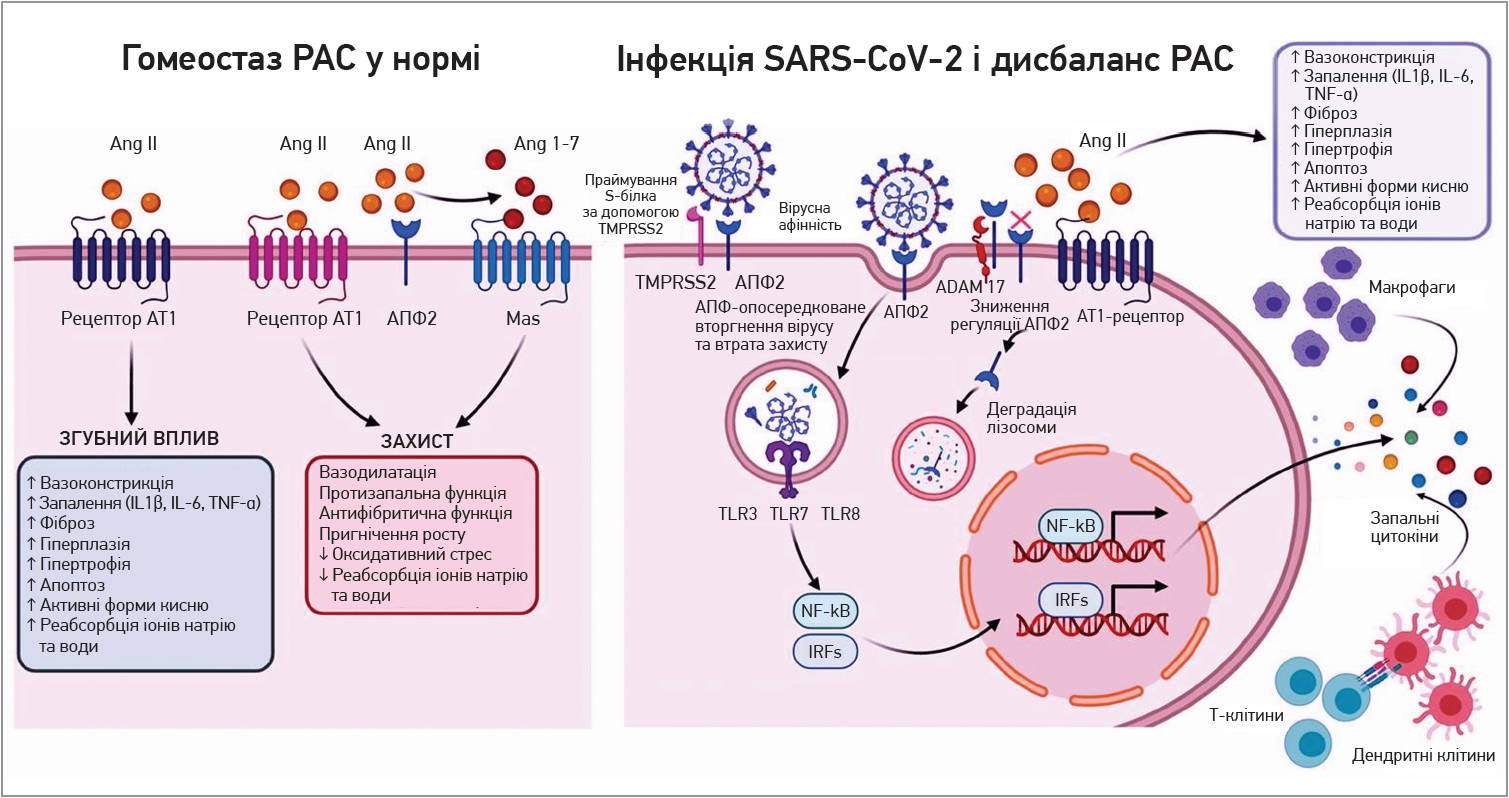
АПФ‑2 є головним регулятором ренін-ангіотензинової системи (РАС). Активність РАС залежить від балансу між осями AПФ / ангіотензин (Ang) II / Ang I й AПФ‑2 / Ang 1-7 / Mas. АПФ перетворює Ang I на активний судинозвужувальний Ang II, дія котрого опосередковується рецепторами AT1 й Ang II типу 2 (AT2). Активація осі рецептора AПФ / Ang II / AT1 призводить до шкідливих ефектів, включаючи вазоконстрикцію, запалення, фіброз, клітинний ріст і міграцію, а також затримку рідини. АПФ‑2 є основним ферментом, що утворює Ang 1-7, а пов’язаний із G‑білком Mas є функціональним рецептором Ang 1-7 (Tipnis S. R. et al., 2000). Ang 1-7 і зв’язування з Mas забезпечують декілька сприятливих ефектів, як-от вазодилатація, пригнічення росту клітин, антитромботична й антиаритмогенна дії (Ferrario C. M. et al., 2010) (рис.).
Рис. Роль взаємодії Ang II, AПФ-2 та SARS-CoV-2 у патогенезі COVID-19, втрата запальної відповіді та серцево-судинного захисту
Примітка: IL – інтерлейкін; TNF-α – фактор некрозу пухлини-α.
Отже, враховуючи те що AПФ‑2 широко експресується в ендотеліальних клітинах, кардіофібробластах, кардіоміоцитах, епітеліальних клітинах легень, судинах легень, нирках, жировій тканині, печінці, кишечнику та центральній нервовій системі, втрата функції AПФ‑2 після зв’язування S‑білка й ADAM17-опосередковане виділення разом із цитокіновим штормом, імовірно, асоційовані з дисфункцією багатьох органів, у тому числі з розвитком серцево-судинних ускладнень COVID‑19.
Основні кардіометаболічні чинники ризику, пов’язані з гіршим результатом у разі COVID‑19
Результати кількох звітів демонструють, що наявні ССЗ та кардіометаболічні чинники ризику, як-от артеріальна гіпертензія, цукровий діабет, ожиріння та/або куріння, є основними чинниками ризику тяжчого перебігу та смертності від COVID‑19 (Mechanick J. I. et al., 2020; Docherty A. B. et al., 2020; Petrilli C. M. et al., 2019; O’Hearn M. et al., 2021). У нещодавньому порівняльному аналізі за участю понад 900 тис. пацієнтів зі США майже 30% госпіталізацій із приводу COVID‑19 були пов’язані з ожирінням, 26% – з артеріальною гіпертензією, 21% – із цукровим діабетом і 12% – із серцевою недостатністю (СН). За результатами дослідження, зниження кардіометаболічних чинників ризику на 10% потенційно може запобігти 11% госпіталізацій унаслідок COVID‑19 (O’Hearn M. et al., 2021). Тому обізнаність пацієнтів про профілактичні заходи покращує стан серцево-судинної системи загалом і може зменшити ризик тяжкого перебігу COVID‑19.
Ураження міокарда
Останні звіти вказують на те, що ураження міокарда, яке проявляється підвищеним рівнем циркуляції серцевого тропоніну cTn, появою електрокардіографічних або візуальних ознак, часто трапляється серед пацієнтів із COVID‑19.
Точну частоту ураження міокарда в пацієнтів із COVID‑19 важко встановити через відмінності в трактуванні порогових значень cTn, досліджуваних групах населення та клінічних станах. Пошкодження міокарда спостерігалося в 7-40% пацієнтів із COVID‑19 залежно від географічних регіонів, із більшою поширеністю в осіб, які потребують інтенсивної терапії (Huang C. et al., 2020; Shi S. et al., 2020; Arentz M. et al., 2020; Ruan Q. et al., 2020; Lala A. et al., 2020; Giustino G. et al., 2020; Wei J. F. et al., 2020). Смертність становить приблизно 22% у пацієнтів із cTn вище верхньої контрольної межі та 61,5% серед тих, у кого рівень cTn у >10 разів перевищує таку (Shi S. et al., 2020; Lala A. et al., 2020; Giustino G. et al., 2020; Metkus T. S. et al., 2021).
Механізми підвищення рівня тропоніну при COVID‑19, імовірно, мають багатофакторний характер, включаючи кардіоміопатію, пов’язану із сепсисом, спричиненим системним гіперзапальним станом, коронарним тромбозом і розривом бляшки, мікросудинним ураженням унаслідок синдрому дисемінованого внутрішньосудинного зсідання (ДВЗ) крові та тромбозу, гіпоксією й гострим респіраторним дистрес-синдромом (ГРДС), прямою вірусною кардіотоксичністю (Sandoval Y. et al., 2020; Atri D. et al., 2020).
Тромбоемболія у хворих на COVID‑19
Порушення зсідання крові, що призводять до артеріальної й особливо венозної тромбоемболії (ВТЕ), є визнаними ознаками тяжкої COVID‑19. Найчастішими проявами цього патологічного процесу є тромбоз глибоких вен, тромбоемболія легеневої артерії та ДВЗ‑синдром. Запалення, активація ендотелію, підвищена реактивність тромбоцитів, нетоз, порушення регуляції факторів зсідання та стаз спричиняють як артеріальний, так і венозний тромбоз (Tung M. L. et al., 2021).
Хоча всі госпіталізовані пацієнти мають ризик розвитку ВТЕ, особи з ГРДС, тяжким сепсисом та/або ті, що перебувають у відділенні інтенсивної терапії, мають набагато більший ризик через множинні чинники, специфічні для пацієнтів обох груп, як-от вік, ожиріння, сепсис, гіпоксія, супутні респіраторні або серцево-судинні захворювання та чинники, пов’язані з реанімацією (седація, іммобілізація, застосування вазопресорів, центральні венозні катетери). Коагулопатія пов’язана з тяжчим перебігом захворювання та несприятливим прогнозом, при цьому ДВЗ‑синдром зареєстровано в 71% пацієнтів із COVID‑19, які померли, порівняно з лише 0,6% тих, хто вижив (Tang N. et al., 2021).
Згідно з останніми метааналізами, загальна частка випадків ВТЕ, пов’язаної з COVID‑19, у госпіталізованих пацієнтів становить від 15 до 21%. Цей показник є в 4 рази вищим у пацієнтів у критичному стані, які госпіталізовані до відділень реанімації, порівняно з іншими хворими на COVID‑19 (23-31% проти 7-9%) (Jiménez D. et al., 2019; Malas M. B. et al., 2020; Tan B. K. et al., 2021). Слід зазначити, що справжня частота ВТЕ може бути недооцінена, оскільки її нерідко важко виявити в пацієнтів із відділень реанімації. Крім того, тромбоемболія легеневої артерії може бути недостатньо діагностованою, оскільки погіршення дихання є основною ознакою супутнього ГРДС.
Аритмії
Аритмії є частим ускладненням у пацієнтів із COVID‑19. Раннє виникнення порушень ритму в госпіталізованих пацієнтів коливається в межах 8-17% і 44-60% за реанімації та смертельних випадків відповідно (Du Y. et al., 2020; Wang D. et al., 2020; Goyal P. et al., 2020; Wetterslev M. et al., 2021; Parwani A. S. et al., 2021). Згідно з результатами нещодавнього міжнародного великого опитування понад 4500 пацієнтів, аритмії виникали у 18% випадків, при цьому фібриляція/тріпотіння передсердь є найпоширенішим розладом у разі COVID‑19 (Coromilas E. J. et al., 2021). Фібриляція/тріпотіння передсердь, блокада лівої ніжки пучка Гіса, електрокардіографічні ознаки, що вказують на гостре перевантаження тиском правого шлуночка (наприклад, блокаду правої ніжки пучка Гіса), передчасні скорочення шлуночків, а також відхилення сегмента ST асоціюються з підвищенням рівня cTn і смертністю в пацієнтів із COVID‑19 (Lanza G. A. et al., 2021). Небезпечні для життя аритмії (шлуночкова тахікардія / фібриляція шлуночків) можуть виникати в 4-6% госпіталізованих пацієнтів із COVID‑19 і частіше трапляються в пацієнтів із підвищеним рівнем cTn (Guo T. et al., 2020; Coromilas E. J. et al., 2021), тому діагностика уражень міокарда завжди має супроводжуватися одночасним моніторингом ритму.
Хоча точна природа цих аритмій наразі нез’ясована, відомо кілька механізмів, унаслідок яких аритмії можуть виникати при COVID‑19.
П’ять патофізіологічних станів відповідають клінічному перебігу коронавірусної інфекції та можуть спричиняти аритмію:
- Наявні проаритмічні стани (структурні захворювання серця, порушення іонних каналів) (Kytomaa S. et al., 2019).
- Прямі кардіотропні ефекти вірусу SARS-CoV‑2 або гіперзапальна реакція, котру він зумовлює. Такі цитокіни, як IL‑2, IL‑6 та IL‑8, а також TNF‑α, можуть призводити до порушення серцевого ритму (Guo Y. et al., 2012; Henry B. M. et al., 2020). Цитокіни можуть спричиняти розвиток синдрому подовженого інтервалу QT, впливаючи на функцію іонних каналів K+ і Ca2+ у кардіоміоцитах (Lazzerini P. E. et al., 2020). Окрім того, тахікардія, пов’язана із запаленням, що виникає внаслідок посилення симпатичної активації β-адренергічних рецепторів (Tracey K. J., 2002) або безпосередньої активації клітин синусового вузла цитокінами (Takayama K. et al., 2005), може призвести до небезпечних для життя аритмій, особливо в пацієнтів із ССЗ.
- Серцево-респіраторна нестабільність, що потребує невідкладної допомоги та вентиляції з позитивним тиском (Varma N. et al., 2020; Boriani G. 2019). Аритмії можуть свідчити про погіршення загального стану пацієнта. Порушення електролітного балансу через швидке погіршення функції нирок можуть діяти як потенційні тригери, тому їх слід ретельно контролювати.
- Медикаментозна терапія препаратами, що подовжують інтервал QT. Кілька досліджуваних методів лікування COVID‑19, як-от застосування гідроксихлорохіну й азитроміцину, можуть спричинити подовження інтервалу QT, що завершується torsades de pointes (Rosenberg E. S. et al., 2020). Обґрунтованим є проведення базової електрокардіографії (ЕКГ), якщо пацієнти отримують антиаритмічну або психотропну терапію. Що ще важливіше: призначення ліків, які подовжують інтервал QT, слід переглянути, якщо QTc >500 мс або QTc збільшується на ≥60 мс (ESC, 2020).
- Нарешті, залишкова дисфункція міокарда та ризик аритмії після COVID‑19 з ураженням серця. Пацієнти зі зниженою фракцією викиду лівого шлуночка, стійкими змінами на ЕКГ або МРТ‑ознаками кардіофіброзу можуть претендувати на довгострокове спостереження щодо потенційних аритмічних ускладнень після COVID‑19 (Ali-Ahmed F. et al., 2020).
Нутриціологічна підтримка для зменшення постковідних кардіометаболічних ризиків
У контексті вищенаведеного та з огляду на наявні сьогодні терапевтичні стратегії щодо лікування COVID‑19 видаються вельми недооціненими природні засоби, як-от мікроелементи, коензим Q10, що здатні позитивно впливати на підтримку кардіоваскулярної системи та запобігання серцево-судинним ускладненням COVID‑19.
Зокрема, калій (К+) – один із найважливіших мікроелементів у людському організмі, задіяний у регуляції кислотно-лужної рівноваги крові, водного балансу міжклітинної та внутрішньоклітинної рідини, водно-сольового балансу, осмотичного тиску. Калій забезпечує створення мембранного потенціалу, потрібного для скорочення скелетних і серцевого м’язів, бере участь у передачі нервових імпульсів, а також у нервовій регуляції серцевих скорочень (Дудар І. О., 2018).
Дані епідеміологічних і клінічних досліджень продемонстрували роль низького вмісту калію в організмі людини в патогенезі есенціальної гіпертензії (Krishna G. G., Kapoor S. C., 1991). Натомість високе його споживання асоціюється з антигіпертензивною дією, що зумовлено збільшенням натрійурезу, прямим вазодилатувальним ефектом, зниженням серцево-судинної реактивності на норадреналін і Ang ІІ (Newberry S. J. et al., 2018).
Кардіопротекторну роль К+ було доведено в дослідженні United Kingdom Heart Failure Evaluation and Assessment of Risk за участю 433 пацієнтів. Було продемонстровано, що низький рівень калію асоціюється зі збільшенням частоти випадків раптової смерті у хворих на СН.
У багатьох фізіологічних процесах калій діє синергічно з магнієм (Mg); дефіцит останнього часто супроводжується дефіцитом калію. У новому Фремінгемському випробуванні (Taylor Pickering R. et al., 2021) досліджували співвідношення «доза – відповідь» натрію (Na), K, Mg та Ca з ризиком розвитку ССЗ, а також комбіновану дію цих мінералів. У дослідженні взяли участь 2362 особи обох статей віком 30-64 роки (без кардіоваскулярних захворювань на початковому етапі). Тривалість спостереження становила 12 років. За результатами випробування, низьке споживання Na (<2500 проти ≥3500 мг/добу) не асоціювалося з меншим ризиком ССЗ. Споживання Ca ≥700 (проти <500) мг/добу асоціювалося зі статистично незначущим серцево-судинним ризиком. Натомість споживання калію ≥3000 (проти <2500) мг/добу було пов’язано з 25% зменшенням кардіоваскулярного ризику, тоді як споживання Mg ≥320 (проти <240) мг/добу забезпечило зменшення ризику розвитку ССЗ на 34%. Ці результати підкреслюють важливість K та Mg для здоров’я серцево-судинної системи.
У серці Mg відіграє ключову роль щодо модуляції збудження нейронів, внутрішньосерцевої провідності та скорочення міокарда шляхом регулювання низки іонних транспортерів, у тому числі калієвих і кальцієвих каналів, а також у регуляції судинного тонусу, атерогенезу та тромбозу, кальцифікації судин, проліферації клітин непосмугованої мускулатури ендотелію й судин. Отже, Mg потенційно має суттєвий вплив на патогенез ССЗ. Дані спостережень продемонстрували зв’язок між низькими концентраціями Mg у сироватці крові та розвитком атеросклерозу, ішемічної хвороби серця, аритміями, СН (Tangvoraphonkchai K., Davenport A., 2018).
Важливо, що дефіцит Mg спричиняє зменшення активності Na-K-АТФази, що зумовлює підвищення концентрацій Na та K у клітинах, а також зниження рівнів Mg та K у серці (DiNicolantonio J.J. et al., 2018). Унаслідок таких змін підвищується схильність коронарних артерій до спазму, що може призводити до розвитку інфаркту міокарда й аритмій (Kubena K. S. et al., 1990).
У цьому контексті доцільно звернути увагу на коензим Q10 – природний антиоксидант, який продукується в організмі людини та відіграє фундаментальну роль у виробленні клітинної енергії. Результати клінічного дослідження Y. Rabanal-Ruiz і співавт. (2021) свідчать, що на тлі застосування коензиму Q10 достовірно знижуються оксидативний стрес, рівень летальності від серцево-судинних причин, покращується клінічний результат у пацієнтів після аортокоронарного шунтування, зменшуються жорсткість судин та ендотеліальна дисфункція, підвищується рівень NO.
Ці результати не поодинокі. Зокрема, в метааналізі 5 рандомізованих контрольованих досліджень L. Gao та співавт. (2012) на тлі прийому коензиму Q10 відзначалося значне поліпшення ендотеліальної функції, яка вимірювалася за допомогою потік-опосередкованого розширення периферичних артерій.
У 2014 р. S. A. Mortensen і співавт. у рандомізованому контрольованому багатоцентровому дослідженні, до якого залучили 420 хворих на СН, дослідили вплив коензиму Q10 на прогресування та перебіг цього ССЗ. Установлено, що коензим Q10 у дозі 100 мг перорально 3 р/день (у разі додавання до стандартної терапії) був безпечним, усував симптоми СН, а також знижував частоту основних серцево-судинних подій.
Окрім того, в метааналізі 14 рандомізованих контрольованих досліджень (n=2149) встановлено, що учасники, які приймали коензим Q10, демонстрували вищу здатність переносити фізичне навантаження та мали нижчу смертність, аніж ті, хто приймав плацебо (Lie L. et al., 2017).
Сьогодні в Україні доступний унікальний засіб Корамаг® (фармацевтична компанія «Асіно»). Це вітамінно-мінеральний комплекс, до складу якого входять: хлорид калію, карбонат магнію, коензим Q10, вітамін Е, екстракт софори японської (джерело вітаміну Р). Корамаг® може бути рекомендовано як дієтичну добавку до раціону харчування з метою первинної профілактики ССЗ, зокрема в постковідний період.
Підготувала Наталія Нечипорук