3 серпня, 2022
Персоніфікований підхід до лікування гострих бронхітів у дітей: міфи чи практика, що заснована на доказах?
 Патологія бронхолегеневої системи в дітей, зокрема гострі бронхіти (ГБ), є однією з 5 найпоширеніших причин звертання пацієнтів по амбулаторну допомогу. ГБ у будь-якому періоді дитинства найчастіше має вірусну етіологію. Незважаючи на чинні прості й чіткі рекомендації щодо лікування бронхітів, реальна клінічна практика показує різноманітні, часто необґрунтовані, підходи з поліпрагмазією до ведення таких пацієнтів. Особливо важливим є поширена практика призначення антибіотиків (АБ). Окрім побічних ефектів вони призводять до зростання проблеми антибіотикорезистентності, яку сьогодні Всесвітня організація охорони здоров’я (ВООЗ) розцінює як загрозу національній безпеці.
Патологія бронхолегеневої системи в дітей, зокрема гострі бронхіти (ГБ), є однією з 5 найпоширеніших причин звертання пацієнтів по амбулаторну допомогу. ГБ у будь-якому періоді дитинства найчастіше має вірусну етіологію. Незважаючи на чинні прості й чіткі рекомендації щодо лікування бронхітів, реальна клінічна практика показує різноманітні, часто необґрунтовані, підходи з поліпрагмазією до ведення таких пацієнтів. Особливо важливим є поширена практика призначення антибіотиків (АБ). Окрім побічних ефектів вони призводять до зростання проблеми антибіотикорезистентності, яку сьогодні Всесвітня організація охорони здоров’я (ВООЗ) розцінює як загрозу національній безпеці.
У керівництвах Американської академії педіатрії, Британського торакального товариства та ін. з лікування гострих респіраторних інфекцій (ГРІ) верхніх і нижніх дихальних шляхів лікувальна тактика залежить від вираженості симптомів, віку, загального стану здоров’я, тяжкості перебігу захворювання. Проте однаковими є вимоги дотримання температурного режиму, вологості повітря і корекція водного балансу [27].
Три режимних завдання в лікуванні ГРІ та ГБ
1. Оптимізація фізичних параметрів повітря.
Чисте прохолодне зволожене повітря в приміщенні, де перебуває хвора дитина, – це обов’язкова умова оптимального перебігу ГРІ (оптимальні фізичні параметри – температура 17-19 °С, вологість – 75-90%).
2. Режим харчування.
- Абсолютно неприпустиме примусове годування.
- Раціон – легкозасвоювані вуглеводи.
- Зменшення об’єму одного годування за рахунок збільшення кратності прийому їжі.
3. Регідратація.
- Збільшення добового об’єму рідини в 1,5-2 рази.
- Температура рідини – кімнатна.
Критеріями ефективної регідратації є: вологість слизових оболонок і шкіри, ефективний діурез, нормалізація температури тіла і частоти серцевих скорочень.
Британське торакальне товариство, Національний інститут здоров’я і досконалості допомоги (National Institute for Health and Care Excellence, NICE) 7 лютого 2019 р. оприлюднило клінічну настанову «Гострий кашель: призначення антимікробних засобів» (NG120) [25]. Ця рекомендація визначає стратегію призначення антимікробних препаратів для лікування гострого кашлю, пов’язаного з інфекцією верхніх дихальних шляхів або ГБ, у дорослих, осіб молодого віку та дітей. Вона спрямована на обмеження використання АБ і зниження резистентності до них (рис. 1, 2) [25].
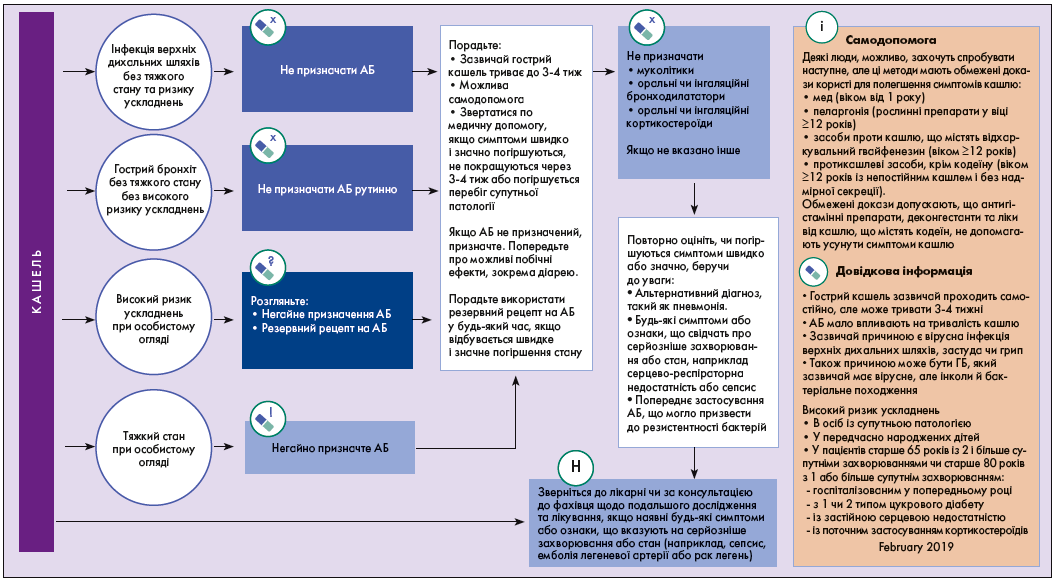 Рис. 1. Ведення пацієнтів із кашлем і ГБ
Рис. 1. Ведення пацієнтів із кашлем і ГБ
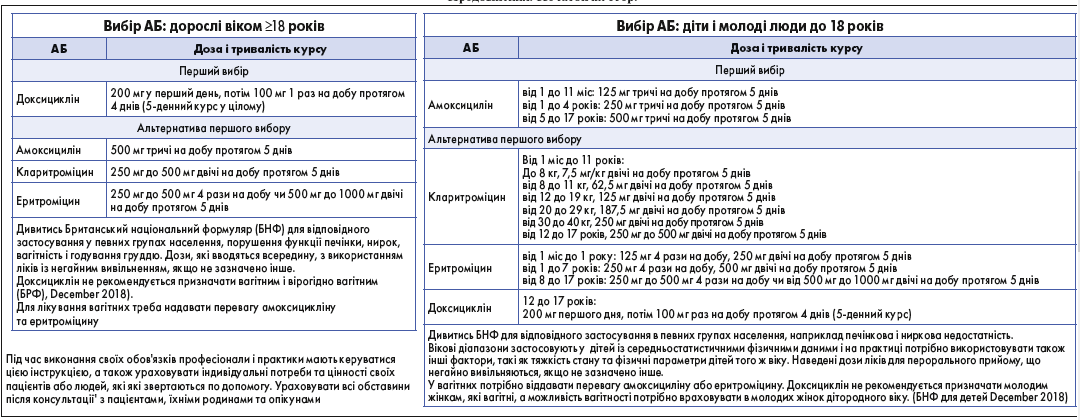 Рис. 2. Вибір АБ для лікування кашлю і ГБ
Рис. 2. Вибір АБ для лікування кашлю і ГБ
Зазвичай АБ в разі ГРІ та ГБ не призначають. Оскільки в їхній етіології провідне значення мають віруси, актуальним є пошук етіотропного лікування ГРІ із використанням препарату з противірусним і антибактеріальним спектром. Декаметоксин являє собою четвертинну амонієву сполуку, що належить до поверхнево-активних речовин, які розчиняються у воді і мають антисептичні властивості. У клінічній практиці декаметоксин використовують для небулайзерної терапії у формі стерильного розчину в небулах під торговою назвою Декасан® виробництва фармацевтичної компанії «Юрія-Фарм» (Україна). Декаметоксин внесений до електронної бази даних хімічних сполук і сумішей PubChem, яка існує з 2004 року, належить Національному центру біотехнологічної інформації США (NCBI) і є підрозділом Національної медичної бібліотеки США (PubMed) [26].
У керівництвах Европейського респіраторного і Британського торакального товариств перевагу в способі доставки ліків надано небулайзеру (рівень доказовості ІА) [11, 23, 24, 28] завдяки тому, що:
- небулайзерна терапія – це таргетна терапія, тобто введення препарату в «мішень – збудник у дихальних шляхах»;
- будь-яка речовина, яку введено в дихальні шляхи, діє вдвадцятеро швидше, ніж при пероральному прийомі;
- за необхідності можливе використання високих доз препарату і досягнення ефекту за короткий проміжок часу;
- є можливість застосування в будь-якому віці – не потребує додаткових зусиль для виконання процедури;
- відсутня необхідність синхронізації глибокого вдиху і застосування пристрою, як при використанні дозованих інгаляторів;
- дає можливість застосовувати лікарські засоби без системних побічних ефектів;
- це неінвазивний метод, який не чинить травмувального впливу на психіку (передусім дитячу).
Перше повідомлення про антисептичні властивості декаметоксину з’явилося 28 травня 1881 р., коли в «Британському медичному журналі» доктор медицини J.G. Sіncler Coghill написав про результати лікування пацієнтів із пульмонологічними захворюваннями за допомогою інгаляцій розчином декаметоксину («Antiseptic inhalation in pulmonary affections»).
Спектр дії декаметоксину. Антимікробний спектр декаметоксину вивчався на 350 штамах мікроорганізмів [5]. У дослідженнях доведено, що декаметоксин має широкий спектр дії:
- бактерицидний – на грампозитивні (стафiлококи, стрептококи, коринебактерії, капсульнi бактерії) і грамнегативні мікроорганізми (синьогнійна паличка, ешерихії, сальмонели, шигели, клебсієли, вібріони);
- фунгiцидний – на дрiжджоподiбнi гриби, збудники епiдермофiтiї, трихофiтiї, мiкроспорiї, еритразми, деякi види плiснявих грибiв (аспергiли, пенiцили);
- протипротозойний – на трихомонади, лямблiї;
- вiруліцидний – на складні ліпофільні віруси грипу A, B, простого герпесу, вірус везикулярного стоматиту, ВІЛ, віруси гепатиту) [5, 13, 17, 19-21];
- чинить виражену віруліцидну дію на SARS-CoV-2 (коронавірус; див. Інструкцію для медичного застосування);
- руйнує екзотоксини бактерій і знижує адгезію коринебактерій, сальмонел, стафілококів [15].
Декаметоксин виявляє бактерицидну дію щодо стафілококів у концентрації 0,9 мкг/мл. Фекальний стрептокок гине при концентрації декаметоксину в препараті 3,9 мкг/мл. Родина нтеробактерій виявилася найчутливішою до концентрації 15,6 мкг/мл. Протей і сальмонели гинуть за концентрації декаметоксину 7,8 мкг/мл. Для досягнення бактерицидного ефекту на спороутворювальну форму Bacіllus аnthracoides достатньо 0,2 мкг/мл препарату. Фунгіцидний ефект на гриби роду Candida забезпечує концентрація 7,8 мкг/мл [15].
У концентрації 0,2 мг/мл чинить виражену віруліцидну дію на SARS-CoV‑2, який спричинює коронавірусну хворобу COVID‑19, за умови тривалості експозиції 60 с, що виражається у зниженні інфекційного титру вірусу (див. Інструкцію для медичного застосування).
Механізм дії декаметоксину полягяє в деструкції та підвищенні проникності мікробної стінки, інактивації екзотоксину, пригніченні синтезу білка виключно в клітинах бактерії-збудника. Особливість дії препарату заснована на його здатності з’єднуватися з ліпідними структурами, порушувати проникність клітинної мембрани – це призводить до порушення гомеостазу всередині клітин, що зумовлює лізис останніх. Вибірковість дії препарату проявляється у відсутності впливу на клітини людського організму. Це пояснюється тим, що стінка бактеріальної клітини складається з коротких ліпідних ланцюжків, які швидко руйнуються під впливом декаметоксину, тоді як довгі ліпідні ланцюжки клітин людини не зазнають впливу його молекул. Для вказаного препарату характерний місцевий ефект, що обмежується поверхнею шкіри і слизових оболонок, він не всмоктується і не чинить системної дії на організм [3, 4, 10].
Важливою властивістю декаметоксину є повільне утворення стiйких форм мікроорганізмів у разі тривалого застосування і відсутність потреби збільшення ефективних концентрацiй препарату. Декаметоксин потенціює дію різних груп АБ (цефалоспоринів, карбапенемів, аміноглікозидів, фторхінолонів, поліміксину) [5, 14].
Встановлено, що декаметоксин у 128 разів потенціює антибактеріальну дію β-лактамів на резистентні штами стафілокока і знищує плазміди резистентності, що запобігає появі та поширенню антибіотикорезистентності (рис. 3) [18].
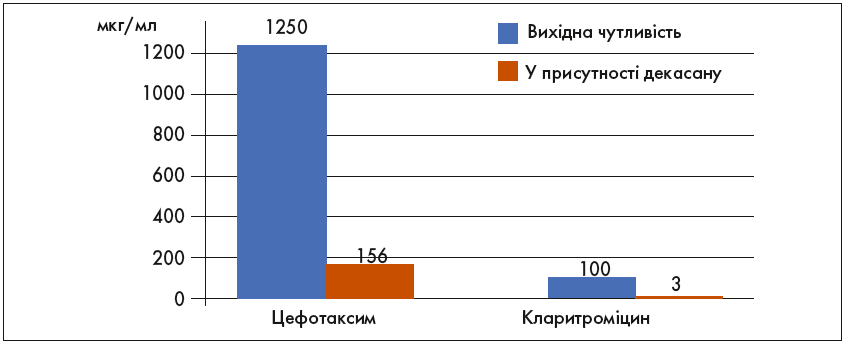 Рис. 3. Вплив суббактеріостатичних доз препарату Декасан® на чутливість стафілококів до цефотаксиму і кларитроміцину
Рис. 3. Вплив суббактеріостатичних доз препарату Декасан® на чутливість стафілококів до цефотаксиму і кларитроміцину
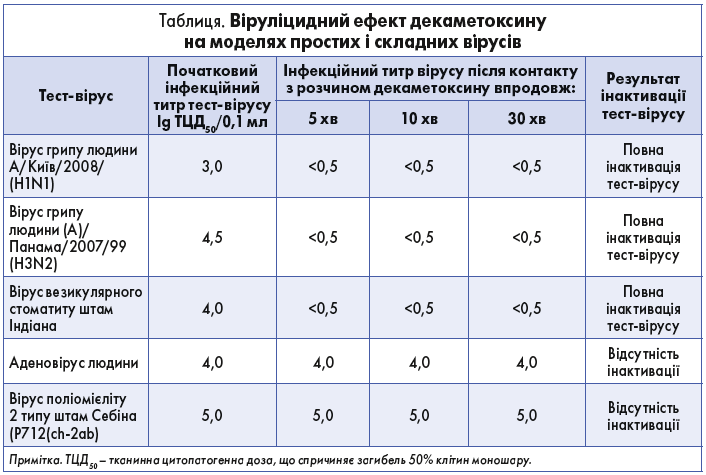
Особливу увагу заслуговує віруліцидний вплив декаметоксину. Противірусні властивості препарату вивчали в межах планових науково-дослідних робіт лабораторії біохімії Одеського науково-дослідного інституту вірусології та епідеміології ім. І.І. Мечникова «Дослідження протигрипозної та протигерпетичної ефективності деяких офіцинальних препаратів (амбен, унітіол, етоній, декаметоксин) для обґрунтування їх застосування у терапії масових вірусних інфекцій», «Обґрунтування розширення показань до застосування деяких препаратів як противірусних засобів» і лабораторії хіміотерапевтичних та імунобіологічних препаратів Українського науково-дослідного протичумного інституту ім. І.І. Мечникова «Дослідження антивірусної дії нових перспективних сполук та удосконалення деяких імунобіологічних препаратів», «Розробка імунобіологічних препаратів та дослідження антивірусних властивостей хіміопрепаратів». Механізм дії реалізується через руйнування ліпідного шару суперкапсидної оболонки складних вірусів [2]. Декаметоксин гальмує процес утворення вірус-специфічних внутрішньоядерних включень на культурі клітин, що свідчить про можливий вплив препарату на такі стадії репродукції вірусу, як проникнення вірусу в клітину та реплікація вірусної нуклеїнової кислоти, що пояснюється хімічною природою декаметоксину, який є поверхнево-активною речовиною [21]. У таблиці наведено результати дослідження віруліцидної дії декаметоксину на моделях простих і складних тест-вірусів. Декаметоксин у вигляді 0,02% розчину є ефективним препаратом щодо складних респіраторних вірусів, зокрема вірусу грипу, проте не чинить віруліцидної дії на прості віруси [22].
Дослідження з вивчення ефективності декаметоксину в пацієнтів із коронавірусним бронхітом довели, що для досягнення чітко вираженої віруліцидної активності щодо прототипного штаму коронавірусу необхідна концентрація 200 мкг/мл препарату, яка забезпечує повну інактивацію 100-1000 інфекційних доз вірусу за умови 30-хвилинної експозиції без проявів цитотоксичної дії [1, 6, 7, 10].
За результатами проведених вірусологічних і клінічних досліджень на базі ДУ «Національний інститут фтизіатрії i пульмонології iм. Ф.Г. Яновського НАМН України» колективом авторів під керівництвом доктора медичних наук, професора О.Я. Дзюблика (2020) була встановлена віруліцидна активність декаметоксину в концентрації 41,8-62,5 мкг/мл (0,004-0,006% розчин) по відношенню до коронавірусів, серед яких стійких до препарату штамів виявлено не було [8-10, 12].
Спектр застосування декаметоксину. Широкий спектр дії декаметоксину дає можливість використовувати його в різних галузях медицини, де він довів свою ефективність.
- Декаметоксин успішно застосовувався в лікуванні хворих з інфекційним загостренням бронхіальної астми. Було доведено, що додавання декаметоксину до базисної терапії в таких пацієнтів сприяло зменшенню інтоксикаційного синдрому (швидше на 2,6 дня проти контрольної групи) і швидшому (у середньому на 1-2 дні) зникненню субфебрилітету, рясного потовиділення і головного болю порівняно з контролем. Водночас мала місце швидша позитивна динаміка щодо зменшення симптомів астми в денний і нічний час, а також потреби в бронхолітиках. Частота бактерійних ускладнень у пацієнтів, які отримували декаметоксин, зменшилася на 23,1%, що було у 2,3 раза рідше, ніж у контрольній групі. Декаметоксин не чинив негативного впливу на показники зовнішнього дихання, добре переносився, побічних ефектів не спостерігали [3, 22].
- Додаткове інгаляційне застосування декаметоксину в комплексному лікуванні пацієнтів з інфекційним загостренням хронічного бронхіту дало можливість зменшити вираженість і тривалість (у середньому на 1-2 дні) проявів інтоксикаційного синдрому і катаральних проявів, скоротити тривалість інфекційного загострення хронічного бронхіту в середньому на 1,6 дня, середню тривалість застосування АБ на 2,1 дня, що дало змогу уникнути невиправданого призначення АБ у лікуванні нетяжкого перебігу інфекційного загострення хронічного бронхіту [5, 9].
- Доведено ефективність інгаляційного застосування антисептичного лікарського препарату на основі декаметоксину в профілактиці й лікуванні інфекційних ускладнень із боку органів дихання у хворих віком 12-18 років із критичними станами (основна група), якщо порівняти з групою, яка не отримувала небулізацію декаметоксином (група контролю). У пацієнтів, що отримували Декасан®, на 48-72-гу год штучної вентиляції легень відбувається поступове покращення: у 3,4 раза – показників динамічного комплаєнсу, у 2,4 раза – резистентності легень. У пацієнтів основної групи зазначалося раннє (на 3-тю добу) зниження абсолютної кількості мікроорганізмів у 104 разів в 1 мл трахеобронхіального секрету в порівнянні з вихідним рівнем мікробної колонізації та повна ерадикація збудників інфекційних ускладнень із боку дихальних шляхів через 14 діб (p<0,001). У пацієнтів, які додатково отримували небулізований Декасан®, спостерігалася суттєва зміна якісного бактерійного складу дихальних шляхів, монокультури (61,11%) переважали вже на 7-му добу, на противагу контрольній групі, де переважали асоціації мікроорганізмів (93,33%). Зменшення кількості грамнегативних мікроорганізмів в аспіраті дихальних шляхів хворих, що отримували Декасан®, відносно вихідних показників (r-Pirson=0,893) зазначалося на 7-му добу лікування [14].
- У порівняльному ретроспективному когортному контрольованому дослідженні у дітей віком від 1 міс до 18 років доведено ефективність профілактики вентилятор-асоційованих пневмоній (ВАП) за допомогою небулайзерних інгаляцій антисептичних та антибактеріальних засобів [16]. У дослідженні взяли участь 57 дітей, що потребували інвазивного респіраторного підтримання. Дітей було поділено на 2 групи: 1-ша група (n=31) – діти з потребою в інвазивному респіраторному підтриманні понад 3 діб – з першої доби після проведення інтубації трахеї вони отримували за допомогою небулайзера 0,02% декаметоксин і/або аміноглікозид (амікацин/тобраміцин). 2-га група (n=26) – діти з потребою в інвазивному респіраторному підтриманні понад 3 діб – не отримували профілактику ВАП за допомогою небулайзера.
У дітей основної групи зазначений значуще менший відсоток розвитку ВАП (у 3 хворих – 9,7%) проти контрольної групи (у 12 хворих – 46,2%). У дітей, які для профілактики ВАП отримували Декасан®, спостерігалося значне зменшення кількості виділених культур мікроорганізмів при дослідженні вмісту трахеобронхіального дерева на 3-тю добу (16 в основній групі проти 26 у контрольній). У дітей основної групи спостерігали відтермінування початку розвитку ВАП на пізніший період (на 25-ту добу проти 18 – у контрольній).
Доведена ефективність місцевого застосування декаметоксину в комплексному лікуванні пацієнтів гінекологічного профілю в разі гнійно-запальних захворювань м’яких тканин (абсцеси, карбункули, флегмони) і ЛОР-органів, для профілактики і лікування інфекційних гнійно-запальних ускладнень у хворих із тяжкою термічною травмою, а також під час виконання абдомінальних оперативних втручань [13].
Важливим, особливо в педіатричній практиці, є питання безпеки, хорошої переносимості препарату. Токсичність і побічні ефекти декаметоксину ґрунтовно вивчено в дослідах на тваринах і клінічній практиці. За допомогою методу обліку хромосомних аберацій шляхом реєстрації видимих структурних порушень хромосом у клітинах кісткового мозку мишей на стадії метафази встановлено, що декаметоксин не чинить мутагенної дії. У дослідах на тваринах препарат не спричиняв порушень репродуктивної функції самців і самок, не виявляв ембріолетальної дії, не чинив негативний вплив на розвиток потомства. У декаметоксину відсутня токсична дія на гуморальну і клітинну імунну відповідь у мишей за результатами тестів реакції гіперчутливості сповільненого типу й за кількістю антитілоутворювальних клітин у селезінці, титрів гемаглютинінів у сироватці крові [5].
Декаметоксин у концентрацiї, що застосовується в Декасанi, не має токсичної дiї. Пiдiгрiвання препарату до 38 °C перед застосуванням пiдвищує ефективнiсть його дiї. У разі запальних явищ і подразнення шкіри препарат потрібно розводити дистильованою водою у співвідношенні 1:1 або 1:2. У зв’язку з вiдсутнiстю всмоктування передозування не спостерiгається. Серед відомих побічних реакцій, що відображені в інструкції до препарату, у деяких пацієнтів можливий розвиток підвищеної iндивiдуальної чутливості. У таких осiб після застосування препарату можлива поява висипань на шкiрi, печіння, сухості, свербежу та інших місцевих алергічних реакцій, при ендобронхiальному введеннi може з’являтися вiдчуття жару за грудниною, що минає через 20-30 хв пiсля закiнчення процедури [13].
Незважаючи на 140-річну історію досвіду використання декаметоксину в медичній практиці, до сьогодні виникають необґрунтовані, недоведені твердження, які потребують пояснення:
Згідно з інструкцією до препарату декаметоксин селективний щодо мікроорганізмів і не руйнує клітини організму людини. Препарат з’єднується з ліпідними структурами виключно бактеріальної клітини, порушує проникність клітинної мембрани, що призводить до порушення гомеостазу всередині клітин і лізису, оскільки стінка бактеріальної клітини складається з коротких ліпідних ланцюжків, які швидко руйнуються під впливом декаметоксину, тоді як довгі ліпідні ланцюжки клітин людини не зазнають впливу його молекул [13, 26].
Для згаданого препарату характерний місцевий ефект, що обмежується поверхнею шкіри і слизових оболонок, він не всмоктується і не чинить системної дії на організм [13, 26].
Висновки
 Гострі респіраторні вірусні інфекції – найчастіша причина розвитку бронхітів у дітей.
Гострі респіраторні вірусні інфекції – найчастіша причина розвитку бронхітів у дітей.
 Антибактеріальна терапія не рекомендована для рутинного лікування ГБ.
Антибактеріальна терапія не рекомендована для рутинного лікування ГБ.
 Інгаляційна терапія за допомогою небулайзерів забезпечує вдвадцятеро швидший ефект від лікування в порівнянні з пероральними засобами.
Інгаляційна терапія за допомогою небулайзерів забезпечує вдвадцятеро швидший ефект від лікування в порівнянні з пероральними засобами.
 Застосування розчину Декасан® для небулайзерної терапії дає можливість уникнути невиправданого призначення АБ у разі нетяжкого перебігу інфекцій респіраторного тракту. Комбіноване застосування АБ із Декасаном зменшує ризики невдачі монотерапії АБ і частоту антибіотикорезистентності.
Застосування розчину Декасан® для небулайзерної терапії дає можливість уникнути невиправданого призначення АБ у разі нетяжкого перебігу інфекцій респіраторного тракту. Комбіноване застосування АБ із Декасаном зменшує ризики невдачі монотерапії АБ і частоту антибіотикорезистентності.
 Застосування інгаляційного антисептика Декасан® має наукове обґрунтування, препарат довів свої ефективність і безпеку в лікуванні інфекцій респіраторного тракту.
Застосування інгаляційного антисептика Декасан® має наукове обґрунтування, препарат довів свої ефективність і безпеку в лікуванні інфекцій респіраторного тракту.
Список літератури – у редакції.
Тематичний номер «Пульмонологія, Алергологія, Риноларингологія» № 1-2 (58-59) 2022 р.