2 лютого, 2023
«Життя – біль»: як допомогти паліативним пацієнтам позбутися больового синдрому?
Життя з больовим синдромом (БС) – це екзамен не тільки для хворого, а й для лікаря, особливо коли йдеться про клінічні стани, за яких біль стає тривалим/постійним супутником пацієнта. Хто з медичних спеціалістів повинен займатися менеджментом БС? Чи дозволено сімейному лікарю призначати опіоїдні аналгетики (ОпА)? Забезпечити гідні умови існування паліативного пацієнта чи безпорадно розвести руками зі словами «А що я можу зробити?» – чи має моральне право лікар на такий вибір, ураховуючи наявність на фармацевтичному ринку дієвих і оптимальних з точки зору безпеки опцій для знеболення? Які з інноваційних препаратів допомагають зробити фінальні акорди життя невиліковних хворих приємними (наскільки це можливо), а не моторошними?
Цих непростих питань торкнулися учасники професійної онлайн-дискусії PRO palliative, що відбулася 7 грудня 2022 р.: онкологи, психологи, клінічні фармакологи, психіатри.
Біль як ознака життя
 Учасники однойменного майстер-класу – Зоя Володимирівна Максимова, завідувачка Центру паліативної допомоги медичної мережі «Добробут» (м. Київ), лікарка мобільної служби паліативної допомоги БФ «СВОЇ», й Андрій Леонідович Гардашніков, лікар-онколог КНП «Обласний клінічний онкологічний центр Кіровоградської обласної ради» (м. Кропивницький), – проаналізували величезний пласт питань, пов’язаних зі знеболенням у рамках паліативної допомоги, призначенням ОпА, зокрема морфіну, й можливих альтернатив, дотриманням професійної етики тощо.
Учасники однойменного майстер-класу – Зоя Володимирівна Максимова, завідувачка Центру паліативної допомоги медичної мережі «Добробут» (м. Київ), лікарка мобільної служби паліативної допомоги БФ «СВОЇ», й Андрій Леонідович Гардашніков, лікар-онколог КНП «Обласний клінічний онкологічний центр Кіровоградської обласної ради» (м. Кропивницький), – проаналізували величезний пласт питань, пов’язаних зі знеболенням у рамках паліативної допомоги, призначенням ОпА, зокрема морфіну, й можливих альтернатив, дотриманням професійної етики тощо.
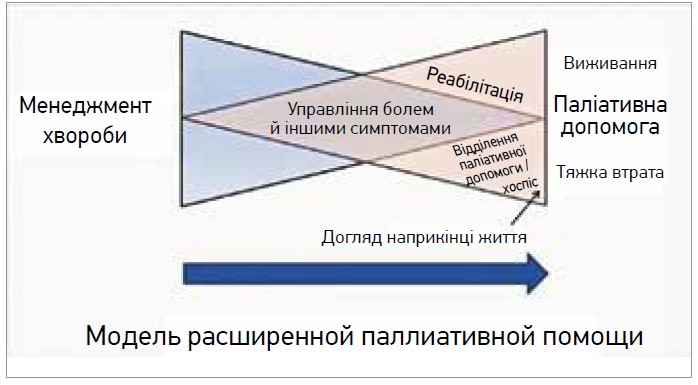
Як зазначили спікери, багато лікарів вважають, що паліативна допомога – це допомога лікаря в підготовці до смерті. Насправді вона передбачає значно більше: це і про підхід до людини як до цілісної системи; і про можливість жити повноцінним життям до останньої хвилини; і про турботу стосовно максимально активного соціального життя й уникнення ізоляції та самотності; і про постійний контроль і менеджмент симптомів; і про переглядання плану дій, підтримку родини пацієнта та психологічного комфорту в сім’ї (рис. 1).
! Невід’ємна частина паліативної допомоги – контроль болю. Його варто здійснювати з моменту встановлення діагнозу невиліковної хвороби.
Хронічним болем (ХБ) вважається той, що триває понад 3 місяці та супроводжується пролонгацією періоду загоєння тканин. За різними даними, поширеність ХБ і рецидивного болю становить 7-45%. Частіше від нього страждають жінки. На жаль, попри відчутне погіршення якості життя хворих із ХБ сімейні лікарі не завжди корегують цей симптом.
Варто зауважити, що ХБ спостерігається не тільки в онкологічних пацієнтів (частота – 84%): від нього страждають 89% хворих на ревматоїдний артрит, 82% пацієнтів із хворобою Паркінсона, 67% – із хронічним обструктивним захворюванням легень (ХОЗЛ), 67% – із цирозом печінки, 64% – із цукровим діабетом, 63-80% – із вірусом імунодефіциту людини, 47-50% – із хронічною нирковою недостатністю, 47% – із хворобою Альцгеймера й деменцією, 43% – із розсіяним склерозом (Higginson I. J., 1997; Solano J. P., Higginson I. J., 2006).
Рис. 1. Розширена модель паліативної допомоги
«Згідно з Уніфікованим клінічним протоколом паліативної медичної допомоги при хронічному БС (2012), який нині переглядається робочою групою, не тільки онкологічні пацієнти мають право на знеболення, – нагадав А. Л. Гардашніков. – Проте в пошуку відповіді на запитання, хто повинен призначати ОпА й виписувати рецепт паліативному хворому, сімейний лікар і онколог нагадують гравців у бадмінтон: вони безжально «ганяють по колу» пацієнта, немов волан. Хочу наголосити, що обидва спеціалісти (як і лікарі іншого профілю) мають рівнозначне право призначати ОпА. Не варто цього боятися! Через безпідставні упередження фахівців життя пацієнта з ХБ стає нестерпним».
Інший бік медалі – страх призначення ОпА й асоційованих із ними виникнення залежності, посилення інтенсивності болю, притаманний пацієнтам. Однак, як зауважили експерти, найчастіші побічні ефекти ОпА (зокрема морфіну), з якими вони стикаються в практичній діяльності, – нудота й закрепи.
Ще один поширений міф, який циркулює й у медичному середовищі, й серед хворих, полягає в переконанні, що використання морфіну зумовлює вищий ризик летальності. «Раніше морфін призначали пацієнтам у вкрай тяжкому стані як «винагороду» перед смертю. Тобто рівень смертності в цій популяції апріорі вищий, аніж серед хворих помірної тяжкості, що й спричинило поширення такого хибного уявлення», – пояснив Андрій Леонідович.
Що ж небезпечніше: знеболення ОпА чи його відсутність? За словами Зої Максимової, незадоволена потреба в адекватному знеболенні часто стає причиною суїцидів / суїцидальних спроб, це підтверджений практикою та статистикою факт. «Деколи пацієнти просять: «Зробіть мені укол, щоб я помер, я не в змозі більше терпіти біль», – поділилася гірким досвідом доповідачка.
У цьому контексті спікери сформулювали декілька важливих тез і порад колегам.
- Що раніше пацієнт отримає адекватне знеболення, то кращим у нього буде прогноз і успішнішим – лікування.
- Довіряйте пацієнту та його опису інтенсивності болю (тільки хворий здатний визначати, наскільки сильно йому болить). Інтенсивність болю оцінюйте при кожному огляді пацієнта – в стані спокою та під час руху.
- Якість життя й гідність людини мають залишатися пріоритетом.
- Визначайте тип болю – ноцицептивний, нейропатичний, змішаний, дисфункціональний або проривний, використовуючи різні шкали оцінки інтенсивності болю (візуально-аналогова шкала (ВАШ), вербальна, мімічна – для ноцицептивного болю (НцБ), DN4 – для нейропатичного болю (НпБ), PAINAD – для пацієнтів, які не розмовляють або страждають від деменції, СРОТ – для реанімаційних хворих).
- Корегуйте проривний біль. Це епізод сильного болю, що виникає в пацієнтів, які отримують стабільну терапію ОпА в режимі, що дає змогу постійно контролювати біль на рівні слабкого (Mercadante S., Portenoy R. K., 2016). Оцінюють проривний біль за опитувальниками BPQ (2007), ABPAT (2014). Він буває спонтанний і спровокований (рухом, кашлем, медичною процедурою), потребує обов’язкової корекції додатковою дозою ОпА.
- Уникайте висловлювань «наркотики», «наркота» стосовно ОпА.
- У разі змішаного болю комбінуйте декілька знеболювальних засобів.
«НпБ ефективно вгамовують препарати канабісу. Сподіваюся, їх застосування дозволять в Україні», – висловив припущення Андрій Гардашніков.
Основні принципи терапії хронічного БС за рекомендаціями Всесвітньої організації охорони здоров’я (ВООЗ) такі:
- Віддавати перевагу пероральному прийому препаратів (таблетовані форми та трансдермальні терапевтичні системи – ТТС) протягом максимально тривалого часу.
- Застосовувати знеболювальні засоби «за годинником» (через фіксовані проміжки часу); наступну дозу вживати до моменту, коли мине ефект попередньої (працюємо на випередження).
- Призначати терапію по висхідній – від ненаркотичних аналгетиків до ОпА.
- Дотримуватися індивідуального підходу (правильна доза – та, що знеболює).
- Реєструвати всі побічні ефекти й корегувати їх.
- Обирати основний аналгетик і ад’ювантні засоби залежно від інтенсивності болю та його патогенезу.
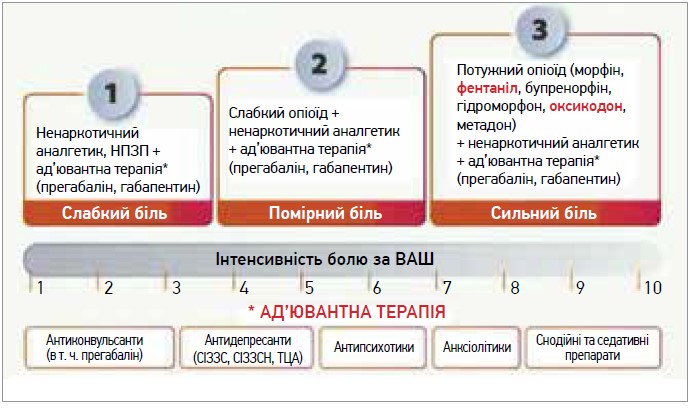
У разі хронічного БС ВООЗ рекомендує триступеневу схему фармакологічного знеболення (рис. 2).
Рис. 2. Триступенева схема знеболення в разі хронічного БС (ВООЗ, 2016)
Примітки: НПЗП – нестероїдні протизапальні препарати;
СІЗЗС – селективні інгібітори зворотного захоплення серотоніну;
СІЗЗСН – селективні інгібітори зворотного захоплення серотоніну та норадреналіну; ТЦА – трициклічні антидепресанти
«Проте наведена схема не враховує досягнень сучасної фармакології, онкології та стадійність пухлинного процесу, недостатньо відображає патофізіологію болю, – уточнила Зоя Максимова. – НПЗП, що рекомендуються як 1-ша сходинка, в максимальних дозах можуть використовуватися лише 7-10 днів з огляду на гастротоксичність та інші побічні ефекти. Також хочу зауважити, що один із лідерів лікарських призначень – налбуфін – не підходить для лікування хронічного БС».
Щоби зрозуміти, коли потрібно зробити заміну ОпА, спікери порадили дотримуватися такої тактики. Варто дізнатися разову дозу (РД), яку приймає пацієнт. Час у годинах, протягом якого препарат, що прийнятий у РД, ефективний – «А». Поділивши 24 на кількість годин «А», протягом яких БС контролюється, отримаємо потрібну кратність прийому. Помноживши РД на потрібну кратність прийому, визначимо добову дозу для адекватного знеболення. Якщо розрахункова добова доза вища за максимальну добову дозу препарату, потрібно призначити потужніші ОпА.
Учасники дискусії проаналізували переваги й недоліки популярних ОпА, рекомендованих паліативним пацієнтам з інтенсивним БС.
Морфін (морфіну сульфат, морфіну гідрохлорид – таблетована форма 5 і 10 мг) діє швидко, через 30-40 хв, ефективно вгамовує біль протягом 4-6 год, дає змогу контролювати проривний біль на тлі прийому інших ОпА.
Стандартної, як і максимальної добової, дози морфіну в інструкції не вказано. Правильна доза – та, яка полегшує біль (ВООЗ, 1996).
Недоліки препарату – обмежене використання при печінковій і нирковій недостатності, побічні ефекти (нудота, закреп, гістаміноподібні реакції).
! 3 таблетки морфіну сульфату 10 мг еквівалентні 1 ампулі морфіну гідрохлориду 10 мг/мл 1,0 мл.
У разі сильного болю також використовують фентаніл у вигляді ТТС, що доступний на українському ринку понад 2 роки (Фентавера, Acino). Він у 100 разів потужніший за дією порівняно з морфіном, забезпечує контроль болю протягом 72 год, характеризується нижчими рівнем звикання й частотою побічних ефектів, представлений у різних варіантах дозувань.
Це препарат вибору для пацієнтів із порушенням ковтання за умови відсутності уражень шкіри. Титрація дози протягом доби до максимально можливої – 300 мкг/год.
Основними особливостями препарату, які необхідно врахувати при його застосуванні, є те, що він починає діяти не раніше ніж через 12 год; не підходить у разі вираженої жовтяниці, гіпертермії, гіпергідрозу, шкірних захворювань; може спровокувати контактний дерматит.
«Ефект у разі використання трансдермального пластиру Фентавера настає повільно, але плавно. Препарат накопичується в підшкірній жировій клітковині. Діє протягом 48-72 год. ТТС Фентавера – вихід для пацієнтів, які не можуть ковтати або погано реагують на ін’єкції», – зазначила Зоя Максимова.
Вона навела дані анкетування, здійсненого БФ «СВОЇ» серед 130 пацієнтів, які використовували ТТС фентанілу. Половина опитаних відзначили зменшення споживання ОпА швидкої дії на тлі застосування пластиру, 36% – зниження інтенсивності БС на 2-3 бали за ВАШ, у 10% спостерігалася відсутність ефекту, в 4% – побічна дія (нудота, порушення свідомості).
! Не можна клеїти пластир Фентавера на щойно поголену шкіру, зони з волосяним покривом, травмовану та/або вологу шкіру, забороняється його різати. Оптимальні зони фіксації: передпліччя, спина, грудна клітка, внутрішня поверхня стегна. Слід забезпечувати повний контакт пластиру зі шкірою, а при його зміні змінювати й місце аплікації.
«Опіоїди (морфін, ТТС фентанілу), крім знеболення, впливають на задишку: всупереч побоюванням у низьких дозах ці препарати зменшують вираженість задишки, частоту дихальних рухів, у тому числі за наявності ХОЗЛ, бічного аміотрофічного склерозу», – наголосила Зоя Володимирівна.
У рамках бесіди експерти не оминули увагою й «паперові» нюанси, що регламентують використання ОпА й часто стають бар’єром, який заважає медичному спеціалісту рекомендувати саме цю групу засобів. Призначення наркотичних аналгетиків (виписування рецептів) регулюється Постановою Кабінету Міністрів від 13.05.2013 № 333, Наказами МОЗ України від 19.07.2005 № 360 і від 07.08.2015 № 494.
«Рецепт форми № 3 – ціна страждань пацієнта в разі, коли лікар боїться призначити опіоїдний аналгетик і виписати рецепт. Не ігноруйте потребу пацієнта в знеболенні! – закликав колег Андрій Гардашніков. – До речі, можна одночасно виписувати рецепт на різні лікарські форми, наприклад ампули й таблетки. На одному рецептурному бланку дозволяється виписувати препарат у кількості, потрібній на 15 днів лікування. Для таблетованого морфіну – 90-360 шт., морфіну в ампулах – 180 шт., трамадолу в капсулах – 120 шт. Виправлення на рецепті не дозволяються: якщо допущено помилку, рецепт перекреслюємо по діагоналі, а в кутку робимо позначку «На списання» й повертаємо відповідальній особі. Для виписування нового рецепту використовуємо новий бланк». «Зараз вже існує можливість виписки електронних рецептів, але в аптеці повинні приймати традиційні паперові рецепти форми № 3, не мають права відмовити», – додала Зоя Максимова. Важливо, що можливість виписати рецепт форми Ф-3 має лікар будь-якої спеціальності, у котрого є ліцензія на медичну практику. І він при цьому не повинен мати жодного спеціального дозволу на роботу з ОпА, адже йдеться про рецепт, а не про зберігання таких речовин.
Підбиваючи підсумки дискусії, спікери наголосили, що успіх лікування БС забезпечує, в тому числі, використання ад’ювантних засобів на всіх етапах терапії – антидепресантів, антиконвульсантів, глюкокортикоїдів, міорелаксантів. Роль ад’ювантів особливо важлива в разі НпБ і болю, спричиненого ураженням кісток. Ефективність призначення для ад’ювантної терапії продемонстрували прегабалін (Неогабін, Acino); пластир із канабідіолом (CBD).
«Забезпечити паліативному пацієнту можливість контролю болю, позбавити його бюрократичних перешкод під час придбання препаратів, надати хворому шанс провести останні місяці життя гідно й комфортно – обов’язок кожного лікаря», – озвучили спільну думку учасники майстер-класу.
Не морфіном єдиним. Сучасні форми для знеболення: коли, кому, як
 Властивості та можливості використання сучасних ОпА ретельно проаналізувала завідувачка кафедри фармакології Національного медичного університету (НМУ) ім. О. О. Богомольця (м. Київ), доктор медичних наук, професор Ганна Володимирівна Зайченко.
Властивості та можливості використання сучасних ОпА ретельно проаналізувала завідувачка кафедри фармакології Національного медичного університету (НМУ) ім. О. О. Богомольця (м. Київ), доктор медичних наук, професор Ганна Володимирівна Зайченко.
Щороку паліативної медичної допомоги потребують близько 40 млн осіб, однак отримують її лише 14%. Домінувальним симптомом, який найістотніше погіршує якість життя паліативних пацієнтів, є БС, що збільшує потребу в сучасних ОпА.
У США зареєстровано 14 монопрепаратів і 8 фіксованих комбінацій для використання в триступеневій фармакотерапії БС за ВООЗ. В Україні доступні лише 8 позицій: налбуфіну гідрохлорид (85% у структурі призначень, за даними про обсяги роздрібних продажів у групі ОпА за 2021 р.); морфін (10%); трамадол (4,5%); кодеїн + парацетамол (0,05%); бупренорфін (0,04%); фентаніл (0,02%); оксикодон (0,01%); тримеперидин (0,01%).
Для корекції помірного болю (2-га сходинка триступеневої схеми фармакотерапії) використовуються слабкі опіоїди: кодеїн, трамадол, гідрокодон, оксикодон, морфін, гідроморфон. «Хочу акцентувати увагу на оксикодоні: на 2-й сходинці він застосовується в дозі ≤20 мг як монотерапія або в комбінації з парацетамолом. На 3-й сходинці – для корекції сильного болю – оксикодон призначають у дозі понад 20 мг. Також на цьому етапі показані морфін, гідроморфон», – уточнила Г. В. Зайченко.
За хімічною структурою ОпА розподіляють на:
- похідні фенантрену (морфін, бупренорфін, кодеїн, гідрокодон, налоксон, оксикодон та ін.);
- похідні бензоморфану (пентазоцин);
- похідні фенілпіперидину (фентаніл, солі фентанілу);
- похідні дифенілгептану (метадон, пропоксифен);
- похідні фенілпропаноламіну (трамадол, тапентадол).
Оксикодон – напівсинтетичний препарат, похідне алкалоїду тебаїну. Застосовується переважно перорально та ректально, рідше – парентерально, інтраназально. Синтезований у Німеччині в 1916 р. Механізм дії: стимулює μ-, κ-, σ-підвиди опіатних рецепторів, блокує міжнейронну передачу больових імпульсів у різних відділах центральної нервової системи, включно з корою головного мозку та спинним мозком. Характеризується невеликою частотою конкурентних взаємодій з іншими ліками. Тривалість знеболювальної дії – 12 год.
Долоніка (Acino) – оксикодон із повільним вивільненням, що забезпечує тривале й рівномірне надходження в кров активної речовини, 24-годинний контроль симптомів захворювання, оптимальну абсорбцію, рівномірне насичення рецепторів, збільшення біодоступності, покращення профілю безпеки, підвищення комплаєнсу.
Долоніка характеризується меншим ризиком побічних ефектів порівняно з іншими ОпА: ймовірність появи інфекційних ускладнень, нудоти, блювання нижча, ніж така при використанні морфіну.
Переваги препарату Долоніка:
- пролонгована дія (ефект протягом 12 год);
- застосування 2 р/день;
- ефективна корекція ХБ і можливість тривалого прийому;
- широкий вибір форм, персоніфікований підбір дози (10/20/40/80 мг).
Рекомендації щодо дозування препарату Долоніка наведено в таблиці 1.
Г. В. Зайченко описала ключові особливості препарату Долоніка.
- Таблетки не можна дробити або жувати через ризик швидкого вивільнення активної речовини, проте допускається їх поділ по розділювальній смужці.
- Метаболізується в печінці за участю системи цитохрому Р450 – у нороксикодон (під впливом CYP3A4) й оксиморфон (під впливом CYP2D6).
- Біодоступність у разі перорального прийому – 75%, що майже вдвічі перевищує таку морфіну.
- Роль метаболітів у фармакодинамічних ефектах незначна.
- Оксикодон і його метаболіти виводяться із сечею та калом.
- Проникає крізь плацентарний бар’єр, виявляється в грудному молоці.
- Період напіввиведення форми пролонгованої дії становить 4-5 год.
При порівнянні ОпА орієнтуються на активність морфіну, яка прийнята за 1. Для оксикодону відповідний коефіцієнт становить 1,5 (тобто його знеболювальний ефект у 1,5 раза потужніший за такий морфіну), для бупренорфіну – 40, а для фентанілу – 80-100.
Фентаніл (традиційна форма) був синтезований у 1959 р. Застосовується з метою знеболення під час оперативних втручань. Взаємодіє переважно з μ-опіоїдними рецепторами. Низька молекулярна маса, висока ліпофільність, відсутність біотрансформації у шкірі дають змогу використовувати фентаніл у вигляді ТТС. У разі внутрішньовенного введення починає діяти через 15 с. Основний недолік фентанілу – короткочасність дії.
Фентаніл представлений у вигляді декількох лікарських форм (табл. 2).
«ТТС фентанілу – оптимальні для тривалого контролю болю. Їх знеболювальний ефект триває 72 год. Показані пацієнтам зі стабільною потребою в опіоїдах, є терапією вибору у хворих із порушенням ковтання, обструкцією шлунково-кишкового тракту, поганою переносимістю морфіну або низьким комплаєнсом до пероральної терапії. Також можуть використовуватися за вираженої патології нирок. Наркогенний потенціал ТТС фентанілу нижчий, аніж інших опіатів. На відміну від традиційного «короткоживучого» фентанілу, доступний в Україні інноваційний фентаніл Фентавера (Acino) у вигляді пластиру ефективно усуває біль приблизно на 3 дні», – уточнила Г. В. Зайченко.
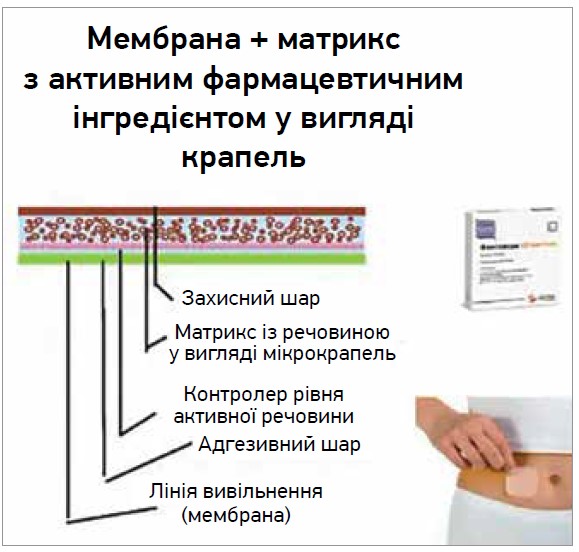
Фентавера належить до 3-го покоління ТТС, найбільш технологічно просунутих (рис. 3).
Рис. 3. Принцип дії ТТС Фентавера
Переваги ТТС Фентавера:
- Ефективний, неінвазивний і зручний метод знеболення на період до 3 днів.
- Придатна для використання особами без медичної підготовки.
- Стабільний контроль болю, немає «стелі» аналгетичної дози.
- Ризик побічних ефектів (нудоти, блювання, закрепу, сонливості, затримки сечі) на 30-60% нижчий порівняно з аналогічним показником для пероральних форм морфіну.
- Зручна для індивідуального дозування.
Фентаніл метаболізується за допомогою CYP3A4. Одночасне застосування з інгібіторами цього ферменту (флуконазол, вориконазол, циметидин, еритроміцин, кларитроміцин, грейпфрутовий сік) збільшує плазмову концентрацію фентанілу й ризик передозування; з індукторами CYP3A4 (карбамазепін, фенітоїн, фенобарбітал, звіробій, рифампіцин) – знижує плазмову концентрацію й активність фентанілу.
Оптимальні зони для фіксації ТТС Фентавера – тулуб або верхні відділи руки (грудна клітка, плече, спина). 1-ша аплікація ТТС (пластиру) демонструє аналгетичний ефект через 12-18 год. Під час використання першої дози можливий проривний біль, що потребує терапії ОпА короткої дії протягом 2-3-го дня застосування пластиру. Потім дозу ТТС фентанілу можна збільшити з урахуванням потрібної додаткової щоденної кількості ОпА короткої дії. Корегування дози проводять із кроком 12 або 25 мкг/год відповідно до додаткової добової потреби в ОпА короткої дії. Корекція дози допускається тільки через 72 год після нанесення першого пластиру.
«Нові лікарські форми ОпА – Долоніка та Фентавера – мають оптимальний профіль ефективність\переносимість щодо усунення БС у паліативних пацієнтів і відчутно покращують якість їхнього життя», – резюмувала Г. В. Зайченко.
Біль, тривога, інсомнія: життя в патологічному трикутнику
 Професор кафедри медичної психології, психосоматичної медицини та психотерапії НМУ ім. О. О. Богомольця, доктор медичних наук Олена Олександрівна Хаустова приділила увагу в доповіді коморбідності БС і тривоги, інсомнії, депресії в умовах війни; зупинилася на можливостях їх немедикаментозної та фармакотерапевтичної корекції.
Професор кафедри медичної психології, психосоматичної медицини та психотерапії НМУ ім. О. О. Богомольця, доктор медичних наук Олена Олександрівна Хаустова приділила увагу в доповіді коморбідності БС і тривоги, інсомнії, депресії в умовах війни; зупинилася на можливостях їх немедикаментозної та фармакотерапевтичної корекції.
Як повідомила спікерка, в сучасних війнах найбільше страждають цивільні особи – від фізичних (побиття, страта, сексуальне насильство й ін.); психологічних (погрози, допити, звинувачення, викрадення, імітація страти, перебування без комунікацій, приниження, позбавлення волі); соціальних (знищення майна, втеча/міграція, розрив зв’язків у спільнотах, сім’ях) і екологічних (знищення інфраструктури, тактика випаленої землі, непридатне для життя середовище) тортур. Наразі українці перебувають в умовах гострої стресової реакції при травматичних повторювальних ситуаціях, що супроводжуються інсомнією, тривогою, болем. У багатьох спостерігається стійка соматизація, зокрема атиповий біль різної локалізації, тривалість якого перевищує 6 міс і суттєво погіршує якість життя.
Вплив емоційної складової на біль надзвичайно важливий. У дослідженні за участю людей, які пережили війну в Північному Косово, встановлено, що найпотужніший предиктор болю – гнів; із цією емоцією асоціювалися больові відчуття, локалізовані в зоні голови, грудей, живота (Shr-Jie W. et al., 2012). Гнів, ненависть, комплекс неповноцінності посилюють відчуття болю. Люди, які страждають від інтенсивного болю та/або болю з локалізацією в ділянці шиї, плечей, верхніх кінцівок, частіше змінюють або припиняють роботу/навчання через депресію чи травму. За наявності в пацієнта нестерпного болю та гніву підвищується ризик інсомнії й суїцидальних думок.
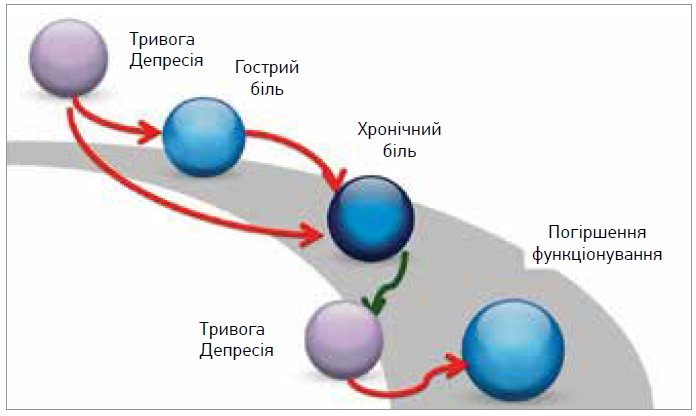
Гострий біль часто трансформується в ХБ; ХБ може поєднуватися з тривогою, депресією, порушеннями сну, зниженням когнітивних функцій, ізоляцією / соціальним відчуженням, проблемами в стосунках, зловживанням психоактивними речовинами, почуттям зневіри, нікчемності, безпорадності (рис. 4).
Рис. 4. Трансформація гострого болю в хронічний
Відповідно до уявлень сучасної психосоматики існує двобічний шлях розвитку від запалення й болю до тривоги та депресії.
«Біль – це завжди особистий досвід, різні пацієнти по-різному його відчувають, сприймають і проживають, – поділилася спостереженням О. О. Хаустова. – Виділяють три основні варіанти болю: НцБ, НпБ, ноципластичний (цей термін було запроваджено у 2018 р. як заміну визначенням «психогенний», «дисфункціональний»), а також змішаний біль. Нова концепція хронічного первинного болю відображена в Міжнародній класифікації хвороб 11-го перегляду: захворювання або тривалі умови, пов’язані з ХБ, слід визнати самостійно, навіть якщо чіткого розуміння основної етіології чи патофізіології відсутнє. Це свідомий відхід від практики позначення незрозумілого болю «психічним розладом із соматичними симптомами».
У квітні 2021 р. з’явилася настанова Національного інституту здоров’я та вдосконалення медичної допомоги Великої Британії (NICE) щодо лікування хронічного первинного та вторинного болю. У ній як ХБ визначено той, що триває понад 3 міс; як хронічний первинний біль – ХБ у ≥1 анатомічних зонах, що характеризується значним емоційним переживанням (тривога, гнів, фрустрація, пригнічений настрій) або функціональним порушенням (вплив на повсякденну діяльність і зменшення участі в соціальних ролях). Також у NICE розмежовано ноципластичний біль як первинний (без чіткого основного стану й непропорційний будь-якій видимій травмі чи захворюванню) та НпБ як вторинний (спричинений основним захворюванням).
Доповідачка описала декілька моделей менеджменту ХБ.
- Біопсихосоціальна, відповідно до якої терапія має бути мультимодальна й мультидисциплінарна, із залученням трьох лікарів-кураторів (а якщо серед них немає психіатра, то до команди мають входити лікарі двох медичних спеціальностей і клінічний психолог), активними психосоціальними втручаннями (рис. 5).
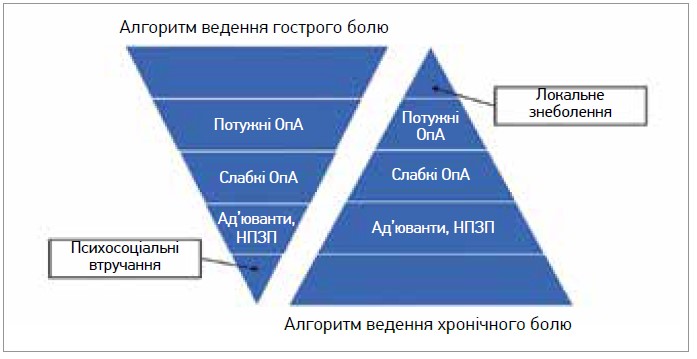
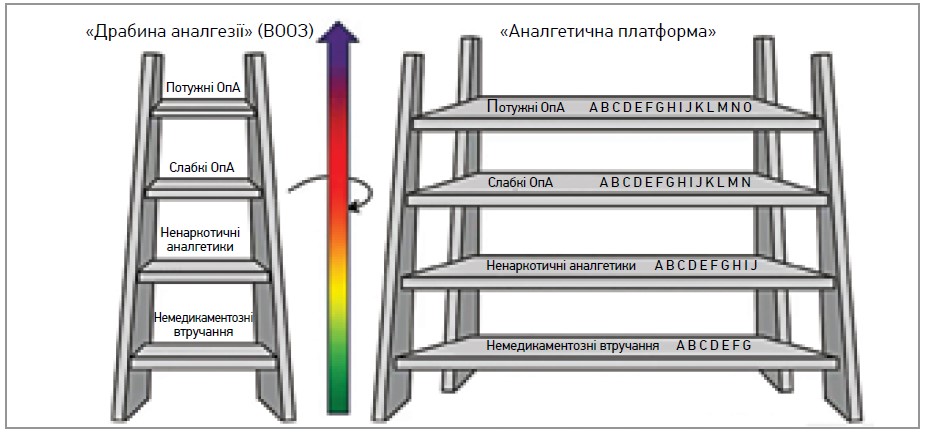
- «Від драбини до платформи» (Leung L., 2012; рис. 6).
- 8-рівнева міжпрофесійна система лікування ХБ, розроблена в Ottawa Hospital (Bell et al., 2020).
- Шотландська модель менеджменту ХБ.
Рис. 5. Мультидисциплінарний підхід до корекції ХБ
«Ефективність терапії ХБ підвищують інформування й залучення пацієнта в процес лікування, когнітивна поведінкова терапія, формування у хворого відчуття контролю над болем. Лікар не завжди може гарантувати пацієнту ліквідацію болю, тому одне із завдань – навчити його жити з болем, корегувати негативні думки про ХБ, зменшити страх, депресивні прояви», – підкреслила спікерка.
Рис. 6. Концепція менеджменту ХБ «від драбини до платформи»
Примітки: A – лікувальна фізкультура та фізіотерапія;
B – інтеграція розуму й тіла (наприклад, йога, медитація, релігійна підтримка);
C – гіпноз і релаксація; D – акупунктура; E – хіропрактика; F – зовнішня
терапія (лосьйони та ін.); G – інші опції комплементарної й альтернативної
медицини (тай-чи тощо); H – міорелаксанти (наприклад, циклобензаприн,
баклофен, дантролен); I – ін’єкційні засоби (стероїди, місцеві анестетики);
J – міжособистісне підкріплення (група підтримки); К – протисудомні засоби
(габапентин, прегабалін, ламотриджин); L – антидепресанти;
M – сполуки, що демонструють синергічну дію з ОпА (наприклад, канабіноїди);
N – когнітивна поведінкова терапія та психологічне консультування;
O – хірургічні та нейрохірургічні процедури.
Вибір фармакотерапії залежить насамперед від варіанта болю.
- Антиконвульсанти: НцБ, Нп Б.
- Антидепресанти: НцБ, НпБ, ноципластичний біль.
- Знеболювальні локальні ін’єкції: НцБ, Нп Б.
- Поведінкові стратегії: НцБ, НпБ, ноципластичний біль.
- Нейромодуляція: НцБ, Нп Б.
- НПЗП: Нц Б.
- Опіоїди: НцБ, Нп Б.
- Фізичні вправи: НцБ, ноципластичний біль.
Важливе місце в лікуванні НпБ (діабетична нейропатія, постгерпетична невралгія тощо) посідають габапентиноїди (габапентин, прегабалін). В Україні представлений препарат прегабаліну Неогабін (Acino), який успішно застосовується в лікуванні Нп Б. Початкова доза становить 75 мг 2 р/добу, через 3-7 днів її можна збільшити до 300 мг/добу, через 7 днів – до максимальної, а саме 600 мг/добу.
У пацієнтів із поєднанням НпБ та тривоги/інсомнії прегабалін достовірно знижував рівень тривоги й покращував сон (Siddall P. J. et al., 2006; Meyer-Rosberg K. et al., 2001), зменшував потребу в снодійних. Ефективні добові дози – 300-600 мг. У таких пацієнтів прегабалін є препаратом вибору.
Якщо ж НпБ поєднується з депресією, доповідачка порадила застосовувати дулоксетин (Дулоксин, Acino). Серед показань до використання дулоксетину – діабетичний периферичний Нп Б.
Доведено, що дулоксетин 120 мг/добу зіставний за ефективністю з комбінацією дулоксетин 60 мг + прегабалін 300 мг/добу та прегабаліном 600 мг/добу (Tesfaye S. et al., 2013). Проте в разі болю, що давить, або НцБ краще працює комбінація дулоксетин 60 мг + прегабалін 300 мг/добу.
При парестезії/дизестезії в разі неефективності дулоксетину 60 мг доцільніше збільшувати його дозу до 120 мг/добу, ніж додавати прегабалін. За наявності ХБ і неефективності прегабаліну 300 мг як стартової терапії краще додати дулоксетин 60 мг, а не підвищувати дозу прегабаліну.
! Найдієвішим наступним кроком лікування після стартової терапії виявилася саме комбінація дулоксетин 60 мг/добу + прегабалін 300 мг/добу.
«Терапія першої лінії в разі нейропластичного болю – антидепресанти (дулоксетин, флуоксетин, пароксетин, есциталопрам, сертралін або амітриптилін), навіть якщо діагноз депресії не встановлено», – повідомила О. О. Хаустова.
Ключовий меседж, який прозвучав у кожній із доповідей, полягає в такому: адекватне знеболення відповідно до наявних рекомендацій із використанням інноваційних ТТС (зокрема, препаратів Фентавера й Долоніка), вдалий підбір ад’ювантної терапії, призначення адекватних доз ОпА – пріоритетне завдання для лікаря та чи не єдина можливість гідного життєвого фіналу для паліативних пацієнтів.
Матеріали онлайн-дискусії PRO palliative доступні за посиланням:
https://pan.ac/palliative2022rec
Підготувала Олександра Марченко
UA-NEOG-PUB-012023-071
Медична газета «Здоров’я України 21 сторіччя» № 1-2 (537-538), 2023 р.