30 березня, 2023
Протокол надання медичної допомоги хворим на рак нирки
Рекомендовано Спілкою онкоурологів України
Сучасний розвиток медицини передбачає постійне удосконалення заходів з діагностики, лікування та профілактики захворювань з урахуванням вимог доказової медицини. Система стандартизації медичної допомоги орієнтована на розроблення медико-технологічних документів, які допомагають лікарю ефективно діяти в конкретних клінічних ситуаціях, уникаючи неефективних і помилкових втручань.
Протокол надання медичної допомоги хворим на рак нирки створено згідно з методикою, затвердженою наказом Міністерства охорони здоров’я України (МОЗ) № 751 від 28.09.2012 р. «Про створення та впровадження медико-технологічних документів зі стандартизації медичної допомоги в системі Міністерства охорони здоров’я України», зареєстрованим у Міністерстві юстиції України 29.11.2012 р. за № 2001/22313. Протокол розроблений на основі рекомендацій Європейської асоціації урологів «Рак нирки» та Національної онкологічної мережі США (NCCN). У протоколі зосереджено увагу на основних етапах надання медичної допомоги пацієнтам із раком нирки. При розробленні протоколу керувалися такими завданнями, як забезпечення якості, ефективності медичної допомоги та рівних можливостей доступу до неї пацієнтів з раком нирки, створення єдиних принципів здійснення профілактики, діагностики, лікування та реабілітації хворих, а також обґрунтування кадрового забезпечення та ресурсного оснащення закладу охорони здоров’я.
І. Паспортна частина
1.1. Діагноз – нирковоклітинний рак (НКР)
1.2. Шифр за міжнародною класифікацією хвороб Х перегляду – C64
1.3. Призначення
Протокол призначений для лікарів загальної практики – сімейних лікарів, онкологів, гематологів, хірургів-онкологів, радіологів, лікарів з променевої терапії, лікарів, що провадять господарську діяльність з медичної практики як фізичні особи-підприємці, керівників закладів охорони здоров’я різних форм власності та підпорядкування, організаторів охорони здоров’я.
1.4. Мета
Визначення комплексу заходів з раннього та своєчасного виявлення, діагностики та лікування НКР, а також медичної допомоги після закінчення спеціального лікування пацієнтам старшим 18 років.
ІІ. Загальна частина
Діагноз рак нирки встановлюється в медичних закладах на основі ультразвукового дослідження (УЗД), спіральної комп’ютерної томографії (СКТ), магнітно-резонансної томографії (МРТ), результатів гістологічного (цитологічного) дослідження біоптату та/або на основі морфологічного дослідження післяопераційного матеріалу. Перед початком спеціалізованого лікування необхідне всебічне обстеження з метою правильного встановлення ознак росту злоякісної пухлини, стадії захворювання.
Лікарі загальної практики – сімейні лікарі відіграють ключову роль в організації раннього (своєчасного) виявлення безсимптомного раку, заохоченні населення до профілактичних обстежень, сприянні виконанню усіх рекомендацій фахівців онкологічного профілю під час протипухлинного лікування. Саме на них покладається відповідальність у забезпеченні належної паліативної допомоги пацієнтам, які виявляють бажання перебувати вдома у термінальній стадії захворювання. Істотну допомогу в роботі лікаря загальної практики – сімейного лікаря надають фельдшери та медсестри за фахом «Медсестринство в онкології».
ІІІ. Основна частина
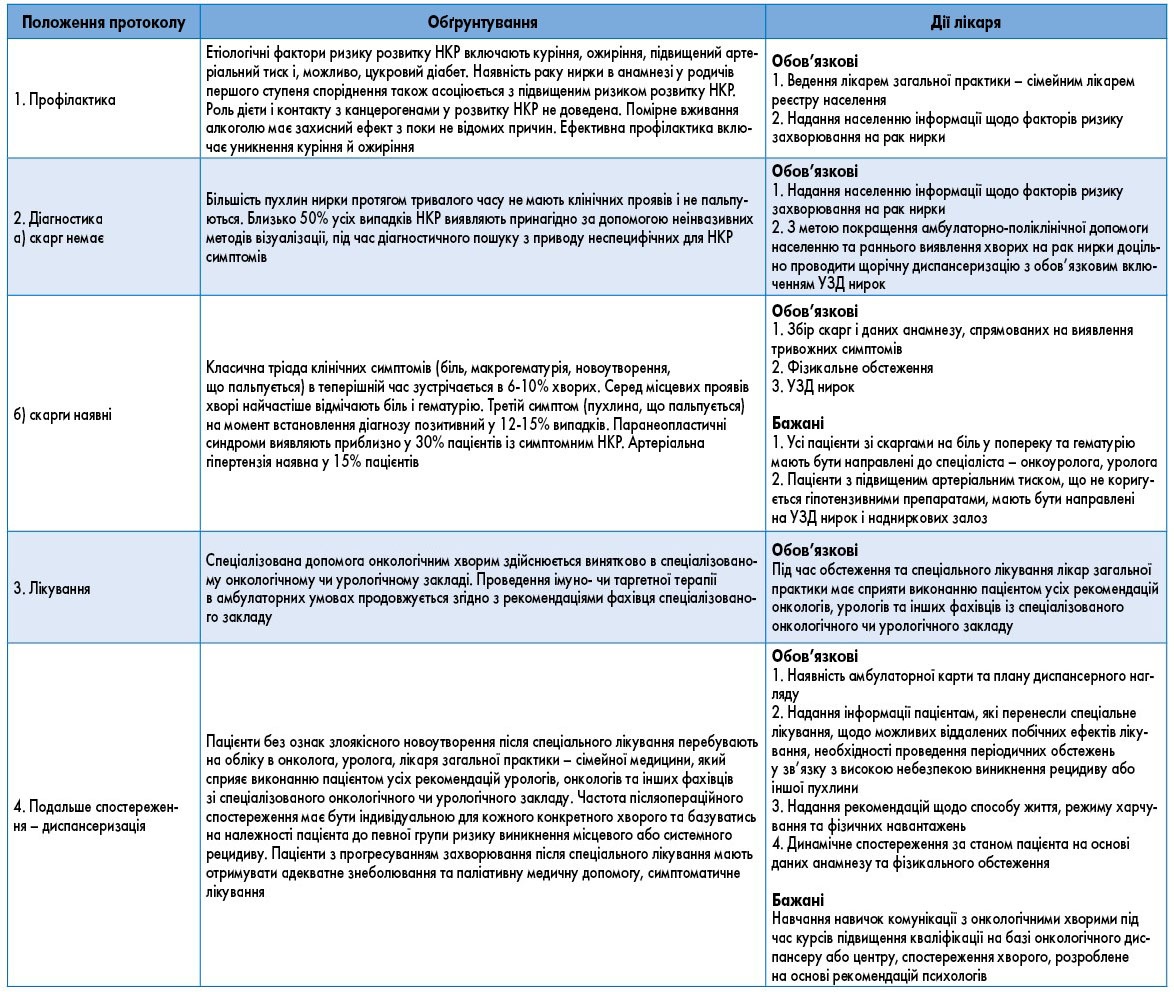
3.1. Первинна медична допомога
3.2. Вторинна (спеціалізована) медична допомога
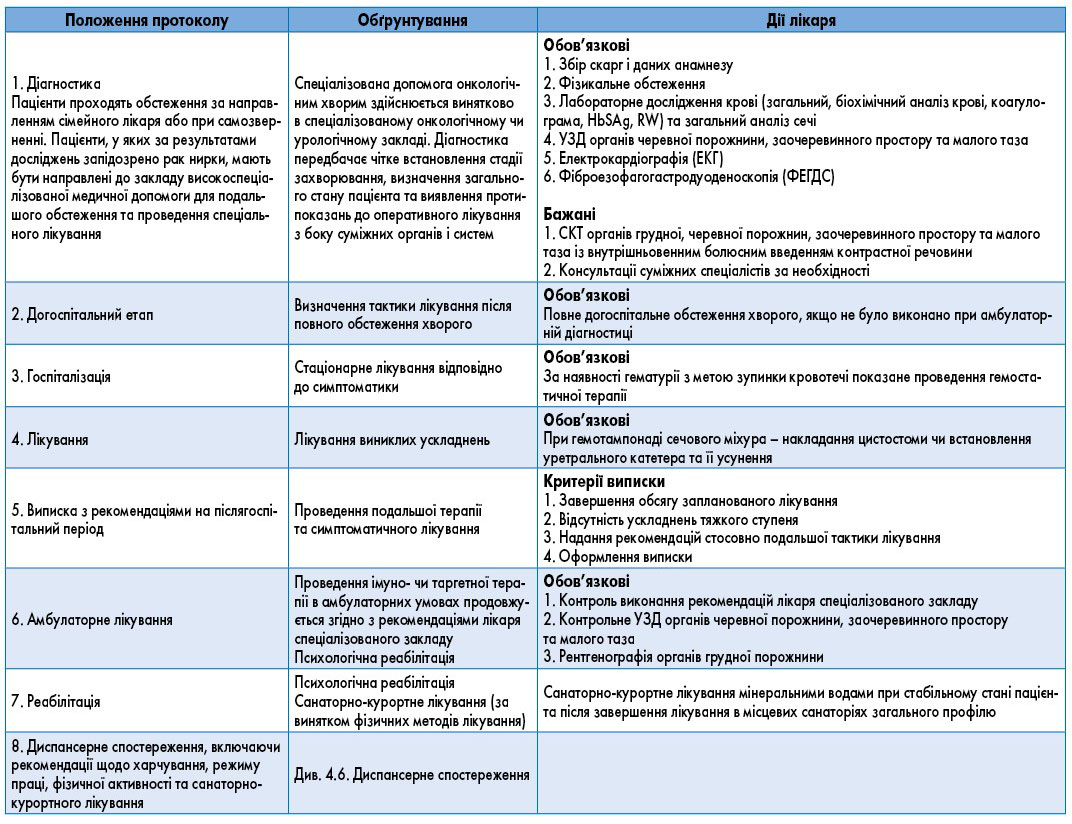
3.2.1. Вторинна (не онкологічна, не урологічна) медична допомога
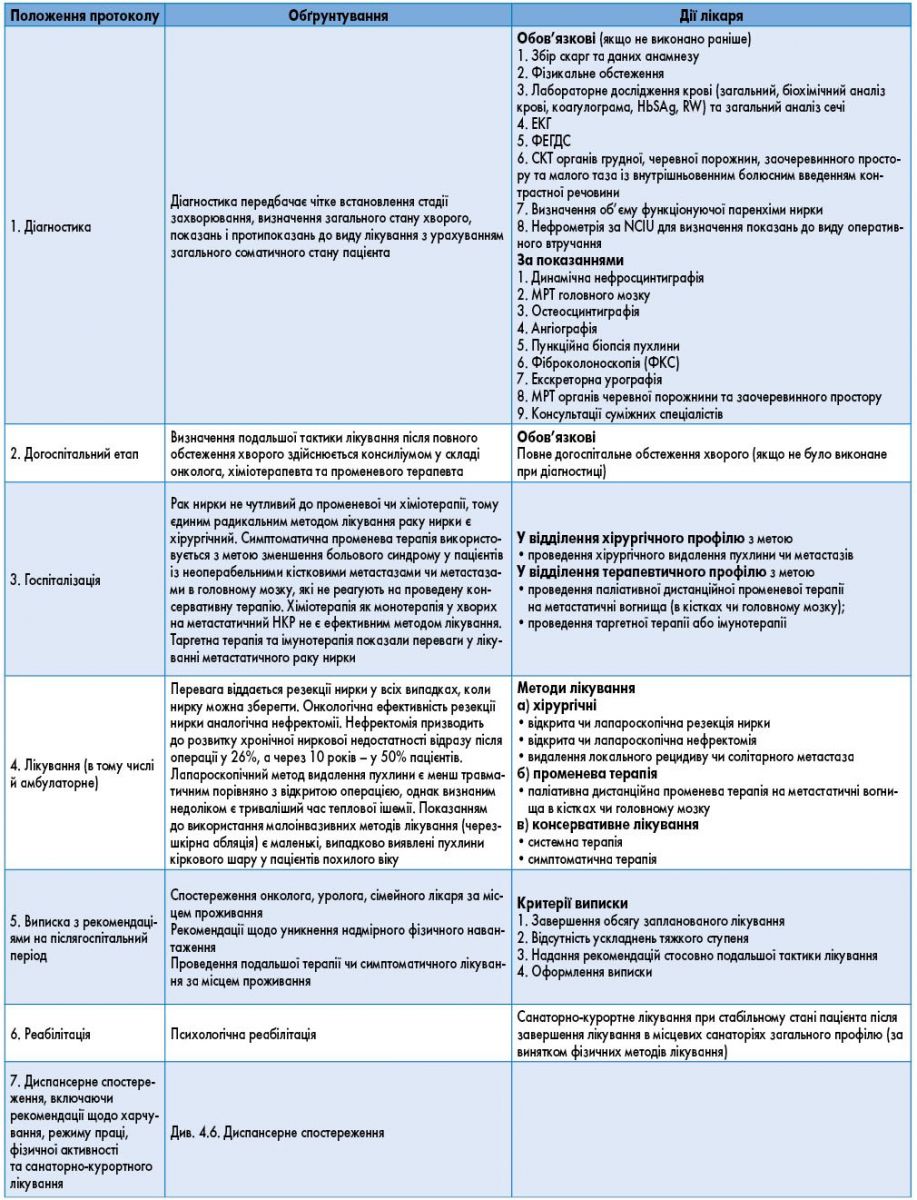
3.3. Третинна (онкологічна, урологічна) медична допомога
Клінічний маршрут хворих на рак нирки для установ, що надають третинну (онкологічну, урологічну) медичну допомогу, подано на рисунку 4.1.
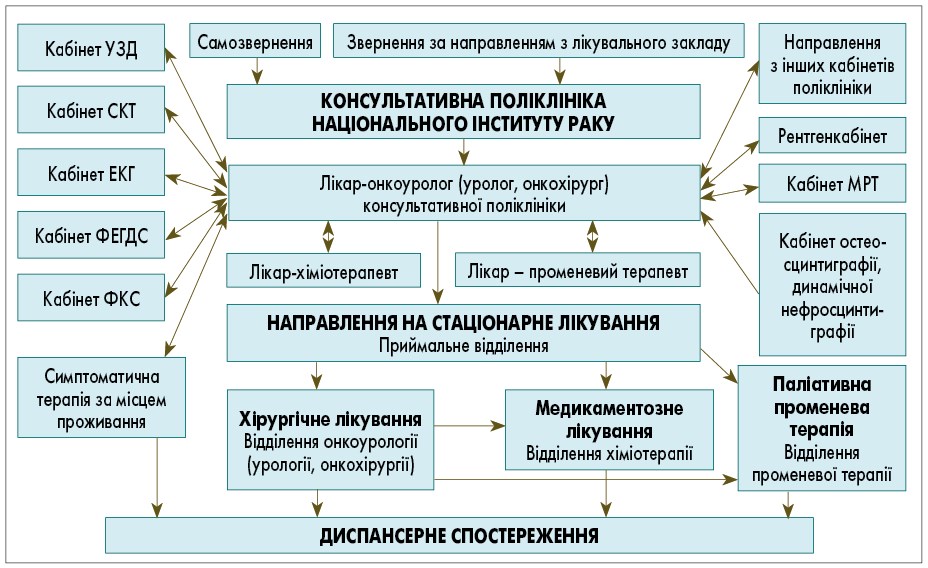 Рис. 4.1. Клінічний маршрут хворого на рак нирки
Рис. 4.1. Клінічний маршрут хворого на рак нирки
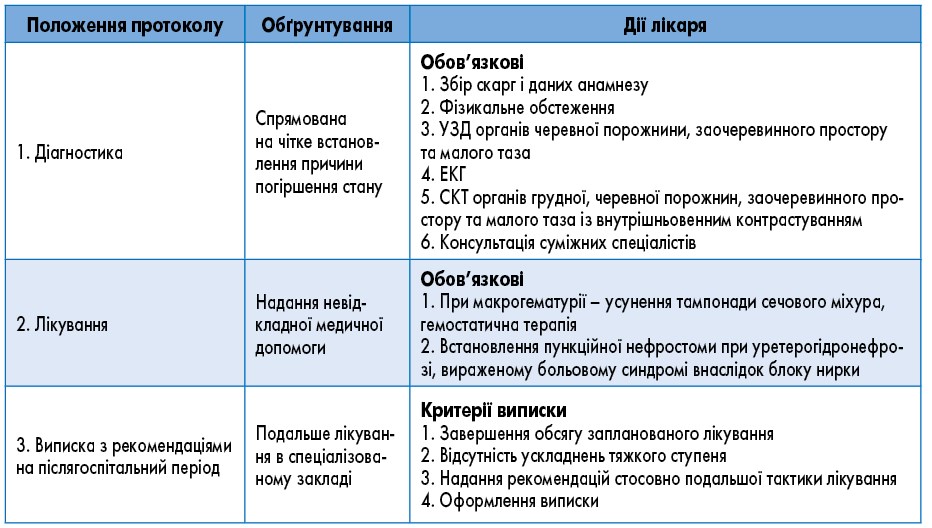
3.4. Екстрена медична допомога
ІV. Опис етапів медичної допомоги
4.1. Перелік обов’язкових обстежень, з якими пацієнт має прийти до закладу третинного рівня надання медичної допомоги
- Лабораторне дослідження крові (загальний аналіз крові із лейкоцитарною формулою, біохімічний аналіз крові – рівень сечовини, креатиніну, загального білка, білірубіну, глюкози, електролітів; коагулограма, HbSAg, RW), загальний аналіз сечі.
- ЕКГ.
- ФЕГДС.
- СКТ органів грудної, черевної порожнин, заочеревинного простору та малого таза із внутрішньовенним контрастуванням.
4.2. Перелік обстежень, які виконуються за показаннями
- ФКС – при скаргах з боку шлунково-кишкового тракту або підозрі на його залучення в пухлинний процес.
- Динамічна нефросцинтиграфія проводиться для визначення окремої функції кожної нирки з метою встановлення ймовірності виникнення ниркової недостатності в післяопераційний період.
- Екскреторна урографія показана хворим із проявами макрогематурії для диференційної діагностики від папілярних новоутворень верхніх сечових шляхів.
- МРТ нирок, сечових шляхів, органів черевної порожнини показана при підозрі на пухлинний тромбоз нижньої порожнистої вени, для уточнення діагнозу при підозрі на уротеліальний рак верхніх сечових шляхів; головного мозку – при наявності неврологічної симптоматики.
- МРТ показана пацієнтам з алергією на контрастну речовину, що застосовується для підсилення при комп’ютерній томографії (КТ), і вагітним без порушення функції нирок.
- Остеосцинтиграфія обов’язково проводиться при наявності болю в кістках та підвищенні вмісту лужної фосфатази в сироватці крові.
- Біопсія пухлини нирки з метою верифікації діагнозу показана при пухлинах діаметром до 3 см з високою ймовірністю доброякісності або у разі відмови хворого від оперативного втручання з метою верифікації діагнозу та проведення нехірургічного лікування.
4.2.1. Рекомендації щодо діагностичної оцінки НКР
- Контрастна мультипараметрична мультиспіральна КТ органів грудної та черевної порожнин рекомендована для проведення діагностики та стадіювання НКР.
- Слід використовувати МРТ для оцінювання ураження вен пухлинними тромбами з метою зменшення променевого навантаження або у разі неможливості застосування контрастного підсилення при КТ.
- Необхідно застосовувати неіонізуючі методи, переважно контрастне УЗД, для динамічного спостереження за пухлинами невеликого розміру, пухлинними тромбами та диференціації незрозумілих утворень у нирках.
- Сканування кісток скелета та позитронно-емісійну комп’ютерну томографію (ПЕТ-КТ) не рекомендується проводити рутинно з метою стадіювання НКР.
- Біопсію пухлини нирки рекомендується виконувати перед проведенням абляції пухлини і системної терапії при відсутності раніше отриманих патогістологічних даних.
- Черезшкірна біопсія рекомендується пацієнтам, які перебувають під активним спостереженням.
- Черезшкірну біопсію пухлини нирки слід проводити під контролем коаксіальної техніки.
- Проведення біопсії кіст нирки не рекомендовано.
- Для гістологічної верифікації солідних пухлин нирок слід використовувати тонкоголкову біопсію. Застосування аспіраційної біопсії не доцільне.
4.3. Лікування
4.3.1. Лікування локалізованого раку нирки
Більшість популяційних аналізів показують значно нижчу канцерспецифічну смертність пацієнтів, яких лікують хірургічним методом, ніж нехірургічними методами.
За даними клінічних досліджень, резекція нирки забезпечує кращі онкологічні та функціональні результати, ніж радикальна нефректомія, незважаючи на обраний хірургічний доступ. У разі застосування вищезгаданих методик не виявлено статистично достовірної різниці щодо рівня канцерспецифічної виживаності.
4.3.1.1. Загальні зауваження щодо ведення локалізованого раку нирки
- Загальна виживаність після резекції нирки зіставна з такою після радикальної нефректомії на стадії с/рТ1 НКР.
- Виконання іпсилатеральної адреналектомії під час резекції нирки чи нефректомії не рекомендоване пацієнтам без клінічних ознак інвазії в надниркову залозу, позаяк не впливає на виживаність, однак її варто проводити при пухлині верхнього сегмента.
- У пацієнтів із високим ризиком слід виконувати регіонарну лімфаденектомію, оскільки вона має клінічні переваги.
- У хворих на НКР з масивною гематурією чи болем у попереку, в яких пухлина є неоперабельною, емболізація може бути корисною як паліативний метод лікування.
- Після лапароскопічної радикальної нефректомії смертність нижча, ніж після відкритої нефректомії.
- Лапароскопічна та відкрита радикальна нефректомія характеризуються зіставними ранніми онкологічними результатами при пухлинах Т1-Т2а.
- Резекція нирки може бути виконана відкритим, лапароскопічним чи робот-асистованим методом залежно від досвіду хірурга.
- Резекція нирки може супроводжуватися вищим відсотком позитивного краю, ніж радикальна нефректомія.
- У більшості хворих, які перебувають під активним спостереженням, динаміка росту малих пухлин нирки низька, а прогресування до метастатичного захворювання відбувається рідко (1-2%).
- Не можна зробити однозначних висновків щодо смертності та онкологічних результатів кріоабляції та радіочастотної абляції при НКР. Дослідження низької якості свідчать про вищу частоту виникнення місцевих рецидивів при використанні термоабляції порівняно з резекцією нирки.
4.3.1.2. Рекомендації щодо лікування локалізованого раку нирки
- Пацієнтам з локалізованим НКР слід рекомендувати хірургічне лікування.
- Резекція нирки має пріоритет перед радикальною нефректомією у хворих на НКР стадії Т1.
- Показання до резекції нирки чи нефректомії мають базуватися на даних нефрометрії за NCIU (визначенні частки функціонуючої паренхіми нирки та локалізації пухлини).
- Виконання резекції нирки показане при наявності понад 55% функціонуючої паренхіми нирки на боці ураження.
- Проведення протягом 2-3 міс неоад’ювантної таргетної терапії дозволяє зменшити розмір пухлини, збільшити об’єм функціонуючої паренхіми нирки на боці ураження та виконати резекцію.
- Резекція нирки без ішемії або з локальною ішемією покращує функціональні результати порівняно з такими при центральній ішемії нирки.
- Не слід виконувати іпсилатеральну адреналектомію, якщо немає клінічних ознак інвазії в надниркову залозу, проте з метою запобігання виникненню локального рецидиву її проведення обґрунтоване при локалізації пухлини у верхньому сегменті нирки.
- Пацієнтам із несприятливим клінічним прогнозом, у тому числі з пухлинами великих розмірів, рекомендують розширену лімфаденектомію.
- Хворим на НКР з масивною гематурією чи болем у попереку, у яких пухлина є неоперабельною, пропонують емболізацію.
- Пацієнтам із пухлинами стадії Т2 чи місцево-поширеними пухлинами, яким не може були виконана резекція нирки за даними нефрометрії за NCIU, рекомендують лапароскопічну радикальну нефректомію.
- Не слід виконувати малоінвазивну радикальну нефректомію хворим зі стадією Т1, яким можна провести резекцію нирки будь-яким способом, включаючи відкритий.
- Не слід виконувати малоінвазивну хірургічну операцію, якщо такий підхід може погіршити онкологічні, функціональні та післяопераційні результати.
- При малих пухлинах нирки у хворих старшого віку та/або з вираженою супутньою патологією рекомендовані активне спостереження, радіочастотна абляція чи кріоабляція.
- Якщо пропонуються радіочастотна абляція, кріоабляція чи активне спостереження, слід повідомити пацієнта про вищий ризик місцевого рецидиву та/або прогресування захворювання.
4.3.2. Лікування місцево-поширеного НКР
Крім зауважень і рекомендацій, викладених у розділі 4.3.1 для локалізованого НКР, додаткового висвітлення потребують методи лікування місцево-поширеного процесу.
4.3.2.1. Загальні зауваження щодо ведення місцево-поширеного раку нирки
- У хворих на місцево-поширений НКР з клінічно збільшеними лімфатичними вузлами не доведено користі для виживаності виконання лімфаденектомії, однак її проведення надає інформацію для стадіювання захворювання.
- Враховуючи дані досліджень із доказовою базою, проведення нефректомії з тромбектомією при неметастатичному НКР може бути корисним.
- Емболізація пухлини та встановлення венозних фільтрів не покращують результати лікування.
- Ад’ювантне використання цитокінів не покращує виживаність хворих після нефректомії.
- Після нефректомії у вибраних пацієнтів із високим ризиком в одному з двох доступних для ознайомлення досліджень призначення сунітинібу в ад’ювантному режимі покращувало безрецидивну виживаність, але не загальну виживаність.
- Після нефректомії призначення сорафенібу, пазопанібу або акситинібу в ад’ювантному режимі не покращує безрецидивної та загальної виживаності.
4.3.2.2. Рекомендації щодо лікування місцево-поширеного НКР
- У пацієнтів з клінічно збільшеними лімфатичними вузлами лімфодисекція може бути виконана з метою покращення локального контролю та стадіювання захворювання.
- Видалення пухлини нирки з тромбектомією показане у пацієнтів з неметастатичним НКР.
- Не слід призначати сорафеніб, пазопаніб або акситиніб в ад’ювантному режимі.
- Сунітиніб в ад’ювантному режимі не рекомендований хворим групи високого ризику згідно з настановами International Metastatic RCC Database Consortium (IMDC)/Memorial Sloan Kettering Cancer Center (MSKCC) після видалення пухлини.
4.3.3. Лікування поширеного та метастатичного раку нирки
4.3.3.1. Локальна терапія поширеного/метастатичного раку нирки
Циторедуктивна нефректомія як первинна процедура може бути використана при лікуванні пацієнтів із задовільним загальним станом, хорошим прогнозом за IMDC/MSKCC та іншими прогностичними факторами.
Циторедуктивна нефректомія все ще застосовується у лікуванні хворих на метастатичний НКР:
- з паліативною метою;
- при поодиноких метастазах у разі можливості виконання метастазектомії;
- у разі хорошої відповіді або стабілізації процесу після первинної системної терапії. Проведення нефректомії підвищує ризик відкладення системної терапії внаслідок хірургічної травми, погіршення загального стану чи прогресування захворювання.
Крім того, деякі пацієнти не є кандидатами на циторедуктивну нефректомію, оскільки їх первинна пухлина вважається нерезектабельною.
Виконання циторедуктивної резекції нирки дозволяє зменшити об’єм пухлини, зберегти максимальну кількість функціонуючої паренхіми органа при мінімальній хірургічній травмі, що забезпечує зниження рівня ниркової недостатності та, як наслідок, – кращі результати системної терапії.
4.3.3.1.1. Загальні зауваження щодо локальної терапії поширеного/метастатичного раку нирки
- Призначення сунітинібу перед нефректомією у хворих на метастатичний НКР із сумнівним прогнозом за IMDC/MSKCC дає можливість отримати перевагу щодо виживаності при аналізі вторинних кінцевих точок та визначити пацієнтів, резистентних до системної терапії.
- Результати призначення тільки сунітинібу нічим не відрізняються від результатів негайної циторедуктивної нефректомії з подальшим прийомом сунітинібу у пацієнтів із сумнівним і поганим прогнозом за IMDC/MSKCC.
- Циторедуктивна нефректомія у пацієнтів із симультанним видаленням одиничного метастаза чи олігометастазів покращує виживаність і відтерміновує початок системної терапії.
- Виконання циторедуктивної резекції у поєднанні із системною терапією підвищує виживаність без прогресування та загальну виживаність порівняно з циторедуктивною нефректомією.
- Пацієнти із поганим прогнозом за IMDC/MSKCC (≥4 факторів ризику) не отримають переваги від хірургічного лікування.
- За винятком метастазів у головному мозку, та, можливо, в кістках, метастазектомія залишається оптимальним методом локальної терапії.
- Результати ретроспективних порівняльних досліджень вказують на вищу ефективність повної метастазектомії у контексті загальної та канцерспецифічної виживаності, відтермінування призначення системної терапії.
- Променева терапія на ділянку кісткових метастазів і метастазів у головному мозку при НКР значно полегшує локальні симптоми (наприклад, біль).
4.3.3.1.2. Рекомендації щодо локального лікування поширеного/метастатичного раку нирки
- Не слід виконувати циторедуктивну резекцію чи нефректомію у хворих із поганим прогнозом за IMDC/MSKCC.
- Не потрібно проводити негайну циторедуктивну резекцію чи нефректомію пацієнтам із сумнівним прогнозом за IMDC/MSKCC, які мають безсимптомну синхронну первинну пухлину та потребують системної терапії інгібітором фактора росту ендотелію судин (VEGFR) чи інгібітором тирозинкінази (ІТК).
- У пацієнтів із сумнівним прогнозом за IMDC/MSKCC, які мають безсимптомну синхронну первинну пухлину і потребують системної терапії VEGFR-ІТК, слід розпочати системну терапію без циторедуктивної резекції чи нефректомії.
- Потрібно обговорити можливу затримку виконання циторедуктивної резекції чи нефректомії під час терапії VEGFR-ІТК у пацієнтів із сумнівним прогнозом за IMDC/MSKCC, які мають довготривалу стійку відповідь та/або мінімальне залишкове метастатичне ураження.
- У пацієнтів із хорошим прогнозом і хорошими показниками, які не потребують системної терапії, слід провести негайну циторедуктивну резекцію чи нефректомію.
- У пацієнтів з олігометастазами необхідно виконати негайну циторедуктивну резекцію чи нефректомію, якщо можна досягти повного видалення метастазів.
- Для контролю місцевих симптомів слід запропонувати абляційну терапію, включаючи метастазектомію, пацієнтам із метастатичним захворюванням і сприятливими факторами, у яких досяжне повне видалення пухлини.
- При клінічно важливих метастазах у кістках або мозку для місцевого контролю та полегшення симптомів рекомендують стереотаксичну променеву терапію.
4.3.3.2. Системна терапія (хіміотерапія, імунотерапія, вакцини)
У зв’язку з тим що НКР розвивається із проксимальних канальців збиральної системи, цей вид пухлини має високий рівень експресії гена множинної медикаментозної стійкості і його продукту Р-глікопротеїну. Це є причиною резистентності до більшості хіміопрепаратів.
4.3.3.2.1. Загальні зауваження щодо системної терапії поширеного та метастатичного раку нирки
- Монотерапію інтерлейкіном (ІЛ)-2 та інтерфероном (ІФН) не можна використовувати для лікування місцево-поширеного та метастатичного НКР у зв’язку з її значно нижчою ефективністю порівняно з таргетною терапією та інгібіторами контрольних точок.
- Застосування ІФН у комбінації з бевацизумабом значно менш ефективне порівняно з таргетною терапією.
- Використання комбінації пембролізумабу й акситинібу у первинних пацієнтів з метастатичним НКР будь-якої групи за IMDC забезпечує кращі результати порівняно з сунітинібом.
- Акситиніб може бути залишений як монотерапія у пацієнтів з метастатичним НКР за виражених проявів токсичності терапії пембролізумабом.
- Монотерапія ніволумабом є первинним варіантом вибору після прогресування на фоні 1-ї або 2-ї ліній таргетної терапії.
- Сунітиніб чи пазопаніб можуть бути використані як 1-ша лінія терапії у пацієнтів зі сприятливим і сумнівним прогнозом за IMDC, котрі мають протипоказання до проведення терапії інгібіторами контрольних точок.
- Кабозантиніб може бути використаний як 1-ша лінія терапії у пацієнтів із метастатичним НКР та сумнівним і поганим прогнозом за IMDC, котрі мають протипоказання до проведення терапії інгібіторами контрольних точок.
- Принципи вибору системної терапії підсумовані в таблицях 4.1 та 4.2.
4.3.3.2.2. Рекомендації щодо системного лікування поширеного та метастатичного раку нирки
- Хіміотерапія чи імунотерапія ІФН-альфа чи ІЛ-2 у хворих на метастатичний НКР неефективні.
- Основні напрями системної терапії метастатичного НКР включають таргетну терапію та терапію інгібіторами контрольних точок або їх комбінацію.
4.3.3.3. Таргетна терапія
При спорадичних формах світлоклітинного НКР відбувається інактивація фактора, індукованого гіпоксією (HIF), що призводить до експресії VEGF та фактора росту тромбоцитів (PDGF), які ініціюють неоангіогенез. Цей процес істотно впливає на розвиток і прогресування НКР. Деякі таргетні препарати схвалені для використання при метастатичному НКР у США, Європі й Україні: сорафеніб, сунітиніб, бевацизумаб + ІФН-альфа, пазопаніб, еверолімус та акситиніб.
Більшість оприлюднених клінічних досліджень стосувалися світлоклітинного варіанта НКР, тому немає чітких рекомендацій щодо несвітлоклітинних варіантів. У більшості досліджень, метою яких була подальша реєстрація схвалених таргетних агентів, хворих стратифікували за групами ризику відповідно до шкали MSKCC. З часу розроблення критеріїв Моцера в еру цитокінів IMDC створено модель ризиків, що дає змогу точніше оцінити прогноз у пацієнтів із метастатичним НКР, які отримують лікування в еру таргетної терапії.
4.3.3.3.1. ІТК
Сорафеніб – це пероральний мультикіназний інгібітор з активністю проти Raf-1 серин/треонінкіназ, D-Raf, VEGFR-2, PDGFR, FLT-3 та с-КІТ. У дослідженні ІІІ фази, в якому порівнювали ефективність сорафенібу та плацебо після невдалої імунотерапії, показано покращення виживаності без прогресування (р<0,01). Загальна виживаність покращилася у хворих, що перейшли з групи плацебо до групи сорафенібу. У хворих із попередньо не лікованим метастатичним НКР сорафеніб не був ефективнішим за ІФН-альфа. У кількох дослідженнях при рефрактерності до сунітинібу використовували сорафеніб як препарат для групи контролю проти акситинібу, довітинібу або темсиролімусу. У жодному з цих досліджень не показано переваги виживаності порівняно з сорафенібом.
Сунітиніб – пероральний ІТК, що має протипухлинну й антиангіогенну активність. У 2-й лінії монотерапії забезпечує часткову ефективність в 34-40% випадків і стабілізацію захворювання >3 міс у 27-29% пацієнтів з метастатичним НКР. Використання препарату в 1-й лінії монотерапії сприяло досягненню довшої безрецидивної виживаності порівняно з ІФН-альфа. Загальна виживаність була вищою для пацієнтів, що отримували сунітиніб впродовж 26,4 та 21,8 міс, незважаючи на кросовер (зміну групи лікування). У дослідженні EFFECT використання сунітинібу в дозі 50 мг/день (4 тижні прийому/2 тижні без препарату) порівнювали з постійним безперервним застосуванням препарату в дозі 37,5 мг/добу у пацієнтів зі світлоклітинним варіантом метастатичного НКР. Середній час до прогресування захворювання в групі сунітинібу 50 мг був значно довшим, ніж в іншій групі (9,9 проти 7,1 міс відповідно). Не виявлено істотних відмінностей у загальній виживаності хворих (23,1 проти 23,5 міс; р=0,615). Токсичність була рівноцінна в обох групах. Через неістотний, але в цифровому значенні більший період до прогресування захворювання в першій групі автори рекомендували прийом сунітинібу в дозі 50 мг протягом 4 тижнів з перервою на 14 днів. Альтернативний режим – 2-тижневий прийом препарату з наступним тижнем без сунітинібу – застосовують у разі високої токсичності препарату.
Пазопаніб – пероральний інгібітор ангіогенезу. У дослідженні ефективності пазопаніб порівнювали з плацебо у пацієнтів з нелікованим метастатичним НКР і пацієнтів, що отримували цитокіни. Було відмічено значне покращення виживаності без прогресування та відповідь з боку пухлини на лікування пазопанібом. Медіана виживаності без прогресування у разі застосування пазопанібу порівняно з плацебо склала 9,2 проти 4,2 міс; 11,1 проти 2,8 міс у підгрупі нелікованих хворих; 7,4 проти 4,2 міс у підгрупі пацієнтів, яких раніше лікували цитокінами. За результатами дослідження, у якому порівнювали ефективність пазопанібу та сунітинібу (СOMPARZ), пазопаніб визначено препаратом вибору 1-ї лінії терапії. Було показано, що пазопаніб не погіршував виживаності без прогресування та загальної виживаності пацієнтів порівняно з сунітинібом, також показники якості життя були кращими в групі пазопанібу. Препарати мають дещо різні профілі токсичності. В іншому дослідженні, у якому вивчали вибір пацієнтів (PISCES), з’ясовано, що хворі частіше надавали перевагу пазопанібу, ніж сунітинібу. Основним недоліком досліджень є те, що постійний прийом препарату (пазопаніб) порівнювався з переривчастим прийомом (сунітиніб).
Акситиніб – пероральний селективний інгібітор VEGFR-1, -2 та -3 другого покоління. Спочатку його досліджували як препарат 2-ї лінії терапії. У дослідженні AXIS (акситиніб проти сорафенібу у пацієнтів з метастатичним НКР із прогресуванням на тлі прийому цитокінів або таргетних препаратів) було показано, що довшу медіану виживаності без прогресування забезпечував акситиніб. Найбільша різниця цього показника була відмічена у пацієнтів після неуспішної терапії цитокінами. Для тих пацієнтів, у яких відбулося прогресування захворювання на тлі застосування сунітинібу, акситиніб забезпечував більшу виживаність без прогресування (4,8 проти 3,4 міс відповідно). Асоційована з прийомом акситинібу токсичність >3 ступеня проявлялася діареєю (в 11% осіб), гіпертензією (в 16%) та слабкістю (в 11%). Нудота спостерігалася в 32%, блювання – в 24%, астенія – в 21% пацієнтів. Загальну виживаність оцінювали без кросоверу, при цьому статистично достовірної різниці між досліджуваними групами не виявлено.
Також акситиніб досліджувався як препарат 1-ї лінії терапії. У дослідженні акситинібу проти сорафенібу в 1-й лінії терапії нелікованого світлоклітинного метастатичного НКР різниці медіани виживаності без прогресування не було показано. За результатами цього дослідження акситиніб не був дозволений до використання як препарат 1-ї лінії терапії метастатичного НКР.
4.3.3.3.2. Моноклональні антитіла до циркулюючого VEGF
Бевацизумаб – гуманізоване моноклональне антитіло. У дослідженні AVOREN порівнювали лікування комбінацією бевацизумабу та ІФН-альфа з монотерапією ІФН-альфа. Медіана загальної відповіді склала 31% в групі бевацизумабу + ІФН-альфа та 13% при використанні монотерапії ІФН-альфа (р<0,0001). Медіана виживаності без прогресування істотно збільшилась із 4,5 міс при терапії ІФН-альфа до 10,2 міс при використанні схеми бевацизумаб + ІФН-альфа (р<0,0001), але тільки в групі низького та проміжного ризику прогресування. Результати схожого порівняльного дослідження (CALGB90206) бевацизумабу + ІФН-альфа проти монотерапії ІФН-альфа свідчили про більшу медіану виживаності без прогресування для групи комбінованого лікування. Загальний рівень відповіді на терапію був також вищим для групи комбінованого лікування.
4.3.3.3.3. Інгібітори мішені рапаміцину ссавців
Еверолімус – пероральний інгібітор мішені рапаміцину ссавців (mTOR). У дослідженні RECORD-1 порівнювали результати лікування еверолімусом + підтримуюча терапія з плацебо + підтримуюча терапія в тому ж режимі у пацієнтів, що раніше отримували терапію анти-VEGF-агентами. Медіана виживаності без прогресування склала 4,0 міс у групі еверолімусу та 1,9 міс у групі плацебо (р<0,001) і в фінальному аналізі була продовжена до 4,9 міс. У стратифікованому аналізі у пацієнтів, що отримували лише 1 ІТК, виживаність без прогресування дорівнювала 5,4 міс. У дослідженні RECORD-3 сунітинібу проти еверолімусу у нелікованих пацієнтів, що передбачало зміну лікування на сунітиніб або еверолімус при прогресуванні захворювання, виявлено більшу медіану виживаності без прогресування для 1-ї лінії лікування сунітинібом. Показники виживаності в послідовності сунітиніб-еверолімус високі, але остаточний аналіз ще не завершений.
4.3.3.4. Імунотерапія інгібіторами контрольних точок
Блокада імунної контрольної точки моноклональними антитілами-мішенями та інгібуючого Т-клітинного рецептора PD-1 або цитотоксичного асоційованого з Т-лімфоцитами антигену 4 (CTLA-4) спрямована на відновлення специфічного до пухлини Т-клітинного імунітету. Монотерапія інгібіторами контрольних точок була досліджена як терапія 2-ї та 3-ї ліній. У дослідженні III фази ніволумабу проти еверолімусу після однієї або двох ліній терапії, спрямованої на VEGF (CheckMate 025 NCT01668784), відмічено довшу загальну виживаність, кращу якість життя та меншу кількість побічних проявів 3-4 ступеня на користь ніволумабу. Ніволумаб забезпечує вищу загальну виживаність порівняно з еверолімусом (95% довірчий інтервал – ДІ – 0,57-0,93; р<0,002) у разі VEGF-рефрактерного НКР із медіаною 25,0 проти 19,6 міс при використанні еверолімусу (1b). У це дослідження були включені пацієнти, які отримали кілька ліній терапії, спрямованої на VEGF, і досягли хорошого результату, що сприяло початку широкого застосування інгібіторів контрольних точок. Учасниками дослідження були також 15% пацієнтів із поганим прогнозом за MSKCC. У них перевага ніволумабу отримана лише в контексті підвищення загальної виживаності. Сьогодні біомаркер PD-L1 не застосовується для відбору пацієнтів для цієї терапії.
У жодному клінічному дослідженні не доведено ефективність використання одного інгібітора контрольних точок у монорежимі для лікування первинних пацієнтів. У рандомізованому дослідженні II фази, у якому порівнювали терапію атезолізумабом і сунітинібом, відношення ризиків становило 1,19 (95% ДI 0,82-1,71), що не дозволило використовувати атезолізумаб як єдиний терапевтичний агент у 1-й лінії, незважаючи на високий рівень відповіді у пацієнтів з позитивним біомаркером. Дані дослідження ІІ фази Keynote-427 для пембролізумабу свідчать про високий рівень відповіді – 38% (до 50% у пацієнтів з PD-L1+), проте виживаність без прогресування залишилась невисокою, на рівні 8,7 міс (95% ДІ 6,7-12,2). На підставі цих результатів та за відсутності даних рандомізованих досліджень ІІІ фази терапія інгібіторами контрольних точок у монорежимі не рекомендується як альтернатива терапії 1-ї лінії.
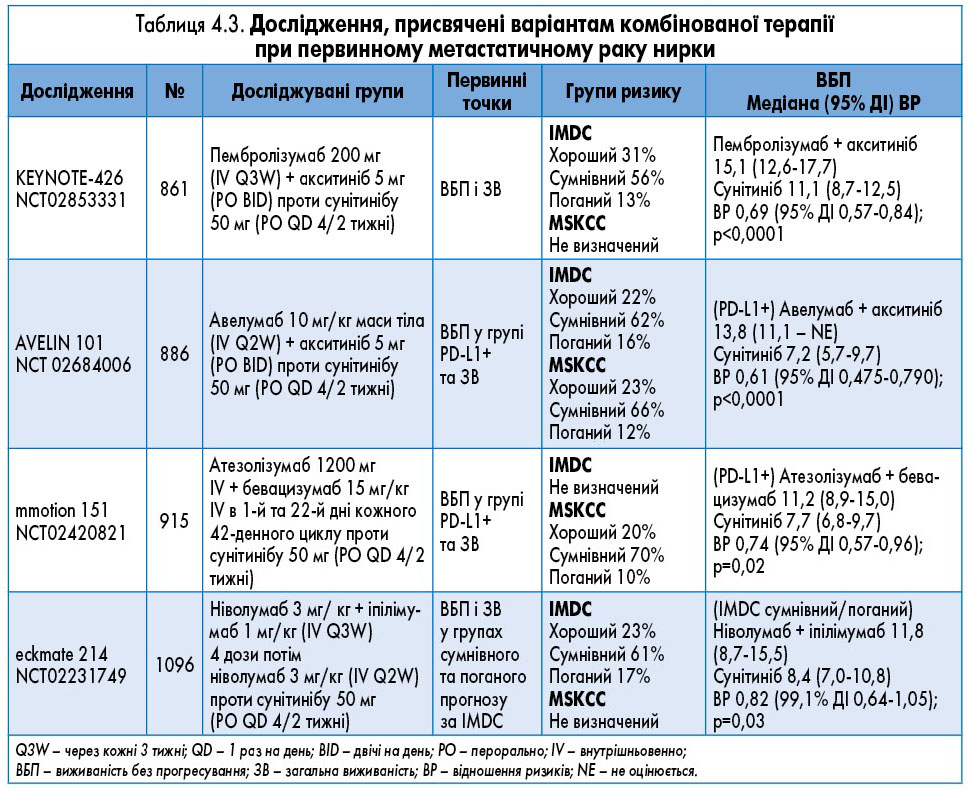
Дані щодо комбінованої терапії з використанням інгібіторів контрольних точок підсумовані в таблиці 4.3.
Згідно з даними, представленими в таблиці 4.3, можна стверджувати, що оптимальною схемою терапії пацієнтів будь-якої групи за IMDC є комбінація пембролізумабу й акситинібу, що подовжує медіану виживаності без прогресування до 15,1 міс.
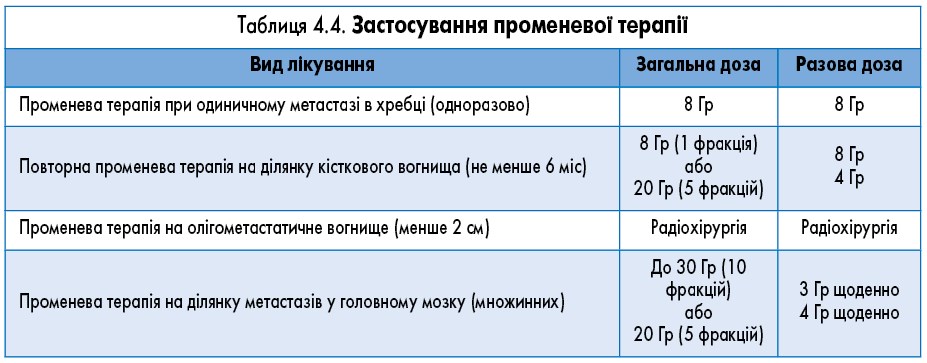
4.3.3.5. Променева терапія
Симптоматична променева терапія використовується з метою зменшення больового синдрому у пацієнтів із неоперабельними кістковими метастазами чи метастазами в головному мозку, які не реагують на проведену консервативну терапію (табл. 4.4).
Променева терапія на ділянку вогнищ у кістках чи головному мозку має супроводжуватися прийомом бісфосфонатів 1 раз на 28 днів.
Протипоказання:
а) відсутність морфологічного підтвердження діагнозу;
б) розпад пухлини з масивною кровотечею;
в) загальні протипоказання до променевої терапії.
4.4. Виписка з рекомендаціями після госпіталізації
При виписуванні пацієнта надається виписка з медичної карти стаціонарного хворого встановленої форми, яка містить інформацію про отримане лікування, особливості перебігу захворювання, рекомендації щодо подальшого лікування та спостереження.
Лікар має обов’язково оформити виписку із медичної карти амбулаторного (стаціонарного) хворого (форма № 027/о). Пацієнтам, які перенесли спеціальне лікування, слід надати інформацію про можливі віддалені побічні ефекти лікування, необхідність проведення періодичних обстежень відповідно до плану диспансеризації, рекомендації щодо способу життя, режиму харчування та фізичних навантажень.
4.5. Алгоритм реабілітації
4.6. Диспансерне спостереження
У зв’язку з небезпекою виникнення рецидиву та/або метастазів хворі на НКР підлягають диспансерному спостереженню з плановими оглядами в закладі спеціалізованої допомоги, у якому отримували лікування, або за місцем реєстрації.
Спостереження після радикального лікування НКР дає можливість онкологу, урологу моніторувати або виявляти:
- післяопераційні ускладнення;
- функцію нирок;
- локальний рецидив після резекції нирки або абляційної терапії;
- метастаз у контрлатеральній нирці;
- появу віддалених метастазів.
Післяопераційне спостереження додає важливу інформацію про перебіг НКР і має бути виконане урологом, який повинен чітко констатувати час рецидиву або розвитку метастазів. Післяопераційні ускладнення і функція нирок легко оцінюються на основі історії хвороби, скарг пацієнта, фізикального обстеження та визначення рівня креатиніну сироватки крові чи швидкості клубочкової фільтрації.
Динамічне спостереження має на меті насамперед визначити наявність місцевого рецидиву або метастазів на ранній стадії. При метастатичному захворюванні більше поширення пухлини може обмежити можливість хірургічного лікування, яке є стандартом при виявленні резектабельних, особливо солітарних метастазів. До того ж, рання діагностика рецидивів може позитивно вплинути на ефективність системної терапії, якщо пухлинне ураження незначно поширене.
Чутливість рентгенографії органів грудної порожнини для виявлення дрібних метастазів досить низька, а УЗД малоінормативне. Спостереження не повинно покладатися на ці методи візуалізації. При пухлинах із низьким ризиком інтервали спостереження мають бути адаптовані відносно дози опромінення та діагностичної користі. Для зменшення радіаційного опромінення може бути використана МРТ.
При пухлинах середнього або високого ризику рецидиву слід застосовувати КТ грудної клітки та черевної порожнини, незважаючи на значний ризик, пов’язаний з опроміненням, який необхідно враховувати при повторних КТ.
Динамічне спостереження має також включати клінічну оцінку функції нирок і серцево-судинної системи.
Позитронно-емісійна томографія і ПЕТ-КТ, а також остеосцинтиграфія скелета не є стандартними методами динамічного спостереження при НКР через обмежену специфічність і чутливість.
В останні роки були розроблені та перевірені на великих групах хворих післяопераційні прогностичні системи та номограми, що включають незалежні прогностичні фактори. Ці системи можуть бути більш точними в прогностичному відношенні, ніж класифікація TNM чи градація за Фурманом, для розрахунку виживаності при НКР. Вагомою ознакою номограм є можливість підрахунку точності прогнозу, що дає об’єктивну інформацію за всіма новими параметрами. Зараз розроблено декілька нових доопераційних номограм з високою точністю прогнозу, однак вони не рекомендуються як стандарт.
Американське товариство клінічної онкології запропонувало номограму, точність якої складає 86,3%. Суть визначення виживаності полягає в тому, що на номограмі проводиться перпендикулярна лінія від показника за кожним пунктом (T, N, M і т.д.) до відповідного показника балів. Перпендикулярна лінія, проведена від загальної суми балів, набраних за кожним пунктом, до показника виживаності буде відповідати виживаності у кожного конкретного хворого (рис. 4.2).
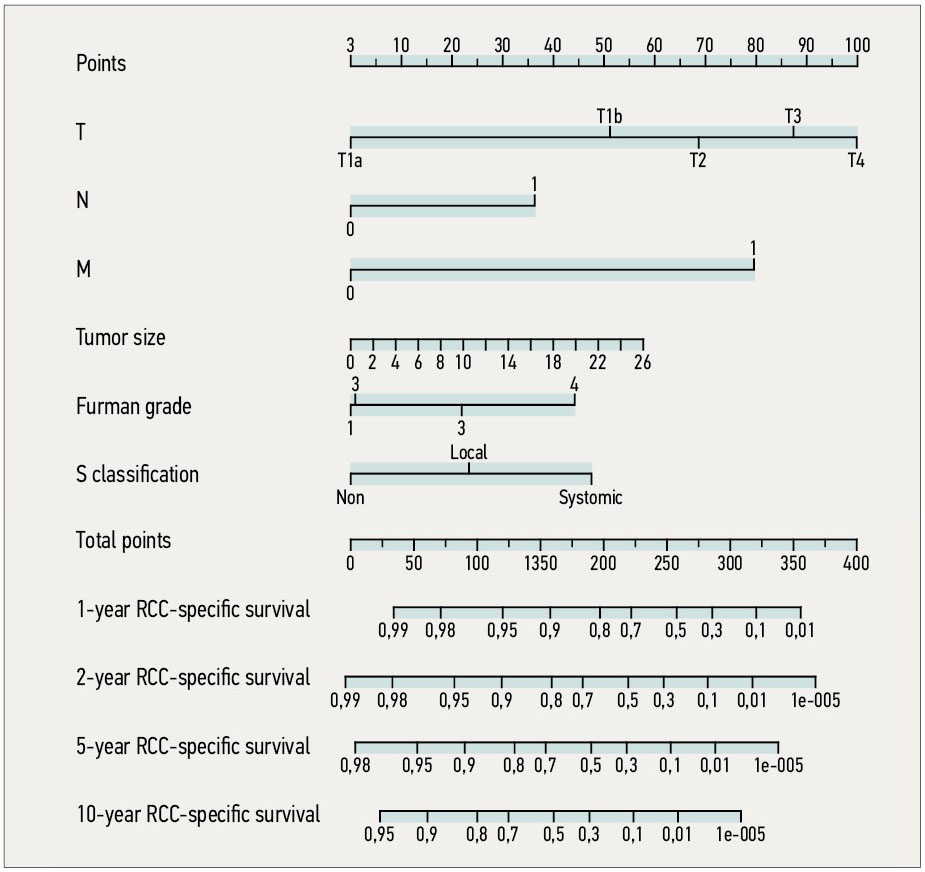 Рис. 4.2. Номограма визначення 1-, 2-, 5- та 10-річної виживаності хворих на НКР
Рис. 4.2. Номограма визначення 1-, 2-, 5- та 10-річної виживаності хворих на НКР
Т – первинна пухлина; N – метастази у регіонарних лімфатичних вузлах; М – віддалені метастази; Tumor size – розміри пухлини; Furman grade – градація ядра пухлинної клітини за Фурманом; S classification – клінічні симптоми: відсутні, локальні, системні.
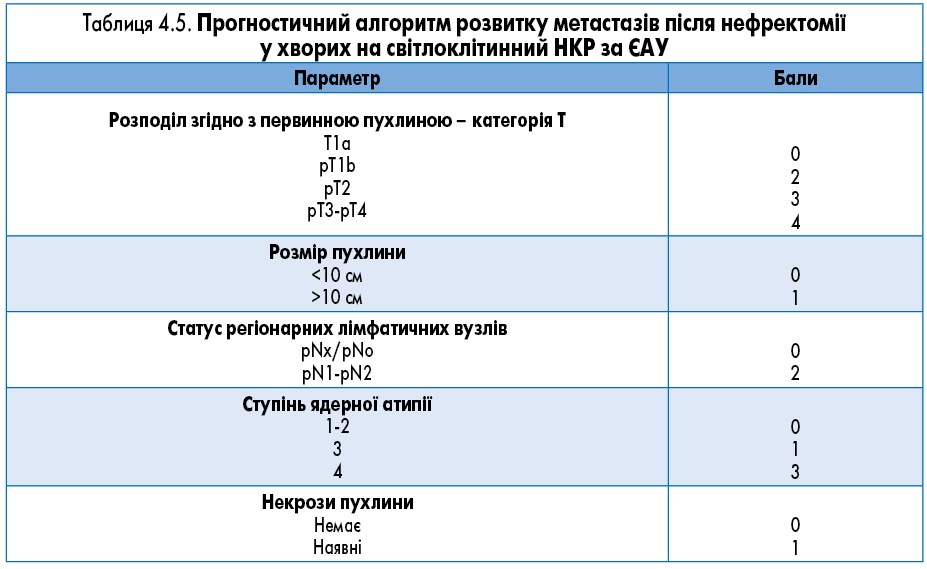
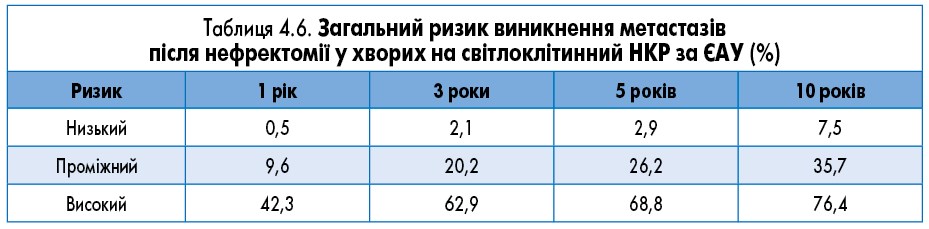
Європейська асоціація урологів (ЄАУ) пропонує номограми, подані в таблицях 4.5 та 4.6.
Розрізняють групи низького (0-2 бали), проміжного (3-5 балів) і високого (>6 балів) ризику виникнення рецидиву.
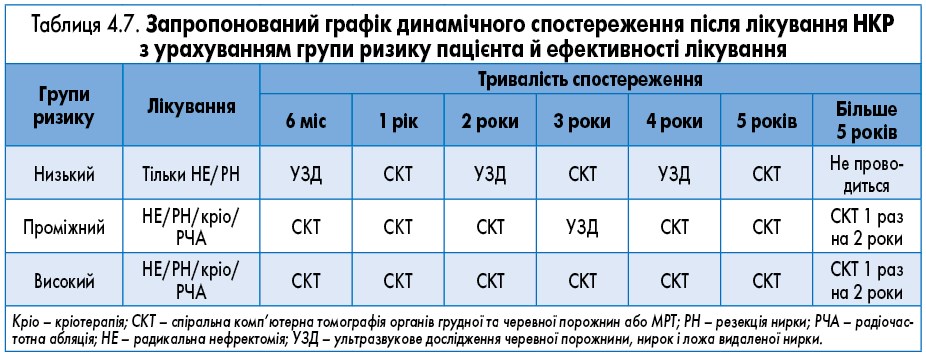
Алгоритм динамічного спостереження за пацієнтами після лікування НКР необхідний, але у ньому має бути врахований не лише профіль ризику пацієнта, а й ефективність лікування (табл. 4.7).
Лікар, що здійснює спостереження, обов’язково має забезпечити ведення реєстраційної карти хворого на злоякісне новоутворення (форма №030-6/о) та відображати в ній заходи з диспансеризації.
Основні схеми лікування пацієнтів із раком нирки подані на рисунках 4.3, 4.4.
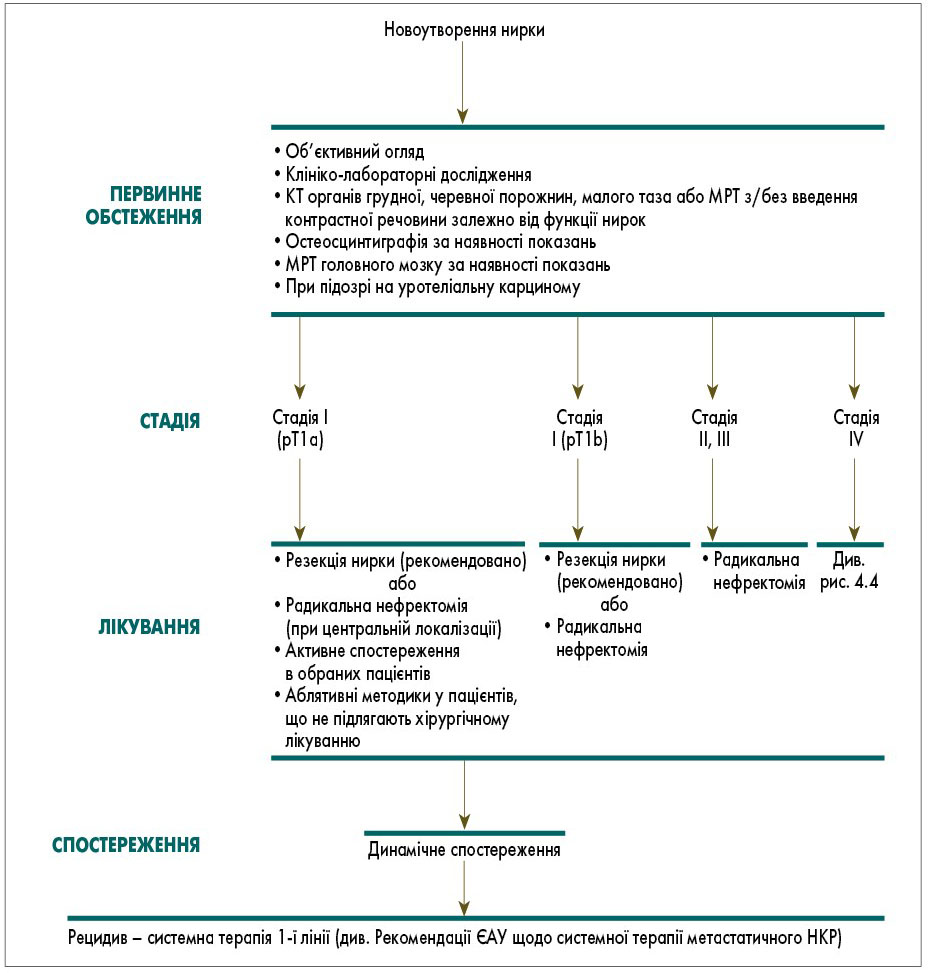 Рис. 4.3. Схема лікування хворих на рак нирки (I-III стадія)
Рис. 4.3. Схема лікування хворих на рак нирки (I-III стадія)
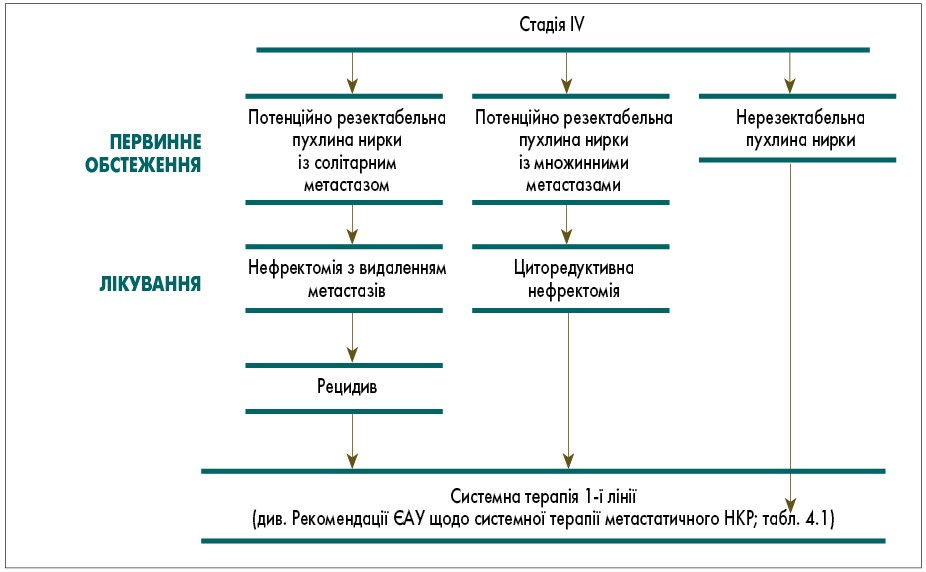 Рис. 4.4. Схема лікування хворих на рак нирки (IV стадія)
Рис. 4.4. Схема лікування хворих на рак нирки (IV стадія)
V. Ресурсне забезпечення виконання протоколу
При розробленні та застосуванні докального клінічного протоколу медичної допомоги (клінічного маршруту пацієнта) необхідно перевірити реєстрацію в Україні засобів матеріально-технічного забезпечення і відповідність призначення лікарських засобів Інструкції для медичного застосування лікарського засобу, затвердженій МОЗ України. Посилання на Державний реєстр лікарських засобів України: http://www.drlz.kiev.ua/.
VI. Індикатори якості медичної допомоги
6.1. Перелік індикаторів якості медичної допомоги
- Наявність у лікарів, які надають первинну медичну допомогу, локального протоколу ведення пацієнта з раком нирки.
- Наявність у лікарів, які надають вторинну (спеціалізовану) медичну допомогу, локального протоколу ведення пацієнта з раком нирки.
- Частка пацієнтів, для яких отримано інформацію про медичний стан протягом звітного періоду.
- Частка випадків раку нирки, виявлених протягом звітного періоду, для яких діагноз підтверджено морфологічно.
- Виживаність пацієнтів із раком нирки.
Підготовлено за матеріалами Протокол надання медичної допомоги хворим на рак нирки. Рекомендовано Спілкою онкоурологів України. – К.: ТОВ «Рекламна агенція «Медичні видання», 2021.
Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Рак нирки». Затверджено наказом МОЗ України від 20.06.2022 р. № 1061.Повний текст протоколу: https://www.dec.gov.ua/mtd/rak-nyrky.
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 6 (79) 2022 р.