9 липня, 2023
Ефективність та безпека рисдипламу при лікуванні пацієнтів зі спінальною м’язовою атрофією типів 2 та 3
Спінальна м’язова атрофія (СМА) – спадкове захворювання, за якого мутація в гені SMN1 призводить до продукування дефектного білка виживання моторних нейронів (survival motor neuron, SMN), внаслідок чого відбувається поступове відмирання моторних нейронів спинного мозку й атрофія м’язів. Препарат рисдиплам – пероральний модифікатор сплайсингу пре-мРНК цього гена, схвалений для лікування СМА. Пропонуємо до вашої уваги огляд результатів дослідження ефективності застосування цього препарату, викладених у публікації M. Oskoui et al., SUNFISH Working Group «Two-year efficacy and safety of risdiplam in patients with type 2 or non-ambulant type 3 spinal muscular atrophy (SMA)» видання J Neurol (2023 May; 270 (5): 2531‑2546).
Уперше СМА як спадкове прогресуюче нервово-м’язове захворювання, що призводить до втрати рухової функції та скорочення тривалості життя, було описане у немовлят на початку 1890-х рр. лікарями G. Werdnig and J. Hoffmann. Приблизно через століття було виявлено, що його спричиняють аутосомно-рецесивні мутації в гені виживаності моторних нейронів 1 (SMN1), які призводять до втрати рухових нейронів і прогресування м’язової слабкості.
Задля кращого розуміння природи цієї хвороби, розроблення терапевтичних стратегій і клінічних випробувань потенційних методів лікування протягом останнього часу проведено низку досліджень, які охоплюють широке коло осіб із різними симптомами СМА та руховими можливостями.
Епідеміологія та патогенез СМА
СMA – це аутосомно-рецесивний нервово-м’язовий розлад, спричинений зниженим рівнем білка SMN через гомозиготні делеції або мутації зі втратою функції гена SMN1 (Mercuri et al., 2018). Як зазначають дослідники, СМА є основною генетично зумовленою причиною смерті немовлят і дітей молодшого віку (Hamilton and Gillingwater, 2013; Simone et al., 2016).
Без функціонального гена SMN1 організм «покладається» на резервний гомологічний ген SMN2, який набагато менш ефективний щодо виробництва білка SMN. СMA є мультисистемним розладом, і втрата білка SMN може спричинити неправильне функціонування нервових клітин, що призводить до виснажливої, а іноді й фатальної м’язової слабкості (Lorson et al., 1999).
Спектр тяжкості захворювання варіює від раннього дебюту з дихальною недостатністю впродовж перших місяців життя до легкого типу з початком у дорослому віці та повільним прогресуванням (Schorling et al., 2020).
До 60% серед народжених зі СМА мають тип 1, який також називають хворобою Вердніга-Гоффмана. Симптоми дебютують із народження або протягом перших шести місяців життя. Немовлята зі СMA типу 1 мають труднощі з ковтанням і смоктанням. У власному розвитку вони не досягають таких типових етапів, як тримання голови або сидіння. Оскільки м’язи продовжують слабшати, діти стають схильнішими до респіраторних інфекцій і колапсу легень (пневмоторакс). Більшість дітей зі СМА типу 1 помирають до свого другого дня народження. У пацієнтів зі СМА типу 2 симптоми виникають у віці від 6 до 18 міс., вони досягають здатності самостійно сидіти та іноді стояти або робити кілька кроків з опорою, проте не можуть стояти або ходити самостійно. Також можуть виникнути проблеми з годуванням і диханням (Mercuri, 2012).
СМА типу 3, що також згадується як хвороба Кугельберга-Валландера, зазвичай виявляється у віці 1,5-3 роки (тип 3а), або після трьох років життя (тип 3b). Це клінічно неоднорідна група пацієнтів. Як правило, вони досягають усіх основних етапів руху, а також самостійної ходьби. Однак згодом втрачають здатність ходити та пересуваються в інвалідному візку. Вони досягають здатності самостійно ходити, але можуть її втратити (Mercuri et al., 2018).
Популяція пацієнтів зі СМА типів 2 і 3 є численною та охоплює дітей, підлітків і дорослих із різними функціональними статусами, контрактурами і сколіозом. Зрештою, для СМА типу 4 характерний розвиток симптомів у дорослому віці та незначна виразність м’язової слабкості.
Рисдиплам – перший препарат для перорального лікування СМА
За останнє десятиліття розроблено нові стратегії лікування СМА, як-от модуляція сплайсингу SMN 2 та заміна гена SMN 1 за допомогою генної терапії. Так, за раннього застосування вони можуть значуще змінити природний перебіг хвороби, тому скринінг новонароджених на СМА впроваджується у дедалі більшій кількості країн.
Першим і єдиним натепер пероральним препаратом для лікування СМА є рисдиплам (ЕврісдіТМ), виробництва компанії «Рош».
Рисдиплам модифікує сплайсинг пре-мРНК SMN2 для підвищення рівнів функціонального білка SMN (Ratni et al., 2016). У дослідженнях на тваринних моделях СMA (миші) лікування рисдипламом сприяло значущому збільшенню вмісту функціонального білка SMN у центральній нервовій системі (ЦНС) та периферичних тканинах (Poirier et al., 2018). Ефективність препарату підтверджено у немовлят зі СМА типу 1 (Darras et al., 2021) та зі СМА типів 2 і 3 (Mercuri et al., 2022).
Дворічне вивчення ефективності й безпеки рисдипламу в пацієнтів зі СМА типів 2 і 3: огляд дослідження SUNFISH
Ефективність, безпеку, переносимість, фармакокінетику та фармакодинаміку рисдипламу у великій популяції дітей, підлітків і дорослих віком від 2 до 25 років зі СМА типів 2 або3 вивчали у дослідженні SUNFISH. Це багатоцентрове рандомізоване подвійне сліпе контрольоване плацебо двоетапне дослідження фази 2/3, що досі триває і має дві частини.
Із дослідження не виключали пацієнтів із низьким базовим рівнем рухової функції або ознаками більшого прогресування захворювання, як-от тяжкий сколіоз, контрактури, порушення бульбарної функції та потреба в ентеральному харчуванні чи неінвазивній вентиляції легень. У частині 1 дослідження SUNFISH (n=51) оцінювали безпеку, переносимість і фармакокінетику / фармакодинаміку різних доз рисдипламу в пацієнтів зі СМА типів 2 або 3 (здатних / нездатних ходити) для визначення оптимального дозування, що застосовуватиметься у частині 2.
Лікування рисдипламом у частині 1 сприяло стійкому підвищенню рівня білка SMN у крові та поліпшенню або стабілізації рухової функції (Mercuri et al., 2022).
Підтверджувальна частина 2 (n=180) присвячена дослідженню ефективності рисдипламу в дозі, визначеній у першій частині дослідження, у пацієнтів зі СМА типів 2 або 3, які не в змозі ходити.
Матеріали та методи дослідження
У частині 2 дослідження SUNFISH брали участь пацієнти віком від 2 до 25 років, не здатні ходити, із генетично підтвердженим діагнозом 5q-аутосомно-рецесивної СМА та клінічними симптомами, притаманними СМА типів 2 або 3. Пацієнтів виключали з дослідження, якщо вони отримували лікування SMN 2-націленим антисмисловим олігонуклеотидом, модифікатором сплайсингу SMN 2 або генною терапією.
Учасників дослідження розподілили за віком (2‑5, 6‑11, 12‑17 та 18‑25 років) і рандомізували у співвідношенні 2:1 (із прихованим розподілом) для отримання рисдипламу або плацебо щодня впродовж 12 міс. Доза рисдипламу становила 0,25 мг/кг для пацієнтів вагою <20 кг і 5 мг для осіб вагою ≥20 кг. Через 12 міс. пацієнтів, які отримували плацебо, перевели на рисдиплам (засліпленим способом, під час візиту на 52-му тиж.), після чого всі учасники отримували рисдиплам до 24-го місяця.
Загалом 180 пацієнтів були включені до частини 2 дослідження SUNFISH і рандомізовані для приймання рисдипламу (n =120) або плацебо (n=60) протягом 12 міс. Чотири пацієнти припинили дослідження протягом контрольованого плацебо періоду (рисдиплам: n=3, плацебо: n=1), щоб розпочати комерційно доступне лікування (Mercuri et al., 2022). Через 12 міс. усі пацієнти отримували рисдиплам. Загалом 176 пацієнтів почали відкритий період лікування (у дослідженні визначено як 12‑24 міс.).
Метою дослідження було визначення протягом 24 міс.:
- ефективності лікування рисдипламом щодо рухової функції (виміряної за допомогою шкали оцінки моторної функції з 32 пунктів, англ. Motor Function Measure 32 — MFM 32) (Berard et al., 2005), розширеної функціональної моторної шкали Хаммерсміта (HFMSE) (Pera et al., 2017) та переглянутого модуля оцінки верхньої кінцівки RULM (Mazzone et al., 2011);
- дихальної функції – за показниками форсованої життєвої ємності легень [ФЖЄЛ], об’єму форсованого видиху за першу секунду та максимальної швидкості видиху під час кашлю;
- самостійності, про яку повідомляли пацієнт і доглядальник та яка вимірюється за допомогою інструменту «Шкала оцінювання незалежності при СМА – модуль оцінки верхньої кінцівки (SMA Independence Scale-Upper Limb Module, SMAIS-ULM) (Trundell et al., 2022);
- безпечності та переносимості терапії.
Безпеку лікування оцінювали протягом усього дослідження завдяки моніторингу та реєстрації небажаних явищ (НЯ), зокрема серйозних НЯ, результатів лабораторних досліджень, життєво важливих показників, даних електрокардіографії, а також офтальмологічного, неврологічного та антропометричного обстеження.
Результати дослідження
Рухова функція
Шкала MFM 32
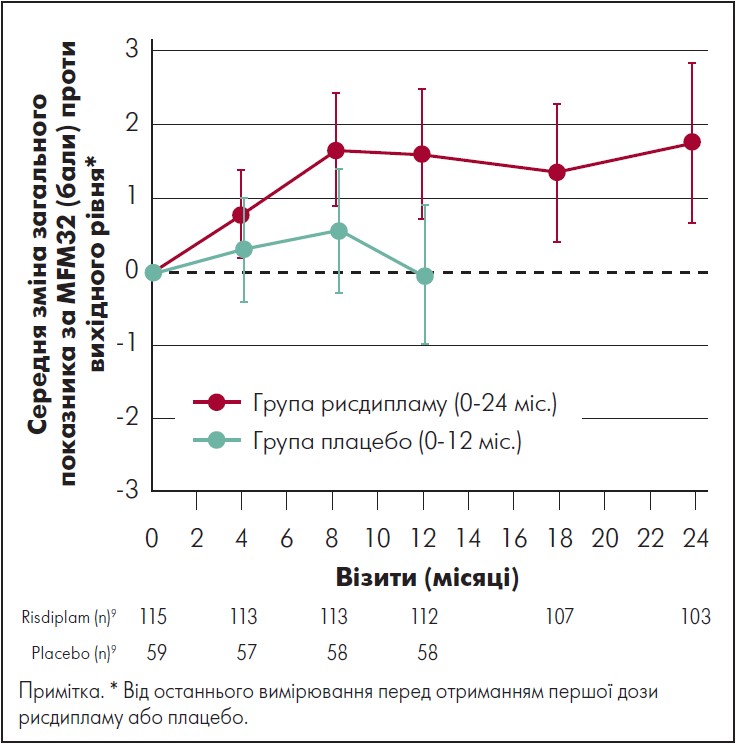
У пацієнтів, які спочатку отримували рисдиплам, середня зміна загального показника за шкалою MFM 32 на 24-му місяці становила 1,8 бала (95% довірчий інтервал [ДІ] 0,7‑2,9) (рис. 1). Загалом у 58% пацієнтів спостерігалася стабілізація загального показника за шкалою MFM 32 (зміна ≥ 0), а 32% пацієнтів досягли клінічно значущого поліпшення на ≥3 бала після 24 міс. лікування рисдипламом.
Рис. 1. Динаміка загального показника за MFM32 у пацієнтів, від початку рандомізованих для приймання рисдипламу (24 міс.), і тих, хто до 12-го міс. отримував плацебо
Адаптовано за M. Oskoui et al., 2023.
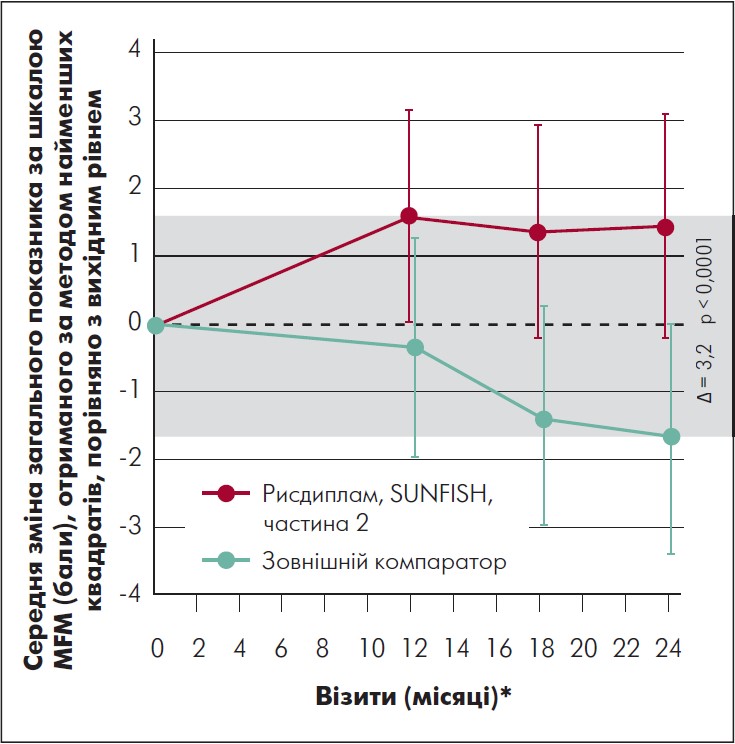
У пацієнтів, які спочатку отримували плацебо, середній рахунок за шкалою MFM 32 також змінився від скоригованої базової лінії, зміна становила 0,3 після 12 міс. лікування рисдиплам. Загалом 59% пацієнтів, які спочатку отримували плацебо, досягли стабілізації у загальному рахунку за шкалою MFM 32 (зміна ≥0) після 12 міс. переходу з рисдипламу до плацебо, і 16% продемонстрували клінічно значуще поліпшення. Для надання відповідного контексту результатам дослідження SUNFISH, частина 2, на 24-й місяць щодо тих, хто спочатку був рандомізований у групу лікування рисдипламом, була використана зовнішня група порівняння, яка складалася з нелікованих осіб зі СМА типів 2 і 3. Популяція тих, хто отримував терапію зовнішнім компаратором, включала 81 пацієнта з дослідження NatHis-SMA (ClinicalTrials.gov [2018] NCT02391831) і 57 пацієнтів із групи плацебо дослідження фази 2 ефективності олесоксиму (ClinicalTrials.gov [2016] NCT 01302600); в обох повідомлялося, що показники за MFM відповідали базовому рівню характеристик груп осіб, що отримували лікування. Порівняння груп лікування рисдипламом і зовнішнім компаратором виявило різницю в 3,12 бала за шкалою MFM (95% ДІ 1,67‑4,57) на користь рисдипламу (рис. 2). Крім того, 63% пацієнтів, які отримували рисдиплам у частині 2 дослідження SUNFISH продемонстрували стабілізацію загального показника MFM (зміна >0 балів) на 24-му місяці проти 40% популяції зовнішнього контролю, а 34% групи рисдипламу продемонстрували клінічно значуще поліпшення (зміна ≥3 балів) проти 16% у групі зовнішнього порівняння.
Рис. 2. Динаміка загального показника за шкалою MFM у групі рисдипламу порівняно з групою зовнішнього компаратора
Адаптовано за M. Oskoui et al., 2023.
Шкала RULM
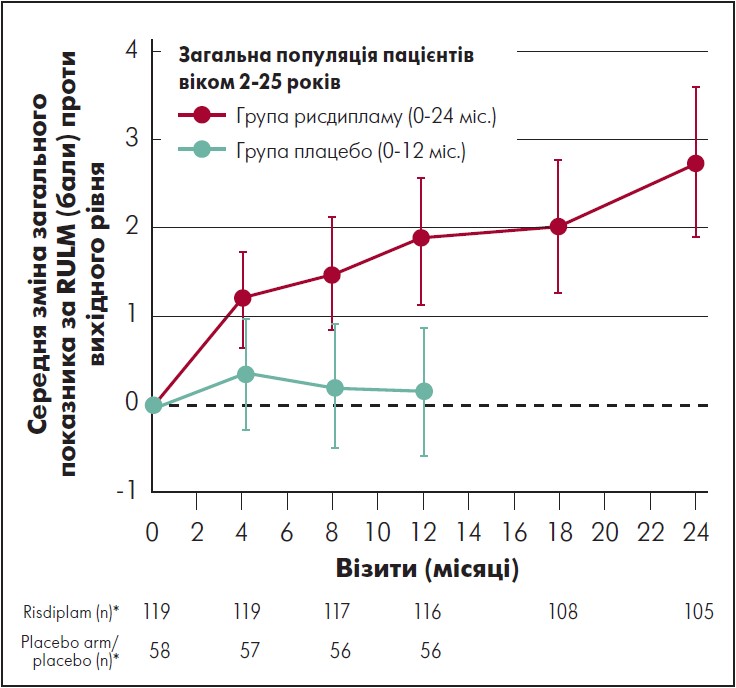
Пацієнти і в групах рисдипламу і переходу з плацебо на рисдиплам досягли покращення через 24 міс. На 24-му місяці середня зміна загального показника за RULM проти початкового рівня в групі рисдипламу становила 2,8 бала (95% ДІ 1,9‑3,6); 52% пацієнтів досягли поліпшення стану ≥2. В учасників, які перейшли з плацебо на рисдиплам спочатку отримували плацебо, середня зміна загального показника за RULM проти вихідного рівня становила 0,9 бала (95% ДІ 0,1‑1,6) після 12 міс. лікування рисдипламом, а у 34% зміна показника за RULM проти вихідного рівня – на ≥2 бала (рис. 3).
Примітка. * Від останнього вимірювання перед отриманням першої дози рисдипламу або плацебо
Рис. 3. Динаміка загального показника за RULM у пацієнтів, від початку рандомізованих для приймання рисдипламу (24 міс.), і тих, хто до 12-го міс. дослідження отримував плацебо
Адаптовано за M. Oskoui et al., 2023.
Шкала HFMSE
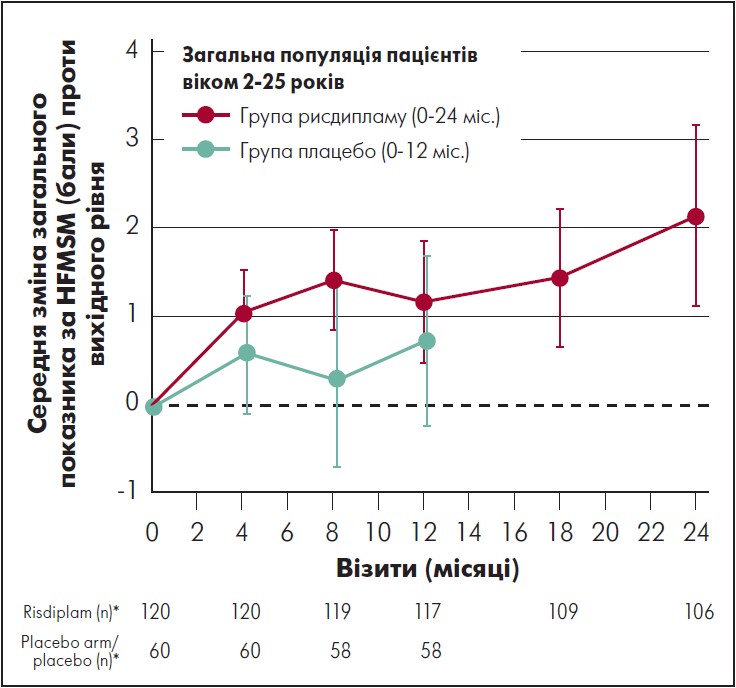
Пацієнти в групі рисдипламу на 24-му місяці досягли значного покращення через 24 міс. На 24-му місяці середня зміна загального показника за шкалою HFMSE проти вихідного рівня в групі рисдипламу становила 2,2 бала (95% ДІ 1,1‑3,2). Загалом 45% пацієнтів досягли поліпшення на ≥2 бала за шкалою HFMSE після 24 міс. лікування рисдипламом. У пацієнтів, які перейшли з плацебо на рисдиплам, середня зміна загального показника за HFMSE проти початкового рівня становила 0,0 бала (95% ДІ від -1,0 до 1,1) після 12 міс. лікування рисдипламом, а у 24% зміна показника за HFMSE проти вихідного рівня – на ≥2 бала (рис. 4).
Примітка. * Від останнього вимірювання перед отриманням першої дози рисдипламу або плацебо
Рис. 4. Динаміка загального показника за HFMSM у пацієнтів, від початку рандомізованих для приймання рисдипламу (24 міс.), і тих, хто до 12-го міс. дослідження отримував плацебо
Адаптовано за M. Oskoui et al., 2023.
Дихальна функція
ФЖЄЛ
ФЖЄЛ оцінювали в осіб віком 6‑25 років під час скринінгу. Динаміка респіраторної функції в цій популяції відповідала природному перебігу захворювання, що свідчить про відсутність різкого поліпшення в цьому вимірі. У пацієнтів, які отримували рисдиплам протягом 24 міс., середня зміна ФЖЄЛ проти вихідного рівня порівняно з прогнозованим значенням становила -7,8% (95% ДІ від -11,6 до -3,9) після 24 міс. лікування рисдипламом. В осіб, які спочатку отримували плацебо, середня зміна ФЖЄЛ проти вихідного рівня становила -3,4% (95% ДІ від -8,0 до 1,3) після 12 міс. лікування рисдипламом. Подібні результати спостерігалися і в дослідженні нусінерсену з реальної клінічної практики у пацієнтів із типами 2 та 3 СМА у віці 4-12 років; це дослідження не виявило поліпшення у ФЖЄЛ через 300 днів після лікування. Автори пояснили ці результати пізнім початком використання лікування в перебігу захворювання і відсутністю доказів того, що хворобомодифікуюча терапія СМА чинить вплив на торакальні контрактури (контрактури грудної клітки, що супроводжуються м’язовою слабкістю, є основною причиною грудного обмеження за нервово-м’язових захворювань).
Самостійність
Шкала SMAIS-ULM
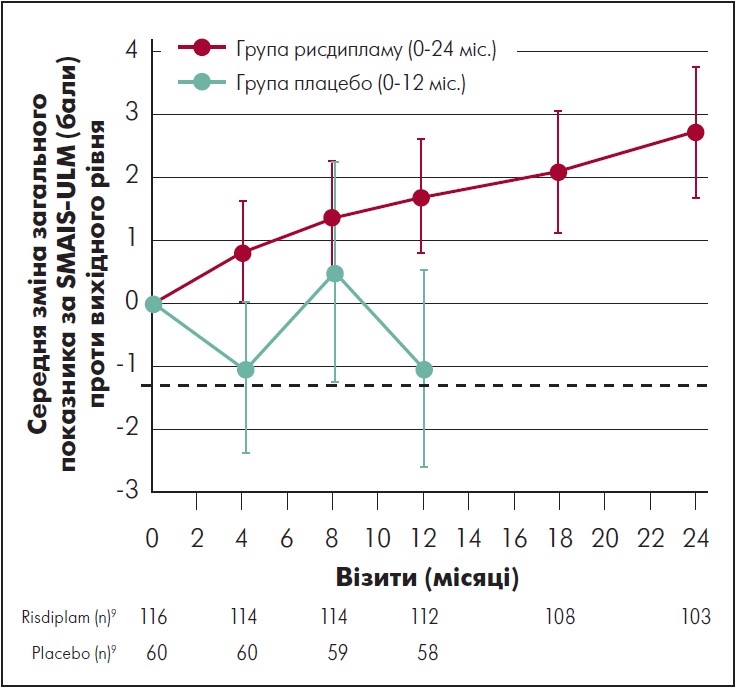
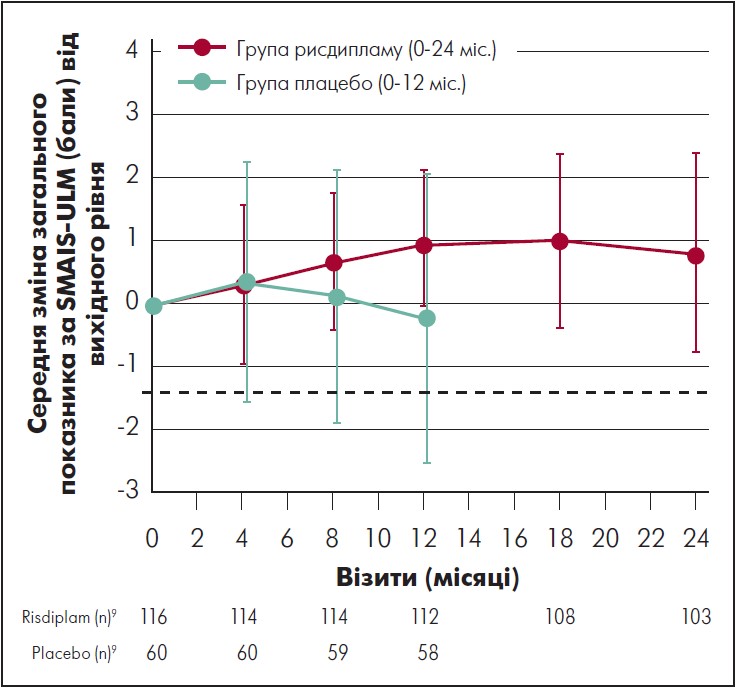
У пацієнтів, які отримували рисдиплам упродовж 24 міс., середня зміна порівняно з початковим рівнем загального показника за шкалою SMAIS-ULM, який визначали доглядальники, становила 2,7 бала (95% ДІ 1,7‑3,7) на 24-му місяці (рис. 5). Середня зміна загальної оцінки за показником SMAIS-ULM, який визначали самі пацієнти (тільки для осіб віком 12‑25 років), проти вихідного рівня становила 0,8 бала (95% ДІ від -0,8 до 2,4) (рис. 6). У пацієнтів, які спочатку отримували плацебо, середня зміна проти вихідного рівня загального показника за SMAIS-ULM, який визначали доглядальники, становила 1,6 бала (95% ДІ 0,4‑2,8) після 12 міс. лікування рисдипламом; середня зміна проти вихідного рівня загального показника за SMAIS-ULM, який визначали самі пацієнти, була 0,6 (95% ДІ від -1,0 до 2,2).
Рис. 5. Зміни загального бала за SMAIS-ULM, який визначали доглядальники, порівняно з вихідним рівнем в осіб групи рисдипламу та плацебо
Адаптовано за M. Oskoui et al., 2023.
Рис. 6. Зміни загального бала за SMAIS-ULM, який визначали пацієнти (віком 12‑25 років), порівняно з вихідним рівнем в осіб групи рисдипламу та плацебо
Адаптовано за M. Oskoui et al., 2023.
Результати щодо безпеки
Загалом 91,7% пацієнтів у групі рисдипламу зазнали принаймні одного НЯ між 12 і 24 міс. дослідження. Серед пацієнтів, які спочатку отримували плацебо, 91,7% зазнали щонайменше одного НЯ проти початкового рівня до 12 міс. дослідження. Після переходу на рисдиплам на 12-му місяці у 80,0% пацієнтів спостерігалося принаймні одне НЯ між 12 і 24 міс. Найпоширенішими НЯ при застосуванні рисдипламу були: інфекції верхніх дихальних шляхів, назофарингіт, лихоманка, головний біль, діарея, блювання та кашель. Серед найпоширеніших серйозних НЯ – пневмонія.
У групі рисдипламу 20,0% пацієнтів перенесли щонайменше одне серйозне НЯ проти початкового рівня до 12 міс. дослідження, а 20,8% – щонайменше одне серйозне НЯ між 12 і 24 міс. Серед пацієнтів, які спочатку отримували плацебо, 18,3% зазнали принаймні одного серйозного НЯ проти початкового рівня до 12-го місяця дослідження (період плацебо). Після переходу на рисдиплам на 12-му місяці у 5,0% спостерігалося щонайменше одне серйозне НЯ між 12 і 24 міс. Повідомлень про фатальні серйозні НЯ не було. Не повідомлялося про жодні серйозні НЯ, пов’язані з лікуванням рисдипламом. Не виникло жодних НЯ / серйозних НЯ, які призвели б до відміни лікування.
Обговорення
Природний перебіг СМА типів 2 і 3 передбачає прогресування хвороби та тривалу втрату функцій (Kaufmann et al., 2012; Annoussamyet al., 2021). Однак траєкторії перебігу відрізняються залежно від віку та тяжкості захворювання. У публікаціях, присвячених результатам досліджень природного перебігу хвороби за участю нелікованих пацієнтів зі СМА типів 2 і 3 (здатних і нездатних ходити), показано зниження загального показника за RULM упродовж 12 міс. (-0,4 бала у пацієнтів віком 2,7‑49,7 років) (Pera et al., 2018) і 24 міс. (-0,79 бала у пацієнтів віком 5‑56 років) (Coratti et al., 2022); загального показника за шкалою HFMSE протягом 12 міс. (-0,54 бала у дітей віком ≥2 років та дорослих віком до 19 років), а також значне зниження протягом 24 міс. загального показника за шкалою MFM 32 (-2,08 бала у пацієнтів віком 2‑30 років). Зміни показників за функціональними шкалами оцінювання моторних функцій (у досліджені SUNFISH RULM, HFMSE, MFM 32) визначено як клінічно значущі, оскільки досягнення стабілізації рухової функції є важливою метою у пацієнтів зі СМА типів 2 і 3, а отже, вважається клінічно значущим результатом у цій популяції (Cruz et al., 2018; Gusset et al., 2021).
Рухова функція і самостійність
Лікування рисдипламом у клінічно гетерогенній популяції дітей, підлітків і дорослих із пізнім початком СМА та різною тривалістю захворювання сприяло тривалій стабілізації або поліпшенню рухової функції. Загалом поліпшення рухової функції після 12 міс. лікування рисдипламом зберігалося або збільшувалося до 24 міс., що підтверджує переваги довгострокового застосування рисдипламу.
Для пацієнтів із тривалим перебігом захворювання не очікується, що поліпшення після лікування буде очевидним у короткостроковій перспективі, оскільки це потребує активації багатьох компенсаторних процесів реіннервації. Зокрема, контрактури кульшового суглоба у пацієнтів із тривалим перебігом захворювання обмежують функціональні переваги під час виконання завдань, які вимагають повного розгинання кульшового суглоба. Тобто метою лікування є довготривала стабільність певних функцій (до більшості яких залучено верхні кінцівки), що є важливим для автономності пацієнтів, які не ходять.
Поступове поліпшення показника за шкалою RULM (1,91 бала – на 12-му; 2,06 бала – на 18-му та 2,79 бала – на 24-му місяці відповідно) після лікування рисдипламом у цьому дослідженні є прикладом впливу препарату на функцію верхньої кінцівки. Так, підвищення загальної оцінки за інструментом оцінювання самостійності SMAIS-ULM, про яке повідомляли доглядальники (1,68 бала – на 12-му; 2,10 бала – на 18-му та 2,73 бала – на 24-му місяці відповідно), і яка сильно корелює з показником за RULM, також підтверджує послідовність впливу рисдипламу на функцію верхніх кінцівок у досліджуваній популяції пацієнтів.
Власне, значуще збільшення загальних показників за шкалами HFMSE та SMAIS-ULM, про яке повідомляли самі пацієнти на 24-му місяці, також свідчить, що рисдиплам є корисним для осіб, які отримували лікування, порівняно з контрольною групою (без лікування протягом перших 12 міс.).
Динаміка загальних показників за шкалами MFM 32 та RULM змінювалася у пацієнтів, які перейшли з приймання плацебо на терапію рисдипламом на 12-му місяці, на відміну від зниження порівняно з базовим рівнем, яке спостерігалося до 12 міс. (коли отримували плацебо). Тенденцію до поліпшення або стабілізації рухової функції фіксували упродовж 12‑24 міс. (через 12 міс. після переходу на лікування рисдипламом).
Результати порівняння використання рисдипламу із зовнішнім контролем (дослідження природного перебігу) продемонстрували, що терапія рисдипламом, за даними зовнішнього порівняння, сприяла значному поліпшенню рухової функції на 12 і 24-му місяці.
Ці зміни порівняно з вихідним рівнем протягом 12 міс. в аналізі порівняння узгоджується з різницею в лікуванні рисдипламом і плацебо в первинному аналізі даних SUNFISH (частина 2) на 12-му місяці, згідно з яким середня різниця 1,55 бала (95% ДІ 0,30‑2,81; p=0,016) у загальній оцінці за шкалою MFM 32 свідчить на користь рисдипламу (Mercuri et al., 2022).
Аналіз загальних балів за шкалою MFM 32 засвідчив, що лікування рисдипламом у межах дослідження SUNFISH (частина 2) сприяло збільшенню середнього показника проти початкового рівня до 24 міс., що значуще відрізнялося від прогресивного зниження, яке фіксували за зовнішнього застосування препарату порівняння.
Після 24 міс. лікування для більшої частки осіб, які отримували рисдиплам, продемонстровано поліпшення або стабілізацію (зміна показника на ≥3 або ≥0 балів відповідно) загального показника за MFM проти зовнішнього препарату порівняння. Ці результати є додатковим підтвердженням довгострокової ефективності рисдипламу в широкій популяції осіб зі СМА типів 2 і 3 порівняно з нелікованими пацієнтами.
Дихальна функція
Зміна ФЖЄЛ порівняно з прогнозованим значенням у досліджуваній популяції знижувався зі швидкістю, яка відповідає популяційним даним, що свідчить про відсутність індукованого рисдипламом поліпшення цього показника (Trucco et al., 2021).
Такі результати спостерігали в одноцентровому дослідженні ефективності антисмислового олігонуклеотиду нусінерсену в 12 пацієнтів зі СМА типів 2 і 3 віком 4‑12 років; це дослідження продемонструвало відсутність поліпшення ФЖЄЛ через 300 днів лікування (Heitschmidt et al., 2021).
Автори пояснюють цей результат пізнім початком застосування нусінерсену під час перебігу захворювання та браком доказів того, що препарат чинить вплив на контрактури, спричинені слабкістю периферичних м’язів при СМА (контрактури грудної клітки, що виникають після слабкості м’язів, є основною причиною обмеження рухів грудної клітки при нервово-м’язових захворюваннях). Брак поліпшення ФЖЄЛ порівняно з прогнозованим значенням, що спостерігали у дослідженні SUNFISH, акцентує на важливості безперервної підтримки дихальної функції.
Безпека
Профіль безпеки рисдипламу після 24 міс. лікування відповідав результатам щодо безпеки після 12 міс. терапії. Кількість пацієнтів, у яких виникло щонайменше одне серйозне НЯ, була стабільною протягом другого року лікування рисдипламом (21%) порівняно з першим (20%).
І навпаки, серед пацієнтів, які спочатку отримували плацебо, а потім перейшли на терапію рисдипламом на 12-му місяці, кількість тих, хто повідомив про принаймні одне серйозне НЯ, зменшилася впродовж другого року дослідження, на тлі лікуванні рисдипламом (до 5%) порівняно з першим роком, коли вони отримували плацебо (18%).
Початкові спостереження в подвійному сліпому періоді продемонстрували дещо вищу частоту тяжкої пневмонії у пацієнтів групи рисдипламу (8%) проти групи плацебо (2%). Однак частота серйозної пневмонії не зросла у тих осіб, які перейшли на рисдиплам на 12-му місяці (0%) порівняно з першим роком приймання плацебо (2%).
Крім того, захворюваність на пневмонію не зросла протягом другого року лікування рисдипламом (7%) порівняно з першим роком лікування рисдипламом (8%). Огляд лабораторних параметрів не виявив жодної токсичності, пов’язаної з рисдипламом. Не виявлено також жодних клінічно значущих даних щодо безпеки пацієнтів, які відображали б потенційні ризики, раніше встановлені в доклінічних токсикологічних дослідженнях (вплив на епітеліальні тканини, токсичність щодо сітківки або гематологічні ефекти).
Висновки
Підсумовуючи, M. Oskoui et al. зазначають, що лікування рисдипламом у широкій та клінічно неоднорідній популяції пацієнтів (дітей, підлітків і дорослих із пізнім початком СМА та різною тривалістю захворювання), сприяло тривалому клінічно значущому поліпшенню рухової функції у 32% та її стабілізації у 58% пацієнтів, згідно із загальною оцінкою за шкалою MFM 32 на 24-му місяці. Це було підтверджено прогресивним поліпшенням показника за шкалою RULM – додаткового незалежного вимірювання рухової функції верхньої кінцівки, а також загальної оцінки за інструментом SMAIS-ULM, визначеної доглядальниками пацієнтів.
Поліпшення рухової функції, яке спостерігалося після 12 міс. лікування рисдипламом, зберігалося або зростало через 24 міс., що підтверджує переваги довготривалого лікування рисдипламом. Профіль безпеки після 24 міс. терапії відповідав тому, який раніше фіксували після 12 міс.
Отже, дані дослідження SUNFISH (частина 2) за 24 міс. демонструють клінічно значущі переваги рисдипламу та підсилюють позитивний профіль співвідношення його користі та ризику під час лікування дітей, підлітків і дорослих із пізнім початком СМА.
Підготувала Олександра Демецька
M-UA-00000845
Матеріал підготовлено на замовлення ТОВ «Рош Україна»
Перед застосуванням препарату рисдиплам уважно ознайомтеся з Інструкцією для медичного застосування лікарського засобу Еврісді, затвердженою Наказом МОЗ України від 29.09.2022 № 1767. Реєстраційне посвідчення № UA/19668/01/01
Інформація для професійної діяльності медичних і фармацевтичних працівників. Для розміщення в спеціалізованих виданнях, призначених для медичних закладів або спеціалістів охорони здоров’я
Повідомити про побічні явища під час лікування лікарським засобом ТОВ «Рош Україна» або поскаржитись на якість лікарського засобу ви можете за контактними реквізитами офісу або на електронну адресу: mailto:ukraine.safety@roche.com
Запит медичної інформації про лікарські засоби ТОВ «Рош Україна» ви можете надіслати на електронну адресу:
mailto:ukraine.medinfo@roche.com
ТОВ «Рош Україна», м. Київ, 03150, вул. Велика Васильківська, 139, 5-й поверх
Тел.: +380 44 29 888 33; Факс: +380 44 29 888 34;
е-mail: mailto:kiev.office@roche.com
https://www.roche.ua