15 березня, 2021
Унікальні можливості телмісартану в лікуванні хворих із серцево-судинною патологією
 Сучасна терапія пацієнтів із серцево-судинною патологією має бути спрямована не тільки на досягнення цільових значень рівня артеріального тиску (АТ), а й на зниження рівня серцево-судинного ризику.
Сучасна терапія пацієнтів із серцево-судинною патологією має бути спрямована не тільки на досягнення цільових значень рівня артеріального тиску (АТ), а й на зниження рівня серцево-судинного ризику.
Для поліпшення довгострокової захворюваності та смертності в популяції пацієнтів з артеріальною гіпертензією (АГ) рекомендується використовувати препарати з доведеною здатністю щодо захисту від розвитку як фатальних, так і нефатальних ускладнень, віддаючи перевагу лікарським засобам із найсильнішою доказовою базою, отриманою в клінічних дослідженнях і великих метааналізах наукових даних. У значній кількості проведених досліджень продемонстровано, що поряд із вираженими антигіпертензивними властивостями телмісартан (ТС) проявляє ефективну органопротекцію (серце, судини, нирки) та захищає від несприятливих серцево-судинних ускладнень. У багатьох випадках клінічні результати застосування ТС перевищували такі в інших груп антигіпертензивних препаратів (АГП). Протягом багатьох років препарат посідає позиції лідера серед сартанів завдяки хорошій вивченості, доведеному високому співвідношенню ефективності/безпеки та цінової доступності.
У сучасному світі серцево-судинні захворювання є основною причиною смертності населення, адже спостерігається 17,5 млн випадків смерті на рік (приблизно 31% від загальної кількості смертей) [1]. АГ через свою значну поширеність – іще одна з найважливіших причин ураження органів-мішеней, а також широкого спектра серцево-судинних ускладнень. На АГ у світі страждають >1 млрд осіб [2]. Ускладнення захворювання спричиняють ≈9,4 млн смертей щороку; сама АГ у 3,5 раза частіше зумовлює їх розвиток порівняно з курінням, а також у 1,6 раза частіше порівняно з гіперхолестеринемією [2].
АГ спричиняє розвиток діастолічної та систолічної дисфункцій серця, гіпертрофії лівого шлуночка (ГЛШ), хронічної серцевої недостатності (СН) (серед усіх випадків недостатність кровообігу на тлі АГ у чоловіків становить 39% випадків, у жінок – 59%), порушень мозкового кровообігу, потенціювання атеросклеротичного ураження судин, ішемічної хвороби серця (ІХС), у т. ч. інфаркту міокарда, нефросклерозу та хронічної хвороби нирок [2]. Приблизно в 50% пацієнтів ускладнення з’являються на тлі неадекватної антигіпертензивної терапії (АГТ). Водночас слід підкреслити, що рівень АТ є одним із найпоширеніших модифікованих факторів ризику. Згідно з результатами клінічних досліджень, за належного контролю АТ частота появи інсульту зменшується на 35-40%, інфаркту міокарда – на 20-25%, СН – на 50% [2]. Окрім того, зниження систолічного АТ (САТ) на 10 мм рт. ст. асоціюється зі зменшенням ризику розвитку ІХС на 22%, інсульту – на 41%, а також зумовлює скорочення смертності від кардіометаболічних причин у чоловіків і жінок на 46 і 41% відповідно [3].
У сучасних європейських [4] рекомендаціях щодо діагностики та лікування АГ особлива увага приділяється стратифікації ризику та принципам його максимально можливої мінімізації, в чому, крім зміни способу життя, першочергове значення має АГТ.
Для контролю рівня АТ використовують 5 основних класів АГП – інгібітори ангіотензинперетворювального ферменту (ІАПФ), блокатори рецепторів ангіотензину II 1 типу (БРА), чи сартани, антагоністи кальцію (АК), β-адреноблокатори (β-АБ) та діуретики. У патогенезі підвищеного АТ, ремоделювання міокарда та судинного русла центральне місце посідає ренін-ангіотензин-альдостеронова система (РААС). Своєю чергою, ангіотензин (АТ) II як ключовий медіатор РААС безпосередньо негативно впливає на стан серцево-судинної системи. Саме тому наразі як АГТ першої лінії застосовують препарати з групи БРА й ІАПФ, які модулюють активність РААС, а також зменшують її негативний вплив на серце та судини.
 Механізм дії ІАПФ полягає в пригніченні активності АПФ, який опосередковує перетворення АТ I на АТ II. Водночас в організмі АТ II синтезується й іншими способами, зокрема, в тканинах він утворюється під дією ферментів хімаз [5]. Такі шляхи втрачають вплив ІАПФ, у результаті чого пригнічення РААС цим класом АГП може виявитися недостатньо ефективним. На відміну від ІАПФ, БРА як свою мішень мають рецептори АТ II 1 типу (АТ1); блокуючи їх, вони ефективніше виключають прямий негативний вплив АТ II на серцево-судинну систему. БРА містять низку представників, у т. ч. лосартан, валсартан, ТС, кандесартан, олмесартан, азилсартан.
Механізм дії ІАПФ полягає в пригніченні активності АПФ, який опосередковує перетворення АТ I на АТ II. Водночас в організмі АТ II синтезується й іншими способами, зокрема, в тканинах він утворюється під дією ферментів хімаз [5]. Такі шляхи втрачають вплив ІАПФ, у результаті чого пригнічення РААС цим класом АГП може виявитися недостатньо ефективним. На відміну від ІАПФ, БРА як свою мішень мають рецептори АТ II 1 типу (АТ1); блокуючи їх, вони ефективніше виключають прямий негативний вплив АТ II на серцево-судинну систему. БРА містять низку представників, у т. ч. лосартан, валсартан, ТС, кандесартан, олмесартан, азилсартан.
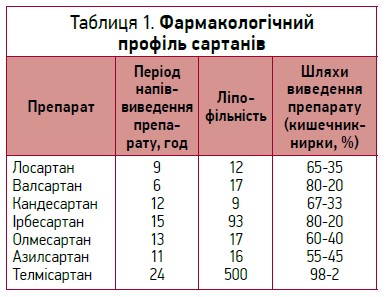
Препарати з доведеним сприятливим впливом на різні етапи патогенезу серцево-судинних захворювань і хронічних хвороб нирок – сартани. Найкраще вивченим за своїми фармакологічними властивостями є представник БРА II покоління ТС (табл. 1). Від інших сартанів його відрізняє висока ліпофільність, пов’язана з великим обсягом розподілу препарату (≈500 л), яка полегшує проникнення ТС у тканини, клітини та клітинні ядра. Препарат має тривалий період напіввиведення (>24 год), що дає змогу приймати його 1 р/день без ризику зниження ефективності наприкінці періоду дозування. ТС не належить до індукторів/інгібіторів ферментів системи цитохрому Р450, що знижує ризик лікарських взаємодій; його біодоступність практично не залежить від прийому їжі. ТС практично повністю (>98% прийнятої дози) виводиться через шлунково-кишковий тракт, тому фармакокінетика препарату не залежить від функції нирок. Також на фармакологію препарату не впливає вік пацієнта (табл. 2).
 ТС завдяки особливим фармакокінетичним властивостям здатний, окрім вираженої антигіпертензивної активності, сприятливо впливати на вуглеводний, ліпідний обміни та має велику доказову базу клінічних і експериментальних досліджень, що дає змогу вважати його «еталонним» представником класу БРА (табл. 3).
ТС завдяки особливим фармакокінетичним властивостям здатний, окрім вираженої антигіпертензивної активності, сприятливо впливати на вуглеводний, ліпідний обміни та має велику доказову базу клінічних і експериментальних досліджень, що дає змогу вважати його «еталонним» представником класу БРА (табл. 3).
За допомогою низки випробувань (у т. ч. порівняльних) доведено, що ТС є високоефективним АГП. Так, у багатоцентровому проспективному рандомізованому дослідженні EVERESTE (EValuation de l’Efficacité RESiduelle du TElmisartan) [6] протягом 12 тиж оцінювали ефективність зниження офісного АТ й АТ за даними самостійного вимірювання пацієнтами в групах ТС (n=217) і периндоприлу (n=218). Спочатку призначали 40 мг ТС або 4 мг периндоприлу з можливістю подвоєння доз кожного препарату через 6 тиж у разі недосягнення цільового діастолічного АТ (ДАТ) <90 мм рт. ст. У групі периндоприлу подвоєння дози потребувала більша кількість пацієнтів (р=0,005) порівняно з хворими, котрі отримували ТС (55 і 41% хворих у кожній групі відповідно). Наприкінці періоду спостереження було виявлено, що в групі ТС відбулося достовірно більше зниження ДАТ при самостійному вимірюванні пацієнтами: -5,1 та -6,6 мм рт. ст. відповідно (р=0,03), а також при офісному вимірюванні в кабінеті лікаря: -6,3 та -8,8 мм рт. ст. відповідно (р=0,002). Аналогічно в пацієнтів, які отримували ТС, відбулося достовірно більше зниження САТ як при самостійному вимірюванні хворими, так і при клінічному вимірюванні лікарем (р=0,004 та р=0,016 відповідно). У групі ТС більше пацієнтів досягли цільових значень САТ <140 мм рт. ст. – 46 і 32% відповідно (р<0,005), а також ДАТ – 58 і 46% відповідно (р<0,01). Є дані про переваги ТС у зниженні офісного АТ і над лізиноприлом [7].
 Проводили дослідження [8, 9] з оцінки впливу ТС на офісний АТ порівняно з іншими представниками класу БРА, за результатами якого виявлено, що ТС краще знижує офісний САТ і ДАТ порівняно з лоcартаном, кандесартаном і валсартаном, а також має найбільшу тривалість дії (р<0,05) [8].
Проводили дослідження [8, 9] з оцінки впливу ТС на офісний АТ порівняно з іншими представниками класу БРА, за результатами якого виявлено, що ТС краще знижує офісний САТ і ДАТ порівняно з лоcартаном, кандесартаном і валсартаном, а також має найбільшу тривалість дії (р<0,05) [8].
Низка авторів [10, 11] порівнювали антигіпертензивні властивості ТС і β-АБ та дійшли висновку, що ТС дозою 80 мг краще знижує офісний САТ (р=0,03), ніж атенолол дозою 50 мг (ΔСАТ -21,7 та -11,8 мм рт. ст. відповідно) [10]. У багатоцентровому рандомізованому подвійному сліпому дослідженні [11] протягом 26 тиж вивчали ефективність і переносимість ТС (n=325) й атенололу (n=164). Дозу препаратів титрували залежно від досягнення цільового рівня ДАТ ≤90 мм рт. ст. або зниження ДАТ на ≥10 мм рт. ст. Серед інших результатів роботи було виявлено, що ТС сприяє більшому зниженню офісного рівня САТ (р=0,005) порівняно з атенололом (ΔСАТ -20,9 та -16,7 мм рт. ст. відповідно). У групі ТС, на відміну від групи атенололу, в достовірно більшої кількості пацієнтів було відзначено зниження офісного рівня САТ на ≥10 мм рт. ст. – 80 і 68% хворих відповідно (р=0,003).
Вищезазначені показники, що свідчать про переваги ТС у зниженні офісного АТ порівняно з іншими АГП, можна пояснити відмінними властивостями препарату, котрий має дуже високу афінність до АТ1. У дослідженні [12] in vitro продемонстровано найбільшу спорідненість ТС до АТ1; серед інших БРА афінність до АТ1 зростала в такому порядку: лосартан ≤ валсартан ≤ кандесартан < олмесартан < ТС. Окрім того, в дослідженнях in vivo [13] продемонстровано ефективний і тривалий антагонізм ТС щодо АТ II. Останній навіть у високих концентраціях не зміг реактивувати заблоковані АТ1, що ще раз підкреслює міцність зв’язку ТС із ними.
Наразі накопичено значний обсяг даних клінічних досліджень, які свідчать про перевагу показників добового моніторування АТ (ДМАТ) над його офісними значеннями. Амбулаторний АТ має кращу прогностичну значущість щодо коронарної патології та смертності, частоти розвитку фатальних і нефатальних інсультів. На ці факти звертається особлива увага в Європейських рекомендаціях із діагностики та лікування АГ [1, 4], а також у рекомендаціях щодо проведення ДМАТ [14]. Це підтверджується результатами дослідження OvA (The Office versus Ambulatory Blood Pressure Study), де порівнювався серцево-судинний ризик протягом 5 років у 1963 пацієнтів, розподілених на групи залежно від початкового середньодобового й офісного АТ [15]. За підсумками роботи встановлено, що загалом ризик серцево-судинних подій у хворих із середньодобовим САТ ≥135 мм рт. ст. був у 3,2 раза вищим, аніж у пацієнтів із середньодобовим САТ <135 мм рт. ст. Після корекції терапії за показниками офісного АТ ризик у пацієнтів у групі із середньодобовим САТ ≥135 мм рт. ст. залишався в 1,3 раза вищим. Отже, середньодобовий АТ був важливим незалежним індикатором серцево-судинного ризику. У дослідженні PAMELA (Pressioni Arteriose Monitorate e Loro Associazioni) [16] протягом 131 міс спостерігали 2051 пацієнта, котрим були проведені вимірювання АТ у кабінеті лікаря (офісний АТ), а також здійснювався самостійний контроль АТ пацієнтом у домашніх умовах і ДМАТ. Було зареєстровано 56 (2,7%) серцево-судинних смертей; одним із важливих результатів виявилося те, що підвищення середньодобового АТ на 10 мм рт. ст. асоціюється зі значнішим прогресивним збільшенням ризику, ніж таке саме підвищення офісного АТ. Аналогічні висновки спостерігали в дослідженні [17] за участю 502 осіб, 252 з яких на момент залучення до випробування мали вперше діагностовану АГ; період спостереження становив 16,1±3,9 року (з 1992 по 2011 р.). Із погляду корекції ризику в пацієнтів з АГ важливим питанням ефективності АГП є їхня здатність знижувати АТ за даними ДМАТ. Для ТС накопичено чималий досвід клінічних досліджень, які демонструють його виражений позитивний вплив на рівень АТ протягом доби.
У випробуванні MICCAT‑2 (The Micardis® Community Ambulatory Monitoring Trial) [18] вивчали антигіпертензивні властивості ТС і ефективність контролю АТ протягом доби в реальній клінічній практиці. У дослідженні взяли участь 1619 пацієнтів із неконтрольованою АГ, 675 з яких перед залученням до випробування не вдалося досягти цільового АТ, незважаючи на прийом АГП; інші не отримували АГТ. Спочатку всім хворим призначали ТС стартовою дозою 40 мг. Якщо після завершення 2 тиж офісний АТ залишався ≥140/85 мм рт. ст., дозу препарату збільшували до 80 мг. Якщо ще через 4 тиж цільового АТ досягти не вдавалося, призначали гідрохлортіазид (ГХТ) дозою 12,5 мг. Усім пацієнтам на початку та наприкінці періоду спостереження здійснювали ДМАТ. На тлі терапії було виявлено суттєве зниження як середньоденних, так і середньонічних рівнів САТ/ДАТ (-11,8/-7,2 мм рт. ст. і -9,6/-5,7 мм рт. ст. відповідно). У хворих із початковим рівнем середньодобового АТ ≥130/85 мм рт. ст. відбулося його виражене зниження; ΔСАТ і ДАТ становили -16,8 та -11,4 мм рт. ст.
Переваги ТС над ІАПФ та іншими представниками класу БРА в зниженні АТ протягом доби отримано за допомогою низки інших робіт [19-21]. Зокрема, у двох подвійних сліпих рандомізованих дослідженнях з однаковим перехресним дизайном і призначенням плацебо на 1 день (еквівалент пропуску дози) аналізували антигіпертензивну ефективність ТС дозою 40-80 мг (n=447) і валсартану дозою 80-160 мг (n=430) [21]. Період спостереження становив 8 тиж. За об’єднаного аналізу результатів даних досліджень було продемонстровано, що ТС краще знижує середньодобові САТ і ДАТ, аніж валсартан. Окрім того, в останні 6 год дії препаратів на тлі терапії ТС (порівняно з валсартаном) відзначено більше зниження як САТ (-11,1 та -9,1 мм рт. ст.), так і ДАТ (-7,6 та -5,8 мм рт. ст. відповідно; р<0,01). Після пропущеної дози середньодобовий САТ/ДАТ у групі ТС знижувався також краще (р<0,05) порівняно з групою валсартану (-10,7/-7,2 мм рт. ст. і 8,7/5,5 мм рт. ст.).
Заслуговує на увагу метааналіз [22] двох подвійних сліпих рандомізованих порівняльних досліджень ефективності ТС добовою дозою 40-80 мг і лосартану дозою 50-100 мг протягом 8 тиж терапії (сумарно в 720 пацієнтів з АГ). В останні 6 год дії препаратів у групі ТС, на відміну від групи лосартану, спостерігали вираженіше зниження ДАТ -6,6±0,4 мм рт. ст. і 5,1±0,4 мм рт. ст. (р<0,01), рівня САТ -9,9±0,6 мм рт. ст. і 7,8±0,6 мм рт. ст. відповідно (р=0,01). На тлі терапії ТС відзначено також нижчі середні погодинні значення САТ і ДАТ за весь період ДМАТ. Є й інші порівняльні дослідження ТС із лосартаном [23], епросартаном [24], в яких ТС краще знижував АТ за результатами ДМАТ.
Таке ефективне зниження АТ протягом доби на тлі прийому ТС можна пояснити його високою афінністю до АТ1, а також найбільшим періодом напіввиведення серед інших БРА, що перевищує 24 год [25].
Із метою профілактики несприятливих серцево-судинних і цереброваскулярних подій украй важливим є адекватний контроль АТ у ранні ранкові години, оскільки існує прямий зв’язок між підвищеною величиною ранкового підйому (ВРП) АТ і виникненням тих чи інших ускладнень АГ. Наприклад, у ранкові години відносний ризик інфаркту міокарда підвищується на 40%, раптової серцевої смерті – на 29%, інсульту – на 49% [26]. Згідно з результатами Фремінгемського дослідження, максимальний ризик раптової смерті спостерігається в період із 07:00 до 09:00 год [27]. Відомо, що найбільша кількість інфарктів міокарда (незалежно від статі, віку та встановленого діагнозу ІХС) відбувається саме в ранкові години, а в пацієнтів зі стабільною стенокардією в цей час спостерігається до 46% епізодів больової та безбольової ішемії міокарда загалом за добу [28]. Крім того, пікова частота виникнення інсульту також припадає на період із 06:00 до 12:00 год [29]. Водночас у дослідженнях продемонстровано тісний взаємозв’язок надлишкової ВРП АТ з ураженням органів-мішеней [30], зокрема з ГЛШ, індексом маси міокарда ЛШ (ІММ ЛШ), діастолічною дисфункцією ЛШ, епізодами депресії сегмента ST, потовщенням комплексу інтима-медіа сонних артерій і їх атеросклеротичним ураженням, жорсткістю артерій, наявністю безсимптомних вогнищ ураження головного мозку, а також із мікроальбумінурією (МАУ). Вкрай важливою є змога забезпечувати контроль АТ у ранні ранкові години. ТС завдяки своїй винятковій фармакокінетиці та довготривалій дії має таку здатність, що було доведено в значній кількості робіт.
У подвійному сліпому плацебо-контрольованому дослідженні [31] за схемою «титрування-ефект» порівнювали антигіпертензивні властивості ТС дозою 40-120 мг з амлодипіном дозою 5-10 мг. Спостерігали 232 пацієнтів з АГ протягом 12 тиж. Усім учасникам дослідження виконували ДМАТ. У результаті виявлено, що ТС достовірно краще знижує ДАТ у нічний час і в останні 4 год періоду своєї дії, ніж амлодипін; відмінності між групами за останнім показником становили 3,4 мм рт. ст. (р<0,05).
Заслуговує на увагу дослідження ATHOS (A comparison of Telmisartan plus Hydrochlorothiazide with amlodipine plus hydrochlorothiazide in Older patients with predominantly Systolic hypertension) [32], яке проводилося щодо літніх пацієнтів віком ≥60 років (n=1000) з ізольованою систолічною АГ. Порівнювали ефективність двох схем терапії: ТС дозою 40-80 мг у комплексі з ГХТ 12,5 мг, а також амлодипін дозою 5-10 мг у комплексі з ГХТ 12,5 мг. Період спостереження становив 6 тиж. Під час дослідження продемонстровано зниження САТ, що в останні 6 год дії препаратів було достовірно вираженішим у групі ТС на відміну від групи амлодипіну (-18,3 та -17,4 мм рт. ст. відповідно). Крім цього, частка пацієнтів, у яких досягнута нормалізація САТ (середньодобовий САТ <140 мм рт. ст.), також була вищою в групі ТС (65,9 та 58,3%; р=0,0175). Результати дослідження мають дуже важливе клінічне значення, адже, з одного боку, серед дигідропіридинових АК амлодипін має найбільший період напіввиведення й діє також >24 год, з іншого боку, в літніх пацієнтів часто складно досягти задовільного контролю АТ, тому ТС може бути препаратом вибору в цієї категорії хворих.
Коли йдеться про контроль АТ у ранні ранкові години, слід зазначити, що в описаному раніше дослідженні MICCAT‑2 [18] ТС у загальній вибірці зумовив достовірне зниження ВРП САТ/ДАТ на -11,5/-7,0 мм рт. ст. (р<0,001), а в підгрупі пацієнтів (n=95) із початковою підвищеною ВРП САТ (>30 мм рт. ст.) зниження ВРП для САТ/ДАТ становило -17,2/-10,1 мм рт. ст. відповідно (р<0,05) порівняно з пацієнтами без підвищеного ВРП. Існує низка інших робіт, які демонструють переваги ТС у зниженні ВРП АТ порівняно з іншими АГП – лосартаном, кандесартаном, валсартаном [8].
Загальновизнаним і доведеним фактом [4] є взаємозв’язок між ураженням органів-мішеней і ризиком розвитку ускладнень при АГ. Існує достатня кількість досліджень, які демонструють переваги ТС над іншими АГП. Зокрема, ТС здатний спричиняти регрес ГЛШ [33, 34]. У нелікованих пацієнтів (n=75) з АГ 2-3 ступеня серед іншого оцінювали вплив монотерапії ТС (n=25), раміприлом (n=25), а також комбінованого лікування ТС і раміприлом (n=25) на вираженість ГЛШ. Загальна тривалість періоду спостереження становила 6 міс. Ступінь зниження АТ був схожим у всіх трьох групах. Наприкінці дослідження ІММ ЛШ у групах ТС, раміприлу та комбінованої терапії ТС і раміприлом знизився на 11,4; 9,9; 15,6% відповідно. Водночас порівняно з монотерапією раміприлом терапія ТС зумовлювала більше зниження ІММ ЛШ (р=0,002) [33]. У 82 пацієнтів з АГ порівнювали вплив на ГЛШ терапії ТС дозою 80 мг і карведилолом дозою 25 мг протягом 44 тиж [34]. Оцінку вираженості ГЛШ здійснювали за допомогою 3D-ехокардіографії та магнітно-резонансної томографії. Наприкінці періоду спостереження регрес ІММ ЛШ у групі ТС був достовірно більшим (р<0,001), аніж у групі карведилолу, що становив -21,97±5,84 г/м² (-15,7%) та -12,31±3,14 г/м² (-9,1%). Схожі дані отримано під час аналізу динаміки ІММ ЛШ за допомогою магнітно-резонансної томографії. У плацебо-контрольованому субдослідженні TRANSCEND (Telmisartan Randomised AssessmeNt Study in ACE iNtolerant subjects with cardiovascular Disease) в групі ТС (порівняно з плацебо) відзначалося зниження частоти нових випадків ГЛШ на 37% [35].
Є відомості про позитивний вплив ТС на ступінь вираженості МАУ (як проявів субклінічного ураження нирок при АГ). Вивчали взаємозв’язок між поліморфізмом чотирьох генів РААС, ефективністю терапії ТС дозою 80 мг і розвитком МАУ у 206 пацієнтів із помірною АГ [36]. Дослідження тривало протягом 12 міс. Асоціації між поліморфізмом генів РААС і відповіддю хворих на лікування ТС виявлено не було. У 28% хворих спостерігалася МАУ (екскреція альбуміну із сечею >30 мг/добу); середня екскреція альбуміну із сечею становила 32,7 мг/добу. Через 3 міс лікування відзначено зменшення МАУ на 52% (р<0,001), а до кінця періоду спостереження зниження сягнуло 69% (р<0,001).
Підвищення жорсткості судин є незалежним чинником серцево-судинної смертності при АГ [41]. Згідно з результатами клінічних досліджень, ТС здатний позитивно впливати на ригідність артеріального русла. Автори [42] порівнювали вплив ТС і дигідропіридинових АК на жорсткість артерій, екскрецію альбуміну із сечею та рівень АТ у пацієнтів з АГ. Було сформовано дві групи хворих (n=50 у кожній). Пацієнти першої групи отримували ТС, другої – один з АК: амлодипін, ніфедипін, цилнідипін або бенідипін. Період спостереження становив 12 міс. Жорсткість артерій оцінювали за допомогою розрахунку CAVI (Cardio-Ankle Vascular Index) – серцево-гомілкового судинного індексу, а як запобіжний МАУ використовували логарифм екскреції альбуміну із сечею; крім того, всім пацієнтам проводили ДМАТ. У результаті виявлено, що в групі ТС (на відміну від групи АК) відбулося достовірне зниження CAVI й екскреції альбуміну (р<0,05 для обох параметрів). У пацієнтів, які отримували ТС, зазначено більше зниження середньодобового та середньоденного ДАТ (р<0,05). В іншій роботі [43] вивчали швидкість поширення пульсової хвилі на ділянках «сонні – стегнові артерії» та «сонні – променеві артерії» у 28 пацієнтів із ЦД 2 типу й АГ. Хворих рандомізували для прийому плацебо чи ТС дозою 40 мг протягом 3 тиж із подальшою зміною препаратів (за перехресним дизайном) після 2-тижневого періоду вимивання шляхом призначення плацебо. ТС достовірно знижував швидкість поширення пульсової хвилі в напрямку «сонні – стегнові артерії» (р<0,05).
Ще одним напрямом у терапії АГ є заходи, спрямовані на запобігання розвитку ЦД, оскільки це захворювання істотно збільшує ризик розвитку тих чи інших ускладнень й інсульту [1, 4]. ТС має ще одну унікальну властивість – здатність корегувати вуглеводний обмін завдяки взаємодії з PPARγ-рецепторами (Peroxisome Proliferator-Activated Receptors-γ – рецептори-γ, що активуються пероксисомними проліфераторами) [44]. PPARγ-рецептори є внутрішньоклітинними рецепторами, що взаємодіють із гормонами та беруть участь у регуляції метаболізму вуглеводів і ліпідів [44]. Через цю особливість ТС має високий терапевтичний потенціал у лікуванні АГ у пацієнтів із супутнім ЦД 2 типу, ожирінням і метаболічним синдромом. Продемонстровано, що ліганди PPARγ-рецепторів підвищують чутливість тканин до інсуліну, зменшують рівень тригліцеридів у крові, знижують ризик розвитку атеросклерозу, пригнічують негативний вплив підвищеного АТ на міокард і стінки судин, а також посилюють периферичну вазодилатацію [44].
За допомогою низки клінічних досліджень ТС у пацієнтів з АГ продемонстровано його здатність підвищувати чутливість тканин до інсуліну та покращувати ліпідний профіль [45-48].
Зокрема, в подвійному сліпому рандомізованому дослідженні [45] вивчали вплив на вуглеводний обмін ТС дозою 80 мг і лосартану дозою 50 мг у 40 пацієнтів із метаболічним синдромом і вперше виявленою АГ. Період спостереження становив 3 міс. ТС, на відміну від лосартану, достовірно знижував рівень вільної глюкози плазми, концентрацію вільного інсуліну плазми, індекс гомеостатичної моделі оцінки ІР і рівень глікозильованого гемоглобіну (р<0,05), а також вираженіше знижував середньодобові САТ і ДАТ (р<0,05).
В іншій роботі [46] в пацієнтів з АГ і ЦД вивчали вплив ТС дозою 40 мг на ІР, рівень циркулювального адипонектину та високочутливого C-реактивного білка (вч-СРБ). До залучення в дослідження пацієнти отримували валсартан дозою 80 мг або кандесартан дозою 8 мг протягом >6 міс. На тлі терапії валсартаном і кандесартаном змін у біохімічних показниках крові відзначено не було. Після переведення пацієнтів на ТС і його прийому протягом 12 тиж відзначено зниження концентрації інсуліну крові натще – з 10,7±3,8 до 8,6±2,7 мОД/л (р<0,01), тригліцеридів крові – з 133,6±51,1 до 118,7±48,1 мг/дл (р<0,05) і вч-СРБ – з 0,154±0,155 до 0,109±0,120 мг/дл (р<0,05), а також збільшення сироваткового адипонектину – з 6,95±2,9 до 7,97±3,5 мкг/мл (р<0,005). Загальновідомо, що рівень адипонектину та вч-СРБ тісно взаємопов’язаний з ІР і розвитком атеросклерозу [46]. Отже, результати зазначеного дослідження свідчать про те, що ТС здатен пригнічувати метаболічні фактори ризику розвитку ускладнень, що є однією з найважливіших цілей у лікуванні АГ у пацієнтів із ЦД.
Ще в одному спостереженні [47] порівнювали вплив на вуглеводний обмін терапії розиглітазоном у комплексі з ТС дозою 40 мг (n=95) або ірбесартаном дозою 150 мг (n=93) у пацієнтів із ЦД 2 типу та метаболічним синдромом, у яких при попередньому лікуванні гіпоглікемічними препаратами не вдалося досягти контролю рівня глюкози крові. Період спостереження становив 12 міс. У результаті виявлено, що достовірне зниження рівня глікозильованого гемоглобіну та глюкози крові натще відбулося тільки в групі ТС. Також відзначалося достовірно вираженіше зниження інсуліну крові натще й індексу гомеостатичної моделі оцінки ІР.
Антигіпертензивну активність ТС (40 мг) і епросартану (600 мг), їхній вплив на баланс глюкози та ліпідний спектр крові вивчали в 119 пацієнтів з АГ (офісний ДАТ – 91-104 мм рт. ст.) і ЦД 2 типу, котрі не отримували гіпоглікемічних препаратів [24]. Період спостереження становив 12 тиж. Серед інших результатів виявлено, що ТС (на відміну від епросартану) краще знижував рівень ліпопротеїнів низької щільності (р<0,01), тригліцеридів (р<0,05), підвищував рівень ліпопротеїнів високої щільності (р<0,01), а також краще знижував рівень загального холестерину (р<0,05).
Із позиції вивчення впливу ТС на прогноз у пацієнтів з АГ на особливу увагу заслуговує широкомасштабне багатоцентрове рандомізоване подвійне сліпе дослідження ONTARGET (Ongoing Telmisartan Alone and in сombination with Ramipril Global Endpoint Trial) за оцінкою серцево-судинних ускладнень у хворих на АГ на тлі трьох схем терапії: ТС дозою 80 мг, раміприл дозою 10 мг або їх поєднання [49]. Було залучено пацієнтів з ІХС, перенесеним інфарктом міокарда, інсультом, захворюваннями периферичних артерій, ЦД 2 типу, в т. ч. з МАУ. У групі ТС ІХС спостерігалася в 74,5% пацієнтів, інфаркт міокарда – в 49,3%, інсульт або транзиторна ішемічна атака в анамнезі – у 20,6%, захворювання периферичних артерій – у 13,6%, ЦД – у 38%, МАУ – у 13,2%. Первинна кінцева точка дослідження включала серцево-судинну смертність, нефатальний інфаркт міокарда, інсульт і госпіталізацію у зв’язку з декомпенсацією СН. Вторинні кінцеві точки були представлені вперше діагностованими СН і ЦД, проведенням реваскуляризації міокарда, деменцією, виникненням фібриляції передсердь і нефропатією. До випробування залучили 25 620 пацієнтів; період спостереження становив 5,5 року. Слід зазначити, що ТС мав дуже хорошу переносимість (кращу, ніж у групі раміприлу, а також у групі комбінованої терапії) [49]. Результати ONTARGET продемонстрували, що для терапії пацієнтів з АГ високого ризику існує альтернативний підхід із використанням ТС. Слід особливо підкреслити, що ТС – єдиний представник із класу сартанів, у якого серед показань є не лише АГ, а й високий ризик розвитку ускладнень, у зв’язку з чим його можна застосовувати для найширшого кола пацієнтів: зі стабільною ІХС, щодо пацієнтів, які перенесли інфаркт міокарда чи інсульт, мали ЦД 2 типу з МАУ, захворюваннями периферичних артерій.
Необхідно також зазначити, що загальна частота побічних ефектів у клінічних дослідженнях ТС була зіставною з плацебо та не залежала від дози, статі, віку й раси [50]. Як відомо, хороша переносимість препарату забезпечує прихильність пацієнтів до лікування, що слугує додатковим механізмом зниження ризику у хворих на АГ.
Сьогодні на українському фармацевтичному ринку наявні препарати Телпрес (ТС) і Телпрес Плюс – комбінація ТС і ГХТ фармацевтичної фірми «Ксантіс Фарма» (Швейцарія). Телпрес має широкий асортимент доз і форм випуску: Телпрес (ТС) 40 мг і 80 мг, Телпрес Плюс (ТС + ГХТ) – 40 мг ТС + 12,5 мг ГХТ, 80 мг ТС + 12,5 мг ГХТ, 80 мг ТС + 25 мг ГХТ. Під час застосування пацієнтами цього препарату було відзначено високу ефективність і хорошу переносимість.
Телпрес відрізняється нижчою вартістю, а отже, має більшу доступність для пацієнтів з АГ, що дає змогу забезпечити кращий контроль АТ і зниження серцево-судинного ризику. Завдяки соціальній ініціативі фармацевтичної фірми «Ксантіс Фарма» пацієнт може отримати додаткову знижку в аптеці, що вкрай важливо для формування прихильності до лікування. Отже, ТС може бути рекомендований як надійний препарат, який допомагає успішно досягти бажаних терапевтичних цілей.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 3 (496), 2021 р.



