24 березня, 2021
Сучасні грані статинотерапії в практиці сімейного лікаря: запитання та відповіді
Протягом багатьох десятиліть серцево-судинні захворювання (ССЗ), зумовлені атеросклерозом, посідають провідне місце в структурі причин смертності населення більшості країн. Щорічно в Європі кардіоваскулярна патологія забирає життя понад 4 млн осіб. За даними Державної служби статистики України, 2019 року питома вага серцево-судинної патології в структурі загальної смертності становила 67%, що багато в чому визначає несприятливу демографічну ситуацію в нашій країні: загалом смертність перевищує народжуваність майже вдвічі.
Найважливішим напрямом у боротьбі з ССЗ є профілактика та лікування дисліпопротеїнемій (ДЛП), які мають ключове патогенетичне значення в розвитку атеросклерозу та його ускладнень.
Результати численних клінічних досліджень свідчать про те, що застосування статинів як засобів первинної та вторинної профілактики має виражений сприятливий вплив на прогноз, забезпечує значне зниження захворюваності та смертності від ССЗ.
Незважаючи на поінформованість лікарів загальної практики про основні положення клінічних настанов щодо застосування статинів, багато приватних питань їх практичного використання в різних клінічних ситуаціях викликають труднощі: починаючи від вибору препарату, дози, мети терапії залежно від ступеня серцево-судинного ризику (ССР) до контролю ефективності та безпеки статинотерапії.
? Коли, кому та в яких дозах призначати терапію статинами?
Статини в клінічній практиці використовуються понад 30 років. За цей час їхні позиції в різних клінічних рекомендаціях істотно зміцнилися. Якщо спочатку цю групу препаратів використовували виключно з метою лікування пацієнтів зі значним підвищенням рівнів атерогенних ліпопротеїнів, то з плином часу показання до їх призначення суттєво розширилися, а тактика використання змінилася.
У 2019 році була опублікована оновлена версія рекомендацій робочої групи Європейського товариства кардіологів (ESC) і Європейського товариства з вивчення атеросклерозу (EAS) щодо лікування дисліпідемій [1]. Відповідно до цих рекомендацій, для вирішення питання про призначення статинів та їх дозування необхідно передусім зважати на два показники: ССР, незалежно від причин його підвищення (первинна чи вторинна профілактика, цукровий діабет – ЦД, хронічна хвороба нирок – ХХН) і вихідний рівень холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ).
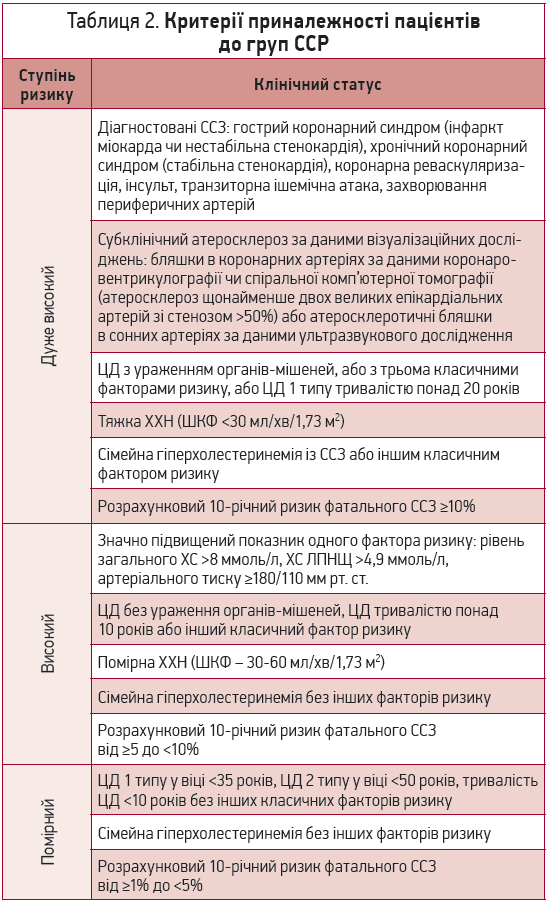
Для оцінки ССР у країнах Європи традиційно використовується шкала SCORE, що враховує низку показників: стать, вік, рівень систолічного артеріального тиску й загального ХС плазми крові, а також статус куріння. Система SСОRЕ дає змогу оцінити ймовірність розвитку фатального серцево-судинного ускладнення в найближчі 10 років. Виокремлюють чотири категорії 10-річного ризику фатальних ССЗ (табл. 1).
Оцінка ризику за шкалою SСОRЕ здійснюється в осіб віком понад 40 років, які не мають ССЗ, зумовлених атеросклерозом. Наявність таких захворювань автоматично переводить пацієнта в групу дуже високого ССР. Окрім того, наявність ЦД 2 типу з ураженням органів-мішеней, тяжкої ХХН зі зниженням швидкості клубочкової фільтрації (ШКФ) <30 мл/хв/1,73 м2, сімейної гіперхолестеринемії в поєднанні з іншими факторами ризику також відносить пацієнта до групи дуже високого ризику.
Докладні характеристики клінічного статусу пацієнтів залежно від приналежності до різних груп ССР наведено в таблиці 2.
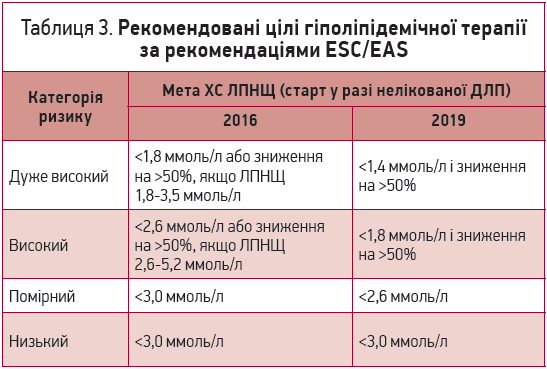
Визначення ступеня ССР має принципове значення для вибору стратегії й тактики ліпідознижувальної терапії, адже дає змогу реалізувати стратегію лікування до мети (treat-to-target), що передбачає досягнення певного рівня ХС ЛПНЩ. Цільовий рівень ХС ЛПНЩ відповідно до рекомендацій ESC/EAS 2019 року став нижчим порівняно з рекомендаціями 2016 року [1]. Порівняльна характеристика цільових рівнів ХС ЛПНЩ представлена в таблиці 3.
Ключовою групою препаратів для гіполіпідемічної терапії в реальній клінічній практиці є статини [2]. Відомо, що статини знижують синтез ХС у печінці шляхом пригнічення активності ГМГ-КоА-редуктази – ключового ферменту в ланцюзі синтезу ХС. Це сприяє зменшенню внутрішньоклітинної концентрації ХС і збільшенню кількості рецепторів до ЛПНЩ на поверхні гепатоцитів. Наслідком цього є підвищення рецептор-опосередкованого захоплення ЛПНЩ і зниження їх рівня в крові. Вплив статинів на концентрацію ЛПНЩ є дозозалежним і широко варіює серед різних представників цієї групи препаратів.
? Як класифікуються статини та чим вони відрізняються один від одного? Які з них найефективніше впливають на концентрацію ХС?
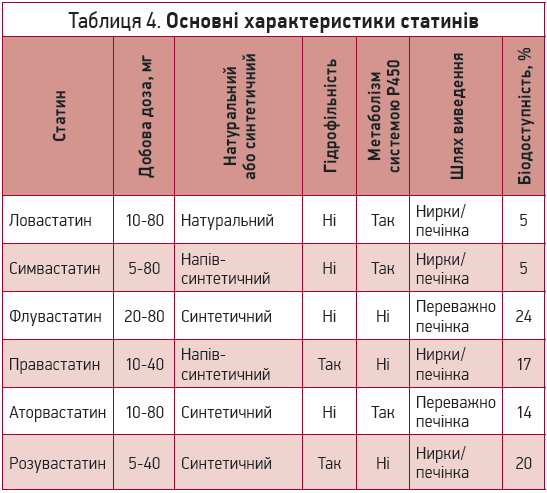
Незважаючи на загальний механізм дії, різні представники групи статинів відрізняються між собою за гідрофільністю, участю в їхньому метаболізмі системи Р450, силою гіполіпідемічного впливу (табл. 4).
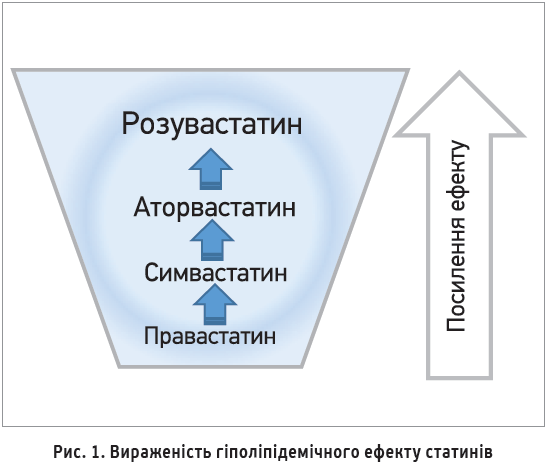
З огляду на низькі цільові рівні ХС ЛПНЩ у пацієнтів із дуже високим і високим ССР, найважливішою властивістю статинів, яку необхідно враховувати при виборі препарату, слід вважати силу його дії. За вираженістю гіполіпідемічного ефекту статини можна розташувати в порядку посилення ефекту в такий спосіб (рис. 1).
Порівняльна ефективність гіполіпідемічної дії статинів вивчалася в дослідженні MERCURY I [3], де оцінювався їх вплив на рівні ХС ЛПНЩ та ХС ліпопротеїнів високої щільності (ЛПВЩ), а також у дослідженні STELLAR, результати котрого показали, що розувастатин 10 мг на 4% більше знижує рівень ХС ЛПНЩ, аніж аторвастатин 20 мг (рис. 2) [4]. Порівняння аторвастатину та розувастатину щодо досягнення цільових рівнів ліпідів продемонструвало неабияку ефективність розувастатину: при його використанні в дозі 10-40 мг цільових цифр ХС ЛПНЩ досягали 82-89% пацієнтів проти 69-85% на аторвастатині в дозі 10-80 мг.
Пацієнтам із дуже високим ССР, для котрих цільовий рівень ХС ЛПНЩ становить 1,4 ммоль/л, однозначно рекомендовано високоінтенсивну терапію статинами. З огляду на це кращим видається використання розувастатину як найефективнішого гіполіпідемічного агента.
Використання симвастатину, котрий часто призначають лікарі в Україні, переважно зумовлено його наявністю в списку препаратів, які підлягають реімбурсації (Наказ МОЗ України від 13.02.2020 № 316 «Про затвердження Реєстру лікарських препаратів, які підлягають реімбурсації, станом на 7 лютого 2020 року»). Разом із тим досягнення цільових рівнів ХС ЛПНЩ у пацієнтів із дуже високим ССР у разі призначення симвастатину неможливо, а з високим ССР – украй проблематично.
Світова практика використання статинів свідчить про те, що найчастіше призначуваними препаратами наразі є розувастатин і аторвастатин. Це зумовлено великою доказовою базою ефективності цих препаратів, широтою показань і досвідом їх використання в різних клінічних ситуаціях (гострий коронарний синдром, хронічний коронарний синдром, період після інсульту чи транзиторної ішемічної атаки, ЦД, артеріальна гіпертензія, облітерувальне ураженням периферичних артерій тощо) [5, 6].
Важливою перевагою розувастатину є те, що гіполіпідемічний ефект розвивається вже після 1 тиж від початку терапії, а через 2 тиж досягається 90% від максимально можливого ефекту. Максимальний терапевтичний ефект зазвичай розвивається до 4-го тижня лікування й підтримується при постійному прийомі препарату.
Гідрофільний розувастатин на відміну від ліпофільного аторвастатину не зазнає метаболізму за участю системи цитохрому Р450, що знижує ризик міжлікарських взаємодій, зменшує проникнення в позапечінкові тканини та мінімізує ризик розвитку міалгії. Зазначені переваги розувастатину сприяють підвищенню ефективності терапії та прихильності пацієнтів до лікування.
У низці досліджень (REGRESS, PLAC I, MARS, MAAS, CCAIT та ін.) доведено зв’язок між рівнем ХС ЛПНЩ та даними коронароангіографії [7-12]. Встановлено також, що статини сповільнюють прогресування атеросклеротичних бляшок і навіть сприяють регресу атеросклерозу коронарних артерій. Вплив інтенсивної терапії розувастатином на розміри атеросклеротичної бляшки переконливо показано в дослідженні ASTEROID [13]. У нього включили понад 500 пацієнтів із коронарним атеросклерозом, яким призначали високодозову терапію розувастатином (40 мг/добу). Тривалість дослідження становила 2 роки. Контроль за обсягом атеросклеротичних бляшок здійснювався за допомогою внутрішньосудинного ультразвукового дослідження. У результаті було показано зменшення нормалізованого обсягу бляшки в найураженішому сегменті коронарної артерії на 6,8% і зменшення абсолютного обсягу бляшки на 9,1%. Отже, інтенсивна високодозова терапія розувастатином забезпечує регрес атеросклеротичного процесу за даними коронарної візуалізації.
Аналізуючи ефективність розувастатину в первинній профілактиці ССЗ, необхідно згадати дослідження METEOR, у якому оцінювали вплив прийому розувастатину в дозі 40 мг/добу на субклінічний перебіг атеросклерозу в сонних артеріях шляхом вимірювання максимальної товщини комплексу інтима-медіа (ТКІМ) [14]. У дослідженні взяли участь пацієнти з низьким ризиком ішемічної хвороби серця (<10% за Фремінгемською шкалою), помірно підвищеним рівнем ХС ЛПНЩ та ТКІМ сонних артерій за даними ультразвукового дослідження в межах 1,2-3,5 мм. Дворічне спостереження показало зменшення максимальної ТКІМ на 0,0014 мм/рік у групі прийому розувастатину проти 0,0131 мм/рік у групі плацебо, в сегменті загальної сонної артерії – 0,0038 мм/рік проти 0,0084 мм/рік відповідно (р<0,001), що вказувало на регрес атероми. Такі зміни відбувалися на тлі зниження ХС ЛПНЩ на 48,8% і підвищення ХС ЛПВЩ на 8%. Отже, результати дослідження METEOR показали, що високодозова терапія розувастатином на стадії формування атеросклеротичної бляшки може сприяти зменшенню кількості пацієнтів із дуже високим ССР у майбутньому.
Важливим моментом, який необхідно пам’ятати лікарю загальної практики, є те, що при вторинній профілактиці в пацієнтів із ССЗ та/або ЦД медикаментозне лікування ДЛП слід починати негайно, незалежно від концентрації ХС ЛПНЩ [1].
? Що таке неліпідні (плейотропні) ефекти статинів і чому вони важливі?
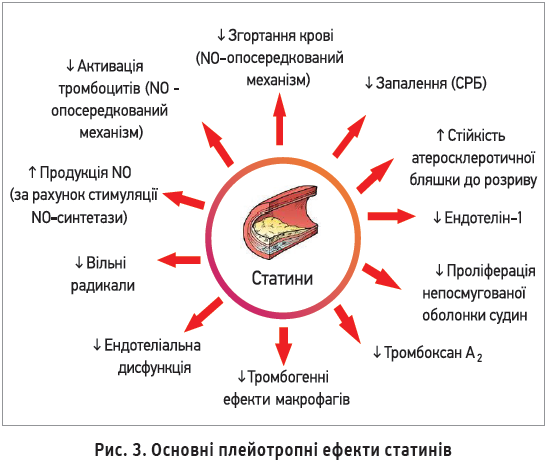
Позитивний вплив статинів на клінічний статус і прогноз пацієнтів із серцево-судинною патологією та високим ССР не обмежується впливом на ліпідний спектр крові. Величезне значення мають неліпідні (плейотропні) ефекти цієї групи препаратів [15]. Основні плейотропні ефекти статинів представлено на рисунку 3.
Статини мають виражений протизапальний ефект, знижують рівень С-реактивного білка (СРБ), чинять позитивну дію на функціональний стан ендотелію. Крім того, препарати цієї групи знижують адгезивні властивості моноцитів, зменшують кількість макрофагів в атеросклеротичній бляшці та секрецію ними металопротеїназ, впливають на проліферацію клітин непосмугованих м’язів, що сприяє стабілізації покришки атеросклеротичної бляшки. Вираженість цих ефектів залежить від інтенсивності статинотерапії.
Одним із найважливіших плейотропних ефектів статинів є їхня протизапальна дія. Зниження рівня СРБ під впливом цієї групи препаратів настає досить швидко й безпосередньо корелює зі зниженням імовірності серцево-судинних ускладнень. Протизапальний ефект статинів було показано в низці плацебо-контрольованих досліджень, у яких зафіксовано зниження рівня СРБ, що корелювало зі зменшенням частоти серцево-судинних подій.
Зокрема, в дослідженні JUPITER із вивчення ефективності й безпеки розувастатину 20 мг/добу в рамках первинної профілактики та його впливу на «тверді» кінцеві точки в чоловіків і жінок без гіперхолестеринемії, але з підвищеним рівнем СРБ спостерігалося не тільки його зниження, а й зменшення ризику інфаркту міокарда, інсульту, серцево-судинної смерті та системного венозного тромбоемболізму на 47%. Зниження рівня ХС ЛПНЩ у групі терапії розувастатином у дозі 20 мг/добу становило 50%, високочутливого СРБ – 37% [16].
? Наскільки великим є спектр побічних ефектів статинів? Чи є ці препарати небезпечними за тривалого прийому? Як контролювати ефективність і безпеку статинотерапії в конкретного пацієнта?
Питання безпеки тривалого прийому статинів є предметом активної дискусії як серед лікарів, так і серед пацієнтів. Після виходу цієї групи препаратів на фармацевтичний ринок спочатку їм приписували велику кількість небажаних ефектів, включаючи онкопатологію, катаракту, когнітивне зниження, токсичні ураження печінки, інсульт тощо. Проте страхи з приводу цих побічних ефектів виявилися сильно перебільшеними. Реальними побічними ефектами можна вважати підвищення трансаміназ, яке зазвичай має транзиторний характер, міалгії, незначне збільшення ризику розвитку ЦД 2 типу та вкрай рідкісні випадки рабдоміолізу.
Прогресування печінкової недостатності на тлі прийому статинів буває вкрай рідко. Статини дозволені до застосування в пацієнтів з алкогольним ураженням печінки чи хронічними захворюваннями печінки поза загостренням. Вони не погіршують прогноз у разі хронічних вірусних гепатитів [17]. Підвищення рівня трансаміназ часто редукується при зменшенні дози чи заміні препарату на інший статин [18].
Трирічне проспективне дослідження GREACE [19] показало, що менш ніж 1% хворих на неалкогольну жирову хворобу печінки, котрі приймали статини, повністю припинили прийом препарату через підвищення рівня АСТ або АЛТ >3 верхньої межі норми (ВМН). Ба більше, в підгрупі хворих із початково підвищеною концентрацією АЛТ, АСТ або γ-глутамілтранспептидази, котрі приймали статини, на тлі розпочатої терапії відзначено поліпшення біохімічних показників функції печінки. Протягом 3 років показники функції печінки нормалізувалися у 89% хворих. Ризик розвитку серцево-судинних ускладнень знизився на 68%.
Понад 30 років було потрібно для того, щоб з’ясувати, що статини можуть зумовлювати ризик розвитку ЦД (+9%; 95% довірчий інтервал 1,02-1,17) [20]. Однак ці ризики «перекриваються» зниженням частоти серцево-судинних ускладнень і асоційовані не стільки з прийомом статинів, скільки зі схильністю пацієнтів до ЦД [20-22].
Дослідження CORONA показало, що смертність від раку, інших некардіальних і невідомих причин, а також число госпіталізацій у групі хворих, які протягом 5 років приймали розувастатин у дозі 10 мг/добу, та в групі плацебо були зіставні [23]. За результатами пілотного дослідження, проведеного в США, розувастатин не тільки не поступається іншим статинам у переносимості, але й може успішно застосовуватися за непереносимості інших гіполіпідемічних препаратів. Дані програми GАLАХY, котра включає 29 досліджень за участю 170 тис. пацієнтів із ретельним аналізом параметрів переносимості, дають змогу повністю закрити дискусію про безпеку розувастатину щодо печінки, нирок, ризику міопатії та рабдоміолізу [24].
З огляду на високу ефективність розувастатину навіть у низьких дозах і водночас низьку частоту підвищення АЛТ >3 ВМН, можна вважати, що він характеризується найсприятливішим співвідношенням користь/ризик [25].
У дослідженні SAMSON учені з Великої Британії вивчали симптоми пацієнтів, які протягом року поперемінно приймали статини, плацебо чи не використовували жодних препаратів. Підсумки було представлено на щорічній науковій сесії Американської асоціації серця (AHA, 2020) й опубліковано в журналі The New England Journal of Medicine [26]. До випробування залучили пацієнтів, які раніше приймали статини, але припинили лікування через побічні ефекти. Результати показали, що 90% симптомів, про які повідомляли пацієнти під час прийому статинів, також відзначили учасники, котрі приймали плацебо. Тимчасово відміняти лікування довелося зіставному числу осіб. Отже, статини та плацебо спричиняли схожі побічні ефекти, що може свідчити про переважання психологічних, а не фармакологічних ефектів лікування.
Попри високу безпеку терапії статинами, практичний лікар повинен уважно стежити за клініко-лабораторним статусом пацієнта, котрий отримує гіполіпідемічну терапію, контролювати ефективність і безпеку лікування. Рекомендації з контролю наведено в таблиці 5.
? Як вибрати препарат із групи статинів для конкретного пацієнта? Наскільки ефективні дженерики? Як збільшити прихильність пацієнта до гіполіпідемічної терапії?
Якщо розглядати пацієнтів із наявними атеросклеротичними ССЗ (вторинна профілактика) та хворих із дуже високим і високим ССР, то фактичний вибір може здійснюватися лише між аторвастатином і розувастатином. Це зумовлено тим, що всі інші статини не мають гіполіпідемічної дії, достатньої для досягнення цільових цифр ХС ЛПНЩ. Окрім того, зазначені препарати є найбільш вивченими та довели свою ефективність у великій кількості багатоцентрових рандомізованих клінічних досліджень. Розувастатин – найсильніший статин, отож є найкращим для досягнення мети терапії в 1,4 ммоль ХС ЛПНЩ при дуже високому ССР.
Структура споживання препаратів на українському фармацевтичному ринку відрізняється від такої в розвинених країнах. У США в топ‑10 лікарських засобів провідні позиції належать статинам, тоді як у нас статини не входять навіть у топ‑20.
Практичному лікарю доводиться вибирати не тільки між різними представниками класу статинів, а й між оригінальним і дженеричним препаратом [27, 28]. Дженерик – це відтворений лікарський засіб, аналогічний патентованому (оригінальному) препарату й виведений на ринок після закінчення терміну патентного захисту оригіналу.
Серед дженеричних препаратів розувастатину в Україні заслуговує на увагу препарат Клівас виробництва компанії Acino Group (Швейцарія), котрий довів повну відповідність оригінальному розувастатину в дослідженні біоеквівалентності. Біоеквівалентними визнаються два препарати, якщо вони мають однакові ступінь і швидкість всмоктування, розподіл і виведення з організму в рівних експериментальних умовах. При дослідженні біоеквівалентності враховуються три основні фармакокінетичні параметри: біодоступність, максимальна концентрація в плазмі крові та час досягнення максимальної концентрації від моменту прийому препарату. Дослідження біоеквівалентності Клівасу показало повний збіг кривих залежностей «концентрація/час» порівняно з оригінальним розувастатином [29]. Високий рівень біоеквівалентності Клівасу відзначений у Rx Index, де препарат класифікований як B.1 – дженеричний лікарський засіб, взаємозамінність якого доведена в дослідженні біоеквівалентності in vivo.
Прихильність до терапії статинами серед українських пацієнтів є вкрай низькою, що багато в чому зумовлює високу смертність від ССЗ. Згідно з даними українського реєстру STIMIL, через 12 міс після перенесеного великовогнищевого інфаркту міокарда статини продовжували приймати лише 24,2% хворих [30]. У зв’язку з цим велике значення мають заходи, спрямовані на підвищення економічної доступності препарату, в тому числі шляхом запровадження різних соціальних програм підтримки пацієнтів. Компанія Acino вже протягом 15 років реалізує в Україні соціальну програму «З турботою про співвітчизника».
Сенс програми полягає в тому, що при купівлі в аптеці упаковки препарату на місячний курс лікування пацієнт додатково отримує безкоштовну соціальну упаковку того самого препарату на 10-денний курс. Це зменшує вартість терапії на 30% і, безперечно, сприяє підвищенню прихильності до лікування. У зазначеній соціальній програмі поряд з іншими препаратами присутній Клівас у дозуваннях 10 і 20 мг в 1 таблетці. Це створює можливість для пацієнтів отримувати високоякісний препарат розувастатину за доступною ціною, а для лікарів – повноцінно реалізовувати сучасні принципи гіполіпідемічної терапії.
Список літератури знаходиться в редакції.
UA-CLIV-PUB-032021-049
Медична газета «Здоров’я України 21 сторіччя» № 4 (497), 2021 р.