24 травня, 2021
Коронавіруси та серцево-судинна система: складні аспекти взаємозв’язку
У 2019 р. пандемія нової коронавірусної інфекції COVID‑19 привернула увагу фахівців по всьому світу до важливості коронавірусів людини (CoV) як значної загрози здоров’ю людства. Так, за останні два десятиліття виникли три CoV – тяжкий гострий респіраторний синдром (SARS-CoV), близькосхідний респіраторний синдром (MERS-CoV) та тяжкий гострий респіраторний синдром 2 (SARS-CoV‑2). Як і багато інших вірусів, коронавіруси спричиняють розвиток серцево-судинних захворювань (ССЗ). Хоча коронавіруси мають спільні патофізіологічні аспекти, їх взаємозв’язок із серцево-судинною системою (ССС) є складним, із наявною різницею між ними. Під егідою Європейського товариства кардіологів (ESC) J.M. Pericаs et al. цьогоріч у березні підсумували найважливіші характеристики вірусних інфекцій, зокрема стосовно впливу на ССС, фактори ризику, пов’язані з клінічними проявами COVID‑19, та поточні рекомендації з лікування серцево-судинних (СС) ускладнень, спричинених даною хворобою. Пропонуємо до вашої уваги ключові положення даної роботи.
Станом на травень 2020 року, на COVID‑19 захворіли >16,5 млн осіб і померли >650 тис. осіб на планеті. SARS-CoV‑2 уражає переважно ССС, при цьому рецептором і точкою проникнення до клітини є ангіотензинперетворювальний фермент 2-го типу (АПФ2) (Prasad et al., 2020; Zheng et al., 2020; Gupta et al., 2020). Показано, що, окрім супутніх ССЗ як ключових факторів ризику тяжкого перебігу COVID‑19, дедалі більше підтверджується мультисистемна природа хвороби зі значним ураженням судин, серцево-судинної, цереброваскулярної систем та нирок.
Вплив вірусів на ССС
Негативний плив на ССС чинять не лише коронавіруси. Дослідження показують, що різні типи гострих інфекцій, особливо вірусні, як-от грип, вірус імунодефіциту людини (ВІЛ), ентеровіруси, лихоманка денге, віруси Зіка, чикунгунья та герпеса, парвовірус B19 і респіраторно-синцитіальний вірус, здатні провокувати кардіальне ушкодження та пов’язані з цим CС-події, серед яких міокардит, гострі коронарні синдроми (ГКС), аритмії, серцева недостатність (СН), раптова серцева смерть тощо (Alvarez et al., 2017; Verdonschot et al., 2016).
Вірусна інфекція може призводити до розвитку ССЗ у значного відсотка пацієнтів, що часто не мають клінічних проявів. Серед осіб із грипом в 0,4‑13% спостерігався гострий міокардит (до 50% фатальних випадків), а ризик інфаркту міокарда (ІМ) зростав у шість разів протягом семи днів після підтвердженої інфекції (Sellers et al., 2017; Kwong et al., 2018).
Також було доведено, що грипозна інфекція асоційована з вищим ризиком шлуночкових аритмій та госпіталізації через СН (Madjid et al., 2019; Kytomaa et al., 2019). На додаток, за останні два десятиліття дослідники широко розглядали взаємозв’язок ВІЛ та ССС. Так, 2010 р. в 19% осіб із ВІЛ було діагностоване принаймні одне ССЗ (Pinto, da Silva, 2018). Слід зауважити, що люди з ВІЛ (які отримують або не отримують лікування) мають значно вищий ризик розвитку ССЗ, і клінічно ССЗ проявляється в середньому майже на 10 років раніше, ніж у неінфікованій популяції (Hemkens, Bucher, 2014).
Певні особливості кореляції між вірусами та проявами ССЗ є специфічними. Наприклад, деякі віруси, такі як ентеровіруси або грипозна інфекція, часто спричиняють кардіальні ураження (переважно міокардит) у педіатричній популяції, інші ж, як-то коронавіруси, – ні. Донедавна на ранній розвиток ішемічної хвороби серця (ІХС) серед осіб із ВІЛ значною мірою впливали метаболічні порушення, викликані антиретровірусною терапією, у західних країнах, тоді як пошкодження перикарда, що часто пов’язані з туберкульозом, ВІЛ-асоційованими кардіоміопатією / легеневою гіпертензією, були найпоширенішими СС-ускладненнями серед пацієнтів із ВІЛ у країнах, що розвиваються (Thienemann et al., 2013). Хоча вакцинація у разі грипу, ймовірно, зменшує загальний тягар ССЗ серед літніх хворих, її вплив на частоту розвитку гострих коронарних подій досі незрозумілий (Cheng et al., 2020; Rodrigues et al., 2020).
Існують спільні особливості того, яким чином віруси викликають ураження ССС de novo або декомпенсацію наявних ССЗ. Запалення та окислювальний стрес є важливими факторами, що спричиняють розвиток ССЗ (Steven et al., 2019). Наприклад, вищий рівень С-реактивного білка (СРБ) асоційований із більшою смертністю після перенесеного ІМ (Ridker et al., 2005). Хоча патофізіологія кардіальних пошкоджень на тлі вірусних інфекцій досі переважно невідома, схоже, що при багатьох із них запальні патерни, що призводять до клінічних проявів ССЗ, є подібними. Загалом складне локалізоване запалення судин та стійке системне запалення з різною значущістю прокоагулянтних, мікроангіопатичних та тромботичних ефектів впливають на механізми, залучені до гострого та хронічного впливу на ССЗ. Безпосереднє інфікування ендотеліальних клітин як у серці, так і в судинному руслі було описане при кількох вірусних інфекціях, як-то спричинена вірусом Коксакі або парвовірусом B19, але при грипозній цей процес залишається неясним (Pollack et al., 2015; Bültmann et al., 2003).
Також варто зазначити, що на додаток до вірусів на розвиток СС-подій можуть впливати різні фактори. Так, коінфекція з іншими вірусами чинить синергетичний ефект на ризик ССЗ та смерті (наприклад, грип А, В, ВІЛ та гепатит С), а також із бактеріями (як-то грип і Streptococcus pneumoniae) чи грибами (захворювання, викликані різними різновидами Aspergillus) (Goka et al., 2015; Sosner et al., 2012). Окрім того, одночасне застосування певних препаратів може діяти як підсилювач або буфер для розвитку СС-ускладнень (Izurieta et al., 2018; Gotsman et al., 2020; Modin et al., 2020).
Нові коронавіруси: вірусологія та патофізіологія
Хоча людські CoV, окрім високопатогенних, що виникли протягом останніх двох десятиліть, маловідомі, чотири роди сімейства Coronaviridae (альфа, бета, гамма та дельта) включають інші коронавіруси, які циркулюють серед людей протягом століть, переважно викликаючи легкі респіраторні захворювання (до 30% випадків застуди) (Corman et al., 2018). Коронавіруси отримали свою назву завдяки шипоподібним глікопротеїнам на поверхні частинок вірусу, які нагадують корону. Всі нові CoV (SARS-CoV, MERS-CoV та SARS-CoV‑2) є бета-коронавірусами.
Ці три CoV передаються переважно респіраторним шляхом через великі крапельні вірусні частинки при тісному контакті з інфікованими (Pericas et al., 2020). Також вони можуть залишатися на поверхнях та становити небезпеку навіть через кілька днів (Richard et al., 2020; van Doremalen et al., 2020). Пресимптомна стадія та перші дні симптомів корелюють із вищим вірусним навантаженням, що пов’язано з більшою імовірністю передачі хвороби (He et al., 2020).
Вищезазначені CoV проникають до клітин-господарів шляхом зв’язування з рецепторами клітин – дипептидилпептидазою 4 (ДПП4) у разі MERS-CoV та АПФ2 – SARS-CoV і SARS-CoV‑2. Вони переважно потрапляють до епітелію дихальних шляхів, але також були виявлені у клітинах різних систем органів, таких як кров (ДПП4), серце, нирки, мозок та печінка (АПФ2) (Xu et al., 2011).
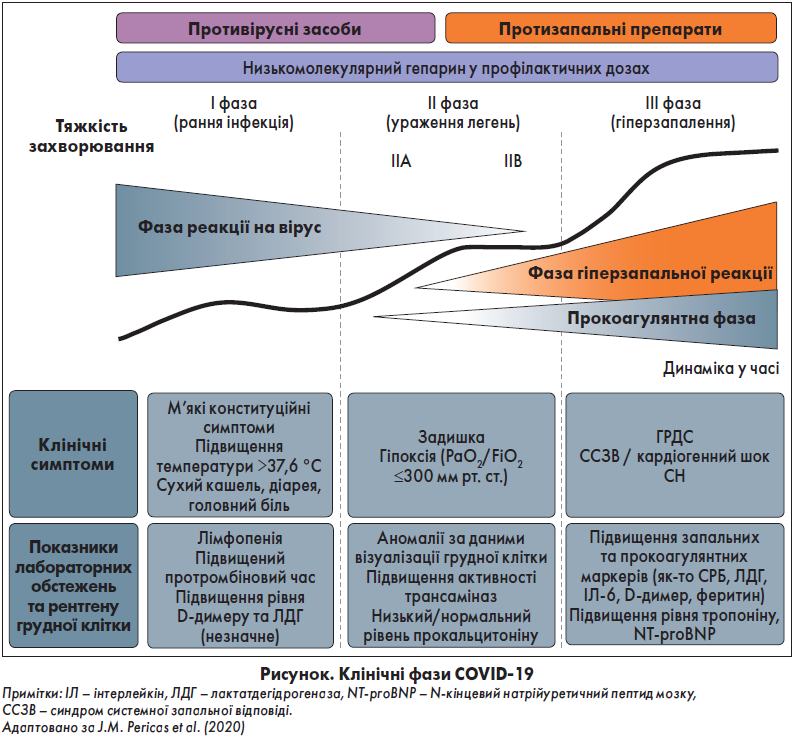
Пандемія COVID‑19 охопила більшу кількість країн і пацієнтів, ніж дві попередні пандемії нових CoV, до того ж інфекція SARS-CoV‑2, імовірно, чинить суттєвіший вплив на ССС (Xiong et al., 2020; Wei et al., 2020). Тому було проведено більше досліджень, присвячених механізмам, що пов’язують SARS-CoV‑2 із ССС, незважаючи на короткий проміжок часу з моменту початкового спалаху COVID‑19. У попередніх випробуваннях науковці зосереджувалися на характеристиках патофізіології гострого респіраторного дистрес-синдрому (ГРДС) та дихальної недостатності, асоційованих із гіперзапальною фазою, що тісно корелює з цитокіновим штормом. 3окрема, у новіших дослідженнях був уведений термін «прокоагулянтна, або протромботична фаза» для позначення стадії, що характеризується порушенням згортання крові з виразною тенденцією до тромбозу на мікро- та макрорівнях (Lippi et al., 2020).
Клінічні стадії COVID‑19 представлені на рисунку. Протягом перших днів від початку інфікування COVID‑19 у пацієнтів зазвичай має місце перша фаза із симптомами, які нагадують вірусну інфекцію верхніх дихальних шляхів, що характеризується лихоманкою та кашлем. Через 8‑12 днів відбувається перехід у фазу запалення, під час якої можуть з’явитися легеневі симптоми у вигляді задишки. У хворих, які переходять у гіперзапальну фазу з відповідним ураженням легень, існує значна ймовірність розвитку ГРДС. Крім того, на цій стадії для пацієнтів характерний високий ризик тромботичних та емболічних подій через прокоагулянтний стан.
СС-ускладнення частіше проявляються орієнтовно через два тижні після появи симптомів COVID‑19, але також можуть виникати дуже рано або навіть через кілька місяців (Guzik et al., 2020; Mitrani et al., 2020). У будь-якому разі пошкодження мікросудин, найімовірніше, розвивається на ранній стадії захворювання. Тому була створена рекомендація застосовувати превентивне антикоагулянтне лікування та виникла гіпотеза про те, що антитромботична терапія, можливо, має переваги у пацієнтів із COVID‑19. Тромбоз може розвиватися у 50% критично хворих, а також як вторинне ускладнення в осіб із тяжким респіраторним дистрес-синдромом, але він буває також основним проявом у пацієнтів із легкими респіраторними симптомами (Klok et al., 2020; Poissy et al., 2020). Тромботичні події, від тромбоемболії легеневої артерії (ТЕЛА) до уражень ССС, були зафіксовані як єдині клінічні прояви COVID‑19 або ж виявилися асимптоматичними. Наявність антифосфоліпідних антитіл було зафіксовано у деяких випадках тромбозу, хоча їх справжню патогенну роль у захворюванні ще потрібно встановити (Zhang et al., 2020).
Попередні дані щодо залучення ССС до патогенезу COVID‑19 свідчать про те, що загальні точки їх перетину відповідають ангіопатії різного ступеня, що переважно вражає ендотелій. G. Goshua et al. (2020) оцінили маркери активації ендотеліальних клітин і тромбоцитів, а також фактори згортання крові, ендогенні антикоагулянти та фібринолітичні ферменти у 68 хворих на COVID‑19 порівняно із 13 безсимптомними негоспіталізованими пацієнтами контрольної групи. Було показано, що сумісні з ендотеліопатією патерни частіше зустрічалися в осіб із COVID‑19, і чим вищою була інтенсивність ендотеліопатії, тим гірші результати. На макрорівні B.V. Patel et al. (2020) за допомогою комп’ютерно-томографічної (КТ) ангіографії легень, двоенергетичної КТ та тромбоеластографії у 39 пацієнтів із COVID‑19 виявили, що порушення легеневої перфузії та гіперкоагуляції, що свідчили про розвиток ангіопатії та тромбозу, були різною мірою наявними у всіх хворих.
У серії досліджень глибше вивчали зв’язок ССС та COVID‑19 шляхом опису таких механізмів, як мікросудинне пошкодження внаслідок мікроангіопатії, асоційоване з імунною відповіддю господаря на SARS-CoV‑2, пряме ураження клітин вірусною інфекцією, вплив вихідного ССЗ, як-то артеріосклероз і артеріальна гіпертензія (АГ), на ступінь тяжкості COVID‑19, а також системної запальної реакції та дихальної недостатності на серце, систему кровообігу, судини інших органів тощо (Montone et al., 2020; Vinciguerra et al., 2020). L. Chen et al. (2020) показали, що перицити експресують особливо високий рівень АПФ2 у серці, що може лежати в основі місцевого мікросудинного запалення, індукованого SARS-CoV‑2. Це може спричиняти розвиток як ІМ з елевацією сегмента ST, так і міокардиту (Prasad et al., 2020).
За даними R.A. Montone et al. (2020), ці механізми здатні призводити до розвитку чотирьох груп потенційних проявів ССЗ:
- нестабільність бляшок та тромботична оклюзія, що зумовлюють гострий ІМ 1-го типу (ГІМ);
- гіпоксія, гіпотонія та аритмії, які призводять до ГІМ 2-го типу;
- гостра мікросудинна дисфункція, що викликає синдром Такоцубо;
- опосередкований вірусом лізис кардіоміоцитів та активація імунної системи, що спричиняють міокардит.
Детермінанти того, які саме пацієнти схильні до розвитку ССЗ, які шляхи переважають, і чому уражаються виключно або здебільшого певні органи ССС у конкретних хворих, залишаються до кінця невідомими. На додачу, бракує патологоанатомічних досліджень для глибшого вивчення цього питання. Однак нещодавно внаслідок проведення 14 автопсій хворих на COVID‑19 B.T. Bradley et al. (2020) встановили, що, хоча дифузне альвеолярне пошкодження було поширеним явищем, у п’яти випадках мали місце вогнищеві легеневі мікротромби, а в одному – лімфоцитарний міокардит із вірусною РНК у тканині; мікротромби виявилися рідкісними в інших органах, крім легень, і ендотеліїт не був зафіксований.
СС-ускладнення на тлі коронавірусів
У контексті трьох нових CoV різноманітність проявів ССЗ є ширшою, а частота набагато вища на тлі SARS-CoV‑2 порівняно із SARS-CoV та MERS-CoV (Assiri et al., 2013; Alhogbani, 2016). За винятком SARS-CoV‑2, систематичних досліджень, в яких би оцінювали поширеність та фактори ризику СС-ускладнень при SARS-CoV та MERS-CoV, бракує. Однак для трьох CoV є спільним той факт, що патології серця й АГ, фактори ризику розвитку ССЗ, як-то ожиріння та цукровий діабет, були визначені як чинники ризику зростання тяжкості CoV і смертності (Liu et al., 2020). За даними кількох епідеміологічних досліджень, спостерігався підвищений ступінь тяжкості COVID‑19 у пацієнтів з основними факторами СС-ризику або коморбідними захворюваннями.
Існує чотири ступеня проявів ССЗ на тлі COVID‑19 для проведення оцінки:
- СС-події, насамперед викликані інфекцією SARS-CoV‑2.
- СС-ускладнення у пацієнтів із декомпенсацією раніше підтверджених ССЗ під час COVID‑19.
- ССЗ, частота або ступінь тяжкості яких могли змінитися з різних причин під час спалахів COVID‑19 за різних умов.
- Несприятливі ефекти деяких препаратів із боку ССС, що використовують для лікування COVID‑19.
Ураження міокарда: стресова кардіоміопатія, міокардит та коронарні синдроми
Найбільш ретельно вивченим ураженням ССС на тлі COVID‑19 є гостре пошкодження міокарда, що визначається як підвищення специфічних кардіальних маркерів, переважно високочутливого серцевого тропоніну I (hs-TnI) та N-кінцевого натрійуретичого пептиду мозку (NT-proBNP). Зростання цих біомаркерів може бути пов’язане насамперед із кардіальним навантаженням (особливо правого шлуночка) в умовах тяжкого пошкодження легень, респіраторного дистресу та подальшої легеневої гіпертензії, а також із безпосереднім ураженням міокарда, як у випадку ішемії міокарда або міокардиту.
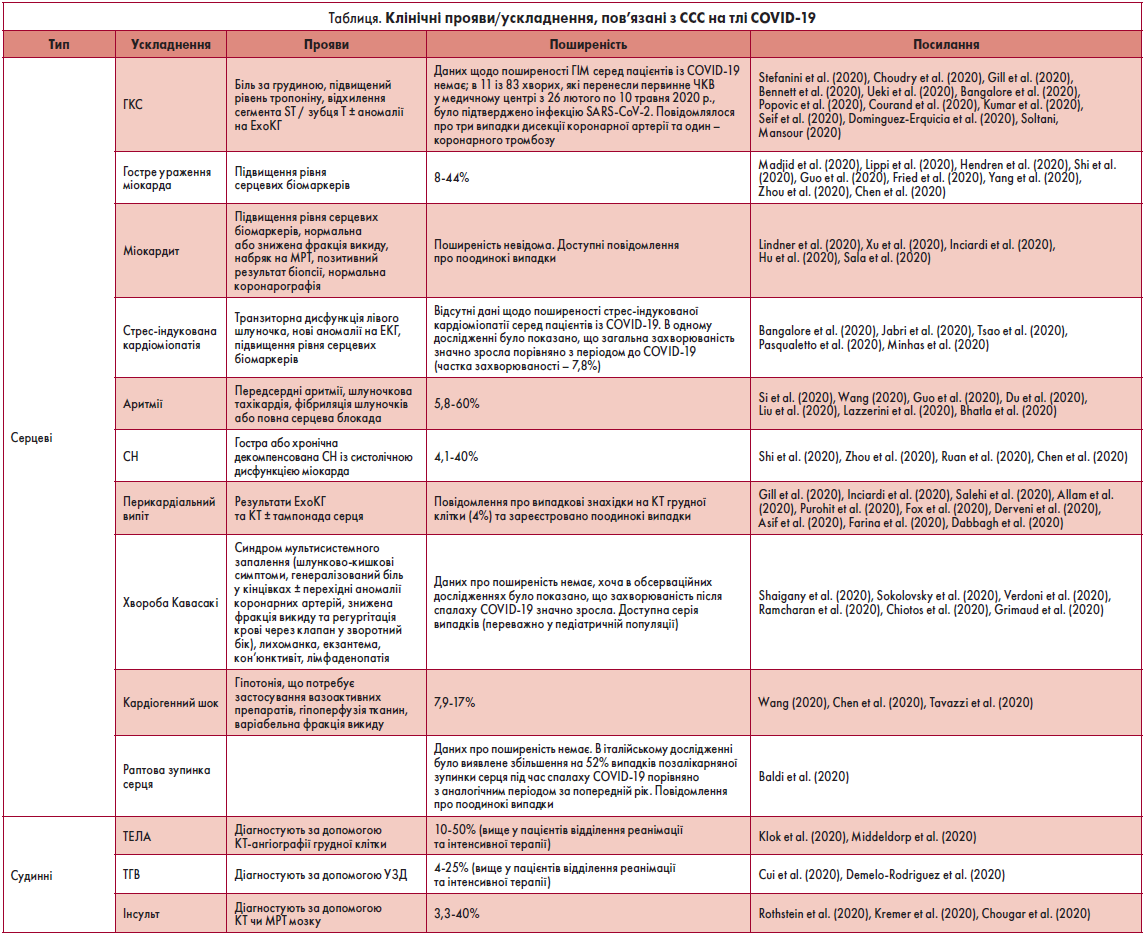
У контексті гострого пошкодження міокарда подальші дослідження також стосувалися міокардиту. При вивченні даних ехокардіографії (ЕхоКГ) нерідко було виявлено знижену фракцію викиду лівого шлуночка за відсутності ІХС. Поширеність гострого пошкодження міокарда становить близько 20%, але у різних дослідженнях цей показник варіює (8‑44%) (таблиця). Подібна частка пацієнтів також має підвищений рівень натрійуретичного пептиду в головному мозку.
Збільшення вмісту тропоніну, NT-proBNP та системних маркерів запалення (цитокінів, СРБ) зазвичай відбувається паралельно та пропорційно (Liu et al., 2020). Діагностика міокардиту в такій ситуації може бути складною. Необхідно враховувати кілька факторів:
- поріг збільшення серцевого біомаркера для визначення кардіального ураження нестійкий;
- дані електрокардіограми (ЕКГ) у багатьох дослідженнях відсутні, тому немає чіткої кореляції між клінічними проявами, відхиленнями лабораторних показників, змінами на ЕКГ та результатами коронарографії;
- часто відсутні дані систематичної магнітно-резонансної томографії (МРТ) серця, ендоміокардіальної біопсії та коронарографії для підтвердження діагнозу міокардиту.
G.G. Stefanini et al. (2020) аналізували 28 хворих на COVID‑19 із діагнозом ІМ та стійкою елевацією сегмента ST (STEMI), в яких провели коронарографію. З них у 39,3% не було зареєстровано аномалій на ЕКГ. Водночас F.A. Choudry et al. (2020) порівняли дані 39 пацієнтів із COVID‑19 та STEMI і 76 осіб без COVID‑19 зі STEMI. Автори виявили, що в жодного хворого на COVID‑19 зі STEMI не було отримано нормальних результатів коронарографії, але відзначалося вище навантаження коронарних тромбів. Тому класифікація деяких випадків як STEMI, а не міокардиту в дослідженні G.G. Stefanini et al. (2020) може бути суперечливою.
Також слід підкреслити важливість диференціації STEMI типу 1 та 2. Адже хоча черезшкірне коронарне втручання (ЧКВ) є обов’язковим при STEMI типу 1, воно може бути непотрібне у разі STEMI типу 2, особливо якщо пацієнти гемодинамічно стабільні. Серійні ЕКГ, рівні тропоніну та аналіз аномалій стінок лівого шлуночка важливі для розрізнення коронарного та некоронарного пошкодження міокарда. Необхідність інвазивної оцінки при ГКС високого ризику має відповідати чинним рекомендаціям незважаючи на наявність інфекції SARS-CoV‑2. При цьому слід оцінювати ризики й переваги обстеження та забезпечувати адекватний індивідуальний захист для лікувальної бригади.
СН і кардіогенний шок
СН є вельми поширеним явищем у пацієнтів із SARS-CoV‑2. Окрім гострого впливу на міокард, інфекція може також виступати декомпенсувальним фактором у хворих на хронічну СН. Застосування натрійуретичних пептидів, візуалізаційних досліджень та вивчення історії хвороби можуть допомогти у диференціальній діагностиці задишки та визначенні найкращої стратегії лікування (de Juan Baguda et al., 2020).
Кардіогенний шок трапляється рідко, хоча деяким пацієнтам на інтенсивній терапії можуть знадобитися вазопресори. Використання екстракорпоральної мембранної оксигенації (EКMO) має бути ретельно оцінене в контексті наявності медичних ресурсів. Як зазначають Y. Sandoval et al. (2020), некардіальні стани, такі як ТЕЛА, критичні стани та сепсис, а не первинні патології серця, ймовірно, є основною причиною ураження міокарда.
Як показано в таблиці, на тлі COVID‑19 розвивається чимало СС-ускладнень. Що стосується кардіальних уражень, переважна частка клінічних проявів відповідає спектру, що охоплює гостре пошкодження міокарда, міокардит і стресову кардіоміопатію, що також може призводити до розвитку аритмій та СН / кардіогенного шоку в пацієнтів з/без раніше підтверджених ССЗ.
Слід зауважити, що COVID‑19, безумовно, пов’язаний з ускладненнями з боку ССС, однак дослідження, проведені в різних країнах, показали різке зменшення кількості госпіталізацій із приводу гострих коронарних синдромів, для проведення ЧКВ, структурних втручань на серці та діагностичних процедур під час пандемії (Garcia et al., 2020; Solomon et al., 2020). Найімовірніше, це вказує на затримку діагностики та лікування ССЗ, а не різке зниження рівня захворюваності серед населення (Siripanthong et al., 2020).
Тромботичні події
Що стосується тромботичних подій в інших органах, окрім серця, на тлі COVID‑19 ТЕЛА, очевидно, є найчастішим проявом. Її було зафіксовано майже у половини тяжкохворих в серіях випадків (Cui et al., 2020). Тромбоз глибоких вен (ТГВ) також виявляється приблизно у чверті пацієнтів у критичному стані (Poissy et al., 2020).
Обидва ускладнення можуть також розвиватися у хворих, які отримують профілактичну антикоагулянтну терапію або раніше лікувалися антикоагулянтами із приводу наявних захворювань. Це вказує на дві основні проблеми, з якими клініцисти зазвичай стикаються при оцінці поширеності та ризику серйозних тромбоемболічних ускладнень в осіб із COVID‑19. Перша стосується часу виникнення. Хоча ТЕЛА і ТГВ частіше виявляють на пізніх фазах COVID‑19, вони можуть розвиватися і на ранніх фазах разом із підвищеною запальною реакцією. Другою проблемою є питання діагностики.
Значна частка пацієнтів із ТЕЛА та ТГВ є безсимптомними або мають неспецифічні клінічні прояви (Middeldorp et al., 2020; Demelo-Rodriguez et al., 2020). Крім того, ці стани здебільшого діагностують у тяжкохворих, яким часто проводять ендотрахеальну інтубацію та призначають седативні засоби. На додаток, рівень D-димеру, фібриногену та інших маркерів згортання крові, що свідчать про тромбоемболічні ускладнення, зазвичай підвищений в осіб із COVID‑19, що ускладнює встановлення порогового значення, яке би вказувало на необхідні додаткові тестування у безсимптомних пацієнтів. Отже, потрібні високий клінічний контроль та майже систематичне візуалізаційне дослідження у хворих групи ризику, інакше тромбоемболічні ускладнення можна вчасно не діагностувати.
Вплив на трансплантацію серця
Пандемія спричинила значне скорочення донорства та трансплантації органів, що, ймовірно, вплинуло на зростання ризику смерті серед тих, хто потребує оперативного втручання (Dominguez-Gil et al., 2020).
Вплив інфекції SARS-COV‑2 на пацієнтів із трансплантацією серця ще слід встановити, але попередні дані свідчать про високу ймовірність летальних наслідків (Latif et al., 2020). Хоча у даній популяції хворих існує нагальна потреба у додаткових даних, Міжнародне товариство трансплантації серця та легень (ISHLT) створило експертний комітет із метою надання рекомендацій щодо догляду за реципієнтами серцевого трансплантата в контексті SARS-CoV‑2 (Aslam, 2020).
Фактори ризику розвитку СС-подій при COVID‑19: вплив на прогноз
Показано, що пошкодження міокарда є основним прогностичним фактором смерті при COVID‑19 (Shi et al., 2020). Точне визначення міокардіального ураження покращує прогнозування клінічних наслідків для пацієнтів із COVID‑19 (Lorente-Ros et al., 2020; Mishra et al., 2020). На жаль, досліджень з оцінки факторів ризику розвитку СС-ускладнень у контексті COVID‑19, а також пов’язаних із ними прогностичних чинників, бракує. Основні причини включають нечітке визначення кардіального ушкодження та відсутність багатофакторного аналізу для оцінки чинників ризику. Однак доступні дані кількох досліджень із цінними, хоча й попередніми висновками. Так, S. Shi et al. (2020) повідомили про патологію серця в 19,7% осіб із COVID‑19. Порівняно з пацієнтами без кардіального ураження вони були старшого віку та мали значно вищі показники АГ, рентгенологічні ознаки запальної інфільтрації легеневої тканини, а також більший вміст лейкоцитів, СРБ, прокальцитоніну, міокардіальної креатинінкінази, міогемоглобіну, hs-TnI, NT-proBNP, аспартатамінотрансферази та креатиніну.
L. Li et al. (2020) ретроспективно дослідили характеристики та фактори ризику пошкодження міокарда у 41,5% із 82 хворих когорти. Багатофакторний аналіз показав, що вік >70 років, СРБ >100 мг/л, лактатдегідрогеназа >300 Од./л та молочна кислота >3 ммоль/л були незалежними чинниками ризику міокардіального ураження. Ferrante et al. (2020) вивчили дані 332 осіб із підтвердженим COVID‑19, з яких 37% мали пошкодження міокарда, визначене як hs-TnI >20 нг/л на момент госпіталізації.
Усім хворим було проведене КТ грудної клітки; діаметр легеневої артерії та показник індексації коронарного кальцію порівнювали між пацієнтами з/без ураження міокарда. Діаметр легеневої артерії був більшим в осіб із пошкодженням міокарда і незалежно асоціювався з підвищеним ризиком його розвитку. Крім того, показник індексації коронарного кальцію виявився нижчим у пацієнтів із міокардіальним ураженням, для котрих він не був незалежним фактором ризику.
Щодо того, як вихідні ССЗ впливають на тяжкість COVID‑19, слід зазначити, що така кореляція, ймовірно, частково пов’язана з віком та типом супутніх захворювань. До того ж після низки суперечливих повідомлень накопичені на сьогодні дані свідчать про те, що блокатори ренін-ангіотензин-альдостеронової системи (РААС) – інгібітори АПФ та блокатори рецепторів ангіотензину (БРА) – не асоційовані з більшою імовірністю ураження SARS-CoV‑2 або вищим ступенем тяжкості чи ризику смерті у хворих на COVID‑19 (Cappuccio, Siani, 2020). Крім того, D. Lоpez-Otero et al. (2020) виявили, що лікування інгібіторами АПФ / БРА (комбіноване та монотерапія) не впливало на СН або серйозні СС-події у 965 пацієнтів із COVID‑19. Також у рекомендаціях низки міжнародних товариств, зокрема ESC, було зазначено про недоцільність припинення лікування інгібіторами АПФ / БРА під час пандемії COVID‑19 (De Simone, 2020).
Попередні дані вказують на те, що генетичний поліморфізм у гені ACE2 може спричинити кардіальне ураження, зокрема звуження судин, запалення, окислення та фіброз (Lippi et al., 2020). Генетико-епігенетичні взаємодії у контексті COVID‑19 є перспективним напрямом досліджень, що заслуговує на увагу та може допомогти краще висвітлити ключові аспекти взаємозв’язку SARS-CoV‑2 та ССС.
Лікування СС-ускладнень COVID‑19
Фахівці у галузі охорони здоров’я, наукові товариства та експерти по всьому світу надали значну кількість рекомендацій щодо боротьби із COVID‑19 від початку пандемії. Тож на сьогодні доступно чимало настанов стосовно оцінки ризику, діагностики, профілактики та лікування ускладнень ССЗ на тлі COVID‑19, а також з адаптації систем та служб охорони здоров’я під час спалаху інфекції, зокрема проведення клінічних випробувань (Cosyns et al., 2020; George et al., 2020; Marchandot et al., 2020). У світлі нещодавно отриманих даних, що свідчать про стійкість симптомів, порушення роботи серця та зниження якості життя у значної частки хворих через кілька тижнів після гострої фази COVID‑19, видається розумним вести нагляд за пацієнтами щонайменше шість місяців (Puntmann et al., 2020; Lindner et al., 2020; Knight et al., 2020).
Далі наведені ключові рекомендації щодо лікування СС-ускладнень у пацієнтів із COVID‑19.
Рекомендації щодо лікування СС-ускладнень у хворих на COVID‑19
Профілактика
З огляду на те, що у пацієнтів із підтвердженими ССЗ підвищений ризик розвитку тяжких форм COVID‑19 та смерті, уникнення інфікування має найбільший пріоритет. Отже, як хворі, так і медичний персонал у лікувальних закладах мають дотримуватися рекомендацій на локальному рівні. Оптимізація вторинної профілактики СС-ускладнень у пацієнтів з основним ССЗ та SARS-CoV‑2 є дуже важливою.
Антитромбоцитарна терапія. Системне профілактичне лікування у пацієнтів, які не отримували антитромбоцитарного лікування до інфікування SARS-CoV‑2, не рекомендоване. Одночасне приймання певних антиагрегантів та противірусних препаратів протипоказане (наприклад, дарунавіру/кобіцистату та клопідогрелю або тікагрелору). У разі наявності клінічних показань до антитромбоцитарної терапії доцільно застосовувати прасугрел, оскільки він має нижчий профіль медикаментозної взаємодії.
Антикоагулянтна терапія. Низькомолекулярний гепарин рекомендований у профілактичних дозах для госпіталізованих хворих на COVID‑19. Варто розглянути можливість розширеної профілактики у пацієнтів із високими маркерами запалення (як-то D-димер×6). Систематичне припинення застосування антикоагулянтів у амбулаторних умовах не рекомендоване. Необхідно звернути увагу на потенційно серйозні фармакологічні взаємодії між деякими антикоагулянтами (наприклад, ривароксабаном, дабігатраном, апіксабаном тощо) та деякими противірусними засобами (як-от лопінавір/ритонавір, дарунавір/ритонавір).
Діагностика
Систематичну оцінку показника hs-TnI рекомендовано проводити не у всіх пацієнтів, а лише з обґрунтованою підозрою на кардіальне ураження (тобто в осіб із підтвердженими супутніми захворюваннями, потенційними клінічними проявами або аномаліями на ЕКГ). Серед серцевих біомаркерів hs-TnI має переваги для виявлення кардіального пошкодження та стратифікації прогнозу. Систематичне застосування NT-proBNP у пацієнтів без СН або симптомів СН не рекомендоване.
Необхідно систематично оцінювати рівень D-димеру, оскільки він може слугувати маркером для виявлення безсимптомної ТЕЛА/ТГВ і корелювати із прогнозом. ЕКГ слід проводити у пацієнтів із симптомами, що вказують на порушення роботи серця, підвищеним умістом тропоніну та підозрою на ТЕЛА, а також хворих, які отримують противірусні препарати з потенційним аритмогенним ефектом. В осіб із підозрою на гостре кардіальне ураження потрібно провести трансторакальну ЕхоКГ.
Визначення кардіальних автоантитіл у пацієнтів із міокардитом та антифосфоліпідних антитіл в осіб із тромботичними ускладненнями може бути корисним, але їх слід ретельно вивчати після виходу COVID‑19 із гострої фази. Завершити діагностику міокардиту можна за допомогою МРТ серця. Проведення коронарографії показане при STEMI, а також її слід враховувати при ІМ без елевації сегмента ST (non-STEMI) високого ризику. Біопсію серця можна розглянути у пацієнтів із шлуночковою дисфункцією та гемодинамічною нестабільністю.
Лікування
Терапія інгібіторами РААС. Застосування інгібіторів АПФ та БРА не слід припиняти. Немає доказів, що підтвердили б їх використання як превентивне лікування для зниження ризику ураження або тяжкості SARS-CoV‑2.
Противірусне лікування. Чітких доказів ефективності противірусних засобів для лікування СС-ускладнень бракує. Перед призначенням слід враховувати та контролювати можливі побічні явища із боку ССС, пов’язані з даними препаратами.
Протизапальна терапія. Даних стосовно впливу на СС-ускладнення на тлі COVID‑19 бракує.
ЧКВ. Ця процедура має бути пріоритетною в осіб зі STEMI типу 1 та COVID‑19. Що стосується інших ГКС, у пацієнтів із мінімальним або незначним ураженням легень рішення має приймати кардіологічна бригада. У хворих із супутніми значущими факторами ризику або помірним/тяжким ураженням легень при COVID‑19 слід віддавати перевагу ЧКВ. Консервативне лікування варто проводити у разі підозри STEMI типу 2 або міокардиту і відсутності гемодинамічної нестабільності.
Запобіжні заходи у медичних установах
Заходи щодо запобігання інфікуванню у лікарнях передбачають використання засобів індивідуального захисту всіма медичними працівниками, зокрема членами реанімаційної бригади під час зупинки серця. Слід розглянути можливість застосування автоматичних пристроїв для серцево-легеневої реанімації хворого з метою мінімізації контакту. Ендотрахеальну інтубацію та компресійне стиснення грудної клітки необхідно проводити тоді, коли медичний персонал повністю екіпірований спеціальними засобами індивідуального захисту для проведення безпечних маніпуляцій.
У лабораторіях катетеризації та електрофізіології вкрай важливо прийняти суворі заходи профілактики під час пандемії. Будь-яка неургентна/ургентна процедура потребує ретельної оцінки та систематичного скринінгу з використанням запобіжних заходів перед інвазивними втручаннями. Слід розглянути можливість забезпечення операційними з негативним тиском із комплексним відповідним захистом медичних працівників за наявності у хворого підозрюваної чи підтвердженої інфекції COVID‑19.
Якщо це клінічно можливо, рекомендовано витримати паузу в 30 хв після ендотрахеальної інтубації пацієнта для входу в операційну (для медичного персоналу, що не бере участі у процедурі із забезпечення прохідності дихальних шляхів). Необхідно створити «зелений коридор» для безпечного переміщення хворого з операційної до палати інтенсивної терапії. Застосування респіратора із класом захисту FFP3 (плюс хірургічна маска поверх нього) та пластикової маски з налобною лупою є розумним запобіжним варіантом для усіх медичних працівників операційної замість традиційних хірургічних окулярів, щоб уникнути перехресного інфікування та внутрішньолікарняної передачі вірусу. У пацієнтів із COVID‑19 не рекомендоване застосування інсуфляції вуглекислого газу, зазвичай використовуваної при операціях на відкритому серці, щоб уникнути аерозолізації.
Доцільно розглянути можливість використання телемедицини для надання медичної допомоги з метою зниження ризику перехресного інфікування, спричиненого тісним контактом. Спостереження за виписаними пацієнтами із COVID‑19 та СС-ускладненнями передбачає періодичні візити до лікаря кожні 1‑3 місяці протягом принаймні шести місяців із моніторингом ЕКГ. ЕхоКГ проводять за клінічними показаннями. Частоту відвідувань та додаткові обстеження слід адаптувати до клінічної ситуації хворого. Для подальших консультацій варто розглянути можливість застосування телемедицини.
У межах кардіологічної реабілітації потрібно сконцентрувати зусилля на основних складових, як-то контроль способу життя та психосоціальна підтримка, з індивідуальним підходом. Особисті зустрічі слід замінити на віддалену оцінку фахівцем та дистанційне медичне консультування (за допомогою телефону, текстових повідомлень, електронних листів, відеозв’язку та веб-додатків). Для COVID‑19-позитивних пацієнтів варто відкласти реабілітаційну програму вправ та оцінювати можливість відновлення індивідуально.
Висновки
Три людські CoV, що виникли протягом останніх двох десятиліть (SARS-CoV, MERS-CoV та SARS-CoV‑2), становлять серйозний ризик для світового здоров’я. Окрім того, що CoV найбільшою мірою уражають легені, нерідко вони призводять до розвитку індукованої гіперзапальною відповіддю поліорганної недостатності. Частими ускладненнями коронавірусів є також серцево-судинні. SARS-CoV‑2 має більшу схильність до розвитку ССЗ і здатний спричиняти ураження серця, тромбоемболічні події та різні СС-події.
Порушення функціонування ССС на тлі COVID‑19, особливо пошкодження міокарда та ТЕЛА, пов’язане з гіршим прогнозом. Нині, на жаль, доступно небагато даних про фактори ризику розвитку СС-ускладнень у пацієнтів, інфікованих SARS-CoV‑2. Необхідні подальші дослідження для поглиблення знань у галузі патофізіології, а також щодо факторів ризику, прогнозу та лікування ССЗ в осіб із COVID‑19.
Підготувала Олена Коробка
Оригінальний текст документа читайте на сайті www.oxfordmedicine.com