16 листопада, 2020
Пілотне дослідження анксіолітичного препарату Лодиксем у пацієнтів із гостро декомпенсованою серцевою недостатністю
 Тривожні розлади нерідко супроводжують перебіг серцево-судинних захворювань і стають дедалі вираженішими в міру їх прогресування. Тривога також є частим супутником пацієнтів із серцевою недостатністю (СН). У недавньому метааналізі 38 досліджень K. Easton і співавт. (2015) підрахували, що 32% пацієнтів із СН відчувають підвищений рівень тривожності, а 13% пацієнтів відповідають критеріям тривожного розладу. На пізніших стадіях СН поширеність тривоги збільшується. Тривожний розлад діагностують приблизно у 20% пацієнтів із декомпенсованою СН, які для підтримки функції лівого шлуночка потребують імплантації допоміжних пристроїв [5, 6].
Тривожні розлади нерідко супроводжують перебіг серцево-судинних захворювань і стають дедалі вираженішими в міру їх прогресування. Тривога також є частим супутником пацієнтів із серцевою недостатністю (СН). У недавньому метааналізі 38 досліджень K. Easton і співавт. (2015) підрахували, що 32% пацієнтів із СН відчувають підвищений рівень тривожності, а 13% пацієнтів відповідають критеріям тривожного розладу. На пізніших стадіях СН поширеність тривоги збільшується. Тривожний розлад діагностують приблизно у 20% пацієнтів із декомпенсованою СН, які для підтримки функції лівого шлуночка потребують імплантації допоміжних пристроїв [5, 6].
На підставі даних стандартизованого анкетування пацієнтів із гостро декомпенсованою СН (ГДСН) було продемонстровано, що більшості таких хворих притаманна так звана ситуативна тривога, рівень якої є дещо вищим у жінок [8].
Після перенесеного гострого коронарного синдрому (ГКС) у 20-30% пацієнтів спостерігається підвищений рівень тривожності. Хоча тривога після ГКС може бути короткочасною, приблизно в половині випадків її тривалість сягає 1 року [1]. Подібні показники розповсюдженості тривоги мають місце в пацієнтів з ішемічною хворобою серця (ІХС), які очікують на операцію аортокоронарного шунтування. У цій популяції 25% пацієнтів мають підвищений рівень тривоги перед втручанням [3].
Наразі існує достатньо даних про те, що тривога не тільки погіршує якість життя таких пацієнтів, а й відіграє самостійну патофізіологічну роль, активуючи симпатичну ланку автономної нервової системи, низькоінтенсивне системне запалення, ендотеліальну дисфункцію, агрегацію тромбоцитів [2-5]. Своєю чергою, зазначені зміни чинять негативний вплив на перебіг серцево-судинної патології, в тому числі СН [6, 7].
Вплив тривоги в пацієнтів із СН на зростання смертності від серцево-судинних подій було встановлено на підставі даних 4 проспективних досліджень [10-13]. Подібна закономірність простежується також у хворих на ІХС. Зокрема, в недавньому метааналізі 44 досліджень було показано, що в осіб з ІХС тривожність призводить до істотного зростання кардіоваскулярної смертності (Celano C. M. et al., 2015).
Отже, корекція тривоги має бути важливою складовою лікування пацієнтів із серцево-судинною патологією. Проте відкритим залишається питання: чи має якийсь з анксіолітиків певні переваги саме в пацієнтів кардіологічного профілю?
 Нашу увагу привернула внутрішньовенна форма анксіолітичного (протитривожного) препарату Лодиксем з її перевагою над традиційно застосовуваними пероральними анксіолітиками щодо швидкості настання терапевтичної дії. Діюча речовина Лодиксему – етилметилгідроксипіридину сукцинат, який у розчині дисоціює на емоксипін й аніонну форму бурштинової кислоти [9]. Емоксипін – синтезована речовина; фундаментальний механізм його дії – інактивація вільних радикалів, наслідками чого є пригнічення перекисного окислення ліпідів, яке реалізується в доведеній універсальній мембранопротекторній дії [10, 11]. Натомість сукцинат – природна речовина, що є проміжним продуктом i регулятором тканинного дихання в мітохондріях [11, 12]. Існують дані, що введення екзогенного сукцинату покращує роботу мітохондрій в умовах гіпоксії, а отже, й енергетичний обмін у клітинах [11, 13]. Емоксипін у такому поєднанні, ймовірно, відіграє ключову роль, оскільки доведена його здатність (за рахунок мембранопротекторної дії) покращувати роботу низки мембраносполучених регуляторних молекулярних сполук, як-от аденілатциклаза, фосфодіестераза, рецептори γ-аміномасляної кислоти, ацетилхолінестераза [14]. Роль двох останніх є однією з ключових у регуляції процесів нейротрансмісії в головному мозку [15, 16].
Нашу увагу привернула внутрішньовенна форма анксіолітичного (протитривожного) препарату Лодиксем з її перевагою над традиційно застосовуваними пероральними анксіолітиками щодо швидкості настання терапевтичної дії. Діюча речовина Лодиксему – етилметилгідроксипіридину сукцинат, який у розчині дисоціює на емоксипін й аніонну форму бурштинової кислоти [9]. Емоксипін – синтезована речовина; фундаментальний механізм його дії – інактивація вільних радикалів, наслідками чого є пригнічення перекисного окислення ліпідів, яке реалізується в доведеній універсальній мембранопротекторній дії [10, 11]. Натомість сукцинат – природна речовина, що є проміжним продуктом i регулятором тканинного дихання в мітохондріях [11, 12]. Існують дані, що введення екзогенного сукцинату покращує роботу мітохондрій в умовах гіпоксії, а отже, й енергетичний обмін у клітинах [11, 13]. Емоксипін у такому поєднанні, ймовірно, відіграє ключову роль, оскільки доведена його здатність (за рахунок мембранопротекторної дії) покращувати роботу низки мембраносполучених регуляторних молекулярних сполук, як-от аденілатциклаза, фосфодіестераза, рецептори γ-аміномасляної кислоти, ацетилхолінестераза [14]. Роль двох останніх є однією з ключових у регуляції процесів нейротрансмісії в головному мозку [15, 16].
Варто зауважити, що, хоча емоксипін наразі класифікований як анксіолітик (рубрика N05B), існує низка публікацій щодо його терапевтичної ефективності в кардіологічних пацієнтів [17-20].
Зважаючи на вищенаведене, метою нашого пілотного дослідження стало вивчення впливу Лодиксему на рівень тривоги, а також супутня оцінка динаміки на тлі його прийому ключових патофізіологічних параметрів, тісно сполучених із клінічним перебігом СН (частота серцевих скорочень – ЧСС, артеріальний тиск – АТ, швидкість клубочкової фільтрації – ШКФ, вазодилататорна функція ендотелію).
Клінічна характеристика пацієнтів і методи обстеження
Обстежено 40 хворих віком від 40 до 75 років, госпіталізованих із приводу ГДСН до відділення серцевої недостатності ДУ «ННЦ «Інститут кардіології ім. М. Д. Стражеска» НАМН України». Пацієнти були розподілені на 2 групи по 20 осіб, зіставних за віком, статтю, етіологією СН, часткою хворих із перенесеним інфарктом міокарда (ІМ) та фібриляцією передсердь, фракцією викиду лівого шлуночка, ШКФ, часткою пацієнтів із коморбідними станами (цукровий діабет, хронічне обструктивне захворювання легень, анемія), а також за магнітудою потік-залежної (ендотелій-залежної) вазодилататорної відповіді (табл. 1).
 Пацієнтам 1-ї групи (активного втручання) до стандартної фармакотерапії з 2-ї доби додавали Лодиксем (500 мг внутрішньовенно інфузійно вранці та 200 мг внутрішньом’язово ввечері); натомість хворі 2-ї групи (порівняння) отримували лише стандартну фармакотерапію.
Пацієнтам 1-ї групи (активного втручання) до стандартної фармакотерапії з 2-ї доби додавали Лодиксем (500 мг внутрішньовенно інфузійно вранці та 200 мг внутрішньом’язово ввечері); натомість хворі 2-ї групи (порівняння) отримували лише стандартну фармакотерапію.
Тривалість уведення Лодиксему в усіх пацієнтів була фіксованою та становила 8 діб. До початку дослідження та через 8 діб дані пацієнтів обох груп, як-от ЧСС, АТ, ШКФ, рівень тривожності в балах за загальноприйнятою госпітальною шкалою HADS і магнітуда потік-залежної (ендотелій-залежної) вазодилатації (ЕЗВД) плечової артерії, реєстрували та вносили до бази даних. ЕЗВД оцінювали за допомогою стандартної манжеткової проби в модифікації Celemaier-Sorensen.
Статистичну обробку отриманих результатів здійснювали за допомогою пакета програм SPSS.
Результати й обговорення
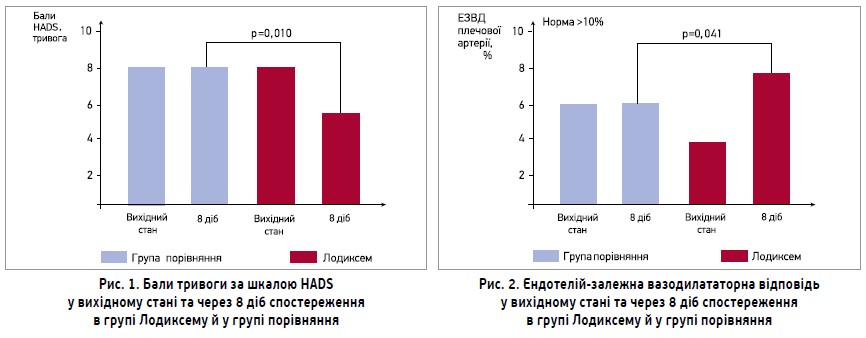
Стандартизоване анкетування пацієнтів за шкалою HADS, здійснене в 1-шу добу після їх потрапляння до стаціонару, не продемонструвало відмінностей у сумі балів за шкалою тривоги між 1-ю та 2-ю групами – 8 (7, 10) та 8 (6, 10); р=0,262. Зазначена сума балів свідчить про наявність субклінічної тривожності.
Через 8 діб клініко-гемодинамічний стан пацієнтів обох груп загалом був стабілізований, причому середні добові дози внутрішньовенного петльового діуретика, за допомогою котрого було досягнуто вищезазначеного ефекту, в обох групах достовірно не відрізнялися, чому відповідала ідентична втрата маси тіла в обох групах. Між пацієнтами 1-ї та 2-ї груп наприкінці спостереження також не виявлено достовірної різниці за значеннями ЧСС та АТ, але зменшення задишки за шкалою Лікерта виявилося вираженішим у групі Лодиксему (табл. 2).
Наприкінці лікування в групі прийому Лодиксему спостерігалися суттєво нижчі значення балів тривоги за шкалою HADS на відміну від хворих групи порівняння, в яких динаміка зазначеного показника була відсутня (рис. 1).
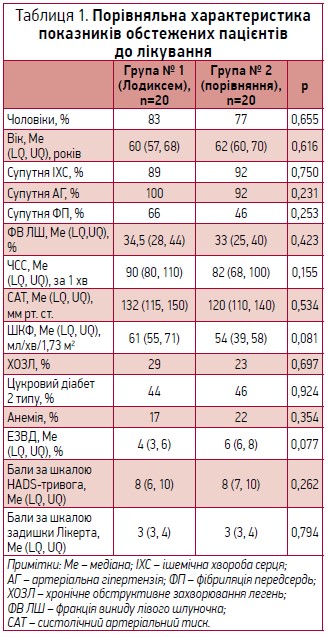
У пацієнтів, які отримували Лодиксем, після лікування спостерігали достовірно більшу магнітуду ендотелій-залежної вазодилататорної відповіді (рис. 2) та достовірно вищу ШКФ.
Проведене дослідження підтвердило вихідну гіпотезу про те, що парентеральне введення етилметилгідроксипіридину сукцинату (Лодиксем) дозою 700 мг/добу може значущо зменшувати тривожні прояви в пацієнтів, госпіталізованих із приводу ГДСН.
Слід зазначити, що здатність емоксипіну сукцинату зменшувати тривожну симптоматику була виявлена ще на етапі доклінічного вивчення, а згодом підтверджена в низці клінічних випробувань. Зокрема, клінічно значущий анксіолітичний ефект препарату спостерігали в пацієнтів з артеріальною гіпертензією [21].
Важливою перевагою емоксипіну сукцинату як анксіолітичного засобу є сприятливий профіль безпеки, що вигідно відрізняє його від бензодіазепінів. Лікарям добре відомо, що останні часто спричиняють надмірну седацію. Емоксипіну сукцинат діє на ГАМК-залежні процеси максимально фізіологічним способом (через мембранопротекцію), а не шляхом жорсткої хімічної конформаційної перебудови ГАМК-А-рецепторів, як це відбувається під впливом бензодіазепінів [22]. Завдяки своєму унікальному механізму дії емоксипіну сукцинат не тільки зменшує тривогу, а й поліпшує настрій і загальне самопочуття пацієнтів. Так, у пацієнтів з артеріальною гіпертензією було відзначено рівномірне зменшення як тривожної, так і депресивної симптоматики [21].
Водночас у проведеному нами дослідженні було отримано результати, що виходять за рамки анксіолітичного ефекту емоксипіну сукцинату та здаються перспективними з клінічного погляду. Йдеться про достовірне зростання ендотелій-залежної вазодилататорної відповіді та про збереження (на відміну від групи порівняння) вихідної ШКФ на тлі активної діуретичної терапії. Тобто емоксипіну сукцинат зменшував прояви дисфункції ендотелію, що має важливе клінічне значення.
Дисфункція ендотелію притаманна синдрому СН, системному атеросклерозу та його клінічно значущим локальним проявам (ІХС, цереброваскулярні розлади, обструктивна хвороба периферичних артерій) і характеризується порушенням балансу в бік синтезу вазоконстрикторних, протромбогенних і прозапальних чинників. Результатом цих змін є обмеження можливостей регуляції кровотоку, зростання ризику внутрішньосудинного тромбозу, а також активізація судинного запалення, що відіграє важливу роль у формуванні атеросклеротичної бляшки [33-35]. Саме ендотелій є головною мішенню для патогенного впливу провідних факторів кардіоваскулярного ризику, таких як куріння, дисліпідемія, цукровий діабет. Зумовлені ними ушкодження ендотелію й, відповідно, його дисфункція є патогенетичною основою розвитку атеросклерозу різних локалізацій і клінічних проявів останнього у вигляді стенокардії, ІМ, цереброішемічних розладів і мозкового інсульту, переміжної кульгавості [35-37].
Незалежно від маніфестації клінічних проявів атеросклерозу (коронарні, периферичні чи церебральні судини) феномен ендотеліальної дисфункції має системний характер. Інформацію про функціональний стан ендотелію можна отримати за допомогою визначення циркулюючих у крові маркерів його активації або ушкодження (наприклад, Е-селектин, фактор Віллебранда, ендотелін‑1, клітини – попередники ендотеліоцитів, мікрочастинки ендотеліоцитів та ін.) [38]. Разом із тим основними залишаються підходи, що оцінюють (ультросонографія чи плетизмографія) ступінь дилатації великої артерії (зазвичай плечової) у відповідь на введення ацетилхоліну чи на тимчасове її перетискання (проба з реактивною гіперемією – РГ; за іншою термінологією – проба з ЕЗВД). Остання розглядається як золотий стандарт неінвазивної оцінки ендотеліальної функції.
Між вираженістю дисфункції ендотелію та ризиком виникнення низки серцево-судинних ускладнень існує пряма залежність. Зокрема, показано, що ступінь порушення ендотеліальної функції за даними проби з РГ прямо корелює з ризиком несприятливого результату при гострому ІМ, а також зі смертністю пацієнтів із хронічною СН [39].
У нашому досліджені застосування емоксипіну сукцинату супроводжувалося суттєвим зростанням ендотелій-залежної вазодилататорної відповіді. Це свідчить про позитивний вплив препарату на функцію ендотелію та дає змогу розраховувати на зниження ризику серцево-судинних ускладнень у майбутньому.
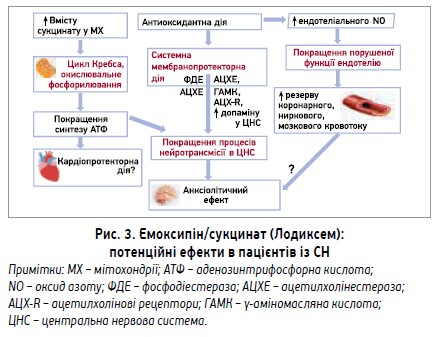 Емоксипіну сукцинат може впливати на функцію ендотелію кількома шляхами. По-перше, він є потужним антиоксидантом, а окислювальний стрес є одним із ключових механізмів розвитку ендотеліальної дисфункції. По-друге, Лодиксем може покращувати стан ендотелію через зменшення тривожної симптоматики. Встановлено, що тривога та тривожні розлади пов’язані з патологічними змінами функціонального стану ендотелію судин [25-30]. У літературі вже є певні дані про здатність емоксипіну сукцинату зменшувати прояви ендотеліальної дисфункції [31, 32]. Своєю чергою, покращення функції ендотелію й, відповідно, мозкового кровотоку теоретично може сприяти прискоренню зменшення тривоги. Робоча схема, в якій наведено механізми потенційних терапевтичних ефектів емоксипіну сукцинату (Лодиксем) при СН, представлена на рисунку 3.
Емоксипіну сукцинат може впливати на функцію ендотелію кількома шляхами. По-перше, він є потужним антиоксидантом, а окислювальний стрес є одним із ключових механізмів розвитку ендотеліальної дисфункції. По-друге, Лодиксем може покращувати стан ендотелію через зменшення тривожної симптоматики. Встановлено, що тривога та тривожні розлади пов’язані з патологічними змінами функціонального стану ендотелію судин [25-30]. У літературі вже є певні дані про здатність емоксипіну сукцинату зменшувати прояви ендотеліальної дисфункції [31, 32]. Своєю чергою, покращення функції ендотелію й, відповідно, мозкового кровотоку теоретично може сприяти прискоренню зменшення тривоги. Робоча схема, в якій наведено механізми потенційних терапевтичних ефектів емоксипіну сукцинату (Лодиксем) при СН, представлена на рисунку 3.
Проведене дослідження показало, що в пацієнтів із ГДСН парентеральне призначення Лодиксему здатне чинити швидку анксіолітичну дію, поєднану з певними сприятливими змінами судинної регуляції, що потребує подальших досліджень. Останнє стосується й оцінки терапевтичного впливу сукцинату як складового компонента цього препарату на міокардіальну функцію в таких пацієнтів, щодо чого наразі є обнадійливі повідомлення [18, 20].
Література
1. Ceiano C.M., Daunis D.J., Lokko H.N. et al. Anxiety disorders and cardiovascular disease. Curr. Psychiatry Rep. 2016. Nov; 18 (11): 101.
2. Kawachi I., Sparrow D., Vokonas P., Weis S. Decreased heart rate variability in men with phobic anxiety (data from the Normative Aging Study). Am. J. Cardiol. 1995; vol. 75 (14): 882-885.
3. Bankier B., Barajas J., Martinez-Rumayor A., Januzzi J. Association between C-reactive protein and generalized anxiety disorder in stable coronary heart disease patients. Eur. Heart J. 2008; vol. 29 (18): 2212-2217.
4. Mercer D., Lavoie K., Ditto B. et al. The interaction between anxietyand depressive symptoms on brachial artery reactivity in cardiac patients. Biol. Psychol. 2014; vol. 102: 44-50.
5. Strike P., Magid K., Brydon L. et al. Exaggerated platelet and hemodynamic reactivity to mental stress in men with coronary artery disease. Psychosom. Med. 2004; vol. 66 (4): 492-500.
6. Gerritsen J., Dekker J., Ten Voorde B. et al. Impaired autonomic function is associated with increased mortality, especially in subjects with diabetes, hypertension, or a history of cardiovascular diseases: the Hoorn Study. Diabetes Care. 2001; vol. 24 (10): 1793-1798.
7. Yapislar H., Aydogan S., Ozum U. Biological understanding of the cardiovascular risk associated with major depression and panic disorder is important. Int. J. Psychiatry. Clin. Pract. 2012; vol. 16 (1): 27-32.
8. Васюк А., Довженко Т., Семиглазова М., Краснов В. Тревожно-депрессивные расстройства и сердечно-сосудистые заболевания: клинические взаимосвязи и современные подходы к терапии. Сердце: журнал для практикующих врачей. 2012; т. 11, № 3 (65).
9. Смирнов А.В., Нестерова О.Б., Голубев Р.В. Янтарная кислота и ее применение в медицине. Часть II. Применение янтарной кислоты в медицине. Нефрология. 2014; т. 18, № 4: 12-24.
10. Лукьянова Л.Д., Атабаева Р.Е., Шепелева С.Ю. Биоэнергетические механизмы антигипоксического действия сукцинатсодержащего производного 3-окипиридина мексидола. Бюлл. экспер. биол. и мед. 1993; № 115 (3): 366-367.
11. Лукьянова Л.Д., Романова В.Е., Чернобаева Г.Н. и др. Особенности антигипоксического действия мексидола связанные с его специфическим влиянием на энергетический обмен. Хим.-фарм. журнал. 1990; № 24 (8): 9-11.
12. Sakamoto M., Takeshihe K., Yasui H., Tokunaga K. Cardioprotective effect of succinate against ischemia/reperfusion injury. Surg. Today. 1998; vol. 28 (5): 522-528.
13. Cairns C.B., Ferroggiaro A.A., Walther J.M. et al. Postishemic administration of succinate reverses the impairment of oxidative phosphorylation after cardiac ischemia and reperfusion injury. Circulation. 1997; vol. 96 (Suppl. 9): 260-265.
14. Смирнов Л.Д., Дюмаев К.М. 3-оксипроизводные шестичленных азотистых гетероциклов. Синтез, ингибирующая активность и биологические свойства. Хим.-фарм. журнал. 1982; № 16 (4): 28-44.
15. Ben-Ari G., Gaiarsa J., Tysio R., Khazipov R. GABA, a pioneer transmitter that exites immature neurons and generates primive oscillations. Physiol. Rev., 2007; v. 87: 1215-1284.
16. Purves D., Augustine G., Fitzpatrick D. et al. Neuroscience (4th ed), Sinauer Assoc. 2008: 121-122.
17. Оганов Р.Г. Положительный опыт применения этилметилгидроксипиридина сукцината в лечении кардиологических больных. Кардиоваскулярная терапия и профилактика. 2017; № 16 (5): 91-94.
18. Sidorenko G.L., Komissarova S.M., Zolotukhina S.F. et al. The use of ethylmethydoxypyridine succinate in the treatment of patients with heart failure. Kardiologiia. 2011; vol. 6: 44-48.
19. Borovkova N.Yu., Il’ina A.S., Spassky A.A. et al. Cytoprotective therapy for kidney injury in patients with ST-elevation myocardial. Cardiology and Cardiovascular Surgery. 2017; vol. 1: 38-41.
20. Statsenko M.E., Evtereva E.D., Turkina S.V. et al. New possibilities of mexicor in the treatment of chronic heart failure in patients with metabolic syndrome. Russian J. Cardiology. 2010; vol. 6 (86): 28-33.
21. Курята А.В., Карапетян К.Г., Бардаченко Н.П. и др. Возможности коррекции когнитивных функций и тревожно-депрессивных расстройств в комплексной терапии артериальной гипертензии в зависимости от функционального состояния почек. Журн. неврол. им. Н.Б. Маньковского. 2015; т. 3, № 3: 5-10.
22. Бурчинский С.Г. Комплексная коррекция тревожных и когнитивных расстройств в ангионеврологии: цели, задачи, инструменты. Международный неврологический журнал. 2017; 8 (94).
23. Heitzer T., Schlinzig T., Krohn K., Meinertz T., Munzel T. Endothelial dysfunction, oxidative stress, and risk of cardiovascular events in patients with coronary artery disease. Circulation. 2001; 104 (22): 2673-2678.
24. Drexler H. Endothelial dysfunction: clinical implications. Prog. Cardiovasc. Dis. 1997; 39 (4): 287-324.
25. Narita K., Murata T., Hamada T. et al. Interactions among higher trait anxiety, sympathetic activity, and endothelial function in the elderly. J. Psychiatr. Res. 2007; 41 (5): 418-427.
26. Mercer D., Lavoie K., Ditto B. et al. The interaction between anxiety and depressive symptoms on brachial artery reactivity in cardiac patients. Biol. Psychol. 2014; 102: 44-50.
27. Harris K., Matthews K., Sutton-Tyrrell K., Kuller L. Associations between psychological traits and endothelial function in postmenopausal women. Psychosom. Med. 2003; 65 (3): 402-409.
28. Felice F., Di Stefano R., Pini S. et al. Influence of depression and anxiety on circulating endothelial progenitor cells in patients with acute coronary syndromes. Hum. Psychopharmacol. 2015; 30 (3): 183-188. doi: 10.1002/hup.2470.
29. von Kanel R., Hepp U., Traber R. et al. Measures of endothelial dysfunction in plasma of patients with posttraumatic stress disorder. Psychiatry Res. 2008; 158 (3): 363-373.
30. Коновалова Е.Л. Актуальные проблемы медицины – 2012. Коррекция эндотелиальной дисфункции комбинацией L-норвалина и мексидола.
31. Баженова Л.Н., Володина Н.Н., Фролова Н.П. Влияние препарата Mексидол на эндотелиальную дисфункцию у больных с хронической сердечной недостаточностью. Бюллетень экспериментальной биологии и медицины. 2006, приложение 1.
32. Vane J., Enggard E., Batting R. Regulatory function of the vascular endothelium. N. Engl. J. Med. 1999; 323: 27-36.
33. Дисфункция эндотелия. Причины, механизмы, фармакологическая коррекция // Под ред. И.Н. Петрищева. – Санкт-Петербург, 2003. – 184 с.
34. Onder R., Barutcuoglu B. The endotelium. Milano, 2006. – 149 p.
35. Березин А.Е. Биологические маркеры кардиоваскулярных заболеваний. Диагностическое и прогностическое значение биомаркеров стратификации пациентов с кардиометаболическим риском. – М., 2015. Lambert Academic Publishing GmbH. – 307 c.
36. Lekakis J., Abraham P., Balbarini A. et al. Methods for evaluating endothelial function: a position statement from the European Society of Cardiology Working Group on Peripheral Circulation. Eur. J. Cardiovasc. Prev. Rehabil. 2011; vol. 18: 775-789.
37. Пархоменко А.Н., Иркин О.И., Лутай Я.М. и др. Эндотелиальная дисфункция у больных с острым инфарктом миокарда: связь с течением заболевания. Укр. кардіол. журнал, 2013; № 4 (додаток): 165-166.
38. Berrazueta J., Guera-Ruiz A., Garsia-Unzueta M. et al. Endothelial dysfunction, measured by reactive hyperaemia using strain-gauge plethysmography, is an independent predictor of adverse outcome in heart failure. Eur. J. Heart Failure. 2010; vol. 12: 477-483.
39. Fisher D., Rossa S., Landmesser U. et al. Endotelial dysfunction in patients with chronic heart failure is independently associated with increased evidence of hospitalization, cardiotransplantation, or death. Europ. Heart J. 2005; 26: 65-69.
Медична газета «Здоров’я України 21 сторіччя» № 19 (488), 2020 р.