10 вересня, 2022
Ефективність протигрибкових агентів проти грибкових спор: дослідження in vitro з використанням мікропланшетної лазерної нефелометрії та штучно інфікованої 3D-моделі шкіри
Дерматомікози – це переважно поверхневі грибкові інфекції шкіри, волосся та нігтів, спричинені дерматофітами, дріжджами, рідше – плісневими грибами. Вони є одними з найпоширеніших дерматологічних захворювань, на які страждають >25% людей у всьому світі, особливо в тропічних і субтропічних регіонах (Havlickova et al., 2008). Хоча дерматомікози не становлять серйозної загрози для здоров’я, вони можуть суттєво знижувати якість життя пацієнтів, а також є причиною чималих витрат на охорону здоров’я (близько пів мільярда доларів на рік) (White et al., 2014). Для лікування дерматомікозів доступний широкий спектр місцевих і системних антимікотичних засобів, проте їхня ефективність останніми роками знижується, що потребує пошуку нових схем терапії. У цьому дослідженні оцінювали спороцидну дію нітрату сертаконазолу щодо низки збудників дерматомікозів. Отримані результати порівнювали з результатами циклопіроксоламіну та тербінафіну.
Місцеві антимікотики часто характеризуються широким терапевтичним спектром, який включає дерматофіти, дріжджі та плісневі гриби. Наразі відсутні точні дані щодо частоти та етіології захворюваності на мікози; втім, останніми роками спостерігається помітне збільшення кількості зразків, що надходять до мікологічної лабораторії відділення дерматології лікарні Єнського університету. Це надає підстави стверджувати про зростання розповсюдженості мікозів (Wiegand et al., 2019). Робити будь-які висновки за рівнем продажів антимікотичних засобів досить складно. Якщо кількість проданих упаковок лікарських засобів, що містять тербінафін і циклопіроксоламін, на ринку Німеччини значно знизилася в період з 2018 по 2020 рік, то кількість реалізованих упаковок препаратів, до складу яких входить сертаконазол, навпаки, суттєво зросла.
Також останнім часом спостерігається перехід від антропофільних дерматофітів, як-от Trichophyton rubrum і Trichophyton interdigitale, до зростання поширеності зоофільних видів, як-от Trichophyton benhamiae та Trichophyton mentagrophytes (Nenoff et al., 2014).
Зоофільні грибки характеризуються полірезистентністю до антимікотичних засобів, що пояснює часті невдачі протигрибкового лікування, зокрема при застосуванні аліламінів та азолів (Burmester et al., 2019; Nenoff et al., 2020).
В основі неефективності протигрибкових методів лікування, а також рецидивуючих і хронічних мікозів може також лежати стійкість грибкових спор. Спори мають сповільнений метаболізм та щільні клітинні стінки, що робить їх менш чутливими до багатьох методів лікування. Отже, для боротьби з грибковими інфекціями потрібні нові протигрибкові засоби, ефективність яких спочатку слід довести в дослідженнях in vitro.
З метою моніторингу росту бактерій, дріжджів і дерматофітів широко використовується мікропланшетна лазерна нефелометрія (МЛН). Також за допомогою цього методу досліджують вплив різних речовин на ріст мікроорганізмів. МЛН дозволяє проводити моніторинг чутливості мікроорганізмів за зміною кривих «доза-відповідь», визначати напівмаксимальну інгібувальну (IC50) і мінімальну інгібувальну концентрацію (MIC), а також проводити пряме порівняння активності препаратів.
Щоб виявити цілеспрямовану протигрибкову дію препарату в присутності клітин людини, умови in vivo часто імітують за допомогою тривимірних (3D) культур клітин. Так, повні моделі шкіри складаються з колагенової матриці, заповненої первинними фібробластами людини як дерми, так і повністю диференційованого епідермісу з первинних кератиноцитів людини (Reddersen et al., 2019; Wiegand et al., 2016).
Протигрибкові та спороцидні ефекти різноманітних сполук можна перевірити на 3D‑моделі, штучно зараженій спорами. Досліджувати вплив грибків в інкубаційному періоді на життєздатність клітин можна за допомогою вимірювання рівня лактатдегідрогенази (ЛДГ) – цитозольного ферменту, який вивільняється за ушкодження клітинної мембрани та в разі загибелі клітини.
Це дослідження проводили для вивчення спороцидного ефекту сертаконазолу. Ефективність сертаконазолу нітрату проти мікроконідій видів Trichophyton, хламідоспор Epidermophyton, бластоспор дріжджів Candida та конідій цвілі Scopulariopsis brevicaulis перевіряли за допомогою методу МЛН. Отримані результати порівнювали із протигрибковою активністю циклопіроксоламіну/тербінафіну. Для демонстрації спороцидної активності речовин in situ в присутності людських клітин була використана повна 3D‑модель шкіри, штучно заражена грибковими спорами.
Матеріали та методи
Приготування досліджуваних розчинів препаратів
Сертаконазолу нітрат, тербінафін або циклопіроксоламін розчиняли в диметилсульфоксиді (Sigma-Aldrich) у кінцевій концентрації 10 мг/мл для приготування вихідних розчинів. Для визначення протигрибкової активності відповідні тестові концентрації готували шляхом розведення вихідних розчинів у середовищі глюкози Сабуро (Merck). Було застосовано нітрат сертаконазолу в діапазоні 0,001-50 мкг/мл для визначення ефективних концентрацій; концентрації тербінафіну варіювали від 0,00005 до 50 мкг/мл, циклопіроксоламіну – від 20 до 100 мкг/мл. Щоб дослідити вплив зразків на повній моделі інфікованої шкіри, відповідні тестові концентрації були приготовлені шляхом розведення основного розчину в надчистій воді.
Культивування штамів грибів
Тестували такі мікроорганізми: Candida albicans DSM 1386, Candida parapsilosis DSM 5784, T. rubrum DSM 16111, T. interdigitale IHEM 22939, Trichophyton soudanense DSM 103786, Trichophyton indotineae DSM 107608, Epidermophyton floccosum RV51/17, S. brevicaulis RV491II/16.
Дріжджі та цвілі культивували на чашках з декстрозним агаром Сабуро (Merck) протягом 48 год за температури 37 °C в аеробних умовах. Дерматофіти вирощували на чашках з агаром Dermasel (Oxoid) при кімнатній температурі протягом 3 тиж. Спори дерматофітів і Scopulariopsis spp. обережно зішкрібали з поверхні пластини з агаром та диспергували в 5 мл стерильного ізотонічного розчину NaCl (9 г/л; Fresenius Kabi), який потім фільтрували через клітинний фільтр 40 мкм. Спорові розчини (плісняви) підраховували вручну за допомогою одноразових лічильних камер. Культури клітин Candida отримували шляхом інокуляції 20 мл 2% середовища глюкози Сабуро (Merck) з 1-2 колоніями та шляхом інкубації культури протягом ночі за температури 30 °C зі струшуванням. Розведення проводили в 2% глюкозному середовищі Сабуро (Merck) до кінцевої концентрації 2×103 спор/мл. Життєздатність спор/клітин визначали посівом на декстрозний агар Сабуро (Merck).
Визначення протигрибкової дії за допомогою МЛН
МЛН проводили за допомогою обладнання NEPHELOstar Galaxy. 100 мкл розчину препарату додавали разом із 100 мкл суспензії спор мікроорганізму до кожної лунки стерильного 96-лункового мікропланшета. Лунки, в яких спостерігалося повне пригнічення росту після часу інкубації, висівали на середовище Сабуро для оцінки фунгіцидних або фунгістатичних ефектів. Ріст колонії визначали протягом подальших 3 днів або до 7 днів. Відсутність росту колоній сприймали як ознаку фунгітоксичних ефектів, на основі чого робили висновок про MIC. Показник IC50 протигрибкових засобів розраховували за кривими росту протягом часу інкубації. Площу під кривою визначали за результатами та розраховували у відсотках від необробленого контролю.
Підготовка повних 3D‑моделей шкіри та їх інфікування спорами
Нормальні людські дермальні фібробласти (Promocell) та нормальні людські епідермальні кератиноцити (Promocell) були використані для створення повних моделей шкіри. Фібробласти культивували в модифікованому середовищі ІГЛА в модифікації Дульбекко, кератиноцити – в базальному середовищі кератиноцитів.
Потім клітини відокремлювали трипсином-EDTA (Gibco, Thermo Fisher Scientific) і ресуспендували у відповідному середовищі. Фібробласти (з метою отримання еквівалента дерми) поміщали в 12-лункові планшети та культивували протягом подальших 3 тиж.
Перед посівом кератиноцитів (для отримання моделі епідермісу) верхню частину еквівалента дерми вкривали фібронектином. Отриману повну модель шкіри культивували ще протягом 19 днів, змінюючи кожні 2-3 дні поживне середовище. Для штучного зараження моделі шкіри поміщали на вкриті спорами колагенові плівки.
Лікування заражених повних 3D‑моделей шкіри
Необхідні концентрації сертаконазолу нітрату, циклопіроксоламіну та тербінафіну, використані на моделях шкіри, обирали відповідно до попередньо визначених значень МІС. З огляду на знижене проникнення речовин через роговий шар шкіри та можливі процеси адсорбції на клітинах, ліпідах і білках антимікотичні засоби використовували в концентраціях, що в 10 разів перевищували визначені показники МІС. Одразу після розміщення моделей шкіри на вкритих спорами колагенових плівках поживне середовище замінювали свіжим і додавали 25 мкл розчину досліджуваного антимікотика. Негативний контроль складався з 25 мкл очищеної води, позитивний – з 25 мкл 1% додецилсульфату натрію. Досліджувані зразки інкубували протягом 48 і 72 год відповідно за температури 37 °C під 5% CO2.
Виявлення грибів, оцінка життєздатності клітин і цитотоксичної дії
Інфікування повних моделей шкіри перевіряли фарбуванням гематоксиліном, а також еозином, окрім того, фарбуванням за Шиффом. З метою попередньої підготовки 3D‑моделі шкіри піддавали впливу 4% розчину формаліну, просушували та парафінували протягом ночі в апараті для обробки тканин. Зрізи завтовшки 4 мкм виготовляли та монтували на предметні скельця мікроскопа. Перед фарбуванням парафін, що містився в зрізах тканин, видаляли за допомогою спирту. Депарафінізацію та фарбування проводили автоматично за допомогою Leica Autostainer XL (Leica Mikrosysteme Vertrieb GmbH) згідно із протоколом виробника. Мікроскопічну оцінку проводили за допомогою мікроскопа Axio Scope A.1. Отримані за допомогою цифрової камери зображення оброблялися та оцінювалися програмою ImageJ. Життєздатність клітин визначали на основі люмінометричного аналізу ATPLiteTM- (PerkinElmer). Вивільнення ЛДГ визначали за допомогою наборів для виявлення цитотоксичності (Roche Diagnostics). Вимірювання вивільнення інтерлейкінів проводили за допомогою відповідних імуноферментних аналізів (ELISA) для IL‑α, IL‑6 та IL‑8.
Статистичний аналіз
Дослідники використовували результати двох незалежних тестувань. Вимірювання проводили 4 рази (МЛФ) або двічі (повна модель шкіри). Для аналізу враховували середні значення ± стандартне відхилення. Статистичну оцінку отриманих показників проводили за допомогою t-тестів Стьюдента в Microsoft® Excel SP2. Значення p<0,05 свідчили про статистичну значущість.
Результати
Визначення протигрибкової активності за допомогою МЛН
Дані МЛН продемонстрували, що нітрат сертаконазолу ефективно зменшує ріст грибків. Найвища його активність in vitro була зафіксована щодо T. soudanense із середнім значенням IC50 0,0014 мкг/мл, T. indotineae – 0,0018 мкг/мл і T. rubrum – 0,0028 мкг/мл. Значно більші концентрації сертаконазолу нітрату були необхідні для пригнічення росту C. albicans із середнім значенням IC50 0,54 мкг/мл, T. interdigitale – 0,39 мкг/мл і S. brevicaulis – 0,11 мкг/мл. Циклопіроксоламін також мав хорошу протигрибкову дію з найвищою ефективністю проти дерматофітів (значення IC50 від 1,02 до 2,62 мкг/мл), а також дещо нижчою щодо дріжджів (4,91 та 4,73 мкг/мл) і цвілі (4,85 мкг/мл). Тербінафін був ефективним проти дерматофітів T. rubrum (0,0015 мкг/мл), T. soudanense (0,0016 мкг/мл), T. interdigitale (0,0038 мкг/мл) та E. floccosum (0,0021 мкг/мл), хоча значно вищі його концентрації були потрібні для знищення резистентного штаму T. indotineae (4,66 мкг/мл). Загалом значення МІС, необхідні для інгібування дерматофітів, дріжджів і плісняви, були вищими за значення IC50, але мали таку саму тенденцію.
Порівняно із сертаконазолу нітратом, для досягнення протигрибкового ефекту необхідні вищі концентрації циклопіроксоламіну. Результати нітрату сертаконазолу виявилися зіставними з результатами тербінафіну проти T. rubrum і T. soudanense. Однак нітрат сертаконазолу був значно ефективнішим проти T. indotineae, S. brevicaulis, C. albicans і C. parapsilosis.
Протигрибкова обробка інфікованих моделей шкіри
Зростання неактивних спор T. rubrum, E. floccosum, S. brevicaulis і C. albicans на повних моделях шкіри було перевірено за допомогою фарбування реактивом Шиффа і фарбування гематоксиліном. Для двох дерматофітів і цвілі ріст грибкових гіфів був помітним через 48 год, а чітке збільшення грибкового навантаження – через 72 год, що зумовило нечіткість контурів дермального й епідермального шарів шкіри внаслідок кератолітичної дії грибів. Було виявлено швидкий ріст C. albicans на моделях шкіри. Вже через 48 год у більшості перевірених ділянок було помітно значне розростання псевдогіфів, а через 72 год моделі шкіри були майже повністю протягнуті псевдогіфами та скупченнями дріжджових клітин. Контрольна обробка 1% додецилсульфатом натрію спричинила значне ушкодження повних моделей шкіри. Обрані концентрації сертаконазолу нітрату, циклопіроксоламіну та тербінафіну не мали негативного впливу на життєздатність повних моделей шкіри.
Інфікування моделей шкіри S. brevicaulis і C. albicans зумовило біологічно значуще зниження життєздатності клітин (<70% від необробленого контролю). Це супроводжувалося значним збільшенням вивільнення ЛДГ і секреції прозапальних цитокінів. Інфікування дерматофітами T. rubrum і E. floccosum не вплинуло на життєздатність клітин 3D‑моделі шкіри, але ріст мікроконідій T. rubrum спричиняв значне збільшення вивільнення ЛДГ.
Додавання до моделей шкіри, інфікованих C. albicans, сертаконазолу нітрату достовірно підвищувало життєздатність клітин на 48 (p<0,05) та 72 год (p<0,01), знижувало вивільнення ЛДГ і секрецію IL‑1α порівняно з інфікованими моделями шкіри, які не пройшли обробки сертаконазолу нітратом. Окрім того, під час лікування нітратом сертаконазолу вивільнення IL‑1α-моделями інфікованої шкіри знизилося до контрольних рівнів, що свідчить про ефективний контроль інфекції.
Тербінафін і циклопіроксоламін мали лише незначний вплив на виживаність моделі шкіри та не могли зменшити вивільнення ЛДГ. Проте тербінафін чинив деякий протизапальний ефект у всіх випадках, зумовлюючи зниження секреції IL‑1α, IL‑6 і частково IL‑8. Циклопіроксоламін був здатний зменшити вивільнення IL‑1α за інфекції C. albicans, E. floccosum і T. rubrum через 72 год.
Визначення ушкодження повних моделей шкіри внаслідок інфекції та ефективності лікування згодом проводили шляхом оцінки гістологічних результатів.
Оцінка ґрунтувалася на ідентифікації гіфів грибів або дріжджових клітин їхньої загальної кількості в досліджуваних зрізах, а також на вираженості ушкодження епідермального та дермального шарів. Сертаконазолу нітрат переважно запобігав розростанню спор T. rubrum протягом 48 год. Через 72 год у деяких випадках спостерігався ріст гіфів, але він був значно меншим порівняно з необробленим контролем. Циклопіроксоламін і тербінафін були здатні зменшити ріст гіфів T. rubrum протягом 72 год, але значно меншою мірою, ніж сертаконазолу нітрат. Отже, спостерігалося типове кератолітичне ушкодження дермального й епідермального шарів. Ріст E. floccosum на шкірних моделях також помітно зменшувався протягом 48 год при додаванні сертаконазолу нітрату.
Через 72 год грибкове навантаження залишалося зниженим порівняно з необробленим контролем, а моделі шкіри були менш ушкоджені.
Оцінка через 72 год після інфікування S. brevicaulis продемонструвала збільшення навантаження грибковими гіфами під час лікування циклопіроксоламіном порівняно із сертаконазолу нітратом і тербінафіном.
Зіставних результатів було досягнуто в разі застосування циклопіроксоламіну та тербінафіну при інфікуванні E. floccosum. Окрім того, тестові зразки були ефективними проти S. brevicaulis протягом 48 год.
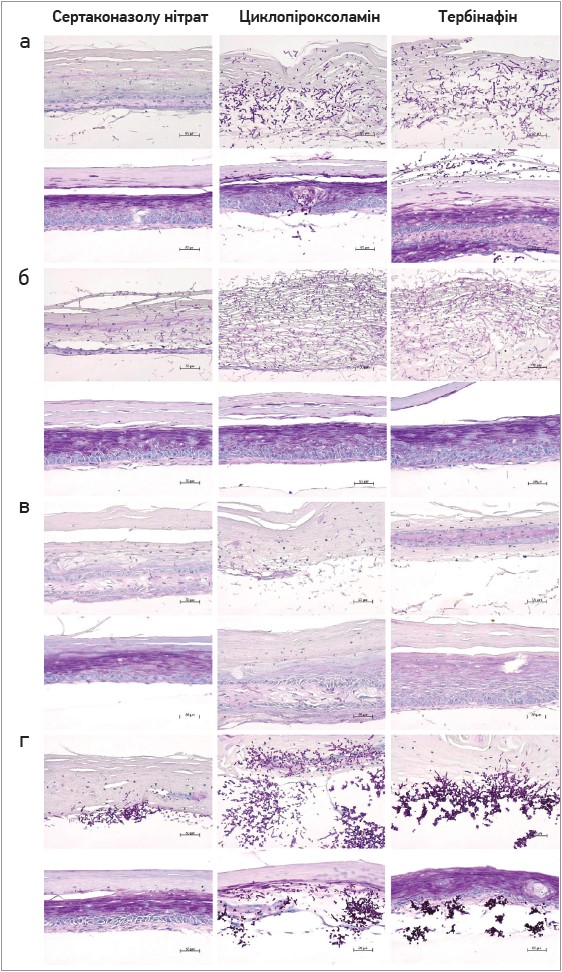
Ріст C. albicans в інфікованих повних моделях шкіри був помітно знижений у разі застосування нітрату сертаконазолу протягом 48 год, а також протягом 72 год. Тут лікування циклопіроксоламіном і тербінафіном мало помітно менший ефект (рис.).
Рис. Гістологічні результати після зараження повних моделей шкіри T. rubrum (а), E. floccosum (б), S. brevicaulis (в), C. Albicans (г) і лікування сертаконазолу нітратом, циклопіроксоламіном або тербінафіном після 72 год (фарбування реактивом Шиффа, 200-кратне збільшення)
Обговорення
Стійкість грибків – проблема, що поширюється, яка стосується всіх протигрибкових засобів, у т. ч. азолів. Наразі є обмежені дані щодо резистентності грибів до сертаконазолу нітрату. Отримані в цьому дослідженні результати свідчать про те, що сертаконазолу нітрат має спороцидну дію.
Спороцидну активність тербінафіну, циклопіроксоламіну, нітрату сертаконазолу додатково досліджували за допомогою 3D-моделі шкіри, що була штучно заражена T. rubrum, E. floccosum, S. brevicaulis або C. albicans. Наскільки відомо, поки що це перший звіт про штучне зараження 3D-моделі шкіри різними типами грибкових спор і подальшу обробку протигрибковими засобами.
Відповідно до результатів МЛН виявлено, що нітрат сертаконазолу зменшує ріст спор T. rubrum, а також пригнічує ріст гіфів E. floccosum і S. brevicaulis, зменшує розширення псевдогіфів C. albicans на інфікованих повних моделях шкіри. Водночас циклопіроксоламін довів зіставну ефективність лише проти E. floccosum і зменшив поширення T. rubrum і S. brevicaulis, але не міг запобігти росту гіфів і ушкодженню моделей шкіри. Крім того, він чинив помітно менший вплив на C. albicans порівняно із нітратом сертаконазолу.
Тербінафін продемонстрував зіставну із сертаконазолу нітратом ефективність проти E. floccosum і меншою мірою пригнічував ріст S. brevicaulis. Він мав менший вплив на ріст C. albicans порівняно із сертаконазолу нітратом, та не досяг аналогічного зниження T. rubrum.
Висновки
Сертаконазолу нітрат продемонстрував певні переваги перед протигрибковими засобами (циклопіроксоламін і тербінафін) у боротьбі з грибковими спорами, а це є свідченням того, що він має перспективи щодо лікування дерматомікозів, які мають схильність до рецидиву.
За матеріалами: Fink S. et al. Efficacy of antifungal agents against fungal spores: An in vitro study using microplate laser nephelometry and an artificially infected 3D skin model Microbiologyopen. 2022 Feb; 11 (1): e1257. Published online 2022 Jan 13. doi: 10.1002/mbo3.1257.
Адаптований переклад з англ. В’ячеслава Килимчука
Медична газета «Здоров’я України 21 сторіччя» № 7-8 (524-525), 2022 р.