29 травня, 2021
Cучасні напрями терапії злоякісних пухлин шкіри

12-14 березня у режимі онлайн на міжнародній медичній науково-освітній платформі Medical Knowledge Hub пройшла Друга школа дерматоонкології. Захід був призначений для лікарів, які займаються діагностикою та лікуванням пухлин шкіри, зокрема дерматологів, онкологів, онкохірургів, патоморфологів, інтернів і суміжних спеціалістів.
 У рамках школи про сучасні напрями терапії злоякісних пухлин шкіри розповів експерт МОЗ України за спеціальністю «Онкологія», завідувач кафедри онкології ДЗ «Запорізька медична академія післядипломної освіти МОЗ України», доктор медичних наук, професор Олексій Олексійович Ковальов.
У рамках школи про сучасні напрями терапії злоякісних пухлин шкіри розповів експерт МОЗ України за спеціальністю «Онкологія», завідувач кафедри онкології ДЗ «Запорізька медична академія післядипломної освіти МОЗ України», доктор медичних наук, професор Олексій Олексійович Ковальов.
– Меланома відома людству ще з часів Гіппократа, який називав її «чорним раком», «смертельною пухлиною з чорною рідиною в організмі». Про тривалу історію цього захворювання свідчить і виявлення дифузних метастазів меланоми у кістках перуанських мумій доколумбового періоду. Власне термін «меланоз» вперше було застосовано Рене Теофілем Лаенеком у 1804 р., проте розуміння механізмів меланогенезу з’явилося лише на початку XXІ століття.
Негативні зміни в способі життя людей стали причиною різкого приросту рівня захворюваності на меланому шкіри у ХХ столітті (O. Hallberg, O. Johansson, 2013). Безпосередній зв’язок між меланомою та ультрафіолетовим опроміненням вперше встановив у 1956 р. австралійський лікар і математик Генрі Ланкастер.
Варто звернути увагу і на існування іще однієї проблеми у проблемі – спадкової меланоми шкіри. Зв’язок раку підшлункової залози із множинними невусами та меланомою вперше описав відомий онколог Генрі Лінч (H.T. Lynch, 1968). Наразі існує можливість проведення молекулярного профілювання з метою встановлення спорадичного чи спадкового виду меланоми.
Особливе місце у лікуванні меланоми займає хірургічне лікування, початок якого було покладено у 1787 р., коли англійський хірург Джон Хантер вперше видалив «раковий грибоподібний наріст», який і був меланомою. Сьогодні відомо, що локальні рецидиви після хірургічного видалення меланоми трапляються вкрай рідко, не частіше ніж у 5% випадків (винятками є десмопластична та нейротропна меланоми). Проте майже у всіх хворих спостерігаються віддалені та регіонарні метастази. У цьому аспекті важливо правильно встановити стадію онкологічного процесу та відповідно вибрати безпечний край резекції. Особливої уваги потребують випадки специфічних локалізацій меланоми, коли загальні принципи хірургічного лікування застосувати складно. Це стосується меланоми обличчя, пальців, нігтьового ложа та стопи.
Незважаючи на використання сучасних методів лікування, проблемою залишається неухильне прогресування захворювання приблизно у 20% пацієнтів із первинною меланомою. При цьому ризик метастазування залежить від товщини пухлини, наявності виразок, мітотичного індексу, ступеня лімфоцитарної інфільтрації, віку, статі, анатомічної локалізації та біологічних особливостей меланоми, а виживаність – від стадії захворювання. Проте було продемонстровано, що циркулюючі клітини злоякісної меланоми, які є відповідальними за метастатичне прогресування (мінімальна залишкова хвороба), виявляються у крові хворих навіть із I стадією меланоми (A.A. Kovalev, T.V. Grudinskaya, 2012). Іншими формами мінімальної залишкової хвороби є преципітовані клітини у кістковому мозку та особливо мікрометастази у сигнальному лімфатичному вузлі (J.E. Gershenwald et al., 1999).
Нині рутинна резекція лімфатичних вузлів виключена зі стандартів лікування меланоми, тому за відсутності клінічних проявів ураження регіонарних лімфатичних вузлів прийнято видаляти лише сторожовий вузол. D.L. Morton та співавт. (1989) описали процедуру виявлення та резекції сторожового лімфатичного вузла для визначення метастатичного ураження лімфатичних вузлів. Обов’язково виявляти сторожовий лімфатичний вузол у хворих із ІІІ стадією меланоми, оскільки лімфатичні вузли уражаються саме на цій стадії онкологічного процесу. Так, категорія N1 передбачає залучення у процес 1 лімфатичного вузла (N1а – мікрометастази, N1b – макрометастази). Категорія N2, при якій уражаються 2-3 вузли, окрім N2а (мікрометастази) та N2b (макрометастази) додатково включає N2с – транзиторні метастази, а категорія N3 свідчить про залучення 4 і більше лімфатичних вузлів. Такий розподіл надзвичайно важливий, адже доведеною є залежність виживаності при ІІІ стадії меланоми шкіри від кількості та характеру ураження лімфатичних вузлів.
За 8-ю версією класифікації Американського об’єднаного комітету з раку (AJCC), виділяють ІІІА, ІІІB, IIIC та IIID стадії меланоми, виживаність при кожній із яких значно різниться. Гетерогенність ІІІ стадії меланоми шкіри зумовлює актуальність пошуку найкращих варіантів її лікування. Не дарма меланому називають «вбивцею ліків», адже при дисемінації процесу наявні сьогодні можливості лікування хворих обмежені.
Раніше при дисемінованій формі меланоми проводили хіміотерапію із застосуванням дакарбазину, темозоломіду, комбінації цитотоксичних агентів з імуноцитокінами, зокрема системне введення дарлейкіну (імунокон’югат, що складається з рекомбінантної форми інтерлейкіну‑2 та фібронектину) з дакарбазином або інтратуморальне використання дарлейкіну. Проте ці схеми лікування не були ефективними, а виживаність не перевищувала кількох тижнів.
Із появою доступу до сучасних методів діагностики меланоми, зокрема молекулярно-генетичного, було встановлено, що найгірша відповідь на хіміотерапію спостерігається у хворих із мутаціями у гені BRAF. На сьогодні з’ясовано, що частота мутацій у кодоні V600 гена BRAF у пацієнтів із меланомою шкіри сягає близько 50% (Cancer Genome Atlas Program Office, 2015). Онкоген BRAF разом із генами ARAF та CRAF належить до сімейства протеїнкіназ RAF, що було продемонстровано Робертом Вайнбергом. Також вчені показали, що майже у 90% випадків меланоми в результаті онкогенних мутацій відбувається активація та фосфорилювання сигнального шляху MAPK-ERK (T.M. Grzywa, 2017). Особливостями мутацій BRAF V600Е є те, що вони виявляються при меланомах шкіри тулуба, проте не голови та шиї; зазвичай виникають у молодому віці й асоціюються із сонячними опіками у дитинстві; спостерігаються при переривчастому ушкодженні шкіри ультрафіолетом, але не при сонячному еластозі; частіше зустрічаються при поверхневій меланомі, ніж при її вузловій формі, а також частіше при пігментних та рідше – при амелатонічних меланомах. Мутація BRAF корелює із мітотичним індексом і товщиною пухлини за Бреслоу та є предиктивним, але не прогностичним маркером. Варто зауважити, що вторинні мутації у гені BRAF не виявляються (I. Vanni et al., 2020).
Висока ефективність лікування меланоми шкіри із застосуванням інгібіторів BRAF (анти-BRAF терапії) була продемонстрована N. Wagle та співавторами. При цьому вираженої клінічної відповіді, яка проявлялася майже повним регресуванням усіх підшкірних пухлинних вузлів, вдалося досягти вже через 15 тижнів лікування. Проте зворотною стороною анти-BRAF терапії є розвиток таких побічних проявів: фотосенсибілізація, висип, втомлюваність, атралгії, гіперкератоз, бородавчастий кератоз, папілярні ураження, кератоакантома та плоскоклітинна карцинома, а іноді – гострий моноцитарний лейкоз, мегакаріоцитоз, NRAS-мутагенний лейкоз, поліпи шлунково-кишкового тракту, меланома de novo, не пов’язана з мутацією BRAF V600, та рецидиви меланоми. Вагомим недоліком анти-BRAF терапії є розвиток резистентності до лікування із виникненням рецидивів. Так, у цьому ж дослідженні, через 6 місяців (23 тижні) після повного регресування спостерігали виражене прогресування хвороби (рис. 1; N. Wagle et al., 2011). Таким чином, це лікування слід обережно застосовувати у пацієнтів з BRAF-залежною пухлиною в анамнезі.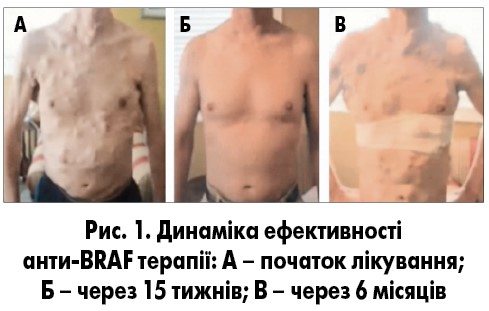
Резистентність до анти-BRAF терапії насамперед зумовлена наявністю мутацій сигнального шляху MEK, що розташований нижче BRAF, та відновлює активність сигнального шляху MAPK, навіть при пригніченні BRAF (T.M. Grzywa, 2017). BRAF-інгібітори пов’язані з парадоксальною активацією шляху MAPK, що може спричинити розвиток вторинних злоякісних пухлин de novo та рецидиву меланоми. Таким чином, подвійне BRAF-MEK інгібування up front є більш ефективним та безпечним, ніж монотерапія інгібіторами BRAF.
Результати нещодавніх досліджень COMBI-D, COMBI-V та CO-BRIM продемонстрували, що подвійне пригнічення сигнального шляху MAPK, яке проводиться із застосуванням комбінації інгібіторів BRAF і MEK, а саме дабрафенібу та траметинібу (Тафінлар® та Мекініст®), сприяє збільшенню загальної виживаності (ЗВ), виживаності без прогресування (ВБП), часу до прогресування та об’єктивної відповіді на лікування. Окрім цього, застосування комбінації інгібіторів BRAF і MEK супроводжувалося більш вираженим зменшенням розміру пухлини порівняно з монотерапією будь-яким із двох препаратів (рис. 2; C. Robert et al., 2019; P.D. Nathan et al., 2019).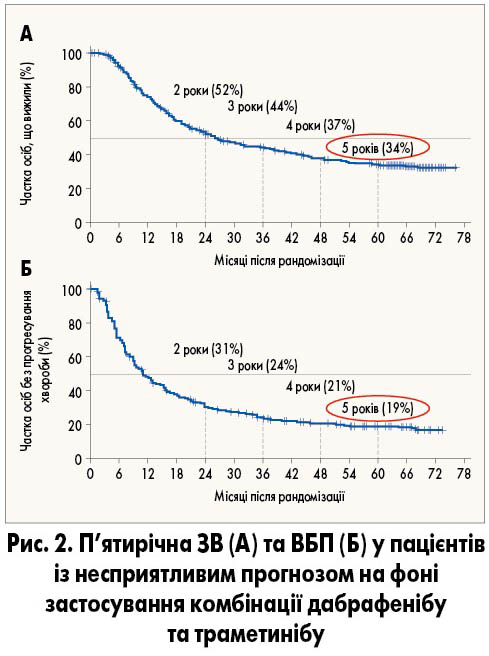
Застосування комбінації дабрафеніб + траметиніб (Тафінлар® + Мекініст®) продемонструвало високу клінічну ефективність у пацієнтів з інтракраніальними метастазами меланоми, в тому числі й симптомними (M.A. Davies et al., 2017).
Незважаючи на ефективність комбінованої анти-BRAF терапії, основною проблемою її використання все ж залишається токсичність препаратів. Так, небажані явища 3-4 ступеня розвиваються майже у половини хворих, а у 54% пацієнтів виникає гіпертермія, механізм розвитку якої на сьогодні залишається незрозумілим. Відомо, що виникнення гіпертермії не асоціюється із сепсисом, при відсутності локальних проявів не потребує подальшого обстеження на наявність інфекційних хвороб, а також не корелює із відповіддю на лікування та клінічними наслідками. Предиктори розвитку гіпертермії до лікування відсутні, а сама гіпертермія не вважається предиктором відповіді на лікування та часто супроводжується ознобом, нічною пітливістю, висипом, дегідратацією, порушенням водно-сольового обміну та гіпотензією. У 13-14% пацієнтів розвиток гіпертермії потребує редукції дози препаратів, проте повна відміна лікування необхідна лише у 2-3% випадків. Відомо, що медіана часу до розвитку першого епізоду гіпертермії становить приблизно 4 тижні, а медіана її тривалості – 3 тижні. У 97% випадків для купірування гіпертермії достатньо тимчасово припинити лікування дабрафенібом і траметинібом або зменшити їх дозу.
Хоча комбінована анти-BRAF терапія і має свої недоліки, ще Вільям Шекспір говорив, що хвороби відчайдушні виліковують тільки засоби відчайдушні. Це твердження є справедливим і для дабрафенібу та траметинібу (Тафінлар® та Мекініст®), які сьогодні впевнено займають свою нішу у лікуванні злоякісних пухлин шкіри.
Таким чином, комбінована анти-BRAF терапія препаратами Тафінлар® та Мекініст® рекомендована для лікування хворих із неоперабельною або метастатичною меланомою з мутацією гена BRAF V600.
Підготувала Ольга Нестеровська
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 2 (69) 2021 р.




