24 березня, 2023
Роль тромбоцитів у запаленні й інфекції
Тромбоцити являють собою без’ядерні гемопоетичні клітини дископодібної форми. Вони відіграють значну роль у системі гемостазу [1]. Проте останнім десятиліттям з’явилися наукові дані про те, що їхні функції виходять за рамки системи згортання крові. Нещодавні дослідження показують їхню участь як одного із ключових регуляторів у запаленні та внутрішньосудинному імунітеті.
Тромбоцити безпосередньо розпізнають патогени, активують й рекрутують лейкоцити в осередку запалення та інфекції, а також модулюють поведінку лейкоцитів, підвищуючи їхню здатність до фагоцитозу, знищення патогенів, стимулюючи унікальні ефекторні функції, як-от продукування нейтрофільних пасток. Водночас тромбоцити беруть участь у природному імунітеті, відіграють вирішальну роль у вроджених й адаптивних імунних реакціях та екстенсивно взаємодіють з ендотеліальними клітинами, різними патогенами, а також майже з усіма відомими типами імунних клітин, у т. ч. нейтрофілами, моноцитами, макрофагами, лімфоцитами. Крім того, тромбоцити впливають на загоєння ран, інтегруючи складні каскади між своїми медіаторами, які включають різні цитокіни, трансформувальні та тромбоцитарні фактори росту, ендотелій судин. Останні дані свідчать про те, що тромбоцити відіграють значну роль у патогенезі злоякісних новоутворень, утворюючи складні, двоспрямовані взаємодії з пухлинними клітинами.
Для підтримання адекватного гемостазу потрібна лише частина популяції тромбоцитів. Надмірна їхня кількість дозволяє цим клітинам виступати в ролі перших та основних «циркулювальних вартових» для розпізнавання чужорідних тіл, активуючи протимікробний захист, визначаючи наявність патогенів через їхні множинні імунні рецептори [2-6].
Роль тромбоцитів у запаленні
Запалення є комплексом реакцій вродженої імунної системи на патологічні подразники, як-от мікроби, патогени або стандартні молекулярні структури (патерни), пов’язані з ушкодженням. Локальне запалення має такі класичні симптоми: dolor (біль), calor (жар), rubor (почервоніння), tumor (припухлість) та functio laesa (втрата функції). Ці ознаки були вперше описані вченими стародавньої медицини Aulus Cornelius Celsus і Claudius Galenus понад 2000 років тому, але вони не втратили свого значення й сьогодні [7]. Місцеве запалення поширюється на обмежену ділянку тканини чи будь-який орган, а системне – на якусь систему організму. Часто локальне запалення набуває системного характеру. Системне запалення виникає при масивній травмі, хронічних захворюваннях або у відповідь на інфекцію. Клінічні реакції за системного запалення передбачають зміну температури тіла, підвищення частоти пульсу, прискорене дихання, лихоманку, лейкопенію та інші симптоми. Водночас спостерігається рекрутування імунних клітин, як-от нейтрофіли та моноцити, стінкою судини з подальшим їхнім проникненням до тканин. Окрім цього процесу запалення також включає декілька інших механізмів, наприклад, залучення системи комплементу, кінінової системи, зміна тонусу судин.
Тромбоцити як медіатори, що регулюють запалення
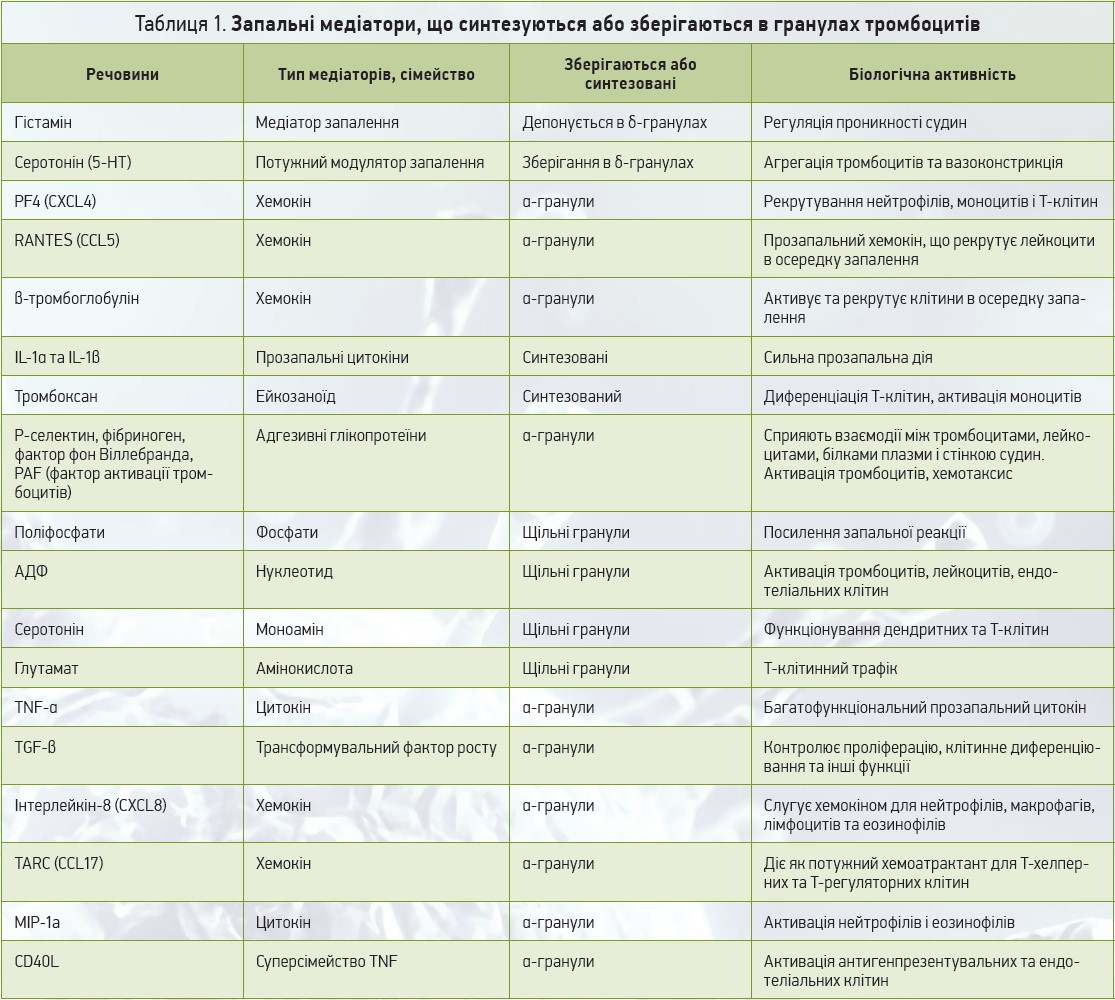
Крім участі в системі гемостазу, тромбоцити виконують багато інших функцій, зокрема і при запаленні [8]. Вони містять низку запальних пептидів та білкових медіаторів, деякі з яких мають здатність синтезуватися de novo, тоді як інші зберігаються і секретуються з гранул (α-гранули, щільні гранули, лізосоми) [9]. Ці гранули зберігають багато важливих тромбоцитарних запальних та імунних медіаторів, які швидко вивільняються після активації тромбоцитів, при цьому тромбоцити збільшуються в розмірах, проникають до осередків запалення, виділяють значну кількість прозапальних речовин із внутрішньоклітинних гранул [10]. Слід зазначити, що >300 видів білків та інших біологічно активних речовин акумульовано в гранулах активованих тромбоцитів [11]. Деякі з найпоширеніших із них включають β-тромбоглобулін, фібриноген, фактор фон Віллебранда (VWF), фактори інгібування фібринолізу, коагуляційні фактори V і XI, ангіогенний та мітогенні фактори, імуноглобуліни, мембранні білки, серотонін тощо. Активовані тромбоцити мають арсенал індукторів запалення, який містить P-селектин, sCD40L, IL1β, HMGB1, сімейство хемокінових лігандів CCL, до якого належать CCL3 (MIP1α), CCL5 (RANTES) і CCL7 (MIP3), а також сімейство CXCL, як-от CXCL1, CXCL4 (PF4), CXCL5, CXCL7. Вивільнення цих цитокінів, хемокінів та ейкозаноїдів при активації дозволяє тромбоцитам залучати лейкоцити до місця запалення чи ушкодження. В таблиці 1 перелічені деякі медіатори запалення (синтезовані та/або зберігаються в гранулах) тромбоцитарного походження.
В α-гранулах тромбоцитів містяться великі білки, багато з яких беруть участь у регуляції запальної реакції [12, 13]. Серед них виокремлюється тромбоцитарний фактор 4 (PF4) – найпоширеніший білок, що секретується активованими тромбоцитами. На його частку припадає ≈25% вмісту α-гранул [14]. Він функціонує як хемоатрактант для моноцитів. PF4 прискорює атерогенез, викликаючи запалення судин, а також сприяє затримці ліпопротеїнів у судинній стінці, що спричиняє атеросклероз. Цей тромбоцитарний фактор усуває повну взаємодію ЛПНЩ (ліпопротеїнів низької щільності) з їхніми рецепторами, спонукаючи ліпопротеїни затримуватися на поверхні клітини, а не зазнавати катаболізму [15]. Тромбоксан A2 (TxA2) тромбоцитарного походження продукується de novo з арахідонової кислоти, сприяє активації та агрегації тромбоцитів і вивільненню цитокінів [16]. Інтерлейкін (ІЛ) 1α секретується тромбоцитами, сприяє експресії молекул адгезії ICAM‑1 та VCAM‑1 на ендотеліальних клітинах. Він також прискорює трансендотеліальну міграцію нейтрофілів і призводить до такого хронічного запального захворювання, як розсіяний склероз [17]. Тромбоцитарні ІЛ‑1α та ІЛ‑1β відіграють прозапальну роль при ревматоїдному артриті [18]. Крім зберігання, тромбоцити можуть синтезувати біологічно активні білки. Наприклад, активація тромбоцитів призводить до синтезу проІЛ‑1β [19]. Цікаво, що синтез проІЛ‑1β пригнічувався нейтралізацією інтегрину бета‑3. Це означає, що пряма антитромбоцитарна терапія може мати протизапальний ефект. ІЛ‑1β із тромбоцитів викликає активацію рецепторів ендотеліальної адгезії та вивільнення прозапальних ІЛ‑6 та ІЛ‑8 з ендотеліальних клітин. ІЛ‑1β також відповідає за активацію NF-κB в ендотеліальних клітинах, необхідного для транскрипції запальних генів MCP‑1 та ICAM‑1. Фактор росту тромбоцитів (PDGF) може бути в ролі хемоатрактанту для моноцитів та еозинофілів. Хемокін RANTES (Regulable upon Activation Normally T-cell expressed and Secreted, регулятор активації процесів експресії та секреції нормальних Т-лімфоцитів) рекрутує моноцити в ендотелії у Р-селектин-залежний спосіб. RANTES відіграє істотну роль при багатьох запальних захворюваннях, у т. ч. астмі, атеросклерозі та реакції гіперчутливості уповільненого типу [20, 21]. Серед інших хемокінів, що походять із тромбоцитів, запальний білок макрофагів (MIP)-1α індукує хемотаксис лейкоцитів in vivo. MIP‑1α є хемоатрактантом для моноцитів, макрофагів, Т-клітин, нейтрофілів і бере участь у трансендотеліальній міграції у місцях запалення; також він необхідний для нормальної відповіді на певні типи вірусів. У мишей з нульовим MIP‑1α розвивається знижена запальна реакція на вірус грипу та міокардит, спричинений вірусом Коксакі [22, 23]. Тромбоцити зберігають велику кількість ліганду прозапальної молекули CD40L. Активовані тромбоцити експресують CD40L (відомий також як CD154), член сімейства факторів пухлинного некрозу. CD40L тромбоцитів може зв’язуватися з мембраною клітин і взаємодіяти з CD40, викликаючи різні запальні реакції, що призводять до місцевого вивільнення молекул адгезії, як-от ICAM1, VCAM1, CCL2 тощо. Крім того, тромбоцити відомі як джерело розчинного CD40L (sCD40L), що може індукувати судинні клітини для експресії E- і P-селектину й ініціювати вивільнення тканинного фактора та ІЛ‑6. Отже, вісь тромбоцитів CD40L – CD40 відіграє центральну роль між тромбозом та запаленням, а самі тромбоцити здатні модулювати адаптивні імунні механізми через таку вісь. Взаємодія CD40L із CD40 на ендотеліальних клітинах та макрофагах викликає вивільнення IL‑8 і MCP‑1, які залучають нейтрофіли й моноцити. Як і IL‑1β CD40L індукує експресію рецепторів адгезії на ендотелії та вивільнення хемокінів, опосередковуючи в такий спосіб рекрутування лейкоцитів. У своїх щільних гранулах тромбоцити містять поліфосфат (поліР). Нещодавно були продемонстровані прозапальні та прокоагулянтні функції поліР [24, 26]. ПоліР, що вивільняється зі стимульованих тромбоцитів, зв’язується з фактором XII, активуючи систему контактної активації, керовану FXII. Вивільнення медіатора запалення брадикініну призводить до накопичення нейтрофілів та підвищує проникність судин за рахунок зв’язування через рецептор BR2. Herter і співавт. [27, 28] використовували модель тромбоцитів як функцію за гострого ушкодження легень, щоб пояснити роль тромбоцитів у запаленні. Згідно із цією моделлю активовані тромбоцити котяться вздовж і прилипають до запаленого ендотелію, взаємодіючи при цьому з нейтрофілами. Цей процес опосередкований Р-селектином, який є інтегральним мембранним глікопретеїном, що експресується тромбоцитами, ендотеліальними клітинами, макрофагами й атеросклеротичними бляшками. Він експресується на поверхні активованих тромбоцитів і на ендотеліальних клітинах.
Отже, тромбоцити зберігають та вивільняють значну кількість медіаторів запалення. Ці молекули можуть сприяти різним захворюванням, пов’язаним із запаленням (рис. 1).
Рис. 1. Імунний арсенал тромбоцитів
Багатофункціональна роль тромбоцитів у запальних реакціях наведена в таблиці 2.
Взаємодія тромбоцитів та нейтрофілів при запаленні
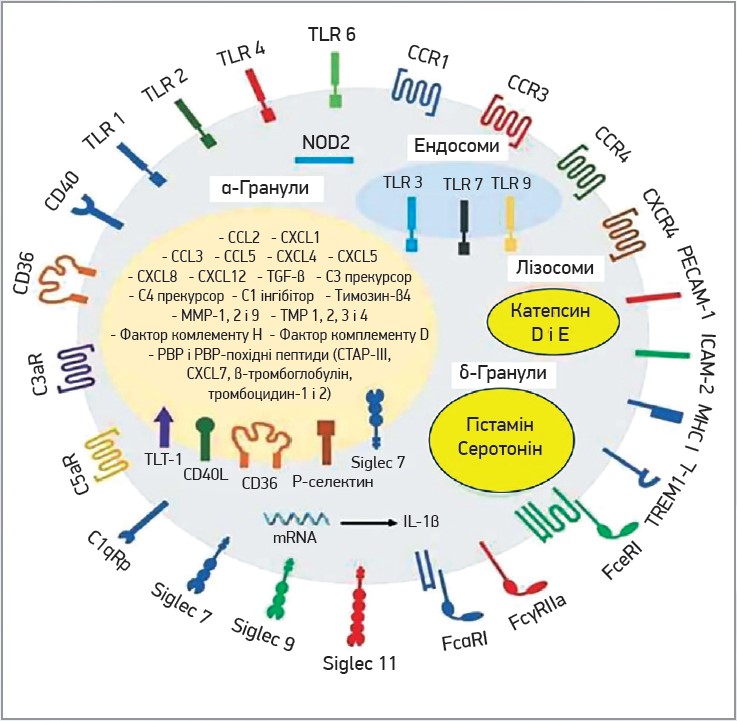
Надходження лейкоцитів до осередку запалення характеризується певною черговістю. Спочатку надходять нейтрофільні гранулоцити, згодом – моноцити та лімфоцити. Нейтрофіли є основними діючими клітинами при хронічних запальних станах і першими з’являються в місцях ушкодження. Вони здійснюють боротьбу із вторгненням патогенів за рахунок комбінації фагоцитозу, утворення активних форм кисню ROS (Reactive Oxigen Species) та вивільнення NET. Взаємодія тромбоцитів і нейтрофілів відіграє ключову роль у всіх цих запальних реакціях, оскільки допомагає локалізувати тромбоцити в осередках запалення, потенціює продукцію кисневих радикалів і відіграє ключову роль в активації нейтрофілів для вивільнення NET. За взаємодії між P-селектином та PSGL‑1, а також глікопротеїном Ibα й MAC‑1 здійснюється тромбоцитарно-нейтрофільна взаємодія при запальних станах [30, 31]. Крім ролі в локалізації нейтрофілів, активовані тромбоцити здатні ініціювати або посилювати різні реакції нейтрофілів (фагоцитоз, ROS, NET). Ці відповіді ініціюються як прямим контактом, так і вивільненням розчинних медіаторів (СCL5, PF4) [32]. Нейтрофіли, своєю чергою, також вивільняють розчинні медіатори, як-от катепсин G та еластаза, що посилюють тромбоцитарну активність реакції шляхом активації протеаз-активованих рецепторів на тромбоцитах. Цікаво, що ці ферменти, котрі походять з нейтрофілів, є негативними регуляторами адгезії тромбоцитів, оскільки можуть здійснювати протеоліз фактора фон Віллебранда [33]. Утворення NET, опосередковане тромбоцитами, потребує взаємодії тромбоцитів із нейтрофілами за рахунок утворення зв’язку P-селектину/PSGL‑1 або зв’язуванням інтегринів нейтрофілів β2 з GPIbα чи αIIbβ3 на тромбоцитах [34]. На рисунку 2 показані основні рецептор-лігандні пари, що беруть участь у взаємодії тромбоцитів і нейтрофілів (P-селектин-PSGL1, GPIbα-Mac‑1), а також шляхи, за допомогою яких тромбоцити посилюють активацію лейкоцитів (вивільненням CCL5 і PF4), отже, й власну активацію (шляхом вивільнення еластази та катепсину G). Ці ефекти тромбоцитарно-нейтрофільної взаємодії включають посилення фагоцитарної активності лейкоцитів, збільшення продукування активних форм кисню, підвищення трансміграції лейкоцитів над ендотеліальним шаром, утворення різних біоактивних лейкотрієнів, активацію згортання через тканинний фактор, опосередковане лейкоцитами відновлення тканин та утворення NET.
Рис. 2. Механізм взаємодії тромбоцитів і нейтрофілів
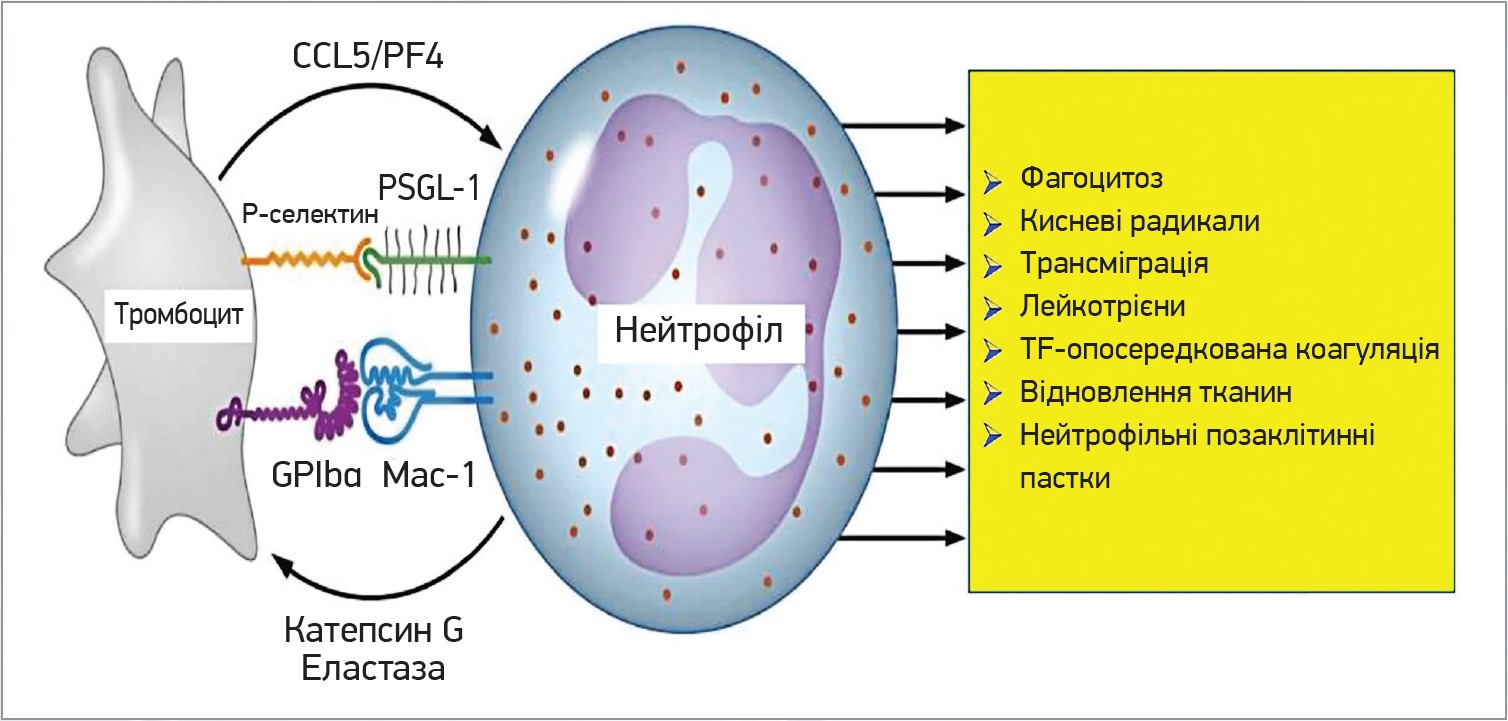
Тромбоцити взаємодіють із нейтрофілами через значну кількість рецепторів. Активовані тромбоцити експресують на своїй поверхні P-селектин, який зв’язує PSGL‑1 на нейтрофілах та ендотеліальних клітинах. CD40L експресується на поверхні тромбоцитів при активації та зв’язує CD40. Mac‑1 нейтрофілів пов’язує GPIb та aIIbb3 тромбоцитів. Загалом усі ці взаємодії сприяють продукуванню ROS, утворенню NET, адгезії, трансміграції та дегрануляції нейтрофілів. За активації тромбоцитів (зв’язування PAMPS із TLR) відбувається вивільнення бактерицидних білків, як-от TC1+2, які знищують бактерії. Тромбоцити секретують значні кількості CXCL4 та CXCL7, що сприяють адгезії, дегрануляції та трансміграції нейтрофілів (рис. 3).
Рис. 3. Утворення тромбоцитами комплексів із нейтрофілами
Тромбоцити й інфекційні захворювання
Тромбоцити та бактерії
Як на своїй плазматичній мембрані, так і всередині тромбоцити можуть переносити різні патогени (віруси, бактерії, паразити) [35-37]. Уперше на зв’язок тромбоцитів із бактеріальною інфекцією звернув увагу С. Levaditi ще в 1901 році, коли зауважив, що тромбоцити формують агрегати з холерним вібріоном [38]. У 1970-х роках С. Clawson і співавт. опублікували перші систематичні дослідження, які підтвердили те, що бактерії можуть зв’язуватися з певними рецепторами тромбоцитів, викликаючи сигнали, котрі призводять до агрегації та дегрануляції внутрішньоклітинного вмісту [39-41]. Активація тромбоцитів бактеріями визначається механізмом адгезії до рецепторів тромбоцитів (GPIb, GPIIb-IIIa, рецепторів комплементу, FcgRIIa або TLR). Ця адгезія може виникати як через пряму взаємодію між структурами на поверхні бактерій з рецепторами тромбоциту, так і непрямим механізмом, коли бактерії покриваються білками плазми крові (фібриноген, фібронектин, фактор фон Віллебранда, фактори комплементу, IgG) і зв’язуються з рецепторами тромбоцитів цих білків плазми крові (рис. 4). Непряма взаємодія виникає, коли бактеріальний адгезин зв’язується з білком плазми або іншими розчинними елементами імунної системи, як-от імуноглобуліни та білки комплементу, які пов’язують бактерії зі специфічним рецептором на поверхні тромбоцитів [42-45].