22 грудня, 2021
Хвороби порушення вуглеводного обміну: новітні дані

У ході чергового засідання науково-освітнього проєкту «Школа ендокринолога», яке відбулося у вересні 2021 року, багато часу було присвячено захворюванням, зумовлении порушенням вуглеводного обміну. Спікери сфокусували увагу на декількох темах. Зокрема, на змінах поглядів на компенсацію цукрового діабету (ЦД ), з акцентом на таке серйозне ускладнення, як гіпоглікемія, на проблемі ожиріння у світі сучасних міжнародних рекомендацій, а також на ролі мікробіоти в розвитку ожиріння і ЦД і можливостях лікування цих патологій.
Ключові слова: метаболічні розлади, ожиріння, лікування ожиріння, цукровий діабет, глікемічний контроль, гіпоглікемія, мікробіота.
Темою доповіді незмінного т’ютора «Школи ендокринолога», керівника відділу діабетології ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», доктора медичних наук Любові Костянтинівни Соколової стала компенсація ЦД і зміни в погляді на цю проблему.
стала компенсація ЦД і зміни в погляді на цю проблему.
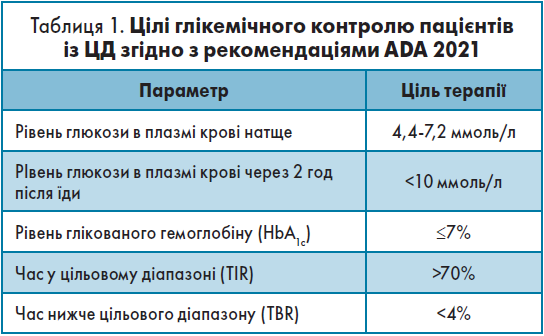
У рекомендаціях ADA (Американська діабетологічна асоціація) від 2021 року відбулися певні зміни щодо цілей глікемічного контролю для більшості пацієнтів із ЦД (табл. 1).
Лікар-ендокринолог має прагнути підтримувати рівень глюкози в плазмі крові натще (ГПН) у межах 4,4-7,2 ммоль/л і рівень глюкози в плазмі крові через 2 год після їди <10 ммоль/л.
Таких значень показників достатньо, щоб рівень глікованого гемоглобіну перебував у цільових межах. Негативні наслідки декомпенсованого внаслідок гіпоглікемій ЦД добре відомі.
Компенсований ЦД – це стан рівноваги між гіперглікемією і ризиком розвитку або розвитком гіпоглікемічних станів. В останніх рекомендаціях додано два дуже важливих параметри: час у цільовому діапазоні (time in range, TIR) і час нижче цільового діапазону (time below range, TBR). Цільовий діапазон для більшості пацієнтів – 3,9-10 ммоль/л. TBR має бути дуже коротким – менш ніж 4%, тобто рівень глюкози в плазмі крові >10 ммоль/л – це краще для контролю ЦД, ніж тривалі затяжні гіпоглікемії.
Минулого року відбулася Нарада експертів із проблем гіпоглікемії і шляхів допомоги пацієнтам. Експерти визнали гіпоглікемію поширеною проблемою, з якою стикаються лікарі різних спеціальностей, якщо мають справу з хворими на ЦД.
Отже, група найбільшого ризику розвитку гіпоглікемії – це пацієнти:
- які застосовують похідні сульфонілсечовини (ПСС) та інсулін (особливо НПХ-інсулін);
- із тривалим стажем ЦД, в яких важче розпізнається гіпоглікемія;
- молодшого віку (діти), а також вагітні в першому триместрі вагітності;
- похилого віку з ускладненнями діабету чи супутніми захворюваннями (ниркова, печінкова і серцева недостатність, деменція);
- із високою варіативністю глікемії протягом доби.
Фактори ризику розвитку гіпоглікемії при ЦД:
- молодший вік хворих на ЦД 1 типу;
- перший триместр вагітності;
- похилий вік;
- наявність ниркової, печінкової або серцевої недостатності;
- тяжка гіпоглікемія в анамнезі, порушення розпізнавання гіпоглікемії;
- інтенсивний контроль глікемії, якщо пацієнт приймає ПСС та інсулін;
- висока варіативність глікемії.
Висока варіативність глікемії – це прогностичний фактор розвитку гіпоглікемії. Кожен лікар має пам’ятати, що рівень НbA1c не завжди може відображати реальну картину компенсації ЦД. Що вища варіативність, то вищий ризик розвитку тяжкої гіпоглікемії. Коли пацієнт не усвідомлює, що входить у гіпоглікемічний стан, і не встигає відреагувати на це, у нього розвивається тяжка гіпоглікемія, яка потребує сторонньої допомоги.
Варіативність глікемії натще є предиктором частої гіпоглікемії. Що вища варіативність глікемії, то вищий ризик розвитку гіпоглікемії в пацієнтів із ЦД 1 і 2 типу.
Наприклад, якщо в пацієнта одного ранку рівень глюкози в крові становить 5,0 ммоль/л, а наступного ранку – уже 17,0 ммоль/л, без суттєвих порушень дієти, це свідчить про те, що у хворого відбулося дуже різке зниження глікемії вночі. Як результат – організм починає боротися з наслідками різкого зниження рівня глюкози, тому зранку спостерігається високий її рівень.
Рівень НbA1c не надає повної інформації про якість контролю ЦД. Оскільки при середньому рівні глюкози (8,6 ммоль/л) або середньому рівні НbA1c (7,0%) хворі начебто компенсовані, але варіативність глікемії в таких пацієнтах може бути абсолютно різною (рис.).
Рис. Порівняння пацієнтів з однаковими середнім рівнем глюкози і рівнем HbA1c
Як можна побачити на рисунку, пацієнт А 24% часу перебуває в стані гіпоглікемії, тому для нього прогностично перебіг ЦД буде найгіршим, із розвитком і швидким прогресуванням когнітивної дисфункції у разі COVID‑19.
Отже вищезгаданою Нарадою експертів із метою зменшення ризику розвитку гіпоглікемії було рекомендовано:
- застосовувати в лікуванні ЦД сучасні ЦЗП, що асоціюються з нижчим ризиком розвитку гіпоглікемії: агоністи рецепторів глюкагоноподібного пептиду 1, інгібітори натрійзалежного ко-транспортера глюкози 2 типу, аналоги інсуліну швидкої (апарт, глюлізин, лізпро) і тривалої дії;
- сприяти ширшому залученню новітніх технологій (безперервний моніторинг рівня глюкози) для діагностики безсимптомних гіпоглікемій;
- під час аналізу даних безперервного моніторингу рівня глюкози приділяти більше уваги TBR.
Сьогодні вже неправильно вважати рівень HbA1c єдиним показником контролю ЦД, адже в майже 51% пацієнтів рівень HbA1c >7%. HbA1c не відображає перенесені епізоди гіпоглікемії або високу варіативність глікемії. Тобто ЦД у пацієнта з рівнем HbA1c 7% може бути некомпенсованим через гіпоглікемічні стани. Висока варіативність ГПН значно підвищує ризик розвитку гіпоглікемії, серцево-судинних катастроф і загальної смертності.
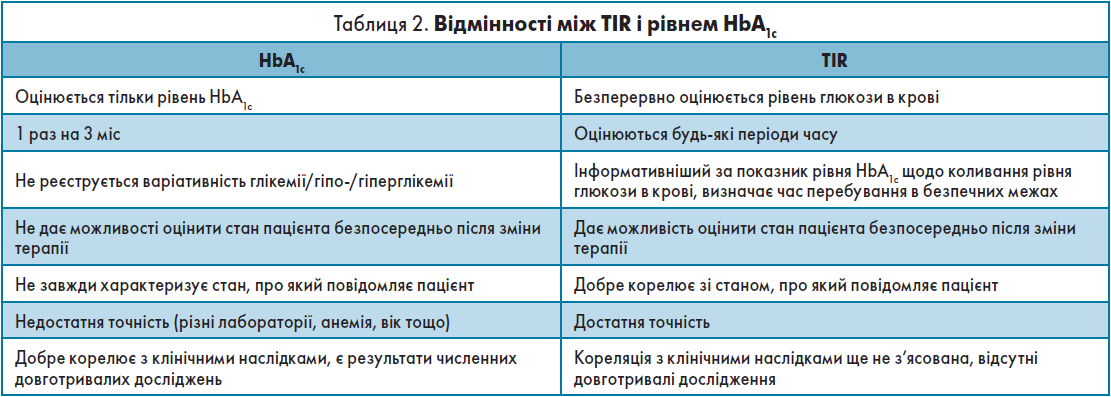
Саме тому в міжнародні консенсуси з контролю ЦД було додано показники TIR, відсотка часу, який пацієнт перебуває в межах цільової глікемії 3,9-10 ммоль/л. Наявні дані свідчать, що TIR обернено пропорційно корелює з ризиком розвитку судинних уражень у хворих на діабет. TIR можна використовувати як цільову точку в клінічних дослідженнях ЦД і як показник контролю глікемії в умовах рутинної клінічної практики. Перебування поза межами TIR супроводжується гіпо- або гіперглікемією (табл. 2).
TIR є інформативнішим показником, але його визначення потребує застосування прогресивніших методів визначення рівня глюкози в крові. Кореляція між TIR і СС та загальною смертністю, за даними CGM (Безперервного моніторингу глюкози – Continuous Glucose Monitoring, CGM): що кращий показник TIR, то нижчий рівень смертності. Якщо пацієнт із ЦД 70% часу перебуває в TIR і 10-20% – у стані гіпоглікемії, такий стан вважають задовільним. Дуже важливо звертати увагу на TIR у вагітних, у жінок із гестаційним діабетом для покращення перебігу вагітності і зменшення ускладнень.
Підсумовуючи вищесказане, спікер сформулювала декілька висновків. А саме, що:
- HbA1c є золотим стандартом контролю ЦД, а також показником його компенсації, прогнозу перебігу, виникнення мікро- і макроангіопатій, а також інших ускладнень, але він має певні обмеження.
- TIR забезпечує точнішими даними про глікемічний статус пацієнта і допомагає кращому контролю ЦД.
- Збільшення TIR сприяє зниженню ризику судинних ускладнень ЦД.
- Оновлені міжнародні керівництва з надання допомоги при діабеті і стандартизований рапорт CGM.
- Відтепер для оптимального контролю ЦД крім рівня HbA1c лікарі мають ураховувати і TIR.
Лікуванню ожиріння у світі сучасних міжнародних рекомендацій присвятила свій виступ завідувач кафедри ендокринології Львівського національного медичного університету ім. Данила Галицького, доктор медичних наук, професор Аліна Мечиславівна Урбанович.
На жаль, у світі кількість людей з ожирінням стрімко зростає, не стали виключенням Україна та інші європейські країни. Останніми роками все більш актуальною визначається проблема ожиріння у дітей і підлітків, і ми розуміємо, що згодом вони звернуться до лікаря з низкою захворювань. У переважній більшості випадків ключовою причиною розвитку ожиріння є неправильний спосіб життя. За допомогою опитувальника STEPS, розробленого для Всесвітньої організації охорони здоров’я (ВООЗ), було визначено, що в нашій країні в середньому на ожиріння страждає більше жінок, ніж чоловіків; приблизно 34,3% дорослого населення України мають надмірну вагу (ІМТ ≥25-<30 кг/м2) і приблизно 24,8% – ожиріння (ІМТ ≥30 кг/м2), із них 30% жінок і 20% чоловіків. У нашій країні ожиріння недостатньо діагностується, багатьма людьми і деякими лікарями не сприймається як хвороба.
Насправді ж із роками ожиріння стає серйозною недугою, і ми не можемо не звертати уваги на цю проблему. Фактично, лише приблизно в 40% осіб з ожирінням воно діагностовано, і менш ніж 20% отримують лікування.
В усьому світі ожиріння вважається хворобою і серйозною проблемою здоров’я, яку недооцінюють у молодому віці, але з кожним роком життя кожний зайвий кілограм загрожує проблемами зі здоров’ям.
Ожиріння аж ніяк не вкладається в поняття здоров’я, адже здоров’я – це стан повного фізичного, психічного і соціального благополуччя. При ожирінні спостерігають порушення регуляції апетиту, аномальний енергетичний баланс, який призводить до розвитку ендокринних порушень, безпліддя, швидкого прогресування неалкогольної жирової хвороби печінки (НАЖХП), дисліпідемії. У таких пацієнтів із роками значно зростає ризик розвитку ЦД 2 типу, серцево-судинних захворювань (ССЗ), онкопатології, швидко прогресує остеопороз і значно вища частота синдрому полікістозних яєчників. У багатьох пацієнтів розвиваються виражені депресивні стани. Майже в кожного 2-го хворого виявляють серйозні порушення функції суглобів, адже надлишкова вага – це додаткове навантаження, найперше на колінні суглоби.
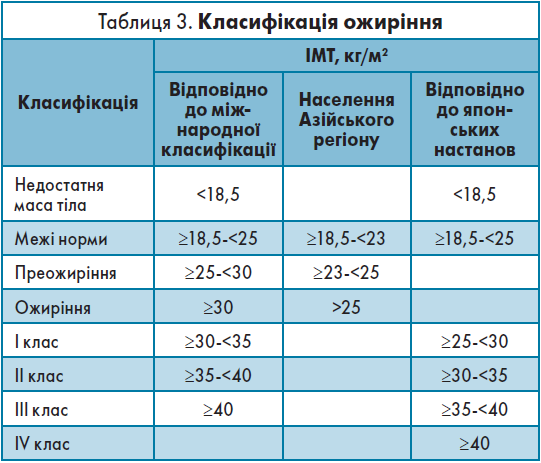
Ожиріння – це медичний стан, описаний як надмір маси тіла у формі відкладеного жиру, що може призвести до значного порушення здоров’я. На сьогодні ІМТ, який розраховують за формулою: маса тіла (кг) / зріст 2 (м2), є найзручнішим показником надмірної ваги й ожиріння на рівні популяції (табл. 3).
За останнє десятиріччя змінилися підходи лікарів і пацієнтів до цієї дуже серйозної проблеми. За результатами дослідження ACTION IO, проведеного у США, 68% осіб з ожирінням визнають, що це хвороба, і 88% лікарів згодні з цим.
Крім усвідомлення, що ожиріння є захворюванням, відбулися суттєві зміни в його діагностиці, лікуванні й веденні пацієнтів. До 2014 року всі авторитетні міжнародні клінічні настанови були орієнтовані на ІМТ, а з 2014 року всі сучасні рекомендації щодо лікування ожиріння орієнтовані на його ускладнення.
Отже, лікар, до якого звертається по допомогу пацієнт з ожирінням, має провести діагностику всіх супутніх патологій, які могли вже розвинутися. Згідно з результатами обстеження необхідно призначити відповідне комплексне лікування наявних патологічних станів, а також рекомендувати пацієнтові засоби для запобігання розвитку численних ускладнень. Серед останніх є:
Метаболічні
- Бронхіальна астма.
- НАЖХП.
- Жовчнокам’яна хвороба.
- Безпліддя через:
- субфертильність;
- гіпогонадизм (чол.);
- синдром полікістозних яєчників;
- ускладнення вагітності.
- Злоякісні новоутворення.
- ССЗ і фактори ризику:
- інсульт;
- дисліпідемія;
- артеріальна гіпертензія;
- ішемічна хвороба серця;
- коронарна хвороба серця;
- тромбоемболія легеневої артерії.
- ЦД 2 типу.
- Тромбоз.
- Подагра.
Механічні
- Нетримання сечі.
- Остеоартрит колінного суглоба.
- Апное уві сні.
- Хронічний біль у спині.
Психічні
- Депресія.
- Тривожність.
Зі збільшенням ІМТ зменшується тривалість життя. Якщо ІМТ <25 кг/м2, шанс дожити до 70 років становить майже 80%, якщо від 35 до 40 кг/м2 – 60%, а вже при ІМТ 40-50 кг/м2 цей шанс становить лише 50%. За статистичними даними, ожиріння скорочує життя, і водночас схуднення навіть на 5-10% сприяє:
- зменшенню ризику розвитку ЦД 2 типу;
- зменшенню СС смертності;
- покращенню ліпідного профілю крові;
- покращенню артеріального тиску;
- зменшенню тяжкості обструктивного апное уві сні;
- покращенню якості життя, пов’язаної зі здоров’ям.
Лікар має ставити перед пацієнтом реальні цілі щодо зниження ваги. Згідно з рекомендаціями на початковому етапі це 5-10% упродовж 6 міс, наступним етапом є стабілізація ваги. Навіть після таких незначних змін пацієнт розуміє, що він може контролювати масу свого тіла, свої харчові звички, і це допомагає йому почуватися краще і бути активнішим.
Основні етапи лікування ожиріння
- Корекція способу життя.
- Фармакотерапія.
- Хірургічне втручання.
На першому етапі проводиться активна робота з психологом, психіатром, дієтологом, ендокринологом, спрямована на формування й закріплення здорових харчових звичок. Усі міжнародні протоколи рекомендують для закріплення результату займатися певним видом спорту, наприклад йогою. Важливим є самоконтроль (ведення щоденників прийому їжі, підрахунок калоражу); управління стресом; регулярна фізична активність (ходьба); управління сном (робота з психологом, психіатром).
Для фармакотерапії ожиріння використовують:
- орлістат;
- ліраглутид у дозі 3,0 мг;
- фентермін/топірамат (спричинює залежність, заборонений у країнах Європи більш ніж 10 років тому);
- налтрексон/бупропіон.
Як засіб хірургічного втручання застосовують баріатричну хірургію.
Згідно зі згаданим дослідженням ACTION IO майже 80% осіб з ожирінням робили хоча б одну серйозну спробу схуднути, і лише 11% із них вдається зберегти ≥5% втрати маси тіла впродовж ≥1 року. На думку медиків, тільки 35% пацієнтів з ожирінням дійсно докладали зусиль для схуднення і в 30% ці зусилля мали успіх.
Ожиріння – серйозне хронічне захворювання, схильне до рецидиву і прогресування, воно пов’язане з багатьма супутніми захворюваннями і ускладненнями. Зменшення маси тіла може покращити перебіг захворювань, пов’язаних з ожирінням. Що більшою є втрата маси тіла, то значнішим є зниження ризику розвитку ускладнень цієї патології. Ожиріння потребує тривалого лікування.
Фармакотерапію рекомендується застосовувати в осіб з ІМТ ≥30 або ≥27 кг/м2 і супутнім захворюванням, пов’язаним із надлишковою вагою. Фармакотерапію потрібно застосовувати тривало не лише для продовження зменшення маси тіла, а й для підтримання досягнутого. Перший курс фармакотерапії має тривати не менше 3 міс, оскільки впродовж першого міс не завжди вдається досягти цілі.
Керівник відділу амбулаторно-профілактичної допомоги ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» (м. Київ), доктор медичних наук Валерія Леонідівна Орленко представила увазі учасників заходу декілька дуже цікавих лекцій, в одній з яких розповіла про роль мікробіому в розвитку ендокринних захворювань.
представила увазі учасників заходу декілька дуже цікавих лекцій, в одній з яких розповіла про роль мікробіому в розвитку ендокринних захворювань.
Мікробіотою називають сукупність усіх мікроорганізмів, які населяють тіло людини. Мікробіом – сукупність усіх генів цих мікроорганізмів. Сьогодні мікробіоту розглядають як метаболічно активний орган, а кишечнику приділяють особливу увагу, оскільки від гормонів, біологічно активних речовин, цитокінів, що секретуються в кишечнику, від стану мікробіоти залежить здоров’я людини.
У людському організмі налічується понад 10 тис видів бактерій. Так, на одну клітину припадає приблизно 10 бактерій, але вони настільки малі, що масова частка всіх мікроорганізмів становить приблизно від 1 до 3% маси тіла.
У геномі людини міститься 22 тис генів, що кодують білки для регуляції метаболізму. Мікробіом додає ще приблизно 8 млн унікальних бактеріальних генів. Саме за геномом ми можемо адекватно оцінити «профіль квартирантів» нашого кишечнику і те, як працює наша мікробіота.
Якщо порівнювати людську ДНК, то вона однакова майже в 99,99% світової популяції, але мікрофлори кишечнику це не стосується – тут збіг становить менше 10%. Немає якогось основного складу мікроорганізмів, які виконують певні функції, можуть траплятися різні поєднання бактерій. Склад мікробіоти людини залежить від регіону проживання, дієти і низки інших чинників.
Мікробіота кишечнику через деякий час пристосовується до того типу їжі, яку споживає людина. Під час перетравлення їжі мікроорганізмами виділяються метаболіти. Вони визначають стан здоров’я і можуть призводити до ендокринних порушень. У країнах із високим рівнем доходів, в яких раціон жителів багатий на білки і жири тваринного походження, у мікробіоті більше бактерій роду Bacteroides, а в мікробіоті мешканців економічно бідніших регіонів, де основою раціону здебільшого є рослинні продукти, багаті на складні вуглеводи, переважають види роду Prevotella.
Вирішальним у формуванні мікробіоти є дитячий вік. Фізіологічні пологи і грудне вигодовування забезпечують колонізацію організму дитини необхідними мікроорганізмами.
Основні функції мікробіоти: захисна, травна, імунна. У разі утворення великої кількості токсинів унаслідок життєдіяльності мікробіоти може розвиватися метаболічна ендотоксемія, коли токсин крізь епітеліальний кишковий бар’єр проникає в кров. Метаболічна ендотоксемія і токсини є надзвичайно важливими факторами активації імунної системи, які можуть провокувати або посилювати системне запалення, що виникло на тлі інших захворювань. Наявність у раціоні надто жирних страв, солодощів, здоби, рафінованих продуктів призводить до порушення мікрофлори кишечнику. Через деякий час, коли мікроорганізми пристосуються до жирної їжі, вони виділятимуть надзвичайно токсичні метаболіти, які транслокуватимуться в кров і тканини, що матиме негативні наслідки, зокрема у вигляді ендокринних захворювань.
Сигнали зі шлунково-кишкового тракту (ШКТ) здатні впливати на харчову поведінку, енергетичний гомеостаз і масу тіла. Backhed та співавт. у своєму досліджені довели, що кишкова мікробіота – одна з ключових причин набору ваги й розвитку ожиріння.
Сьогодні мікробіоту вважають одним із чинників розвитку метаболічного синдрому. Гіперглікемія, жирна їжа спричинюють підвищення рівня ліпополісахаридів, бактеріальних ліпополіпротеїнів, порушення цілісності епітеліальної стінки та метаболічної ендотоксемії. Це сприяє активації імунних клітин, Toll-подібних рецепторів (TLRs – Toll-like receptors), що призводить до розвитку серцево-судинних і інших ускладнень, а також до мутації клітин. Тому ожиріння на тлі порушень мікробіоти може бути фактором ризику розвитку онкологічних захворювань.
Важливо розуміти, що метаболіти, які синтезуються під час перетравлення мікроорганізмами їжі, формують нашу харчову поведінку. Зі ШКТ через нервові шляхи мозок отримує імпульси, які вказують, яку саме людина хоче вживати їжу: солодку, гостру, жирну тощо. При зміні складу мікробіоти харчові звички людини також змінюються. Метаболіти, що утворюються внаслідок життєдіяльності мікробіоти, впливають на синтез інкретинів та інших гормонів, у тому числі серотоніну.
Основні важливі для організму людини метаболіти, що утворюються внаслідок життєдіяльності мікробіоти:
- Коротколанцюгові жирні кислоти (КЛЖК) – стимулюють ліпогенез, глюкогенез, мають протизапальну дію.
- Жовчні кислоти (ЖК) (передусім вторинні) – активують рецептори TGRs, які призводять до підвищеного вивільнення енергії, унаслідок чого м’язи починають активно поглинати глюкозу. Це виявляє захисну дію від інсулінорезистентності (ІР).
- Ліпополісахариди – мають протизапальну дію.
Для того щоб утворювалися корисні метаболіти, особливо КЛЖК, пропіонат, бутират, ацетат, раціон має містити складні рослинні полісахариди. За нормальної кількості метаболітів синтезується достатня кількість енергетичного субстрату для клітин і органів, у тому числі м’язової тканини, серця, нирок, адекватно регулюється рівень рН, моторна і секреторна функції кишечнику.
КЛЖК здатні пригнічувати проліферацію пухлинних клітин, регулюють здатність лейкоцитів виробляти нормальну кількість прозапальних цитокінів і мігрувати у вогнище запалення, стимулюють синтез еукаріотичними клітинами муцинів і речовин з антимікробною активністю, а також є основним джерелом енергії для епітелію кишечнику, підтримують цілісність його бар’єра і сприяють регенерації пошкоджень.
КЛЖК хімусу:
- бутанова кислота – основне джерело енергії для кишкового епітелію, а метанова і пропанова кислоти – субстрати для глюконеогенезу і ліпогенезу в печінці;
- є сигнальними молекулами, які взаємодіють зі специфічними, пов’язаними з G-білком рецепторами GPR41(FFAR3) і GPR43(FFAR2);
- ацетат переважно активує рецептори FFAR2 in vitro: пропіонат з однаковою активністю зв’язується з рецепторами FFAR2 і FFAR3; а бутират переважно взаємодіє з рецепторами FFAR3;
- регулюють синтез інкретинів (їх низький рівень призводить до розвитку метаболічного синдрому, ЦД, кардіоваскулярних ускладнень, депресивних станів);
- зменшують проникність кишкової стінки, виявляють протизапальну дію.
ЖК:
- сигнальні молекули, що взаємодіють із різними внутрішньоклітинними і трансмембранними рецепторами – FXR (фарнезоїдний Х-рецептор), TGR5, із рецептором вітаміну D, конститутивним андростан-рецептором (CAR), прегнан Х-рецептором (PXR), мускариновим рецептором, сфінгозин‑1-фосфатним рецептором 2 (SIPR2). Призводять до активації:
- FXR – зниження експресії гена проглюкагону і синтезу глюкагоноподібного пептиду 1 (ГПП‑1) L-клітинами кишечнику і вплив на гомеостаз глюкози і чутливість тканини до інсуліну;
- TGR5 – потенціювання глюкозостимульованої секреції інсуліну шляхом активації механізму цАМФ/ПКА (цАМФ-залежна протеїнкіназа А), синтезу ДПП‑1 клітинами кишечнику або переключення альфа-клітин при гіперглікемії із синтезу глюкагону на синтез ДПП‑1 за рахунок активації прогормону конвертази‑1 (РС1).
Серед представників Firmicutes при ЦД 2 типу спостерігали зменшення частоти мутації генів, що кодують основні ферменти метаболізму ЖК, якщо порівняти з контрольною групою.
У разі ЦД 2 типу зменшується вміст бутират-продукувальних мікроорганізмів і збільшується число сульфат-продукувальних бактерій, які утилізують таурин.
Надзвичайно важливою є адекватна секреція інкретинів. Інкретини ГПП‑1, глюкозозалежний інсулінотропний поліпептид (ГІП), ГПП‑2, пептид тирозин-тирозин (ПТТ):
- бутират запобігав розвитку ожиріня та ІР в мишей на дієті з високим умістом жиру за рахунок стимуляції експресії Pgc‑1α;
- у мишей без FFAR3 пропіонат і бутират знижували апетит, стимулювали вироблення інкретинів, запобігаючи збільшенню маси тіла і розвитку ІР;
- другий механізм – стимуляція синтезу ГПП‑1 і ПТТ КЛЖК шляхом активації FFAR2;
- бутират безпосередньо активує експресію генів, задіяних у глюконеогенезі в клітинах кишечнику, за допомогою цАМФ-залежного механізму.
Бактерії кишечнику здатні впливати на вагу за таким механізмом:
- при переробці пребіотичних волокон бактерії виділяють КЛЖК, які посилають сигнал про те, що їжі достатньо, у відповідь на цей сигнал посилюється моторика ШКТ – їжа переміщається по ШКТ швидше, отже, часу для вилучення калорій менше;
- з іншого боку, якщо КЛЖК недостатньо, моторика ШКТ сповільнюється, оскільки тіло сигналізує: мало їжі, потрібно збільшити поглинання калорій.
Кишкові бактерії виробляють достатню кількість КЛЖК лише тоді, коли харчуються складними вуглеводами, зокрема пребіотичними волокнами. У такому разі моторика кишечнику посилюється, поглинання калорій зменшується. Коли організм отримує сигнал «Ми голодуємо!», травна система переходить у режим активного поглинання: робить усе можливе, щоб отримати якомога більше з їжі. Цей механізм – одна з фундаментальних причин ожиріння.
Мікробіота чинить вплив і на функцію щитоподібної залози (ЩЗ). Так, вона впливає на всмоктування йоду, який може бути токсичним для мікробіоти. Відомо, що в пацієнтів з аутоімунним тиреоїдитом (АІТ) відбуваються зміни складу мікробіоти. Синдром «негерметичної» кишки, спричинений бактеріальним запаленням, прямо корелює з АІТ. Мікробіота бере участь у рециркуляції естрогенів, а склад мікробіоти різний у чоловіків і жінок. Також встановлено, що фенотрансплантація призводить до регресу тиреоїдних захворювань у пацієнтів з ожирінням.
Деякі представники мікробіоти можуть зумовлювати накопичення йоду, що спричинює розвиток аутоімунних захворювань, АІТ і хвороби Грейвса. Тому патологія ЩЗ також потребує нормалізації складу мікробіоти. Порушення утворення вторинних ЖК призводитиме до порушення синтезу гормонів ЩЗ і розвитку її дисфункції.
Дисбактеріоз, порушення синтезу лептинів, збільшення вироблення гормонів, що посилюють апетит, – усі ці зміни можуть виникати при дисбіозі. Дисбіоз також може призводити до збільшення вироблення гормонів стресу: адреналіну і норадреналіну, що негативно впливає на наднирники. Тривалий дисбіоз здатен стати причиною імунологічних порушень і, як результат, розвитку аутоімунного процесу і ЦД 1 типу. При цьому показано, що ризик розвитку ЦД зростає з кожним курсом антибіотикотерапії (пеніциліни, цефалоспорини, макроліди, фторхінолони).
Кожному лікарю при призначенні будь-якої схеми лікування необхідно пам’ятати про захист мікробіоти від шкідливого впливу препаратів і нормалізацію її складу.
Необхідно рекомендувати пацієнту вживати пребіотики (харчові волокна) і пробіотики (живі мікроорганізми – лакто- або біфідобактерії). Пробіотики і пребіотики позитивно впливають на мікробіоту кишечнику і сприяють нормалізації синтезу інкретинів, інсуліну і зменшенню ІР. На мікробіоту кишечнику впливають також цукрознижувальні препарати (ЦЗП). Так, метформін через GPR впливає на L-клітини і стимулює вироблення інкретинів, сприяє зменшенню метаболічної ендотоксемії і кількості ліпополісахаридів.
Так, призначення лактобактерій сприяє:
- створенню захисного бар’єру на слизовій кишечнику;
- участі в пристінковому травленні та утилізації харчових часточок;
- участі в конкурентній адгезії з патогенними мікроорганізмами;
- активізації всмоктуванню вітаміну D, кальцію і заліза;
- синтезу амінокислот, білків, вітамінів К, В (B1, B2, B3, B6);
- стимуляції розмноження і підвищення активності імунних клітин (В- лімфоцитів, макрофагів, моноцитів), синтезу інтерферону;
- участі у видаленні токсинів (індол, скатол), зв’язуванні токсичних хімічних сполук, що мають канцерогенні властивості.
Призначення біфідобактерій чинить таку дію:
- метаболічну: продукти метаболізму (молочна кислота і перекис водню) закисляють середовище кишечнику, знижуючи рівень рH. Пригнічується життєдіяльність патогенних бактерій (протей, збудники гострих кишкових інфекцій);
- синтезувальну: синтез гуморальних факторів захисту – лізоциму і речовин з антибіотичною активністю – реутерину, антарицину, лактоцидину, лактоліну;
- імуномодулювальну: вплив на окремі зони лімфоїдної тканини, стимуляція яких посилює вроджені імунні реакції клітинного і гуморального імунітету як кишечнику, так і всього організму;
- протипухлинну: виділення речовин, які інгібують розвиток пухлинних клітин, стимуляція імунних клітин.
Таким чином, впливаючи на мікробіоту шляхом призначення як пробіотиків, так і пребіотиків, ми можемо досягти успіху в лікуванні і профілактиці екдокринної патології.
Підготувала Юлія Золотухіна