12 вересня, 2022
Менеджмент гіпотиреозу в дітей і підлітків: стратегія, основні проблеми і практичні аспекти їх вирішення
Гормони щитоподібної залози (ЩЗ) життєво необхідні для нормальної роботи людського організму. Вони беруть участь у забезпеченні клітин організму киснем і поживними речовинами, зокрема глюкозою, амінокислотами, вітамінами та мінералами, а також впливають на вуглеводний, білковий і жировий обмін.  Без тиреоїдних гормонів неможливий нормальний ріст і розвиток скелету і нервової системи, а також функціонування статевої та серцево-судинної систем, формування яких є особливо критичним у дитячому віці. Лікарі всіх спеціальностей, що працюють із маленькими пацієнтами, мають пам’ятати про проблему дитячого і підліткового гіпотиреозу (ГТ) та вибудувати ефективну стратегію ранньої діагностики й лікування патологічних станів ЩЗ в педіатричній популяції.
Без тиреоїдних гормонів неможливий нормальний ріст і розвиток скелету і нервової системи, а також функціонування статевої та серцево-судинної систем, формування яких є особливо критичним у дитячому віці. Лікарі всіх спеціальностей, що працюють із маленькими пацієнтами, мають пам’ятати про проблему дитячого і підліткового гіпотиреозу (ГТ) та вибудувати ефективну стратегію ранньої діагностики й лікування патологічних станів ЩЗ в педіатричній популяції.
Веденню ГТ в дітей і підлітків була присвячена доповідь провідного наукового співробітника Інституту ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України (м. Київ), кандидата медичних наук Юлії Валеріївни Булдигіної, представлена в рамках науково-практичної конференції «Ендокринні порушення у дітей: актуальні проблеми – конкретні рекомендації».
Гіпотиреоз у дитячому віці може бути як вродженим, так і набутим. Вроджений дефіцит гормонів ЩЗ, своєю чергою, буває первинним і вторинним, він спостерігається у 5-7% пацієнтів і зумовлений порушенням розвитку гіпоталамуса і/або гіпофіза. У 70-80% випадків первинний ГТ зумовлений генетичними порушеннями, що спричинюють дисгенез ЩЗ, а у 12-16% – порушення синтезу і секреції тиреоїдних гормонів.
Ураження ЩЗ, спричинене генетичними мутаціями, може призвести до:
- агенезії ЩЗ, тобто відсутності однієї з часток або перешийка ЩЗ;
- аплазії ЩЗ;
- ектопії ЩЗ, зумовленої порушенням міграції ембріонального зачатку в ході ембріогенезу. У такій ситуації ЩЗ може розташовуватися в будь-якому місці, але найчастіше спостерігається її сублінгвальна локалізація. При цьому вона визначається як чужорідне утворення біля основи язика.
Якщо вроджений ГТ спричинений дефектом біосинтезу тиреоїдних гормонів, дисгормоногенез може бути зумовлений:
- порушенням захоплення, органiфiкацiї, зв’язування йоду;
- зміною активності дейодиназ;
- аномаліями синтезу, накопичення і вивільнення тиреоїдних гормонів.
Час появи клінічних симптомів ГТ при тиреоїдному дисгормоногенезі також може варіювати, що призводить до пізньої діагностики на етапах розвитку ментальних дисфункцій, відставання в рості, іноді глухоти і затримки формування мовлення.
Ще однією причиною вродженого ГТ є резистентність до тиреоїдних гормонів. Периферичний ГТ – це рідкісний стан, що успадковується домінантно і супроводжується підйомом рівнів тироксину (Т4) і трийодтироніну (Т3) при незначно підвищеному або нормальному рівні тиреотропного гормону (ТТГ). Клінічні прояви цієї патології варіюють у широких межах і залежать від типу порушення транспортерів чи мембранних рецепторів тиреоїдних гормонів.
Розглядаючи етіологію вродженого ГТ, неможливо не згадати про деякі генетичні синдроми, у клінічній картині яких є симптоми ГТ, зокрема:
- синдром Пeндреда, для якого характерне поєднання ГТ, глухоти і зобу;
- синдром Бамфорта-Лазаруса, проявами якого є ГТ, розщеплення м’якого піднебіння і «гострі пасма» волосся;
- ектодермальну дисплазію, специфічними ознаками якої є гіпогідроз, ГТ і циліарна дискінезія;
- синдром Кохера-Дебера, який супроводжується м’язовою псевдогіпертрофією і ГТ;
- синдром Дауна.
Наслідком невчасної діагностики та лікування вродженого дефіциту гормонів ЩЗ є тяжкі системні ускладнення, крайнім проявом яких може стати тиреогенний кретинізм. Характерною ознакою вказаної патології є затримка росту і розумова відсталість, що іноді доходить до ідіотії. При зрості 90-110 см (тиреогенний нанізм) пацієнти мають украй непропорційну будову тіла, короткі кінцівки та велику голову. Шкіра при кретинізмі товста і груба, очі – маленькі, широко розставлені, косі, а перенісся – втиснуте. Окрім цього у хворих виявляють роздутий живіт і недорозвинені вторинні статеві ознаки. У тяжких випадках спостерігають мікседематозні набряки. Такі самі набряки виникають у 5% пацієнтів із хворобою Грейвса (ХГ), що потрібно враховувати під час діагностики.
Варто зауважити, що дефіцит гормонів ЩЗ у немовлят далеко не завжди має органічну природу, у деяких випадках він може бути транзиторним. Основними причинами такого стану є:
- йододефіцит у матері;
- прийом матір’ю певних медичних препаратів, зокрема йоду, літію, інтерферону та антитиреоїдних препаратів (наприклад, при ХГ);
- передача через плаценту плоду від матері блокуючих антитіл.
Транзиторний ГТ не потребує пожиттєвої терапії, як у разі справжнього вродженого ГТ, утім це не означає, що дитину взагалі не потрібно лікувати. Так, у більшості нелікованих дітей із вродженим транзиторним ГТ спостерігається запізніле формування рухових навичок, емоційних реакцій, компонентів пізнавальної діяльності на першому році життя. При цьому в дітей із найменш сприятливим перебігом захворювання найчастіше виявлялися ознаки загальної і парціальної ретардації, зниження або патологічне підвищення рухової активності та дефіцит уваги.
Виявлені відхилення у психомоторному розвитку дітей, які перенесли транзиторний ГТ, а також статистично значущий зв’язок між рівнем психічного розвитку і показниками функціональної активності ЩЗ, доводять доцільність застосування гормональної корекції при транзиторному ГТ. Усі діти, включені в дослідження, з тримісячного віку перебували під спостереженням і проходили курси відновного лікування (Ахмедова Ш.У., 2013).
Аби зрозуміти важливість ранньої діагностики та корекції дитячого ГТ, незалежно від його етіології, потрібно згадати особливості формування центральної нервової системи (ЦНС). У другій половині вагітності і в ранні строки неонатального періоду відбувається мiєлiнiзацiя нервових волокон. Цей процес формує ЦНС, асоціативні зв’язки і здатність до абстрактного мислення, яка і відрізняє людей від тварин.
У цей період внутрішньоутробного життя фетальна ЩЗ вже здатна синтезувати адекватну кількість тиреоїдних гормонів. Таким чином, процес мієлінізації відбувається під контролем власних гормонів плода. Дефіцит гормонів ЩЗ в разі вродженого ГТ призводить до порушень процесів мієлінізації. Однак завдяки тому що мієлінізація триває i в постнатальний період життя, своєчасне виявлення і лікування вродженого ГТ впродовж першого місяця після народження може повністю відновити процеси мiєлiнiзацiї. При недостатній настороженості можна змарнувати дорогоцінний час, що призведе до затримки нервово-психічного розвитку дитини і негативно позначиться на всьому майбутньому житті маленького пацієнта.
Причини набутого ГТ в дітей практично не відрізняються від таких у дорослих. Так, найчастішою причиною є тиреоїдити. Підгострий тиреоїдит у гіпотиреоїдній фазі в дітей спостерігається рідко. Ця патологія частіше виникає в підлітковому віці, після перенесеної вірусної інфекції, у тому числі COVID‑19. Автоімунний тиреоїдит (АІТ) також може починатися в дитячому віці. Однак із моменту появи перших антитиреоїдних антитіл до розвитку клінічної картини вираженого ГТ може минути від 3 до 8 років, тому діагноз часто встановлюють уже в дорослому віці.
До інших різновидів ГТ належать:
- післяопераційний ГТ;
- ятрогенний ГТ, зумовлений радіойодтерапією і/чи прийомом антитиреоїдних препаратів;
- ендемічний зоб.
Крім того, периферичний ГТ може розвиватися при надмірному вивільненні та активності дейодиназ 3-го типу із судинних пухлин, переважно гемангіом печінки. Інші пухлини, такі як астроцитома і гліобластома, можуть спричинити швидку деградацію Т3 і Т4 з клінікою ГТ.
Об’єктивні клінічні прояви і симптоми набутого ГТ в дітей залежать від ступеня виразності і тривалості перебігу основного захворювання і зазвичай мають стертий і малоспецифічний характер. Найтиповішим проявом є уповільнення лінійного росту, яке супроводжується відносним набором ваги і появою округлості форм. При цьому здатність до навчання виражено не страждає, але сповільнюється темп розумових процесів і швидкість виконуваної роботи.
Особливості та типові помилки при діагностиці вродженого і набутого ГТ в дітей
В Україні, як і в більшості країн світу, проводять обов’язковий неонатальний скринінг на вроджений ГТ. Метою дослідження є визначення рівня ТТГ в «сухій краплі».
Аналіз крові на рівень ТТГ проводять на 3-тю добу життя дитини. Такі строки зумовлені особливостями секреції тиреоїдних гормонів у перинатальному періоді. В утробі матері дитина перебуває в сприятливому середовищі, де панує відносно стала температура. Під час пологів, для того щоб допомогти новонародженому адаптуватися в новому світі, відбувається викид значної кількості тиреоїдних гормонів. Після 3-ї доби життя цей рівень падає, що дає можливість виміряти справжній рівень ТТГ. Залежно від рівня ТТГ обирають подальшу стратегію ведення пацієнта (табл. 1).
Особливої уваги потребує ситуація, коли мiнiмально підвищений рівень ТТГ супроводжується неадекватно низькою концентрацією Т4. У такому разі є підстави підозрювати центральний характер ГТ (Lania А., Persani L., 2008).
Неонатальний скринінг допомагає запобігти розвитку розумової недостатності дитини та вчасно провести низку терапевтичних заходів для забезпечення потенційно нормального рівня інтелекту в більшості випадків вродженого ГТ. Утім навіть при застосуванні сучасних скринінгових програм вроджений ГТ можна пропустити. Можливими причинами цього є:
- рання виписка;
- лабораторна помилка;
- неправильний забір крові;
- тяжке захворювання в новонародженого;
- недоношеність;
- низька маса при народженні;
- переведення в іншу лікарню чи зміна місця проживання.
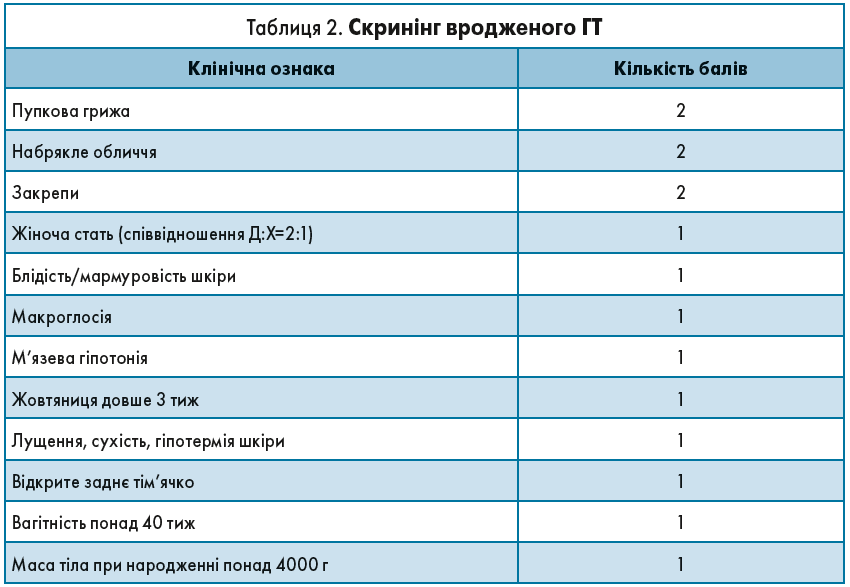
Саме тому завжди варто звертати увагу на клінічні прояви ГТ. Неонатолог, педіатр і сімейний лікар – перші спеціалісти, які зустрічають новонароджену дитину в новому світі, і саме вони можуть запідозрити дефіцит тиреоїдних гормонів ще в перші дні життя немовля. Для полегшення цієї задачі розроблено спеціальний опитувальник (табл. 2). При сумі балів ≥5 є підстави запідозрити вроджений ГТ і провести додаткові обстеження, зокрема визначення рівнів ТТГ і вільного Т4.
Якщо говорити про діагностику набутого ГТ, то крім визначення рівня тиреоїдних гормонів в арсеналі лікаря мають бути допоміжні обстеження. Так, для визначення етіології захворювання суттєве значення мають дані УЗД, які дають можливість оцінити ехогенність і васкуляризацiю тиреоїдної тканини, наявність кіст.
У разі йододефіциту залоза зазвичай збільшена в розмірі, але її структура й ехогенність страждають незначно. У разі АІТ найчастіше спостерігають гіпертрофію та лімфоїдну інфільтрацію ЩЗ, що відрізняє АІТ у дітей від такого в дорослих, для якого характернішою є атрофія залози. При виявленні специфічних ознак визначають антитіла до тиреопероксидази і/або тиреоглобуліну. Їх високі титри свідчать на користь AIT.
Вивчення індивідуальних кривих росту також дає додаткову інформацію щодо тяжкості захворювання і часу його маніфестації. Визначення кісткового віку є ще одним діагностичним інструментом, який використовують у разі тривалого і тяжкого ГТ.
Лікування ГТ в дітей і підлітків: цілі, дози і моніторинг ефективності
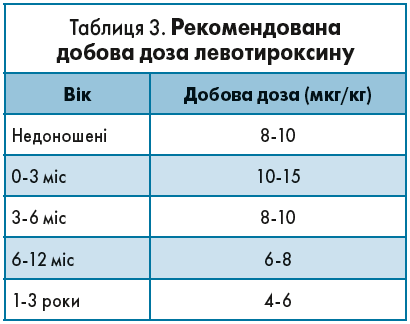
Своєчасно розпочата терапія тиреоїдними препаратами – вирішальний фактор нормального фізичного і психічного розвитку немовля. Саме тому лікування вродженого ГТ необхідно починати віддразу після встановлення діагнозу. Рекомендовані добові дози левотироксину відображені в таблиці 3.
Основним критерієм ефективності замісної терапії препаратами L-тироксину при лікуванні первинного ГТ є тільки рівень ТТГ, оптимальний рівень якого при лікуванні становить 0,5-2,0 мОд/л (референтні значення для здорових осіб – 0,4-4,0 мОд/л).
Лікування ГТ регламентується двома основними документами:
- Настановою з лікування гіпотиреозу Американської тиреоїдної асоціації із замісної терапії тиреоїдними гормонами (Jonkaas J. et al., 2014);
- Європейською настановою NICE «Захворювання щитоподібної залози: оцінка та менеджмент» (NICE, 2019).
Саме останніми рекомендаціями найчастіше користуються при лікуванні дитячого ГТ в нашій країні. Згідно з настановою NICE гормонозамісну терапію потрібно розпочинати в усіх випадках явного ГТ, а також у разі субклінічного ГТ, якщо:
- рівень ТТГ у дітей віком від 28 днів до 2 років становить ≥10 мОд/л;
- рівень ТТГ у дітей віком від 2 років становить ≥20 мОд/л, або
- рівень ТТГ від 10 до 20 мОд/л двічі з інтервалом в 3 міс, або
- рівень ТТГ від 5 до 10 мОд/л двічі з інтервалом в 3 міс, і
- дисгенезiя ЩЗ (недорозвинена ЩЗ) або ознаки чи симптоми дисфункції Щ3.
Треба пам’ятати, що субклінічний ГТ у дітей може бути зумовлений діенцефальним синдромом, тому обов’язково потрібно визначити його причини.
Обсяг і частота обстежень при моніторингу ефективності замісної терапії препаратами L-тироксину згідно з настановою NICE відображені в таблиці 4.
У разі нелікованого субклінічного ГТ (рівень ТТГ нижче 10 мОд/л), а також у дітей, які припинили лікування, рекомендується визначати рівень ТТГ і вільного T4:
- кожні 1-3 мiс в дітей віком від 28 днів до 2 років;
- кожні 3-6 міс у дітей віком від 2 років, якщо в них є ознаки, що вказують на основне захворювання ЩЗ, такі як дисгенезія ЩЗ (недорозвинена ЩЗ) або підвищений рівень автоантитіл ЩЗ;
- кожні 6-12 міс у дітей віком від 2 років, якщо вони не мають ознак, що свідчать про основне захворювання ЩЗ.
У дітей і молодих людей, в яких рівень ТТГ стабілізувався (2 подібні вимірювання в межах референтного діапазону з інтервалом від 3 до 6 міс) і немає ознак основного захворювання Щ3, можна розглянути можливість припинення визначення вмісту ТТГ і вільного T4.
Під час лікування тиреоїдної патології не треба забувати і про профілактику йододефіциту. У нашій країні відсутня масова профілактика йододефіциту, тобто використання йодованої солі. Здорова доросла людина, яка вживає 5-6 г йодованої солі на добу, отримує з нею 150 мкг йоду і не потребує додаткового призначення добавок йоду. Діти, підлітки, вагітні та жінки, які годують, потребують 250 мкг йоду на добу. Тобто при вживанні йодованої солі їм необхідно додатково приймати 100 мкг йоду на добу, а при використанні звичайної солі – 250 мкг йоду на добу у вигляді добавок.
Можливі причини неефективності замісної терапії при ГТ в дітей
Вагомою ознакою, що відрізняє ведення дітей із ГТ від дорослих, є залежність пацієнтів від їхніх батьків. Відповідно, необхідною умовою досягнення комплаєнсу й успіху лікування є консультування батьків із питань етіології вродженого ГТ, елементів тиреоїдної фізіології та прогнозу захворювання на тлі використання і відсутності замісної терапії.
Ще однією запорукою успішної терапії є правильні умови зберігання таблеток левотироксину. Так, у дослідженні S. Benvenga та співавт. пацієнти, направлені до трьох італійських амбулаторних ендокринологічних клінік із рефрактерним ГТ, досліджувалися на предмет впливу на таблетки левотироксину вологи, світла та високої температури (Benvenga S. et al., 2017).
Виявилося, що деякі пацієнти порушували рекомендовані умови зберігання таблеток. В одного пацієнта вони зберігалися в прозорому склі, на тумбочці під абажуром і зазнавали впливу світла та високої температури, в іншого – у прозорій скляній ємності, у кухонній кімнаті, біля вікна (світло), а в третього – у прозорому скляному флакончику, який стояв на тумбочці поблизу опалювального приладу та світла.
Пацієнтам порадили не застосовувати таблетки L-тироксину, що зазнали впливу джерел тепла, світла і/або вологості, і придбати нові упаковки L-тироксину в тій самій аптеці й зберігати їх в оригінальних упаковках, подалі від зазначених вище факторів. Дотримання умов зберігання L-тироксину сприяло нормалізації рівня ТТГ: медіана рівня ТТГ знизилася з 9,45 (10,16±4,87) до 3,0 (2,87±1,83).
Вплив сонячного світла на стабільність L-тироксину вивчали в ще одному дослідженні (Siham A., 2016). Було встановлено, що при зберіганні під прямими сонячними променями впродовж 10 днів таблетки втрачають майже 40% діючої речовини. Це вкотре підтверджує важливість дотримання правильних умов зберігання таблеток L-тироксину.
Проте стабільність дози L-тироксину залежить не лише від умов зберігання, але й від особливостей виготовлення і пакування таблеток, зокрема від:
- наявності світлозахисного блістера, що захищає діючу речовину від розпаду під дією світла;
- використання технології SNAP-TAB, що забезпечує поділ таблетки на стабільно рівні дози;
- відсутності лактози, що захищає L-тироксин від утворення неактивних комплексів із нею.
Усіх цих вимог дотримуються при виробництві таблеток L-тироксину від фармацевтичної компанії БЕРЛІН-ХЕМІ АГ. Використання сучасних технологій і відповідність виробництва правилам належної виробничої практики (GMP) забезпечують високу якість і стабільність таблеток L-ТИРОКСИН БЕРЛІН-ХЕМІ, що підтверджується тривалим успішним досвідом їх використання в умовах реальної клінічної практики.
Отже, прогноз при вродженому ГТ напряму залежить від вчасного призначення замісного лікування. Його відсутність призводить до тяжкої неврологічної iнвалiдностi, розумової відсталості, слухової дисфункції та спастичної диплегії. Замісна терапія, розпочата до віку 3-4 тиж, забезпечує нормальний розумовий і фізичний розвиток, однак навіть у разі своєчасно розпочатого лікування 10% немовлят мають довгострокові проблеми: незначний пізнавальний дефіцит, обмеження зорово-просторових уявлень, уваги і пам’яті.
Для максимальної ефективності замісної терапії лікар має забезпечити прихильність маленького пацієнта до лікування. Призначаючи таблетки L-тироксину, при виробництві яких використовують належні технології для підтримання стабільності діючої речовини (світлозахисний блістер, технологія SNAP-TAB, відсутність лактози), потрібно налагодити адекватну комунікацію з батьками хворої дитини і наголосити на важливості дотримання правильних умов зберігання таблеток.
Підготувала Ганна Кирпач
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 3 (59) 2022 р.