2 жовтня, 2020
Корекція моторики як наріжний камінь лікування функціональних розладів гастродуоденальної зони
 Функціональні захворювання верхніх відділів шлунково-кишкового тракту (ШКТ) становлять значну частину повсякденної практики лікаря-гастроентеролога. Основними мішенями терапевтичного впливу при цих станах є шлункова секреція, моторика езофагогастродуоденальної зони та вісцеральна чутливість, причому всі зазначені чинники часто пов’язані, оскільки є безпосередніми наслідками певних змін нервової регуляції функціонування ШКТ. Надзвичайно актуальними для клінічної практики є питання корекції моторно-евакуаторної функції ШКТ за різноманітних станів як функціонального, так і органічного походження. В арсеналі гастроентеролога на сьогодні є група препаратів-прокінетиків, до яких попри об’ємну доказову базу та тривалий досвід застосування досі виникає чимало запитань. Основними показаннями до застосування прокінетиків є порушення моторної функції верхніх відділів ШКТ, до яких насамперед належать функціональна диспепсія (ФД) і гастроезофагеальна рефлюксна хвороба (ГЕРХ).
Функціональні захворювання верхніх відділів шлунково-кишкового тракту (ШКТ) становлять значну частину повсякденної практики лікаря-гастроентеролога. Основними мішенями терапевтичного впливу при цих станах є шлункова секреція, моторика езофагогастродуоденальної зони та вісцеральна чутливість, причому всі зазначені чинники часто пов’язані, оскільки є безпосередніми наслідками певних змін нервової регуляції функціонування ШКТ. Надзвичайно актуальними для клінічної практики є питання корекції моторно-евакуаторної функції ШКТ за різноманітних станів як функціонального, так і органічного походження. В арсеналі гастроентеролога на сьогодні є група препаратів-прокінетиків, до яких попри об’ємну доказову базу та тривалий досвід застосування досі виникає чимало запитань. Основними показаннями до застосування прокінетиків є порушення моторної функції верхніх відділів ШКТ, до яких насамперед належать функціональна диспепсія (ФД) і гастроезофагеальна рефлюксна хвороба (ГЕРХ).
Як відомо, головною причиною розвитку функціональних шлунково-кишкових порушень є функціональна диссинергія осі «кишечник – мозок», в основі котрої закладена двобічна нейрогуморальна взаємодія між ШКТ і мозком. Іншими словами, органи ШКТ і мозок – це єдиний механізм, який має спільні медіатори та рецептори до них, тому лікування функціональних гастроінтестинальних порушень має бути комплексним і включати вплив як на периферичні (ШКТ), так і на центральні структури (центральна нервова система). Згідно з останніми рекомендаціями Американської асоціації гастроентерологів, лікування пацієнтів із функціональними шлунково-кишковими порушеннями, а саме з ФД є покроковим. До першої лінії терапії (залежно від типу ФД) належить призначення прокінетиків або інгібіторів протонної помпи. У разі їх неефективності як другу лінію лікування призначають антидепресанти. За відсутності ефекту від вищезазначених стратегій лікування розглядається питання щодо індивідуальної психотерапії (консультація психотерапевта) [1].
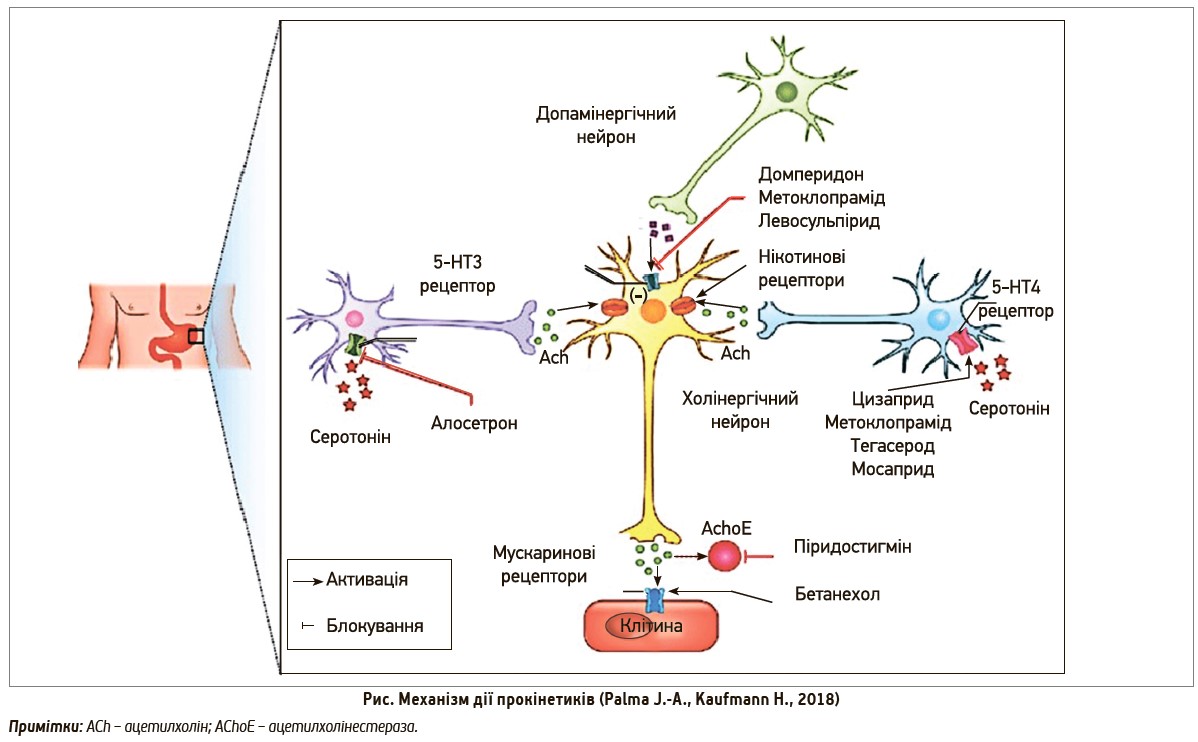
Прокінетики – це група препаратів, основна дія котрих полягає в стимулюванні пропульсивного механізму верхніх відділів ШКТ і прискоренні евакуації хімусу. Це досягається шляхом їх взаємодії з різними рецепторами холінергічних мотонейронів, які, передаючи імпульс, сприяють скороченню клітин непосмугованої мускулатури. У зв’язку з цим прокінетики за механізмом дії поділяють на такі групи:
1. Блокатори допамінових рецепторів:
- неселективні (метоклопрамід);
- селективні 1-го покоління (домперидон);
- селективні 2-го покоління (ітоприд).
2. Агоністи 5-НТ4-рецепторів (тегасерод, мосаприд).
3. Агоністи 5-НТ3-рецепторів (ондансетрон, тропісетрон, алосетрон, силансетрон).
4. Агоністи холінергічних рецепторів (бетанехол, піридостигмін).
Механізм дії прокінетиків наведено на рисунку.
Незважаючи на великий арсенал препаратів, які існують на фармакологічному ринку, питання щодо їх безпечності й ефективності залишається актуальним. «Класикою» серед прокінетиків уже став метоклопрамід – препарат, який є антагоністом допамінових рецепторів і на сьогодні майже винятково призначається як протинудотний та антиеметичний засіб. Однак, попри свою ефективність, метоклопрамід має низку побічних дій, які обмежують його довготривале використання. До найчастіших його побічних ефектів належать неврологічні порушення, в т. ч. поява екстрапірамідної симптоматики, явищ паркінсонізму: гіперкінезів і м’язової ригідності, можливі також спастична кривошия, опістотонус, м’язовий гіпертонус. Його використання сьогодні обмежується саме через ризик цих та інших небажаних ефектів [2].
Селективний прокінетик 1-го покоління домперидон, на жаль, також не позбавлений небажаних явищ, хоча і вважався певний час безпечнішим за свого попередника. Найбільш значущими для домперидону є побічні явища з боку серцево-судинної системи: набряк, відчуття прискореного серцебиття, порушення частоти та ритму серцевих скорочень, подовження інтервалу QT (частота невідома), серйозні шлункові аритмії, шлуночкові аритмії на кшталт torsade de pointes, раптова серцева смерть. Окрім того, метоклопрамід і домперидон підвищують рівень сироваткового пролактину та спричиняють розвиток гінекомастії й галактореї [3].
У вітчизняній практичній гастроентерології теж уже стало «класикою» призначення атипових антипсихотичних засобів, як-от сульпірид, який має схожий до метоклопраміду антидопаміновий механізм дії на ШКТ, але цей препарат залишається в другій лінії лікування функціональних розладів разом з іншими психотропними засобами. Його наступник – левосульпірид, за даними досліджень, продемонстрував вплив на прискорення спорожнення шлунка та на зменшення вісцеральної гіперчутливості, котра, як відомо, є основним компонентом ФД [4-6, 11]. Окрім того, завдяки антагоністичному впливу на допамінові рецептори в головному мозку левосульпірид довів свою антипсихотичну дію [7]. Попри те, що левосульпірид є антагоністом допамінових рецепторів, побічні ефекти у вигляді екстрапірамідної симптоматики в нього виражені менше, ніж у метоклопраміду [7]. Завдяки цьому левосульпірид може розглядатись як препарат для лікування ФД із переважанням постпрандіального дистрес-синдрому. Проте левосульпіриду (як і його аналогам) властиві побічні дії у вигляді підвищення апетиту, збільшення маси тіла та гіперпролактинемії [7].
До блокаторів допамінових рецепторів також належить ітоприду гідрохлорид. Одним із представників цього препарату в Україні є Ітоприд Ксантіс, вироблений у Словаччині за всіма європейськими стандартами якості. Препарат, окрім селективного впливу на D2-рецептори допаміну, пригнічує ацетилхоліностеразу, збільшує концентрацію ацетилхоліну в синаптичній щілині та знімає його інгібіторний ефект. Це, своєю чергою, підвищує тонус нижнього стравохідного сфінктера, посилює моторику шлунка, прискорює евакуацію хімусу з нього та покращує гастродуоденальну координацію [8]. Подвійний механізм дії, зокрема наявність антихолінестеразної активності ітоприду, робить його прокінетичний ефект потужнішим, водночас дає змогу певною мірою отримати стимулювальний вплив на моторику кишечнику, а також жовчовивідних шляхів, розширивши можливості нормалізувати тонус і рухову активність ШКТ при функціональних захворюваннях за рахунок комплексного впливу на моторику. Для лікарів – прибічників застосування антипсихотиків при ФД цікавою й корисною є така інформація: при дослідженні ефекту ітоприду та левосульпіриду було з’ясовано, що обидва препарати мають однаковий ефект у покращенні симптоматики ФД, клінічно й біохімічно чудово переносяться пацієнтами та мінімально впливають на серцево-судинну систему [9]. Крім того, при порівнянні з плацебо й іншими прокінетиками, як-от домперидон і мосаприд, ітоприд довів свою ефективність у зменшенні постпрандіального переповнення та раннього насичення в пацієнтів із ФД [10]. До показань для призначення ітоприду належить і ГЕРХ; тут також є дискусійні моменти: монотерапія не є ефективною, а позитивні сторони препарату потрібно використовувати, але коли та як?
Питання недостатньої ефективності монотерапії ГЕРХ прокінетиками було порушено у 2002 р., проте як допоміжні агенти та засоби профілактики ранніх рецидивів вони й досі успішно використовуються [12]. Зокрема, 10-денний курс лікування ітоприду гідрохлоридом можна використовувати після завершення 8-тижневого курсу лікування рефлюкс-езофагіту, враховуючи ймовірність раннього рецидиву ГЕРХ у період рикошетної гіперсекреції після відміни інгібіторів протонної помпи. У цьому випадку застосування препарату з антирефлюксним механізмом дії (але не кислотоінгібувальним) дає змогу зменшити ймовірність раннього рецидиву симптоматики ГЕРХ [13].
У дослідженні E. Scarpellini та співавт. (2011) було підтверджено, що ітоприд знижував частоту спонтанної релаксації нижнього стравохідного сфінктера без суттєвого впливу на перистальтику стравоходу та тиск у нижньому стравохідному сфінктері [14].
До групи агоністів 5-НТ4-рецепторів також належить мосаприд; результати досліджень підтверджують його вплив на покращення симптоматики ГЕРХ. Окрім того, прийом мосаприду не спричиняє подовження інтервалу QT. Однак під час досліджень мосаприд не довів свою перевагу над плацебо в пацієнтів із ФД [15].
Відносно новим і потенційно ефективним вважається акотіамід, який є мускариновим антагоністом та інгібітором холіностерази. Так, подвійні сліпі мультицентрові дослідження продемонстрували позитивний вплив акотіаміду на зменшення симптомів раннього насичення та постпрандіального наповнення в пацієнтів із ФД [16]. Окрім того, комбінація акотіаміду з езомепразолом у дослідженнях сприяла швидкій регресії симптомів ФД, аніж монотерапія езомепразолом [17].
Що стосується другої лінії терапії (тобто призначення антидепресантів, коли ефективність прокінетиків є недостатньою для корекції симптомів ФД), то в цьому випадку використовується фактично емпіричний підбір препарату з переліку рекомендованих, а їхній ефект також складається зі впливу на вісцеральну чутливість і корекцію моторики (крім основних ефектів: антидепресивного та протитривожного) [1, 18]. У цьому разі допоможе призначення антидепресантів, які за механізмом дії поділяють на такі групи [19]:
- трициклічні антидепресанти (амітриптилін, іміпрамін, дезипрамін, нортриптилін);
- інгібітори зворотного захоплення серотоніну –ІЗЗС (циталопрам, есциталопрам, пароксетин, флуоксетин, сертралін);
- інгібітори зворотного захоплення серотоніну та норадреналіну – ІЗЗСН (дулоксетин);
- норадренергічні та серотонінергічні антидепресанти – НСА (міртазапін, тразодон);
- група азапіронів (буспірон, тандоспірон);
- атипові антидепресанти (левосульпірид, сульпірид).
Однією з найбільш вивчених груп антидепресантів є трициклічні антидепресанти з класичним представником амітриптиліном, який має найпотужніший аналгетичний ефект порівняно з іншими групами та може бути використаний як препарат вибору при ФД, якщо переважає епігастральний больовий синдром [19]. Окрім того, амітриптилін уповільнює перистальтику та є ефективним у пацієнтів із синдромом подразненого кишечнику (СПК) із діареєю. До його основних побічних дій належать сонливість, закрепи, збільшення маси тіла й аритмії [19].
За умови переважання в пацієнтів із ФД постпрандіального дистрес-синдрому, а також СПК із закрепами препаратами вибору є ІЗЗС. Класичним представником цієї групи вважається циталопрам або есциталопрам, механізм дії яких полягає в прискоренні пропульсивної моторики шлунка та кишечнику. Крім того, препарати доцільно призначати за наявності в пацієнта ознак тривожності, фобій чи обсесивно-компульсивних розладів. Серед основних побічних дій цієї групи виокремлюють збудження, діарею, втрату ваги та сексуальну дисфункцію [19]. Схожі властивості характерні також для препаратів групи азапіронів – часткових пре- та постсинаптичних агоністів рецепторів 5-НТ1. Препарати цієї групи сприяють скороченню м’язів стравоходу, а також збільшують шлункову акомодацію в пацієнтів із ФД. У зв’язку з цим основними показаннями до їх призначення є ФД із переважанням постпрандіального дистрес-синдрому, для котрого характерні такі симптоми, як раннє насичення, переповнення, нудота [19, 20].
Схожу дію при порівнянні з трициклічними антидепресантами мають ІЗЗСН. Представником цієї групи є дулоксетин, який пригнічує шлункову та кишкову моторику й частково зменшує вісцеральну гіперчутливість [19, 21]. Основними показаннями до застосування є лікування хронічного больового синдрому, що превалює в пацієнтів із функціональними порушеннями травної системи. Проте препарати групи ІЗЗСН мають менш виражену дію (порівняно з трициклічними антидепресантами) й потребують подальших досліджень [19].
Дані стосовно впливу препаратів групи НСА на моторику та чутливість ШКТ суперечливі [20]. Так, за даними досліджень, прийом міансерину чи міртазепіну не впливав на швидкість шлункової евакуації та на шлункову акомодацію. Крім того, ці препарати не підтвердили свою ефективність у зниженні вісцеральної гіперчутливості. Проте, враховуючи антагоністичні властивості щодо рецепторів 5-НТ3, виникають «сприятливі» побічні дії, що полягають у зменшенні нудоти, больового синдрому та діареї. Прийом препаратів групи НСА асоціюється з підвищенням апетиту та збільшенням маси тіла [4, 19].
Висновки
Корекція моторно-евакуаторної функції ШКТ у практиці гастроентеролога часто стає (певною мірою) творчим процесом, коли це стосується такої багатогранної проблеми, як функціональні захворювання. На сьогодні ми маємо досить чіткі позиції щодо першої та другої лінії терапії ФД. Зокрема, прокінетики залишаються пріоритетом у разі постпрандіального дистрес-синдрому (так само, як інгібітори протонної помпи – при епігастральному больовому синдромі). З формального погляду це досить зручно, оскільки так ми не виходимо за рамки своєї гастроентерологічної компетенції. Щодо другої лінії лікування функціональних захворювань, то тут ми фактично використовуємо «сприятливі» побічні дії антидепресантів, анксіолітиків, нейролептиків, а це дуже вдале (на нашу думку) визначення впливу психотропних препаратів на ШКТ взагалі. Проте той факт, що існують дані (як було зазначено вище) стосовно зіставної ефективності ітоприду й атипових нейролептиків, певною мірою полегшує нам вибір у призначенні саме цього препарату, оскільки в цьому випадку (хоча, можливо, й тимчасово) ми позбавлені подеколи складної необхідності пояснювати пацієнту призначення психотропного препарату. Здобутий за час спілкування з пацієнтом і під час комунікації протягом курсу першої лінії лікування комплаєнс успішно можна та потрібно використати для переадресації пацієнта до психіатра, якщо ми вбачаємо т. зв. психосоматичний компонент провідним у генезі функціональних порушень ШКТ. Ще один важливий аспект – застосування якісного препарату. В такому випадку перехід до другої лінії лікування стає обґрунтованішим, оскільки в нас не має виникати сумніву в номінальному ефекті препарату. В цьому контексті нами був згаданий Ітоприд Ксантіс як приклад доступного за ціною ефективного препарату європейського виробництва з дотриманням усіх аспектів контролю якості. До речі, у своїй практиці ми завжди маємо враховувати, що придбання пацієнтом за власні кошти різних препаратів протягом тривалого часу – це додатковий момент, який спричиняє фрустрацію, як і велика кількість таблеток, які приймаються одночасно, особливо коли ефект такої терапії недостатньо повний. Саме тому має право на життя такий принцип: намагатися досягти ефекту за допомогою мінімальної кількості ліків протягом найменш тривалого з рекомендованих курсів; вартість лікування також має бути мінімальною.
Звісно, ми не можемо забувати, що до першої лінії терапії належить також нормалізація пацієнтом режиму сну, харчування, фізичної активності та формування «здорового» психологічного сприйняття пацієнтом своїх шлунково-кишкових симптомів шляхом нашого роз’яснення їх походження та зменшення акцентуації пацієнта на них. Зрозуміло, що порушення моторики при таких захворюваннях, як ГЕРХ і ФД, первинно розвивається не від того, що пацієнт не приймає прокінетиків. Курс лікування, зокрема ітопридом, може стати свого роду «милицями» для верхніх відділів ШКТ доти, доки подіє весь комплекс наших терапевтичних заходів. Саме тому прокінетична терапія є, на нашу думку, наріжним каменем фармакологічного впливу на моторику ШКТ при його функціональних захворюваннях.
Література
1. Moayyedi P., Lacy B., Andrews C. et al. ACG and CAG Clinical Guideline: Management of Dyspepsia. Am. J. of Gastroenterology. July 2017. Vol. 112. Iss. 7: p. 988-1013. doi: 10.1038/ajg.2017.154.
2. Van Zanten A.R., van der Meer Y.G., Venhuizen W.A. et al. Still a place for metoclopramide as a prokinetic drug in critically ill patients? J. Parenter. Enteral. Nutr. 2015; 39: 63-766. doi: 10.1177/0148607114567711.
3. Quigley M. Prokinetics in the management of functional gastrointestinal disorders. J. Neurogastroenterol. Motil. 2015 Jul; 21 (3): 330-336. doi: 10.5056/jnm15094.
4. Stahl S.M. Essential psychopharmacology: neuroscientific basis and practical applications. New York: Cambridge University Press, 2008.
5. Lozano R. et al. Effectiveness and safety of levosulpiride in the treatment of dysmotility-like functional dyspepsia. Ther. Clin. Risk Manag. 2007 Mar; 3 (1): 149-155. doi: 10.2147/tcrm.2007.3.1.149.
6. Mansi C., Borro P., Giacomini M. et al. Comparative effects of levosulpiride and cisapride on gastric emptying and symptoms in patients with functional dyspepsia and gastroparesis. Aliment. Pharmacol. Ther. 2000; 14: 561-569. doi: 10.1046/j.1365-2036.2000.00742.x.
7. Drossman A. et.al. Neuromodulators for functional gastrointestinal disorders (Disorders of GutLBrain Interaction): a Rome Foundation Working Team Report. Gastroenterology. 2018; 154: 1140-1171. doi: https://doi.org/10.1053/j.gastro.2017.11.279.
8. Gupta S., Kapoor V., Kapoor B. Itopride: a novel prokinetic agent. Drug Review. Vol. 6. No. 2. April-June, 2004.
9. Ranjan A., Chandra A., Kumar D. The comparative effects of itopride and levosulpiride orally used in patients suffering from non-ulcer dyspepsia. International Journal of Basic & Clinical Pharmacology. August 2019. Vol. 8. Iss. 8: p. 1915. doi: http://dx.doi.org/10.18203/2319-2003.ijbcp20193202.
10. Huang X., Lv B., Zhang S., Fan Yi-Hong et al. Itopride therapy for functional dyspepsia: a meta-analysis. World J. Gastroenterol. 2012 Dec 28; 18 (48): 7371-7377. doi: 10.3748/wjg.v18.i48.7371.
11. Distrutti E., Fiorucci S., Hauer S. et al. Effect of acute and chronic levosulpiride administration on gastric tone and perception in functional dyspepsia. Aliment. Pharmacol. Ther. 2002; 16: 613-622. doi: 10.1046/j.1365-2036.2002.01180.x.
12. Caestecker J. Prokinetics and reflux: a promise unfulfilled. Еur. J. Gastroenterol. Hepatol. 2002 Jan; 14 (1): 5-7. doi: 10.1097/00042737-200201000-00002.
13. Рецидивы гастроэзофагальной рефлюксной болезни: возможные пути решения проблемы / В.П. Шипулин, В.В. Чернявский, Л.М. Купчик, Л.С. Гвоздецкая, А.С. Ситников. Сучасна гастроентерологія. 2011; 4: 107-112.
14. Scarpellini E. et al. The effects of itopride on oesophageal motility and lower oesophageal sphincter function in man. 2011. Vol. 33. Iss. 1: р. 99-105. doi: https://doi.org/10.1111/j.1365-2036.2010.04487.x.
15. Ruth M., Finizia C., Cange L. et al. The effect of mosapride on esophageal motor function and acid reflux in patients with gastroesophageal reflux disease. Eur. J. Gastroenterol. Hepatol. 2003; 15: 1115-1121. doi: 10.1097/00042737-200310000-00009.
16. Hallerback B., Bommelaer G., Bredberg E. et al. Dose finding study of mosapride in functional dyspepsia: a placebo-controlled, randomized study. Aliment. Pharmacol. Ther. 2002; 16: 959-967. doi: https://doi.org/10.1046/j.1365-2036.2002.01236.x.
17. Matsueda K., Hongo M., Tack J. et al. Clinical trial: dose-dependent therapeutic efficacy of acotiamide hydrochloride (Z‑338) in patients with functional dyspepsia – 100 mg t.i.d. is an optimal dosage. Neurogastroenterol. Motil. 2010; 22: 618-e173. doi: 10.1111/j.1365-2982.2009.01449.x.
18. Yamawaki Hiroshi et al. Management of functional dyspepsia: state of the art and emerging therapies. Ther. Adv. Chronic. Dis. 2018. Vol. 9 (1): 23-32. doi: 10.1177/2040622317725479.
19. Drossman D., Tack J., Ford A. et al. Neuromodulators for functional gastrointestinal disorders (Disorders of Gut-Brain Interaction): a Rome Foundation Working Team Report. Gastroenterology. 2018; 154: 1140-1171. doi: 10.1053/j.gastro.2017.11.279.
20. Di Stefano M., Papathanasopoulos A., Blondeau K. et al. Effect of buspirone, a 5-HT1A receptor agonist, on esophageal motility in healthy volunteers. Dis. Esophagus. 2012; 25: 470-476. doi: 10.1111/j.1442-2050.2011.01275.x.
21. Johnson A., Greenwood-Van Meerveld B. The pharmacology of visceral pain. Adv. Pharmacol. 2016; 75: 273-301. doi: 10.1016/bs.apha.2015.11.002.
Медична газета «Здоров’я України 21 сторіччя» № 15 (484), 2020 р.