26 грудня, 2020
Роль інгібіторів протонної помпи у забезпеченні оптимального терапевтичного ефекту у пацієнтів із гастроезофагеальною рефлюксною хворобою
.jpg) Незбалансоване харчування, гіподинамія та шкідливі звички є серйозною проблемою для багатьох жителів планети, що зумовлює невпинне зростання кількості людей з ожирінням. Накопичення вісцерального жиру є найбільш прогностично несприятливим для пацієнтів, оскільки з одного боку суттєво збільшує ризик розвитку серцево-судинних захворювань, з іншого – призводить до підвищення внутрішньочеревного тиску, одного з найбільш вагомих чинників ризику розвитку гастроезофагеальної рефлюксної хвороби (ГЕРХ). Для надійного контролю над симптомами ГЕРХ, запобігання прогресуванню захворювання та поліпшення якості життя пацієнтів найбільш оптимальним терапевтичним рішенням є використання інгібіторів протонної помпи (ІПП).
Незбалансоване харчування, гіподинамія та шкідливі звички є серйозною проблемою для багатьох жителів планети, що зумовлює невпинне зростання кількості людей з ожирінням. Накопичення вісцерального жиру є найбільш прогностично несприятливим для пацієнтів, оскільки з одного боку суттєво збільшує ризик розвитку серцево-судинних захворювань, з іншого – призводить до підвищення внутрішньочеревного тиску, одного з найбільш вагомих чинників ризику розвитку гастроезофагеальної рефлюксної хвороби (ГЕРХ). Для надійного контролю над симптомами ГЕРХ, запобігання прогресуванню захворювання та поліпшення якості життя пацієнтів найбільш оптимальним терапевтичним рішенням є використання інгібіторів протонної помпи (ІПП).
У рамках сучасної електронної платформи післядипломної медичної освіти для лікарів, заснованої ГО «Всеукраїнська асоціація безперервної професійної освіти лікарів і фармацевтів» та Національною медичною академією післядипломної освіти імені П.Л. Шупика, більш детально про лікування пацієнтів із ГЕРХ розповів віцепрезидент Асоціації дієтологів України, доцент кафедри внутрішньої медицини № 1 Національного медичного університету ім. О.О. Богомольця, кандидат медичних наук Олександр Аркадійович Мартинчук.
Згідно з даними Всесвітньої гастроентерологічної асоціації (2015), ГЕРХ – це патологічний ретроградний закид вмісту шлунка у стравохід, ротоглотку та/або дихальні шляхи, найбільш частим симптомом якого є печія. Від печії страждає 20-40% дорослого населення Європи та США; на щоденну печію скаржаться близько 10% населення планети. У той самий час більш значущою проблемою є виникнення рефлюкс-езофагіту, який при ендоскопічному обстеженні виявляють у 6-12% людей, що звернулися до лікаря з проблемою виникнення печії. При цьому 40% осіб серед дорослого населення США, що страждають на ГЕРХ, мають клінічні ознаки захворювання, попри те, ще приймають ІПП. Причиною цих симптомів у 40% випадків є симптоматичний некислотний рефлюкс, при якому кислотознижувальна терапія є неефективною.
Як відомо, нижній стравохідний сфінктер відділяє шлунок та стравохід, проте під час його періодичного розслаблення (швидкоплинних релаксацій) може спостерігатися фізіологічний закид частини вмісту шлунку у стравохід. У цей час спрацьовує надійний механізм захисту стравоходу – езофагеальний кліренс, який забезпечує повернення кислого вмісту назад до шлунка.
В окремих випадках при наявності провокувальних факторів компенсаторні механізми стравоходу можуть виснажуватися. Одним із найбільш вагомих чинників залишається ожиріння, оскільки накопичення абдомінального жиру сприяє підвищенню внутрішньочеревного тиску та зумовлює додатковий тиск на шлунок, спричиняючи ретроградний закид його вмісту у стравохід із подальшим розвитком запальних уражень чи функціональних розладів (функціональної печії чи гіперсенситивного стравоходу) (G. Boeckxstaens et al., 2014). Із підвищеним ризиком розвитку ГЕРХ та ерозивного езофагіту (ЕЕ) пов’язане й вживання їжі з високим вмістом насичених жирів та трансжирів. Провокувальним фактором появи нічної печії у пацієнтів із ГЕРХ є споживання газованих напоїв, адже потрапляння великої кількості газів до шлунка призводить до його перерозтягнення та імітації надлишкового потрапляння їжі в орган, що супроводжується надмірною продукцією соляної кислоти. При цьому якщо газований напій солодкий, при його потраплянні у кишечник цукор швидко переробляється мікробіотою кишечнику з утворенням газів, що згодом зумовлює метеоризм, зростання внутрішньочеревного тиску та розвиток рефлюксу. Зв’язок вживання алкоголю із розвитком ГЕРХ поки що до кінця не з’ясований. У деяких людей вживання кави може посилювати печію, ймовірно, це зумовлено дією кофеїну. Куріння сприяє розслабленню нижнього стравохідного сфінктера, що зумовлює зростання ризику розвитку ГЕРХ (J. Tack et al., 2018).
У патогенезі шлунково-стравохідного рефлюксу при ерозивних формах ГЕРХ домінує агресивний вплив кислого вмісту шлунка, а при функціональній печії симптоми виникають внаслідок гіперчутливості слизової оболонки стравоходу. Ці особливості потрібно враховувати при призначенні лікування, оскільки у першому випадку кислотознижувальні лікарські засоби будуть ефективними, а в другому – ні (J. Tack et al., 2018).
Алгоритм ведення необстежених пацієнтів із типовими симптомами рефлюксу насамперед полягає у виключенні тривожних симптомів чи відомих факторів ризику, таких як: вік старше 50 років, безпричинна втрата маси тіла понад 5%, наявність дисфагії, одинофагії, залізодефіцитної анемії, ознак шлунково-кишкової кровотечі, пухлин, стриктур чи виразок стравоходу, обтяженого анамнезу з боку онкозахворювань проксимальних відділів травного каналу та наявність виражених симптомів захворювання протягом тривалого періоду, що дає підстави запідозрити у пацієнта стравохід Барретта (рис. 1) (C.P. Gyawali et al., 2018).
 Рис. 1. Алгоритм емпіричної терапії ГЕРХ (на основі німецьких (2014), італійських (2016) та канадських (2017) настанов)
Рис. 1. Алгоритм емпіричної терапії ГЕРХ (на основі німецьких (2014), італійських (2016) та канадських (2017) настанов)
При виявленні одного з тривожних симптомів потрібно направити пацієнта на відеоезофагогастродуоденоскопію (ВЕГДС). В іншому випадку необхідно призначити емпіричну терапію ІПП із контролем її ефективності протягом 6-8 тижнів. У випадку збереження симптомів необхідно рекомендувати проведення ВЕГДС (рис. 1). Проте терапевтична ефективність ІПП не завжди виключає наявність тяжкої патології стравоходу. В одному з проспективних досліджень за участю 469 пацієнтів із типовими проявами ГЕРХ без тривожних симптомів спостерігалася задовільна відповідь на 2-тижневу терапію ІПП при аденокарциномі стравоходу, що свідчить про те, що за наявності будь-яких мінімальних ознак, які б свідчили про органічне ураження, потрібно направляти пацієнтів на ВЕГДС (S. Peng et al., 2010).
Метод ендоскопічного дослідження дозволяє класифікувати ГЕРХ на неерозивну рефлюксну хворобу (НЕРХ), при якій наявні симптоми ГЕРХ та відсутні ерозії, та ЕЕ з симптомами рефлюксу та ендоскопічним виявленням ерозій (P.O. Katz et al., 2013). Крім того, у деяких хворих ЕЕ може мати перебіг без печії та інших симптомів (J. Dent et al., 2012).
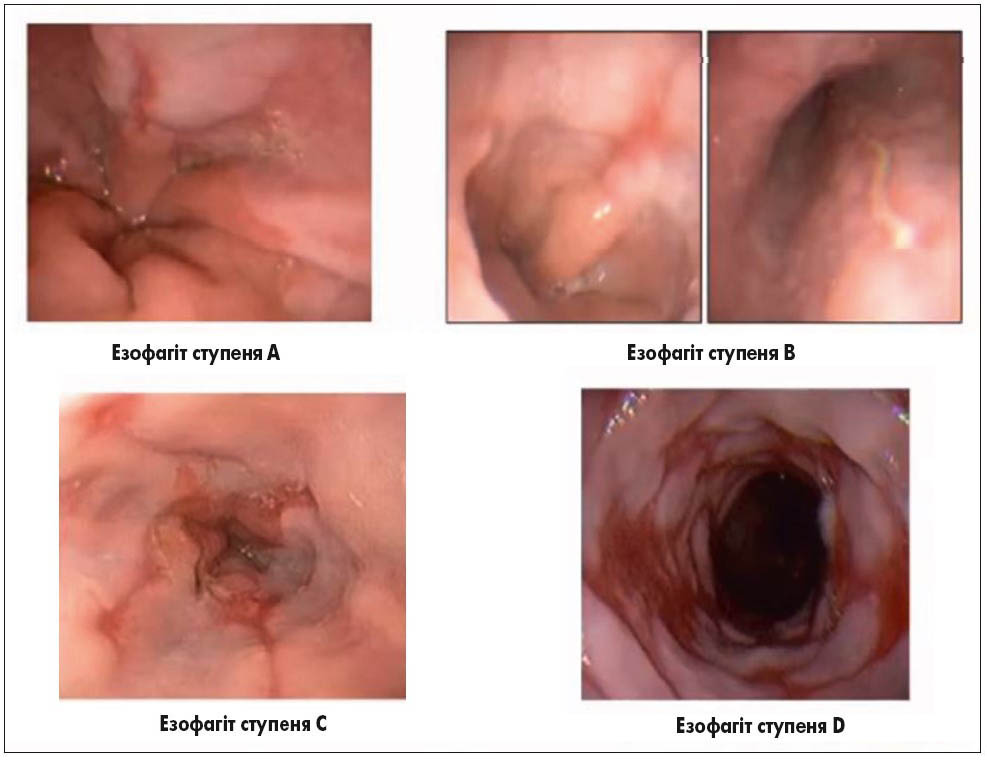
У разі підвищеної настороженості лікаря щодо наявності стравоходу Барретта при виконанні ендоскопічного дослідження можна використовувати барвник чи спеціальну ендоскопічну техніку зі збільшенням потрібної зони у сотні разів з метою кращого виділення ділянки подальшої біопсії. Як правило, зміни, виявлені на рівні стравоходу, підлягають градації за Лос-Анджелеською класифікацією (рис. 2).
Рис. 2. Лос-Анджелеська класифікація езофагітів (на прикладі візуалізації при ВЕГДС)
Ступені езофагіту A і B свідчать про незначне запалення та локалізацію ерозій у межах однієї складки слизової оболонки стравоходу. Відмінність полягає лише у тому, що при ступені A ураження сягає не більше 5 мм, а при ступені B – більше 5 мм. Якщо ерозії та запалення переходять на усі складки стравоходу та займають до 75% окружності, встановлюють езофагіт ступеня C, а при ураженні понад 75% – ступеня D. При гістологічному дослідженні спостерігається потовщення базального шару епітелію та видовження сосочків багатошарового плоского незрілого епітелію (рис. 3).
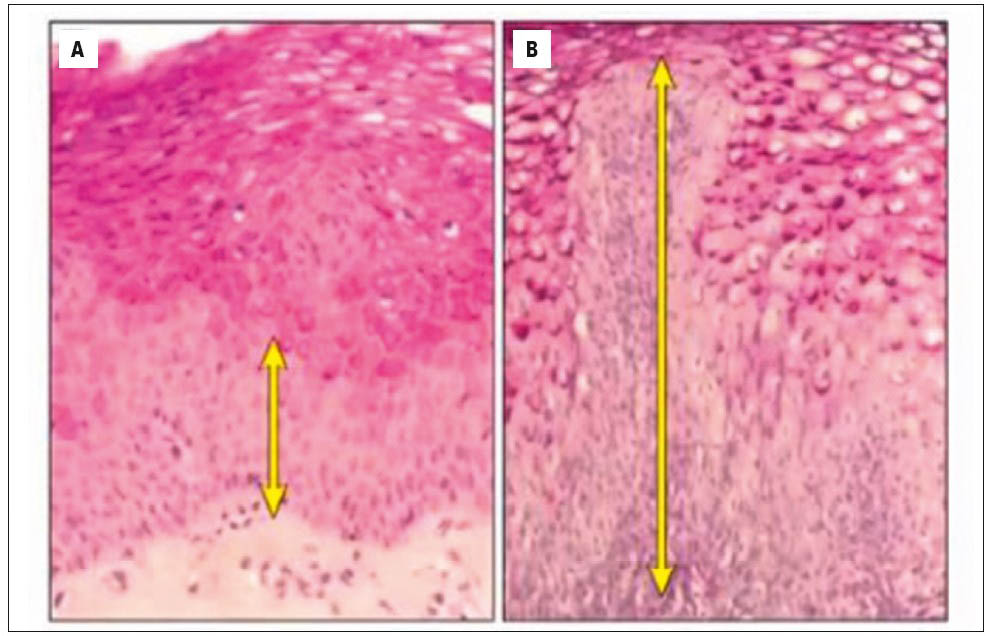 Рис. 3. Дані гістологічного дослідження у пацієнтів із ГЕРХ: (А) – збільшена товщина базального шару (багатошаровий плоский незроговілий епітелій); (В) – видовження сосочків (багатошаровий плоский незроговілий епітелій)
Рис. 3. Дані гістологічного дослідження у пацієнтів із ГЕРХ: (А) – збільшена товщина базального шару (багатошаровий плоский незроговілий епітелій); (В) – видовження сосочків (багатошаровий плоский незроговілий епітелій)
За певних умов чи відсутності оптимальної терапії у пацієнтів із ГЕРХ можуть розвиватися ускладнення, такі як проксимальна, дистальна чи пептична стриктура стравоходу, які добре візуалізуються під час пасажу барію (рис. 4).
Вплив Helicobacter pylori на ГЕРХ є неоднозначним та більшою мірою залежить від ступеня вираженості гастриту, його локалізації, функціонування стравохідно-шлункового сфінктера, стану кислотного кліренсу стравоходу, наявності грижі стравохідного отвору діафрагми, що зумовлює схильність до захворювання. За умов виявлення антрального гастриту у пацієнтів із H. pylori без ознак ГЕРХ ерадикаційна терапія буде ефективною, що, перш за все, знизить ризик утворення пептичних виразок у дванадцятипалій кишці. Проте при ураженні тіла шлунка після ерадикації H. pylori пацієнти інколи починають скаржитися на появу симптомів ГЕРХ, що зумовлено маскуванням симптоматики ГЕРХ клінічними проявами з боку шлунка. У хворих із H. pylori та проявами ГЕРХ із локалізацією гастриту в антральному відділі шлунка призначення ерадикаційної терапії супроводжуватиметься зменшенням симптомів ГЕРХ та зниженням виразкоутворення на рівні дванадцятипалої кишки. При локалізації процесу в тілі шлунка може відмічатися погіршення перебігу ГЕРХ та зменшення ефективності дії ІПП. Важливо, що при проведенні тесту на H. pylori потрібно враховувати час між останнім прийомом ІПП та направленням на тестування, який повинен складати не менше 2 тижнів, а краще – 4 тижні.
Після проведення ВЕГДС тривалість терапії ІПП залежить від результатів ендоскопічного дослідження. При встановленні НЕРХ чи ерозивної форм ГЕРХ на 4-8 тижнів призначається кислотосупресивна терапія, після закінчення якої рекомендовано використовувати різні варіанти підтримувальної терапії. При виявленні у ході ендоскопії стравоходу Барретта тактика лікування залежатиме від висновку патоморфолога. При виявленні не тільки ділянок метаплазії, але й дисплазії показане ендоскопічне лікування, в інших випадках – спостереження за пацієнтом та призначення ІПП. Якщо при ВЕГДС виявлено пептичний стеноз стравоходу, рекомендовано провести його дилатацію з наступним прийомом ІПП.
На шляху успішного лікування ГЕРХ важливими завданнями терапії є: усунення причин появи гастроезофагеального рефлюксу, контроль над симптомами захворювання, запобігання прогресуванню захворювання, зниження ризику виникнення аденокарциноми стравоходу, поліпшення якості життя (C.P. Gyawali et al., 2018). Для досягнення оптимального терапевтичного ефекту пацієнтам із ГЕРХ рекомендовано зменшити масу тілу, обмежити розмір разової порції, прийом смажених і гострих страв та вечеряти не пізніше ніж за 3 години до сну, а також спати з піднятим з боку голови ліжком. Сьогодні призначення ІПП є сучасним стандартом лікування ГЕРХ, що забезпечує пригнічення шлункової секреції шляхом блокування шлункової воднево-калієвої АТФази та досягнення оптимального терапевтичного ефекту у 60-70% пацієнтів із ГЕРХ при прийомі 1 раз на день (C. Reimer et al., 2009). Згідно з даними метааналізу N. Chiba та співавт. (1997), у пацієнтів із ЕЕ застосування ІПП супроводжувалося найшвидшим та найбільш ефективним загоєнням ерозій стравоходу та усуненням симптомів рефлюксу порівняно з використанням H2-гістаміноблокаторів та плацебо. Згідно з результатами дослідження C. Gyawali та співавт. (2017), при рефлюкс-езофагіті терапевтична ефективність ІПП складає 60-80%, у той час як при ендоскопічно негативних формах ГЕРХ – 40-60%. Ефективність прийому ІПП при наявності кислотного рефлюксу складає близько 70% як у пацієнтів із ендоскопічно негативними формами ГЕРХ, так і у хворих із ерозивними формами ГЕРХ (P.W. Weijenborg et al., 2012).
Застосування ІПП при ГЕРХ зумовлене незворотним блокуванням H-K-AТФазних протонних помп парієтальних клітин та пригніченням кислотної продукції до моменту утворення нових протонних помп, тому щоденний їх прийом за 30-45 хвилин до їди (краще вранці) гарантує тривале пригнічення секреції соляної кислоти. Прийом ІПП не впливає на кількість епізодів рефлюксу, проте зменшує їх кислотність, що зумовлює їх ефективність у лікуванні печії. При тривалому призначенні ІПП у пацієнтів інколи може розвинутися дефіцит мікронутрієнтів (зокрема, вітамінів групи В, магнію, кальцію).
У разі неефективності ІПП потрібно враховувати окремі їх характеристики, а саме: нестійкість до дії кислого вмісту шлунка, зменшення абсорбції на 40-70% при прийомі разом із їдою, короткий період напіввиведення (не більше 1-1,7 год), дія тільки на активні помпи та наявність вродженої чи набутої резистентності до препаратів у 10% випадках (P.O. Katz et al., 2013).
Одним із найбільш ефективних ІПП є пантопразол (препарат ПанГастро® фармацевтичної компанії «Сандоз»), який зв’язується з цистеїном 822 і цистеїном 813 протонних помп парієтальних клітин, що забезпечує більш значущий клінічний ефект порівняно з використанням інших представників цього класу. Крім того, пантопразол забезпечує максимально тривале пригнічення секреції соляної кислоти та найшвидше зникнення симптомів порівняно з альтернативними ІПП, що сприяє загоєнню уражень. Ще однією перевагою препарату ПанГастро® є мінімальна лікарська взаємодія з іншими препаратами, що пов’язано з тим, що препарат фактично не метаболізується на рівні цитохрому P450. Випускається лікарський засіб ПанГастро® у формі гастрорезистентних таблеток по 20 та 40 мг № 14 і № 28, а також у формі порошку для приготування розчину для ін’єкцій по 40 мг.
У лікуванні ГЕРХ лікарі часто зустрічаються з рецидивуючими формами захворювання, адже близько 2/3 пацієнтів із НЕРХ можуть мати рецидив симптомів після відміни ІПП. У таких випадках рекомендовано повторно призначати той самий препарат у тій самій дозі, що раніше дозволило досягти контролю над симптомами рефлюксу. При рецидивах, що виникають через 3 або більше місяців після припинення прийому ІПП, рекомендується пройти повний курс 6 тижнів. Якщо рецидив виник раніше, ніж через 3 місяці, й пацієнту не проводилася ВЕГДС, слід направити його на ендоскопію, щоб виключити інші причини клінічних симптомів ГЕРХ. Проте зазвичай пацієнти із раннім рецидивом симптомів рефлюксу потребують тривалої підтримувальної кислотосупресивної терапії з використанням ІПП (S. Ip et al., 2005).
Однією з причин недостатньої ефективності лікування ГЕРХ є неоптимальний контроль кислотної секреції, адже близько 46% пацієнтів не приймають ІПП відповідно до рекомендацій (I. Sheikh et al., 2014). Крім того, метаболізм ІПП залежить від генів, які кодують ізофермент CYP2C19 цитохрому P450. У цьому випадку застосування препарату ПанГастро® буде мати переваги, тому що його метаболізм не контролюється цитохромальною системою. Залишковий кислотний рефлюкс, який відмічається значно рідше при 2-разовому прийомі препарату порівняно з 1-разовим, також може слугувати однією з причин рефрактерності при лікуванні ГЕРХ (S. Charbel et al., 2005). Відсутність відповіді на терапію рефлюксу може відмічатися при некислотному рефлюксі, гіперчутливості стравоходу, функціональній печії чи інших причинах (ахалазії, еозинофільному езофагіті, інфекційному та медикаментозному езофагіті). Тому лікування резистентних форм ГЕРХ часто потребує проведення складних додаткових методів досліджень (імпедансу, pH-метрії, манометрії).
Тактика ведення пацієнтів із рефрактерним перебігом полягає у початковому призначенні курсу ІПП 1 раз на добу протягом 2 місяців. При виникненні нетипових проявів необхідно проведення ВЕГДС, при типовій клінічній картині – перевірка дотримання пацієнтом правил прийому лікарського засобу у певний час доби, а потім – призначення іншого ІПП або зміна дозування. У випадку неефективності попередніх дій доцільно призначити пацієнту проведення імпедансного дослідження слизової оболонки стравоходу, проте при відсутності умов для його проведення – призначити емпіричну терапію залежно від симптомів захворювання, які переважають (T. Hershcovici et al., 2010).
При призначенні ІПП слід уникати найбільш поширених помилок: призначення кислотознижувальних препаратів без надання зрозумілих та чітких рекомендацій щодо їх прийому, збільшення дози ІПП при персистуючій печії та невстановленому діагнозі ГЕРХ. Однією з помилок є хибна думка про те, що ІПП-тест є високоточним методом підтвердження ГЕРХ. Не потрібно відмовлятися від використання кислотосупресивних засобів через ризик ускладнень та побічних ефектів, проте необхідно пам’ятати про можливий розвиток гіпомагніємії у пацієнтів, які тривалий час приймають ІПП. Не слід припиняти прийом ІПП при виявленні поліпозу на дні шлунка та відмовлятися від ІПП у пацієнтів групи високого ризику, які приймають антикоагулянтну терапію. Але необхідно попередити пацієнтів про можливість розвитку «симптомів рикошету» після припинення прийому ІПП.
Згідно з міжнародними рекомендаціями лікування ГЕРХ, ІПП включені як засоби основної терапії НЕРХ та ерозивних форм ГЕРХ. Проте серед усіх представників класу ІПП призначення пантопразолу (препарат ПанГастро®) має ряд переваг, які пов’язані з найбільш тривалим пригніченням секреції соляної кислоти, швидким зникненням симптомів печії та відсутністю лікарських взаємодій порівняно з іншими ІПП, що сприяє надійному та швидкому загоєнню уражень із мінімальним ризиком розвитку побічних реакцій.
Підготувала Ірина Неміш
Інформація для спеціалістів сфери охорони здоров'я.
4-42-ПАН-РЕЦ-1220
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 4 (58) 2020 р.