20 січня, 2023
Інтестинальна проникність pro et contra
 Сьогодні з’являється все більше даних щодо важливої ролі кишкового бар’єру й інтестинальної проникності для підтримання здоров’я та/або у виникненні великої кількості захворювань. З поняттям кишкової проникності пов’язані такі широковживані назви, як професійна – синдром надмірної інтестинальної проникності (СНІП) та розмовна leaky gut («дірява» кишка).
Сьогодні з’являється все більше даних щодо важливої ролі кишкового бар’єру й інтестинальної проникності для підтримання здоров’я та/або у виникненні великої кількості захворювань. З поняттям кишкової проникності пов’язані такі широковживані назви, як професійна – синдром надмірної інтестинальної проникності (СНІП) та розмовна leaky gut («дірява» кишка).
Кількість публікацій по темі СНІП, за даними PubMed, за останні 10 років збільшилася майже в 2,5 рази – 6324 проти 2586 у період 2000-2010 рр., із них 1753 статті опубліковано за останні 2 роки. Розглянемо основні відомості для розуміння понять «кишковий бар’єр», «кишкова проникність» та СНІП.
Кишковий бар’єр – це складна багатошарова система, що умовно складається із зовнішнього фізичного бар’єру (слизова оболонка кишечнику, шар слизу), внутрішнього функціонального (переважно клітинний) та імунологічного бар’єру (імунні клітини, що містяться у власній пластинці, та секретовані ними імуноглобуліни). Взаємодія між цими шарами дозволяє підтримувати нормальну проникність [2], що визначається у здорових людей без ознак інтоксикації, запалення або порушення функцій кишечнику [3].
Здоровий кишковий бар’єр запобігає потраплянню патогенних мікроорганізмів та токсинів, одночасно регулюючи всмоктування поживних речовин, електролітів, амінокислот, коротколанцюгових жирних кислот (КЛЖК), цукрів, води та окремих мікробних метаболітів із просвіту кишечнику в кровообіг.
СНІП визначається як порушена проникність, що призводить до транслокації бактерій та токсинів через стінку кишечнику в кровотік, викликаючи порушення кишечного гомеостазу та формування функціональних порушень і органічних захворювань [3].
Будова та функції інтестинального бар’єру
Поверхня слизової оболонки шлунково-кишкового тракту (ШКТ), яка вистелена епітеліальними клітинами, являє собою ефективний бар’єр, що складається з міжклітинних з’єднань, які розділяють внутрішнє та зовнішнє середовища і перешкоджають проходженню потенційно шкідливих речовин.
ШКТ є однією з систем організму, що піддається найбільшому антигенному навантаженню і має найбільшу поверхню, яка безпосередньо контактує із зовнішнім середовищем, із приблизною площею поверхні 250 м2 (рис.) [5].
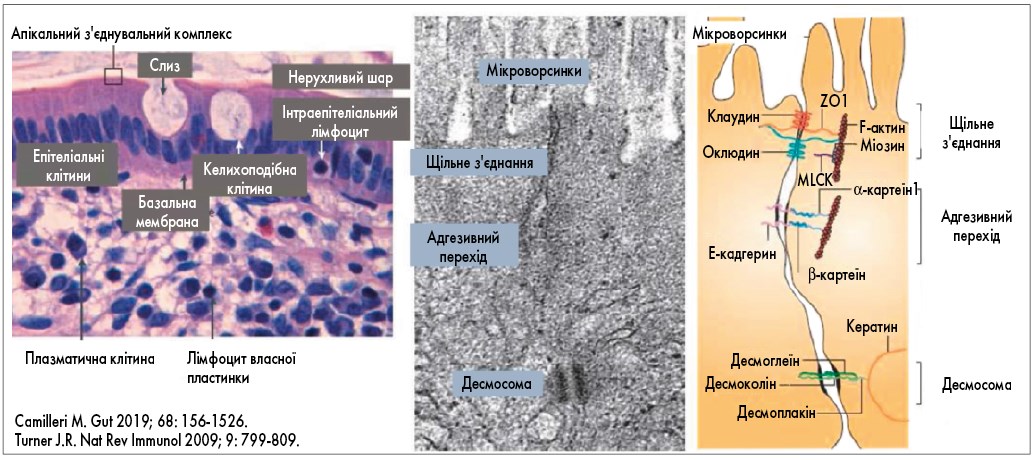 Рис. Анатомія бар’єру слизової оболонки
Рис. Анатомія бар’єру слизової оболонки
Зовнішній бар’єр формує шар слизу, де містяться коменсальні бактерії кишечнику, антимікробні пептиди (АМП), секреторний імуноглобулін А (sIgA) [6]. Ключовим компонентом кишкового бар’єру також виступає кишкова флора, або мікробіота, що виконує безліч життєво важливих функцій, найбільш вивченими з яких є вплив на метаболізм, проліферацію та підтримку епітеліального бар’єру, синтез КЛЖК [7].
Внутрішній бар’єр складається з епітеліальних клітин та включає:
- ентероцити;
- клітини Панета (під впливом бактерій та їх продуктів секретують антимікробні пептиди (AMPs), такі як ліпополісахариди (LPS), виробляють дефензини);
- келихоподібні клітини (вивільняють муцини, які формують глікопротеїни для підтримки слизового бар’єру);
- пучкові клітини (виробляють інтерлейкін (IL)-25, що бере участь у вродженому імунітеті, та IL-13, який контролює реакції IgE і стимулює гіперплазію келихоподібних клітин та вироблення слизу);
- ентероендокринні клітини (продукують пептиди або гормони, такі як GLP-2, що бере участь у регенерації та репарації епітелію та індукції синтезу білків щільного з’єднання – tight junctions zonula occludens (TJ; ZO-1 та оклюдин);
- M-клітини – знаходяться виключно в тонкий кишці, беруть участь у поглинанні антигена й тим самим ініціюють антигенспецифічні імунні реакції слизової оболонки, такі як індукція sIgA.
Власна пластинка містить імунні клітини, такі як макрофаги, дендритні клітини, В- та Т-лімфоцити, тучні клітини, що виділяють IgA та беруть участь в імунологічних захисних механізмах кишкового бар’єру.
Міжклітинні з’єднання
Епітеліальні клітини, з’єднані апікальними сполучними комплексами, транспортують просвітній вміст у кров та реагують на шкідливі подразники секрецією хлориду та антимікробних пептидів (AMPs). Від апікальної до базальної ділянки ентероцитів розрізняють 3 комплекси міжклітинних з’єднань:
- TJ ZO-1, ZO-2, ZO-3;
- адгезивні з’єднання (adherens junction, AJ) – зона злипання (zonula adherens);
- десмосоми, що забезпечують структурну цілісність клітин за рахунок зв’язування їх мереж проміжних філаментів [8].
Разом вони складають апікальний з’єднувальний комплекс і підтримують щільну межу мікроворсинок. TJ беруть участь у регулюванні епітеліальної бар’єрної функції та міжклітинного транспорту [9].
Функціональні або фізичні порушення TJ, AJ та десмосом призводять до збільшення проникності кишечнику, що викликає нерегульовану транслокацію чужорідних речовин і медіаторів запалення та потенційно впливає на розвиток хронічного запалення кишечнику. Посилення запалення продовжує руйнування білків TJ, що призводить до підвищення проникності [10].
Трансцелюлярний та парацелюлярний транспорт
Трансцелюлярний та парацелюлярний шляхи – це основні шляхи, що беруть участь у транспорті речовин через кишковий бар’єр. Трансцелюлярний шлях здійснюється завдяки внутрішньоклітинному перенесенню речовин із просвіту в кровотік. Парацелюлярний шлях включає перенесення речовин між ентероцитами.
Існують 2 різних парацелюлярних шляхи проникності епітелію: шлях «витоку» (для макромолекул діаметром ~100 Å) та «пори» (для дрібних компонентів діаметром ≤8 Å). Повідомляється, що щільні з’єднання, як правило, непроникні для молекул з радіусом ≤11-15 Å [11]. Цей шлях і визначає кишкову проникність. Речовина, на якій вивчалася кишкова проникність та яка здатна підсилити останню, – токсин zonula (білок вібріона холери) – оборотно відкриває щільні з’єднання між клітинами кишечнику, при цьому посилюється транспорт для різних речовин: ліків, потенційно шкідливих токсичних та небажаних молекул, присутніх у ШКТ. Вважається, що шлях «витоку» також регулюється кіназою легкого ланцюга міозину (MLCK), де конститутивно активної MLCK достатньо для збільшення проникності [12]. MLCK, OCLN та ZO-1-подібні білки TJ відіграють важливу роль у регуляції шляху «витоку» [13].
Потік, що виникає через загибель клітин, асоціюється з патологічними станами (ерозіями та виразками), не залежить від щільних з’єднань і забезпечує доступ просвітних антигенів до власної пластинки [14].
Фактори ризику підвищеної кишкової проникності
Згідно з даними систематичного огляду, де оцінювали фактори ризику, асоційовані з кишковою проникністю, у дорослої популяції на основі даних 47 статей, виявлено, що дисліпідемія, поганий глікемічний контроль, хронічне запалення (підвищення рівня прозапальних маркерів), ожиріння, харчування за «західним стилем» є найсильнішими факторами ризику зміненої, а саме – підвищеної кишкової проникності. При цьому ризик підвищеної кишкової проникності збільшується при наявності коморбідності та тяжкості захворювання [15].
Захворювання, пов’язані із синдромом підвищеної кишкової проникності
В останні роки з’являється все більше публікацій про зв’язок кишкового бар’єру з різними захворюваннями, але механізми цих зв’язків до кінця не з’ясовані.
Дисфункція епітеліального бар’єру кишечнику та підвищена проникність були описані при багатьох захворюваннях, включаючи запальні захворювання кишечнику (ЗЗК – неспецифічний виразковий коліт, хворобу Крона), СПК, неалкогольну жирову хворобу печінки (НАЖХП), стеатогепатит, цироз печінки, важкий гострий панкреатит, первинний біліарний холангіт, цукровий діабет (ЦД) 1 та 2 типу, депресію тощо [4].
Клінічні дані свідчать про те, що leaky gut супроводжує аутоімунні захворювання, такі як ЦД 1 типу, розсіяний склероз, ревматоїдний артрит та целіакію, патофізіологічні зв’язки між якими вивчені недостатньо [16].
Методи вимірювання кишкової проникності
Кишкова проникність визначається як одна із функцій кишкового бар’єру, яка вимірюється шляхом аналізу швидкості потоку через кишкову стінку певних молекул, що було чітко визначено консенсусом в експертній групі у Франкфурті (Німеччина) у червні 2012 р. [3]. Кишкова проникність може бути нормальною або надмірною.
Існує нагальна потреба в наявності простих, надійних та чутливих методів вимірювання кишкової проникності задля виявлення груп ризику розвитку певних захворювань та розробки дієвих профілактичних заходів [17].
«Золотим стандартом» функціональних досліджень кишкової проникності у людини вважаються екскреторні тести, а саме лактулозно-манітоловий тест, який вимірює сечову екскрецію перорально вжитих цукрів протягом 6 годин [18]. Аналіз виконується методом високоефективної рідинної хроматографії або методом рідинної хроматографії в комбінації з мас-спектрометрією зразків сечі [3]. Лактулоза – дисахарид великого розміру, що може проникати через кишечник тільки парацелюлярно і визначатися в сечі лише тоді, коли інтестинальний бар’єр скомпрометований. Маніт – молекула меншого розміру, яка може проходити вільно парацелюлярним шляхом через кишковий бар’єр, незалежно від його пошкодження або дисфункції [3]. Таким чином, співвідношення вмісту лактулози до манітолу в сечі дає інформацію про наявну проникність тонкої кишки [18].
Лактулозно-манітоловий тест широко використовується в багатьох дослідженнях у пацієнтів із ЗЗК, СПК та целіакією [19] і може використовуватися у прогнозуванні рецидивів у пацієнтів із хворобою Крона [20, 21].
Оскільки лактулоза та маніт метаболізуються мікробіотою товстої кишки, вони не використовуються для оцінки проникності товстої кишки. З цією метою використовуються інші сполуки: сукралоза, поліетиленгліколь (ПЕГ) або 51Cr-етилендіамінтетраоцтова кислота (ЕДТА), які не метаболізуються мікробіотою товстої кишки та відображають проникність саме товстої кишки або всього кишечнику в залежності від оцінки часу та тривалості збору аналізу сечі.
Для оцінки проникності шлунка використовують сахарозу, оскільки вона гідролізується в дванадцятипалій кишці та не може бути використана для оцінки проникності тонкої кишки [3].
Адсорбційні тести використовуються переважно в дослідницьких проєктах та наукових дослідженнях. На жаль, в Україні можливості для їх проведення відсутні, тому постає питання інших підходів до непрямого (опосередкованого) визначення кишкової проникності. Розглянемо їх.
Одним із маркерів підвищеної кишкової проникності вважається складний білок зонулін, який бере участь у підтриманні щільних з’єднань, змінює цілісність TJ тонкої кишки, активуючи рецептор епідермального фактора росту через активований протеїназою рецептор 2 (PAR-2) [22]. Підвищений рівень зонуліну визначається при кількох розладах, пов’язаних зі зміною кишкової проникності, включаючи СПК [23], целіакію, ЦД 1 типу, ревматоїдний артрит [22, 24, 25].
Іншим методом визначення підвищеної кишкової проникності є вимірювання рівня білків, що зв’язують жирні кислоти (Fatty acid-binding protein, FABP). FABP – це невеликі білки, що містяться в цитозолі зрілих ентероцитів. Базові рівні FABP відображають нормальну швидкість обміну епітелію. Ці білки виділяються та потрапляють у кровотік при загибелі ентероцитів і можуть бути виявлені в плазмі та сечі за допомогою імуноферментного аналізу. Підвищений рівень білків виявляється також у пацієнтів з ішемією кишечнику, синдромом системної запальної відповіді та некротичним ентероколітом [26]. Тест може бути корисним також для виявлення гострого пошкодження кишечнику.
Цілісність епітеліального бар’єру ще можна оцінити за морфологією епітеліального бар’єру та експресією TJ, що визначається за допомогою аналізу вестерн-блот або кількісного ПЛР-тесту біоптатів кишечнику. Електронна мікроскопія виявляє ультраструктурні зміни епітеліального бар’єру. За допомогою імуногістохімії або імунофлуоресценції можна візуалізувати специфічні білки TJ.
Ще один метод – вимірювання рівнів LPS у крові ворітної вени та периферичній крові. Не зважаючи на добре відомі технічні обмеження аналізу, що є результатом виявлення низьких рівнів у периферичній крові, у декількох дослідженнях було успішно використано оцінку рівня LPS для виявлення ендотоксикозу, переважно у пацієнтів із сепсисом [27]. Підвищені рівні LPS були виявлені також у пацієнтів із ожирінням та метаболічним синдромом, НАЖХП [28], що може вказувати на бактеріальну транслокацію з просвіту кишечнику в кровообіг як наслідок порушення функції бар’єрної кишки. Хоча рівень LPS легко вимірюється в крові ворітної вени у тварин, вимірювання рівня LPS у периферичній крові людей залишається проблемою і вимагає ретельної стандартизації вимірювання.
Фекальний кальпротектин (ФК) – найуживаніший у сучасній практичній медицині неінвазивний маркер виявлення інтестинального запалення, часто пов’язаного з порушеною інтестинальною проникністю. Широкий спектр патологій призводить до запалення кишечнику: неоплазія, ЗЗК, СПК, інфекції, аутоімунні захворювання, алергія, гіпоперфузія кишечнику та прийом окремих препаратів, наприклад, нестероїдних протизапальних [29], та супроводжується підвищеним рівнем ФК. При цьому ФК є неспецифічним маркером вимірювання кишкової проникності, оскільки не здатний оцінити напряму парацелюлярний шлях [30].
Таким чином, ми розглянули сучасні погляди на інтестинальний бар’єр, його структуру, обговорили функції здорового кишкового бар’єру та наслідки порушення кишкової проникності з можливостями її визначення.
Як свідчать представлені дані, складність досліджень та методів призводять до неоднозначних інтерпретацій отриманих результатів і формують підстави до необґрунтованого, часто бездоказового використання термінів і понять, пов’язаних зі складними процесами інтестинальної щільності, проникності та наслідками їх порушень.
Саме тому на сьогоднішній час так складно обговорювати і рекомендувати методи корекції порушеної інтестинальної проникності, що ми спробуємо зробити у наступних публікаціях.
Список літератури знаходиться в редакції.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 3(65)-4(66) 2022 р.



