18 квітня, 2024
Маастрихтський консенсус VI щодо лікування інфекції Helicobacter pylori: фокус на стандартну потрійну терапію
Інфекція Helicobacter pylori (H. pylori) офіційно визнана інфекційним захворюванням і включена до Міжнародної класифікації хвороб (МКХ) 11-го перегляду, тому рекомендовано лікувати всіх інфікованих пацієнтів. Проте, зважаючи на широкий спектр клінічних проявів, пов’язаних із гастритом, викликаним H. pylori, лишаються специфічні проблеми, які потребують регулярного перегляду для оптимізації лікування.
Маастрихтський консенсус є ключовим документом, що узагальнює основні принципи діагностики та лікування з позицій доказової медицини. Відповідно до оновленого консенсусу, терапією 1-ої лінії для ерадикації H. pylori залишається потрійна комбінація інгібітора протонної помпи (ІПП), амоксициліну та кларитроміцину. Ця схема, відома як PAC (proton pump inhibitor, amoxicillin, clarithromycin), продемонструвала високу ефективність у численних клінічних дослідженнях і реальній практиці.
Маастрихтський V / Флорентійський консенсусний звіт був опублікований у 2017 р., і з того часу відбулися суттєві зміни, які зумовили необхідність оновлення, що відображає прогрес і вирішує складні клінічні питання. Зростаюча резистентність H. pylori до антибіотерапії викликає велике занепокоєння і вимагає ретельного перегляду терапевтичних стратегій. В оновленому VІ виданні Маастрихтського консенсусу новий акцент робиться на молекулярному тестуванні для виявлення H. pylori та визначення чутливості до антибіотиків з підтримкою раціонального використання антибіотиків.
Нещодавня важлива еволюція відбулася внаслідок Кіотського консенсусного звіту щодо гастриту з визначенням гастриту H. pylori як інфекційного захворювання. Гастрит H. pylori як інфекційне захворювання тепер включений як нозологічна одиниця в нову МКХ-11, що передбачає лікування усіх пацієнтів, інфікованих H. pylori. Це представляє зміну парадигми, оскільки показання до лікування більше не обмежуються пацієнтами з клінічними проявами інфекції.
Метою нового консенсусного звіту є надання сучасного керівництва щодо ведення інфекції H. pylori та пов’язаних з нею клінічних проявів, а також натхнення для нових клінічних досліджень у цій галузі. У поточному Маастрихтському VI / Флорентійському консенсусному звіті 41 експерт був включений у 5 робочих груп, які були сформовані за наступними темами: показання/асоціації, діагностика, лікування, профілактика/рак шлунка, H. pylori та мікробіота кишечнику.
Методологія
Для розробки Маастрихтського VI / Флорентійського консенсусу було застосовано Дельфійський (Delphi) метод, який широко використовується в доказовій медицині для створення погоджувальних документів. Рівень достовірності доказів позначався як якість доказовості (Quality of evidence) з градаціями А, B, C і D (табл.). Ця класифікація базується на оцінці методологічної якості досліджень, на яких ґрунтуються докази. Найвищий рівень доказовості (А) присвоювався рекомендаціям, що базуються на результатах систематичних оглядів і метааналізів рандомізованих контрольованих досліджень. Нижчі рівні доказовості (B, C, D) відповідали рекомендаціям, що ґрунтуються на доказах меншої методологічної якості.
|
Таблиця. Характеристика рівнів доказів у Маастрихтському консенсусі VI |
|
|
Рівень доказовості |
Характеристика |
|
А Висока якість |
Подальші дослідження навряд чи змінять впевненість в оцінці ефекту |
|
В Помірна якість |
Подальші дослідження навряд чи суттєво вплинуть на впевненість в оцінці ефекту і можуть її змінити |
|
C Низька якість |
Подальші дослідження, ймовірно, суттєво вплинуть на впевненість в оцінці ефекту та змінять її |
|
D Дуже низька якість |
Будьяка оцінка ефекту є дуже невизначеною |
Для оцінки сили рекомендацій (Strength of recommendation) в Маастрихтському VI / Флорентійському консенсусі використовувалася двоступенева градація. Градація 1 відповідає суворій рекомендації і вказує на чітку позицію експертів щодо використання або невикористання сформульованого положення. Вона базується на доказах високої якості та передбачає високу впевненість у тому, що переваги застосування положення переважають потенційні ризики. Градація 2, навпаки, має слабку силу рекомендації і свідчить про недостатність доказів для однозначного схвалення або відхилення сформульованого положення. У цьому випадку рішення про застосування рекомендації має прийматися індивідуально з урахуванням конкретної клінічної ситуації та переваг пацієнта.
Завдяки дослідженням і метааналізам, проведеним в останні роки, в Маастрихтському VI / Флорентійському консенсусі вдалося точніше сформулювати низку положень, які раніше були предметом дискусій і не мали достатнього рівня доказовості. Крім того, до консенсусу було додано нові положення та рекомендації, що відображають сучасний стан знань у галузі діагностики й лікування H. pylori.
Лікування
Ефективна антимікробна терапія інфекції H. pylori повинна забезпечувати надійне лікування у ≥90% пацієнтів, що вимагає застосування препаратів, до яких чутлива локальна популяція мікроорганізмів. Інформацію про резистентність H. pylori до антибіотиків можна отримати кількома методами. Перший підхід передбачає визначення чутливості виділених від інфікованих пацієнтів штамів H. pylori до протимікробних засобів за допомогою молекулярного тестування (найбільш релевантне для кларитроміцину) або культурального методу з подальшим складанням антибіотикограми. Комерційні набори на основі полімеразної ланцюгової реакції (ПЛР) дозволяють тестувати чутливість до кларитроміцину та, можливо, хінолонів. Доступність ПЛР у більшості лікарень робить цю процедуру зручною для впровадження.
Альтернативний, менш точний, підхід полягає у вивченні поширеності резистентності до кларитроміцину та хінолонів в інших патогенів, таких як респіраторні збудники. Третій, широкодоступний, метод – аналіз результатів ерадикаційної терапії, яка регулярно проводиться всім пацієнтам, та обмін цими даними. Неуспіх лікування на тлі оптимізованої в інших відношеннях терапії є переконливим свідченням наявності резистентності, і таку терапію не слід рекомендувати та застосовувати без підтвердження локальної чутливості культуральним або молекулярним тестуванням.
Положення 1. Розумно рекомендувати проведення тестів на чутливість (молекулярних або посіву) у плановому порядку навіть до призначення терапії 1-ої лінії з метою раціонального використання антибіотиків. Однак загальне використання такої стратегії з урахуванням чутливості в рутинній клінічній практиці потребує вивчення (згода 91%, рівень доказовості – РД – D2).
Резистентність H. pylori до антибіотиків досягла тривожного рівня в усьому світі. Для вибору оптимальних схем ерадикації в кожному регіоні необхідні локальні мережі спостереження.
Маастрихтський консенсус VI рекомендує визначення чутливості до антибіотиків (за допомогою культурального дослідження або ПЛР перед призначенням ерадикаційної терапії 1-ої лінії з метою раціонального використання антимікробних препаратів. Ця стратегія дозволяє оцінити поширеність антибіотикорезистентності у пацієнтів, які раніше не отримували лікування, та вплив такої резистентності на ефективність сучасних схем ерадикації 1-ої лінії. Практичні, економічні та логістичні аспекти необхідно оцінювати і вирішувати відповідно до цільової популяції та клінічних ситуацій, щоб забезпечити призначення найефективнішої терапії 1-ої лінії для ерадикації H. pylori, тобто схем, які, як було доведено, забезпечують рівень виліковності ≥90% у локальних умовах (рис.) за алгоритмом лікування. Це також зумовлює необхідність постійного моніторингу показників ерадикації H. pylori у клінічній практиці, щоб гарантувати підтримання високого рівня ефективності лікування.
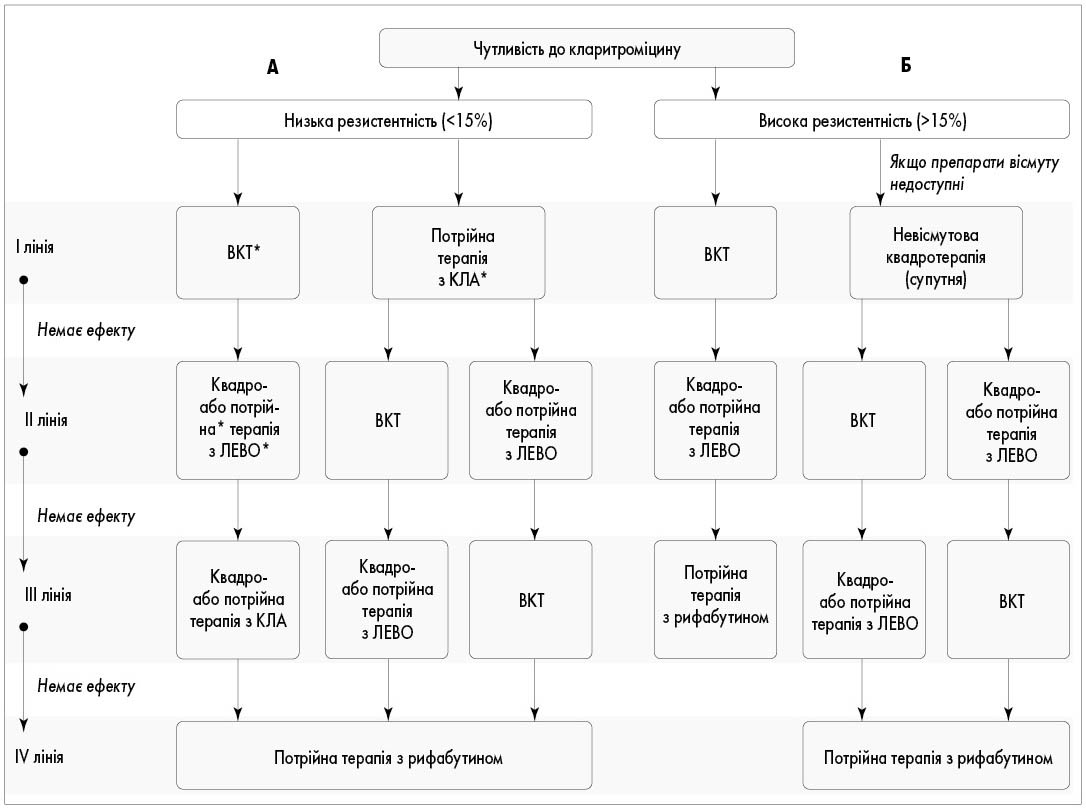 Рис. Алгоритм емпіричного лікування H. pylori 1-ої лінії, а також терапії порятунку (коли тест на чутливість до антибіотиків недоступний) у регіонах із низькою стійкістю (<15%) до кларитроміцину (А) і регіонах із високою (>15%) або невідомою стійкістю до кларитроміцину (Б)
Рис. Алгоритм емпіричного лікування H. pylori 1-ої лінії, а також терапії порятунку (коли тест на чутливість до антибіотиків недоступний) у регіонах із низькою стійкістю (<15%) до кларитроміцину (А) і регіонах із високою (>15%) або невідомою стійкістю до кларитроміцину (Б)
Примітки: ВКТ – вісмут-квадротерапія: вісмут, ІПП, тетрациклін і метронідазол. КЛА – кларитроміцин; потрійна терапія з КЛА: кларитроміцин, ІПП і амоксицилін. Невісмутова квадротерапія (супутня): ІПП, кларитроміцин, амоксицилін і метронідазол; ЛЕВО – левофлоксацин; потрійна терапія з ЛЕВО: левофлоксацин, ІПП і амоксицилін; квадро: те саме і вісмут. *Високі дози ІПП або P-CAB (вонопразан, якщо доступний) + амоксицилін можуть бути іншим варіантом. P-CAB – калій-конкурентний кислотний блокатор.
Положення 2. Якщо дослідження індивідуальної чутливості неможливе, рекомендованим лікуванням 1-ої лінії в регіонах із високою (> 15%) або невідомою резистентністю до кларитроміцину є квадротерапія з препаратом вісмуту (вісмут-квадротерапія – ВКТ). Якщо цей варіант лікування недоступний, можна розглянути можливість використання квадротерапії без вісмуту (згода 92%, РД B1).
У регіонах з рівнем резистентності до кларитроміцину <15% рекомендованою терапією 1-ої лінії залишається ВКТ або потрійна терапія. У регіонах із високою резистентністю до кларитроміцину (>15%) перевагу має квадротерапія з/без вісмуту. Таким чином, Маастрихтський консенсус VI, як і попередні версії, наголошує на важливості врахування локальної антибіотикорезистентності, обмежуючи вибір потрійної терапії регіонами з низькою резистентністю до кларитроміцину.
Положення 3. Тривалість ВКТ має становити 14 днів, за винятком випадків, коли доступна ефективна 10-денна терапія (згода 85%, РД D2).
Положення 4. При виборі квадротерапії без вісмуту (інгібітор протонної помпи – ІПП, амоксицилін, кларитроміцин і нітроімідазол, які застосовують одночасно) кращим вибором має бути супутня терапія з урахуванням її доведеної відтворюваної ефективності та меншої складності порівняно з послідовними та гібридними методами лікування (згода 94%, РД B1).
Положення 5. Рекомендована тривалість квадротерапії без препаратів вісмуту (супутня терапія) становить 14 днів (згода 100%, РД D2).
Положення 6. У регіонах із низькою резистентністю до кларитроміцину як емпіричної терапії 1-ої лінії може бути рекомендована ВКТ або потрійна терапія з кларитроміцином, якщо ефективність такого варіанта буде доведена (згода 94%, РД B1).
Положення 7. Рекомендована тривалість потрійної терапії з кларитроміцином становить 14 днів (згода 100%, РД B1).
Попередні дослідження та метааналізи обґрунтували рекомендацію щодо тривалості потрійної терапії, яка включає ІПП, амоксицилін та кларитроміцин або метронідазол, мінімум 14 днів, що було підтверджено різними консенсусами.
Положення 8. Застосування високих доз ІПП двічі на добу підвищує ефективність потрійної терапії. Залишається незрозумілим, чи підвищують високі дози ІПП двічі на добу ефективність квадротерапії (згода 97%, РД C2).
Положення 9. Ефективність лікування P-CAB у комбінації з антимікробними препаратами перевершує чи не поступається такій традиційної потрійної терапії на основі ІПП при використанні як 1-ої, так і 2-ої лінії, а також перевершує таку у пацієнтів з доведеною стійкістю до антимікробних препаратів (згода 100%, РД B2).
Положення 10. З метою оптимізації лікування вибір емпіричної терапії 2-ої лінії та терапії порятунку має ґрунтуватися на місцевих даних про резистентність, оцінюваних за допомогою тестування чутливості та показників ерадикації, щоб оптимізувати успішність лікування (згода 94%, РД D2).
Положення 11. У разі неефективності ВКТ може бути рекомендована фторхінолонвмісна квадротерапія (або потрійна) або подвійна терапія з високими дозами ІПП та амоксициліну. У разі високої резистентності до фторхінолонів може бути ефективною комбінація вісмуту з іншими антибіотиками чи рифабутином (згода 83%, РД C2).
Положення 12. За неефективності потрійної терапії (ІПП, кларитроміцин, амоксицилін) як терапію 2-ої лінії рекомендують ВКТ, фторхінолоновмісну квадротерапію (потрійну) або подвійну терапію високими дозами ІПП і амоксициліну (згода 84%, РД C2).
Положення 13. Після невдачі безвісмутової квадротерапії рекомендують або ВКТ, або квадротерапію (чи потрійну) із фторхінолоном. Також можна розглянути можливість призначення високодозової подвійної терапії ІПП та амоксициліном (згода 87%, РД C2).
Положення 14. У разі неефективності потрійної терапії 1-ої лінії, що містить кларитроміцин, або чотирикомпонентної терапії без вісмуту, а також ВКТ рекомендується використовувати схему, що містить фторхінолони. У регіонах із відомою високою резистентністю до фторхінолонів слід розглянути можливість застосування ВКТ з різними антибіотиками, терапії порятунку, що містить рифабутин, або подвійної терапії з високими дозами ІПП та амоксициліну (згода 86%, РД В2).
Положення 15. У разі неефективності потрійної терапії 1-ої лінії, що містить кларитроміцин, або чотирикомпонентної терапії, що не містить вісмуту, і терапії 2-ої лінії, що містить фторхінолони, рекомендується використовувати ВКТ. Якщо використання препаратів вісмуту неможливе, слід розглянути подвійну схему лікування високими дозами ІПП та амоксициліну або протокол, що містить рифабутин (згода 84%, РД В2).
Положення 16. У разі неефективності ВКТ 1-ої лінії і фторхінолонвмісної терапії 2-ої лінії рекомендується використовувати потрійну або квадротерапію на основі кларитроміцину тільки в регіоні з низькою (<15%) резистентністю до кларитроміцину. В іншому випадку слід використовувати подвійну терапію з високими дозами ІПП та амоксициліну, або схему, що містить рифабутин, або комбінацію вісмуту з різними антибіотиками (згода 90%, РД C2).
Положення 17. Пацієнтам із підтвердженою алергією на пеніцилін як терапію 1-ої лінії слід рекомендувати ВКТ (ІПП, вісмут, тетрациклін, метронідазол). Як терапію 2-ої лінії – ВКТ (якщо її не призначали раніше) і протокол із фторхінолоном як емпіричні варіанти «терапії порятунку» (згода 85%, РД C2).
Таким чином, Маастрихтський консенсус VI надає оновлені рекомендації щодо лікування інфекції H. pylori, приділяючи особливу увагу блоку терапії. Згідно з консенсусом, вибір ерадикаційної терапії повинен ґрунтуватися на локальних даних про антибіотикорезистентність. У регіонах із низькою резистентністю до кларитроміцину (<15%) рекомендованою терапією 1-ої лінії залишається ВКТ або потрійна терапія (ІПП, амоксицилін, кларитроміцин). Рекомендована тривалість потрійної терапії для досягнення оптимальної ефективності становить 14 днів.
Реферативний огляд статті: P. Malfertheiner, F. Megraud, T. Rokkas et al. (2022) Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report. Gut; 71: 1724-1762. doi:10.1136/gutjnl-2022-327745.
Підготувала Анна Сочнєва
Довідка ЗУ
На ринку України потрійна комбінація ІПП, амоксициліну та кларитроміцину представлена в препараті Пілобакт Нео (ТОВ «Ранбаксі Фармасьютікалс Україна», група компаній «САН ФАРМА») – ефективний набір для ерадикації H. pylori, що відповідає найновішим рекомендаціям Маастрихтського консенсусу VI. Зручна схема прийому та доведена клінічна ефективність роблять Пілобакт Нео препаратом вибору для ерадикаційної терапії 1-ої лінії.
Фармакологічні властивості. Омепразол – ІПП, знижує секрецію соляної кислоти в шлунку. Підвищує рівень pH, забезпечуючи оптимальне середовище для дії антибіотиків. Кларитроміцин – макролідний антибіотик широкого спектру дії, пригнічує синтез білка бактерій. Активний проти H. pylori. Амоксицилін – антибіотик групи напівсинтетичних пеніцилінів. Має бактерицидну дію, інгібує синтез клітинної стінки бактерій. Активний щодо H. pylori. Показання. Ерадикація H. pylori. Спосіб застосування. По 1 капсулі омепразолу, 1 таблетці кларитроміцину та 1 таблетці амоксициліну двічі на добу (вранці та ввечері).
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 1 (71) 2024 р.



