15 листопада, 2020
Актуальні питання сучасної гастроентерології
24-25 вересня в місті Дніпро відбулася науково-практична конференція з міжнародною участю «XII Український гастроентерологічний тиждень». Інститут гастроентерології організував конференцію в режимі онлайн, що дає змогу в цей непростий період не втрачати якості знань і підготовки лікарів. Відбулося цікаве спілкування та була проведена плідна робота з дотриманням усіх протиепідемічних заходів.
.jpg) Розпочалася конференція з доповіді директора ДУ «Інститут гастроентерології НАМН України» (м. Дніпро), доктора медичних наук, професора Юрія Мироновича Степанова «Шлунково-кишкові гепатобіліарні та панкреатичні прояви СOVID-19». Рецептором вірусу SARS-CoV-2 є ангіотензинперетворювальний фермент-2 (АПФ-2), який, окрім епітеліоцитів дихальних шляхів, високо експресується в епітеліальних клітинах шлунково-кишкового тракту (ШКТ), що пояснює зв’язок ШКТ і SARS-CoV-2. Ступінь впливу SARS-CoV-2 наразі активно вивчається. Зареєстровано безліч шлунково-кишкових проявів СOVID-19: діарея, нудота, блювання, біль у животі. Дослідження китайських учених доводять, що РНК SARS-CoV-2 знаходять у калі 83,3% пацієнтів із легкою інфекцією. Ці дані мають значення в дослідженні фекально-орального шляху передачі. Абдомінальні прояви з’являються саме за рахунок наявності у ШКТ рецепторів АПФ-2, що створює потенціал для реплікації вірусу, а також завдяки прямому ушкодженню внаслідок запальних реакцій. Інфікування ентероцитів спричиняє мальабсорбцію, посилення кишкової секреції та діареї (Zhang H. et al., 2020). У деяких випадках абдомінальна симптоматика при СOVID-19 може бути навіть за відсутності респіраторних проявів. Ураження печінки прямопропорційно корелює з тяжкістю перебігу захворювання. Перед початком лікування абдомінальних проявів потрібно виключити іншу інфекційну етіологію, наприклад, аналіз на токсин Clostridium difficile та панель шлунково-кишкових патогенів.
Розпочалася конференція з доповіді директора ДУ «Інститут гастроентерології НАМН України» (м. Дніпро), доктора медичних наук, професора Юрія Мироновича Степанова «Шлунково-кишкові гепатобіліарні та панкреатичні прояви СOVID-19». Рецептором вірусу SARS-CoV-2 є ангіотензинперетворювальний фермент-2 (АПФ-2), який, окрім епітеліоцитів дихальних шляхів, високо експресується в епітеліальних клітинах шлунково-кишкового тракту (ШКТ), що пояснює зв’язок ШКТ і SARS-CoV-2. Ступінь впливу SARS-CoV-2 наразі активно вивчається. Зареєстровано безліч шлунково-кишкових проявів СOVID-19: діарея, нудота, блювання, біль у животі. Дослідження китайських учених доводять, що РНК SARS-CoV-2 знаходять у калі 83,3% пацієнтів із легкою інфекцією. Ці дані мають значення в дослідженні фекально-орального шляху передачі. Абдомінальні прояви з’являються саме за рахунок наявності у ШКТ рецепторів АПФ-2, що створює потенціал для реплікації вірусу, а також завдяки прямому ушкодженню внаслідок запальних реакцій. Інфікування ентероцитів спричиняє мальабсорбцію, посилення кишкової секреції та діареї (Zhang H. et al., 2020). У деяких випадках абдомінальна симптоматика при СOVID-19 може бути навіть за відсутності респіраторних проявів. Ураження печінки прямопропорційно корелює з тяжкістю перебігу захворювання. Перед початком лікування абдомінальних проявів потрібно виключити іншу інфекційну етіологію, наприклад, аналіз на токсин Clostridium difficile та панель шлунково-кишкових патогенів.
Наступна тема, з якою виступив професор, стосувалася подолання больового синдрому при функціональній диспепсії. Передусім причини функціональної диспепсії гетерогенні: психоемоційні чинники, спадкові фактори, інфекція Helicobacter pylori, спосіб життя та характер харчування. На сьогодні в чинних Римських критеріях IV (2016) функціональну диспепсію розподілено на такі форми, як постпрандіальний дистрес-синдром та епігастральний больовий синдром. Залежно від форми в лікуванні застосовують прокінетичні чи спазмолітичні препарати, іноді варто додавати інгібітори протонної помпи (ІПП). Ідеальний спазмолітик для лікування спазмів ШКТ має діяти в зоні проблеми, ефективно знімати спазм, не спричиняти атонії кишечнику, не повинен мати системної дії, а також має бути безпечним. У клінічних дослідженнях доведено, що застосування мебеверину зберігає нормальну перистальтику кишечнику при усуненні гіпермоторики, одночасно зумовлюючи розслаблення спазмованої кишки та запобігаючи розвитку гіпотензії, особливо в пацієнтів із закрепами.
.jpg) Доктор медичних наук, професор Сергій Михайлович Ткач (м. Київ) розповів про ефективність рифаксиміну в лікуванні абдомінального болю при синдромі подразненого кишечнику (СПК). Серед дорослої популяції на СПК страждає 10-15% населення; захворювання найчастіше набуває хронічного перебігу серед гастропатологій. На жаль, етіологія СПК й досі невідома, тому лікування здійснюється залежно від домінувального симптому. При вздутті живота застосовують дієту з обмеженням ферментованих оліго-, ди-, моносахаридів і поліолів (FODMAP), пробіотики та рифаксимін. Якщо переважають абдомінальний біль і дискомфорт, перевагу віддають спазмолітикам, рифаксиміну, трициклічним антидепресантам (ТЦА), елюксадоліну, алосетрону, кишковим секретогенам; при порушенні випорожнень у бік діареї – спазмолітикам, лопераміду, ТЦА, рифаксиміну, елюксадоліну, алосетрону; в бік закрепів – псиліуму, осмотичним проносним, кишковим секретогенам. Майже при всіх формах застосовується рифаксимін, який є селективним кишечним антибіотиком з еубіотичними властивостями; механізм його впливу на зменшення абдомінального болю у хворих на СПК без закрепу може бути пов’язаний із модифікувальним впливом на кишкову мікробіоту.
Доктор медичних наук, професор Сергій Михайлович Ткач (м. Київ) розповів про ефективність рифаксиміну в лікуванні абдомінального болю при синдромі подразненого кишечнику (СПК). Серед дорослої популяції на СПК страждає 10-15% населення; захворювання найчастіше набуває хронічного перебігу серед гастропатологій. На жаль, етіологія СПК й досі невідома, тому лікування здійснюється залежно від домінувального симптому. При вздутті живота застосовують дієту з обмеженням ферментованих оліго-, ди-, моносахаридів і поліолів (FODMAP), пробіотики та рифаксимін. Якщо переважають абдомінальний біль і дискомфорт, перевагу віддають спазмолітикам, рифаксиміну, трициклічним антидепресантам (ТЦА), елюксадоліну, алосетрону, кишковим секретогенам; при порушенні випорожнень у бік діареї – спазмолітикам, лопераміду, ТЦА, рифаксиміну, елюксадоліну, алосетрону; в бік закрепів – псиліуму, осмотичним проносним, кишковим секретогенам. Майже при всіх формах застосовується рифаксимін, який є селективним кишечним антибіотиком з еубіотичними властивостями; механізм його впливу на зменшення абдомінального болю у хворих на СПК без закрепу може бути пов’язаний із модифікувальним впливом на кишкову мікробіоту.
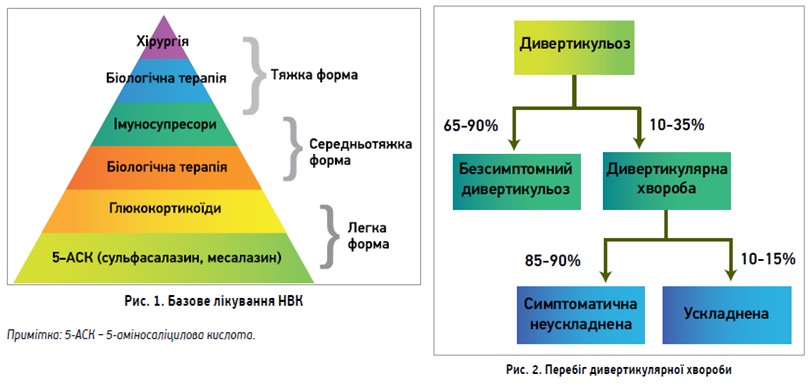
.jpg) Професор Андрій Едуардович Дорофєєв (кафедра терапії Національної медичної академії післядипломної освіти ім. П.Л. Шупика, м. Київ) презентував доповідь «Неспецифічний виразковий коліт (НВК) і дивертикулярна хвороба: схожість патогенезу й особливості терапії». Варто зазначити, що у світі спостерігається зростання частоти захворювань кишечнику. Пацієнти не завжди швидко мають остаточний діагноз, часто потребують постійного прийому препаратів, іноді спостерігаються ускладнення. Зміни зовнішнього середовища є ключовим фактором патогенезу та можуть впливати на імунну відповідь, запальні процеси, зміну геному й мікробіому. Останнім часом (завдяки проведеним дослідженням) покращилося розуміння патогенезу гастропатологій. Фактори ризику реалізуються через порушення слизового бар’єра (мультифункціональної системи, що складається з кишкової мікробіоти, її метаболітів, сигнальних молекул, рецепторного апарату клітин кишкового епітелію), а також структури й активності місцевого імунітету, стінки кишечнику із синтезом слизу й інших компонентів. У багатьох пацієнтів розвивається декілька патологій ШКТ одночасно. Що стосується НВК і дивертикулярної хвороби, то в обох випадках спостерігається зміна кишкової мікробіоти, що поєднує ці дві нозологічні одиниці. При НВК відбуваються зміна кількісного та якісного складу кишкової мікрофлори, синдром надлишкового бактеріального росту (СНБР), зміни метаболічної активності кишкової мікрофлори. Цілі лікування НВК полягають в індукції ремісії, підтриманні ремісії без глюкокортикоїдів (ГК), профілактиці ускладнень і раку кишечнику, запобіганні операціям, покращенні якості життя.
Професор Андрій Едуардович Дорофєєв (кафедра терапії Національної медичної академії післядипломної освіти ім. П.Л. Шупика, м. Київ) презентував доповідь «Неспецифічний виразковий коліт (НВК) і дивертикулярна хвороба: схожість патогенезу й особливості терапії». Варто зазначити, що у світі спостерігається зростання частоти захворювань кишечнику. Пацієнти не завжди швидко мають остаточний діагноз, часто потребують постійного прийому препаратів, іноді спостерігаються ускладнення. Зміни зовнішнього середовища є ключовим фактором патогенезу та можуть впливати на імунну відповідь, запальні процеси, зміну геному й мікробіому. Останнім часом (завдяки проведеним дослідженням) покращилося розуміння патогенезу гастропатологій. Фактори ризику реалізуються через порушення слизового бар’єра (мультифункціональної системи, що складається з кишкової мікробіоти, її метаболітів, сигнальних молекул, рецепторного апарату клітин кишкового епітелію), а також структури й активності місцевого імунітету, стінки кишечнику із синтезом слизу й інших компонентів. У багатьох пацієнтів розвивається декілька патологій ШКТ одночасно. Що стосується НВК і дивертикулярної хвороби, то в обох випадках спостерігається зміна кишкової мікробіоти, що поєднує ці дві нозологічні одиниці. При НВК відбуваються зміна кількісного та якісного складу кишкової мікрофлори, синдром надлишкового бактеріального росту (СНБР), зміни метаболічної активності кишкової мікрофлори. Цілі лікування НВК полягають в індукції ремісії, підтриманні ремісії без глюкокортикоїдів (ГК), профілактиці ускладнень і раку кишечнику, запобіганні операціям, покращенні якості життя.
Згідно із сучасними рекомендаціями, біологічна терапія вже може використовуватись як протизапальний агент при середньотяжких формах НВК (рис. 1); це відображено в сучасних українських протоколах, які були переглянуті 2019 року (в нас є сучасні імунобіологічні препарати: адалімумаб, інфліксимаб, ведолізумаб). Рекомендується призначення інгібіторів фактора некрозу пухлини чи ведолізумабу пацієнтам, рефрактерним до системних ГК та/або імуносупресорів. Для лікування дисбіозу застосовують антибіотики, пробіотики, пребіотики, фекальну трансплантацію. Серед антибіотиків віддають перевагу топічним, як-от рифаксимін. Щодо дивертикулярної хвороби, то епідеміологічні дослідження показали зворотну залежність між кількістю дивертикулярних захворювань і вмістом клітковини в раціоні харчування. Лікують цю патологію зазвичай терапевти, гастроентерологи та сімейні лікарі, адже в 65-90% випадків вона має безсимптомний характер (рис. 2).
Цілі лікування дивертикулярної хвороби полягають в усуненні симптомів (абдомінальні болі, метеоризм, порушення ритму дефекації) та запобіганні розвитку ускладнень. Рекомендовано збільшити кількість клітковини в раціоні. За допомогою досліджень підтверджено, що ефективність лікування підвищується при додаванні рифаксиміну. Топічний антибіотик доцільно використовувати завдяки відсутності резистентності при повторних курсах і тривалому застосуванні, що важливо для профілактики й лікування дивертикуліту. Отже, НВК і дивертикулярна хвороба мають схожі механізми патогенезу. Сучасні схеми лікування таких хворих включають протизапальну терапію та препарати для корекції дисбіозу.
Проведення конференції в режимі онлайн дає змогу також запрошувати іноземних спеціалістів на українські конгреси. Атсумаса Коморі (м. Нагасакі, Японія) доповів про чинні рекомендації щодо холестатичних захворювань печінки. Первинний біліарний холангіт (ПБХ) розвивається внаслідок звуження чи розширення протоків, утворення гранульом або розвитку деструктивного холангіту. Захворювання поширеніше серед жінок середнього віку. Тяжчий перебіг у молодих пацієнтів до 35 років – виживаність без трансплантації печінки значно менша. Урсодезоксихолева кислота (УДХК) – ексклюзивна терапія першої лінії незалежно від тяжкості захворювання. Препаратами другої лінії є обетихолева кислота, фібрати тощо. Під час терапії ПБХ варто робити оцінку клінічної відповіді на лікування через 12 міс. Оцінюються лабораторні показники: білірубін, лужна фосфатаза, аланінамінотрансфераза чи аспартатамінотрансфераза (АСТ). Якщо через рік немає відповіді на лікування, тоді додаються препарати другої лінії. Відповідь на лікування УДХК є прямим прогностичним фактором для перебігу хвороби. Що менша відповідь, то менша ймовірність виживаності без трансплантації. Що стосується первинного склерозувального холангіту (ПСХ), то спільним із ПБХ є термінальна стадія захворювання – холестатичний цироз. Відмінним між цими двома захворюваннями є ураження жовчних протоків різного калібру (малих для ПБХ і великих для ПСХ). Також відмінністю є те, що УДХК у низьких дозуваннях є незамінною для всіх пацієнтів із ПБХ, але ефективна лише для деяких пацієнтів із ПСХ, які дають відповідь.
Професор О.О. Бондаренко розкрила тему «Синдром надлишкового бактеріального росту в умовах панкреатичної недостатності». Первинна екзокринна панкреатична недостатність (ЕПН) розвивається при гострому/хронічному панкреатиті (ХП), муковісцидозі, раку підшлункової залози (ПЗ), цукровому діабеті, панкреатектомії / резекції ПЗ; вторинний прояв ЕПН – при гастроектомії, целіакії, запальних захворюваннях кишечнику, зрідка – при синдромі Золлінгера-Еллісона, СНБР, цукровому діабеті. У нормі при надходженні жирів у дванадцятипалу кишку (ДПК) вони розщеплюються панкреатичною ліпазою. Продукти розпаду жирів повністю всмоктуються в тонкій кишці. В умовах панкреатичної недостатності частка жирів не розщеплюється й у незмінному вигляді проходить у товсту кишку, що спричиняє надлишковий бактеріальний ріст, тобто при порушенні травлення жирів і білків у тонкій кишці вони потрапляють у товсту, розмножується умовно-патогенна й патогенна флора, що зумовлює неспроможність ілеоцекального клапана, закид у тонку кишку товстокишкової мікрофлори, розмноження котрої в тонкій кишці й називають СНБР. Клінічно проявляється метеоризмом, нестійкими випорожненнями зі схильністю до діареї, лієнтореєю, стеатореєю, болями в животі, а також загальними симптомами: ознаки дефіциту жиророзчинних вітамінів, ціанокобаламіну, фолієвої кислоти, заліза, також можуть бути присутні невротичні розлади (слабкість, тривожність, запаморочення). Абдомінальні симптоми СНБР дуже схожі на такі при ХП. Постає запитання: що ж є першопричиною ЕПН? Патологічне хибне коло СНБР полягає в тому, що дефіцит панкреатичних ферментів спричиняє СНБР, унаслідок чого відбувається інактивація ліпази. Основні терапевтичні підходи: антибактеріальна терапія (рифаксимін), адекватна ферментна терапія (панкреатин), усунення дуоденальної гіпертензії (мебеверину гідрохлорид).
Ще одна доповідь, з якою виступив професор С.М. Ткач, стосувалася сучасних підходів до ведення хворих на диспепсію в Україні. Диспепсію слід трактувати і як синдром (вторинна диспепсія), і як самостійну нозологічну одиницю (функціональна диспепсія). Як попередній діагноз у необстеженого первинного пацієнта варто використовувати термін «необстежена диспепсія», а після дообстеження встановлюється вторинна диспепсія (30-40%) або функціональна (60-70%). Вторинна диспепсія діагностується в пацієнтів з органічними, системними чи метаболічними порушеннями, що можуть бути ідентифіковані при проведенні езофагогастродуоденоскопії (ЕФГДС) та ультразвуковому дослідженні органів черевної порожнини, а також шляхом лабораторної діагностики. Helicobacter pylori-асоційована диспепсія, згідно з Кіотським глобальним консенсусом, розглядається як підгрупа вторинної диспепсії, симптоми котрої протягом 6-12 міс зникають або значно поліпшуються після ерадикаційної терапії. Функціональна диспепсія, що є самостійною нозологічною формою, діагностується в пацієнтів із наявністю одного чи більше симптомів, як-от відчуття переповнення шлунка після прийому їжі, швидка насичуваність, епігастральний біль або печіння, котрі неможливо пояснити стандартними клінічними обстеженнями. У хворих на диспепсію віком понад 50 років або за наявності тривожних симптомів (т. зв. червоних прапорців) для виключення неоплазії верхніх відділів ШКТ та іншої органічної патології рекомендоване проведення ЕФГДС (умовна рекомендація, докази помірної якості). У хворих на диспепсію віком до 50 років і відсутністю симптомів тривоги рекомендується проведення неінвазивного тесту на Helicobacter pylori (¹³С-сечовий дихальний тест або визначення фекального антигена Helicobacter pylori) й ерадикаційної терапії в разі позитивних результатів (сильна рекомендація, докази високої якості). Helicobacter pylori-негативним хворим на диспепсію віком до 50 років за відсутності симптомів тривоги рекомендується емпірична терапія ІПП або призначення комбінації ІПП і прокінетика (сильна рекомендація, докази високої якості).
 Доктор медичних наук, професор Володимир Микитович Клименко (м. Запоріжжя) виступив із доповіддю «Хронічний панкреатит: збалансованість етапного терапевтичного та хірургічного лікування на основі нової клінічної класифікації». Сучасне визначення ХП: доброякісне запальне захворювання ПЗ, прогресивні фіброзно-дегенеративні зміни в ПЗ незворотного характеру, тяжкі порушення екзо- й ендокринної функції ПЗ, виражені клініко-анатомічні зміни ПЗ. Серед оперованих 153 хворих (82,4% – чоловіки) переважає алкогольний ХП (77,1%), біліарний генез (7,2%). У патогенезі алкогольного та біліарного ХП провідну роль відіграє панкреатична протокова гіпертензія з розширенням вірсунгової протоки. Своєчасне усунення панкреатичної протокової гіпертензії вирішує основні проблеми ХП. У лікуванні ХП важливо враховувати функціональну складову ПЗ при плануванні консервативного та хірургічного лікування. Лікар має створити умови для збереження власної продуктивної секреції ПЗ та розуміти небезпеку появи панкреатичної протокової гіпертензії задля уникнення розвитку ускладнень перебігу ХП і декомпенсованого стану хворого (тяжкий больовий синдром, екзокринна недостатність, панкреатогенний діабет). Найчастіше саме таких хворих скеровують на хірургічне лікування. У всіх пацієнтів, які потребують хірургічного лікування, відзначається тяжкий ступінь панкреатичної протокової гіпертензії. Об’єктивно спостерігаються розширення вірсунгової протоки в 3-5 разів (до 10-15 мм), стенози, стриктури, конкременти вірсунгової протоки – кальциноз паренхіми ПЗ, утворення ретенціальних і псевдокіст, «псевдотумор» головки ПЗ. Фактори, що зумовлюють таку клінічну картину: тяжкий больовий синдром (нерідко вкрай тяжкий), обструктивний стеноз ДПК, механічна жовтяниця, портальна гіпертензія, панкреатичні свищі (внутрішні, зовнішні), екзокринна недостатність тяжкого ступеня (80-100%), панкреатогенний діабет (40-50%). Саме тому варто вчасно помічати початкові прояви ускладненого перебігу ХП, коли хірургічне лікування буде найефективнішим. Доповідач запропонував схему паренхімозберігальної операції у хворих на ХП: повздовжня тотальна панкреатовірсунгодуоденопапілотомія з ізольованим панкреатикоєюнодуоденоанастомозом. У всіх оперованих із субкомпенсованим типом ХП спостерігався хороший результат: якість життя відповідала якості життя здорових людей. Представлена органозберігальна операція залишає незмінним функціональний резерв ПЗ, створює умови для фізіологічного направлення соку ПЗ і жовчі в ДПК, сприяє нормалізації травлення та має домінувати у хворих на ХП із панкреатичною протоковою гіпертензією.
Доктор медичних наук, професор Володимир Микитович Клименко (м. Запоріжжя) виступив із доповіддю «Хронічний панкреатит: збалансованість етапного терапевтичного та хірургічного лікування на основі нової клінічної класифікації». Сучасне визначення ХП: доброякісне запальне захворювання ПЗ, прогресивні фіброзно-дегенеративні зміни в ПЗ незворотного характеру, тяжкі порушення екзо- й ендокринної функції ПЗ, виражені клініко-анатомічні зміни ПЗ. Серед оперованих 153 хворих (82,4% – чоловіки) переважає алкогольний ХП (77,1%), біліарний генез (7,2%). У патогенезі алкогольного та біліарного ХП провідну роль відіграє панкреатична протокова гіпертензія з розширенням вірсунгової протоки. Своєчасне усунення панкреатичної протокової гіпертензії вирішує основні проблеми ХП. У лікуванні ХП важливо враховувати функціональну складову ПЗ при плануванні консервативного та хірургічного лікування. Лікар має створити умови для збереження власної продуктивної секреції ПЗ та розуміти небезпеку появи панкреатичної протокової гіпертензії задля уникнення розвитку ускладнень перебігу ХП і декомпенсованого стану хворого (тяжкий больовий синдром, екзокринна недостатність, панкреатогенний діабет). Найчастіше саме таких хворих скеровують на хірургічне лікування. У всіх пацієнтів, які потребують хірургічного лікування, відзначається тяжкий ступінь панкреатичної протокової гіпертензії. Об’єктивно спостерігаються розширення вірсунгової протоки в 3-5 разів (до 10-15 мм), стенози, стриктури, конкременти вірсунгової протоки – кальциноз паренхіми ПЗ, утворення ретенціальних і псевдокіст, «псевдотумор» головки ПЗ. Фактори, що зумовлюють таку клінічну картину: тяжкий больовий синдром (нерідко вкрай тяжкий), обструктивний стеноз ДПК, механічна жовтяниця, портальна гіпертензія, панкреатичні свищі (внутрішні, зовнішні), екзокринна недостатність тяжкого ступеня (80-100%), панкреатогенний діабет (40-50%). Саме тому варто вчасно помічати початкові прояви ускладненого перебігу ХП, коли хірургічне лікування буде найефективнішим. Доповідач запропонував схему паренхімозберігальної операції у хворих на ХП: повздовжня тотальна панкреатовірсунгодуоденопапілотомія з ізольованим панкреатикоєюнодуоденоанастомозом. У всіх оперованих із субкомпенсованим типом ХП спостерігався хороший результат: якість життя відповідала якості життя здорових людей. Представлена органозберігальна операція залишає незмінним функціональний резерв ПЗ, створює умови для фізіологічного направлення соку ПЗ і жовчі в ДПК, сприяє нормалізації травлення та має домінувати у хворих на ХП із панкреатичною протоковою гіпертензією.
Гастроентеролог Дорота Васько-Чопник (м. Вроцлав, Польща) розповіла про використання прокінетиків при функціональних розладах ШКТ. Для початку розглянемо таку патологію, як гастроезофагеальна рефлюксна хвороба (ГЕРХ). Етіологічні фактори: порушений кліренс стравоходу (розлади моторики стравоходу, порушення моторики тіла шлунка), слабка нейтралізаційна здатність слини (низька концентрація бікарбонатів, знижена секреція залоз стравоходу), ураження слизової стравоходу, порушення роботи кардіального відділу шлунка (зниження тонусу нижнього сфінктера стравоходу, порушення його релаксації, зниження тиску однієї з ніжок діафрагми, грижа стравохідного отвору діафрагми). Також із боку шлунка розвиток ГЕРХ можуть спричиняти такі фактори, як надмірна секреція, інфікування Helicobacter pylori, наявність пепсину, порушення випорожнення шлунка, дуоденогастральний рефлюкс. Якщо проаналізувати всі етіологічні чинники, можна побачити, що домінують функціональні розлади стравоходу, шлунка та ДПК, меншою мірою – надмірна секреція шлункового соку. Функціональна складова розвитку є спільною для ГЕРХ, СПК і функціональної диспепсії. Ідеальна схема лікування – покращення моторики стравоходу, шлунка, ДПК (прокінетики), зменшення виділення кислоти (ІПП, Н₂-блокатори), захисна дія (для стравоходу – гіалуронова кислота з хондроїтинсульфатом; альгінати, алкіни). Прокінетики відомі вже давно, але часто мають побічні дії. Домперидон не зареєстрований у Польщі, оскільки має аритмогенну дію. Метоклопрамід у різних вікових групах може провокувати неврологічні розлади та гормональні порушення, тому потрібно бути обережним із його застосуванням (тільки за нудоти та блювання тривалістю до 5 днів). Цизаприд також має аритмогенну дію, тому застосовується лише після повного обстеження в кардіолога. Натомість ліки нового покоління стають надією на майбутнє лікування ГЕРХ. Наразі таким препаратом є ітоприд, який має подвійний механізм дії: блокує вивільнення дофаміну, інгібує секрецію холінестерази, завдяки чому сприяє підтриманню оптимального рівня ацетилхоліну та функціонуванню непосмугованих м’язів ШКТ. Для досягнення терапевтичного ефекту при ГЕРХ застосовують ІПП у комплексі з прокінетиками.
 Доктор медичних наук, професор Володимир Володимирович Чернявський (кафедра внутрішньої медицини № 1 Національного медичного університету ім. О.О. Богомольця) розкрив тему «Тривала терапія ІПП чи фундоплікація: що обрати при ГЕРХ?». Це питання залишається відкритим, адже після 4-12 тиж медикаментозного лікування ГЕРХ симптоми часто рецидивують одразу після закінчення курсу, при цьому майже у 80% пацієнтів через 6-12 міс виявляється езофагіт. Підтримувальне протирецидивне лікування необхідне завжди при ерозивній ГЕРХ і в більшості випадків – при неерозивній. При неерозивній формі ГЕРХ можливе використання препаратів на вимогу, що не дуже обтяжує пацієнта. При ерозивному рефлюкс-езофагіті в рекомендаціях із 2003 по 2017 рік зазначається, що потрібне постійне тривале застосування ІПП з титруванням дози до найменшої, котра забезпечує контроль симптомів. З огляду на те що антирефлюксна операція й терапія ІПП мають приблизно однакову ефективність у пацієнтів з езофагеальним синдромом ГЕРХ, терапія ІПП рекомендується як початкове лікування через більшу безпеку (рівень доказовості А). Коли пацієнт з езофагеальним синдромом ГЕРХ відповідає на кислотознижувальне лікування, але не переносить його, антирефлюксну операцію варто рекомендувати як альтернативне лікування. Отже, хірургічне лікування не буде ефективним, якщо не допомагають ІПП при рефрактерній ГЕРХ. Якщо ефективність майже однакова, то потрібна визначеність, кому з пацієнтів рекомендувати терапію, а кому – хірургію. Аналізуючи кожен випадок, ми думаємо над тими мішенями, на які можна вплинути. Терапевтичні мішені – функціональні порушення: секреція соляної кислоти шлунком, тонус нижнього стравохідного сфінктера, уповільнена евакуація зі шлунка. Хірургічні мішені – анатомічні порушення: кила стравохідного отвору діафрагми, вкорочений стравохід. Відносними показаннями до хірургічного лікування є побічні ефекти медикаментозної терапії, труднощі дотримання режиму прийому препаратів, незацікавленість пацієнта в консервативному лікуванні, бажання припинити постійний прийом ліків. Абсолютними показаннями до оперативного втручання є симптоматика, асоційована з великою діафрагмальною килою, регургітація, ларингофарингеальний рефлюкс, патологічний кислий рефлюкс на максимальній дозі ІПП, кореляція симптомів із некислотним рефлюксом на максимальній дозі ІПП. Операція є доволі складною й залежить від досвіду хірурга, адже шлунково-стравохідне з’єднання – комплексне та динамічне утворення; важливо врахувати всі його особливості. Отже, рішення щодо виду лікування приймається індивідуально. Хірургію завжди слід розглядати як альтернативу пожиттєвому прийому ІПП, у разі анатомічних аномалій хірургічне втручання є етіотропним при ГЕРХ. Ключ до припинення прийому ІПП полягає в модифікації способу життя та харчування.
Доктор медичних наук, професор Володимир Володимирович Чернявський (кафедра внутрішньої медицини № 1 Національного медичного університету ім. О.О. Богомольця) розкрив тему «Тривала терапія ІПП чи фундоплікація: що обрати при ГЕРХ?». Це питання залишається відкритим, адже після 4-12 тиж медикаментозного лікування ГЕРХ симптоми часто рецидивують одразу після закінчення курсу, при цьому майже у 80% пацієнтів через 6-12 міс виявляється езофагіт. Підтримувальне протирецидивне лікування необхідне завжди при ерозивній ГЕРХ і в більшості випадків – при неерозивній. При неерозивній формі ГЕРХ можливе використання препаратів на вимогу, що не дуже обтяжує пацієнта. При ерозивному рефлюкс-езофагіті в рекомендаціях із 2003 по 2017 рік зазначається, що потрібне постійне тривале застосування ІПП з титруванням дози до найменшої, котра забезпечує контроль симптомів. З огляду на те що антирефлюксна операція й терапія ІПП мають приблизно однакову ефективність у пацієнтів з езофагеальним синдромом ГЕРХ, терапія ІПП рекомендується як початкове лікування через більшу безпеку (рівень доказовості А). Коли пацієнт з езофагеальним синдромом ГЕРХ відповідає на кислотознижувальне лікування, але не переносить його, антирефлюксну операцію варто рекомендувати як альтернативне лікування. Отже, хірургічне лікування не буде ефективним, якщо не допомагають ІПП при рефрактерній ГЕРХ. Якщо ефективність майже однакова, то потрібна визначеність, кому з пацієнтів рекомендувати терапію, а кому – хірургію. Аналізуючи кожен випадок, ми думаємо над тими мішенями, на які можна вплинути. Терапевтичні мішені – функціональні порушення: секреція соляної кислоти шлунком, тонус нижнього стравохідного сфінктера, уповільнена евакуація зі шлунка. Хірургічні мішені – анатомічні порушення: кила стравохідного отвору діафрагми, вкорочений стравохід. Відносними показаннями до хірургічного лікування є побічні ефекти медикаментозної терапії, труднощі дотримання режиму прийому препаратів, незацікавленість пацієнта в консервативному лікуванні, бажання припинити постійний прийом ліків. Абсолютними показаннями до оперативного втручання є симптоматика, асоційована з великою діафрагмальною килою, регургітація, ларингофарингеальний рефлюкс, патологічний кислий рефлюкс на максимальній дозі ІПП, кореляція симптомів із некислотним рефлюксом на максимальній дозі ІПП. Операція є доволі складною й залежить від досвіду хірурга, адже шлунково-стравохідне з’єднання – комплексне та динамічне утворення; важливо врахувати всі його особливості. Отже, рішення щодо виду лікування приймається індивідуально. Хірургію завжди слід розглядати як альтернативу пожиттєвому прийому ІПП, у разі анатомічних аномалій хірургічне втручання є етіотропним при ГЕРХ. Ключ до припинення прийому ІПП полягає в модифікації способу життя та харчування.
На завершення Олександра Валерійовича Зеленюка нагородили за найкращу доповідь на постерній сесії на тему «Діагностика та хірургічна корекція позапечінкового холестазу при холелітіазі». Друге й третє місця присуджені лікарю Василю Івановичу Гризі з міста Ужгород і співробітниці Інституту гастроентерології Ларисі Вікторівні Демешкіній. Інститут гастроентерології запрошує 26-27 листопада 2020 року на науково-практичну конференцію «VIII наукова сесія Інституту гастроентерології НАМН України. Новітні технології в теоретичній і клінічній гастроентерології».
Підготувала Тетяна Олійник
Медична газета «Здоров’я України 21 сторіччя» № 19 (488), 2020 р.