11 січня, 2022
Нові терапевтичні можливості та майбутні напрямки використання рифаксиміну при лікуванні аутоімунних холестатичних захворювань печінки
 Аутоімунні холестатичні захворювання печінки – це гетерогенні комплексні захворювання з генетичними, імунологічними та екологічними компонентами, що характеризуються прогресуючим імуноопосередкованим запальним руйнуванням жовчних проток, пошкодженням холангіоцитів і гепатоцитів, що призводить до холестазу, фіброзу, біліарного цирозу, термінальної стадії захворювання печінки – гепатоцелюлярної карциноми. Основні причини аутоімунних захворювань печінки досі залишаються не вивченими. Важливу роль у поширеності та патогенезі відіграють фактори навколишнього середовища, мікрооточення кишечнику та пов’язана з ним аномальна кишкова мікробіота (КМ), дисфункції імунної системи, генетичний поліморфізм.
Аутоімунні холестатичні захворювання печінки – це гетерогенні комплексні захворювання з генетичними, імунологічними та екологічними компонентами, що характеризуються прогресуючим імуноопосередкованим запальним руйнуванням жовчних проток, пошкодженням холангіоцитів і гепатоцитів, що призводить до холестазу, фіброзу, біліарного цирозу, термінальної стадії захворювання печінки – гепатоцелюлярної карциноми. Основні причини аутоімунних захворювань печінки досі залишаються не вивченими. Важливу роль у поширеності та патогенезі відіграють фактори навколишнього середовища, мікрооточення кишечнику та пов’язана з ним аномальна кишкова мікробіота (КМ), дисфункції імунної системи, генетичний поліморфізм.
Первинний склерозуючий холангіт (ПСХ) є прототипічним захворюванням осі «кишечник – печінка», яке часто вважається позакишковим проявом запального захворювання кишечнику (ЗЗК). До 80% пацієнтів із ПСХ одночасно страждають на запалення товстої кишки – асоціації, що не спостерігаються при первинному біліарному холангіті (ПБХ) [15].
Хоча передбачувані кишкові тригери гепатобіліарної патології при ПСХ не визначені, мікробні метаболіти або продукти (тобто патогенасоційовані молекулярні структури, PAMP), такі як ліпополісахарид (тобто ендотоксин, LPS) та пептидоглікан (тобто полімер бактеріальної клітинної стінки, PG), були запропоновані як імовірні кандидати. Це становить основу так званої гіпотези мікробіоти ПСХ, коли у деяких пацієнтів із цим захворюванням спостерігається ненормальний склад мікробних метаболітів або аномальна відповідь на них [28].
PAMP виявляються у жовчі або через висхідну інфекцію, або канальцеву секрецію. Також вони можуть змінити функцію холангіоцитів та/або фенотип. Холангіоцити експресують численні рецептори розпізнавання патогенів, включаючи нуклеотидзв’язуючий домен олігомеризації (NOD) і всі відомі толл-подібні рецептори (TLR).
Зв’язування мікробних молекул та інших активаторів запалення з цими рецепторами призводить до сигнальних каскадів, трансдукованих через MyD88-залежні або незалежні шляхи, активації факторів транскрипції (наприклад, NFκB, IRF3), підвищеної експресії різних генів вродженої імунної відповіді, включаючи медіатори профіброзапального процесу і, зрештою, розвитку гепатобіліарного запалення та фіброзу [28].
Складний зв’язок між холангіоцитами, резидентними клітинами печінки та рекрутованими клітинами є важливим напрямком досліджень етіопатогенезу ПСХ (рис. 1).
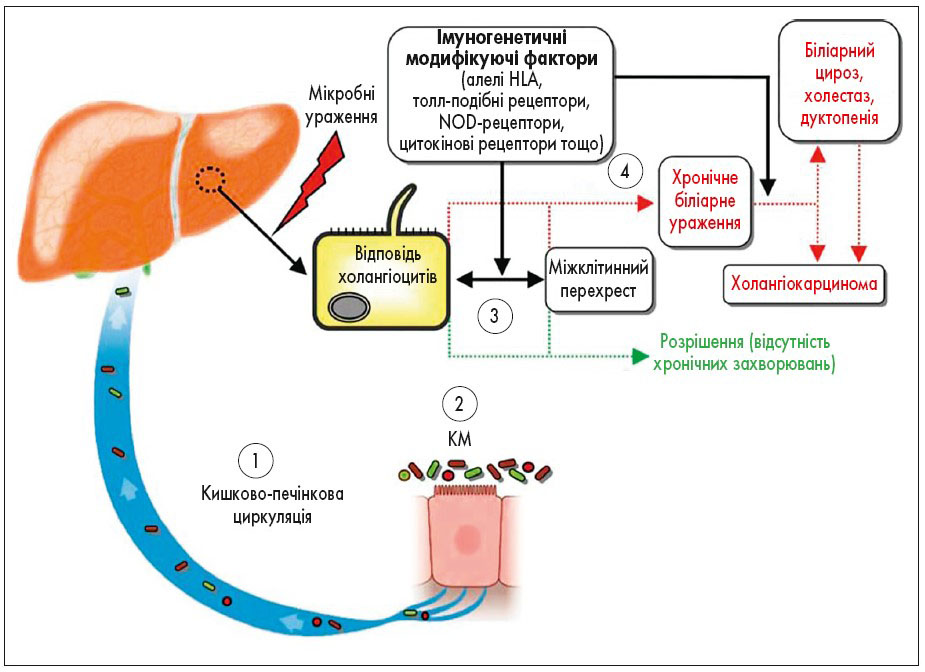 Рис. 1. Концептуальна модель патогенезу ПСХ (J. Tabibian et al., 2014)
Рис. 1. Концептуальна модель патогенезу ПСХ (J. Tabibian et al., 2014)
Запропоновано концептуальну модель етіопатогенезу ПСХ. Холангіоцити існують у мікросередовищі, багатому на потенційні етіологічні медіатори клітинного ураження та активації, включаючи мікробні та немікробні молекули. Імуногенетичні фактори можуть змінювати ці компоненти і таким чином модулювати ініціацію та прогресування ураження жовчних шляхів при ПСХ. ССА – холангіокарцинома, НLА – лейкоцитарний антиген людини, TLR – толл-подібний рецептор, NODs – клас цитоплазматичних клітинних рецепторів, що належать до так званих образорозпізнавальних рецепторів, або PRR. Nod-подібні рецептори разом із толл-подібними рецепторами відіграють важливу роль у вродженому імунітеті [27].
До того ж, окрім порушень бактеріального середовища, у пацієнтів із ПСХ виявлено збільшення росту грибів роду Exophiala та зменшення Sordariomycetes, що свідчить про наявні грибково-бактеріальні взаємодії у КМ пацієнтів із ПСХ [15].
Порушення осі «кишечник – печінка» потенційно є ключовими патогенетичними ланками у розвитку захворювань печінки і, можливо, захворювань жовчовивідних шляхів, враховуючи, що КМ відіграє центральну роль у гомеостазі жовчних кислот [13].
Зниження відтоку жовчі внаслідок імуноопосередкованого ураження тканин та подальше накопичення токсичних продуктів жовчі при ПБХ та ПСХ не тільки призводять до пошкодження біліарного епітелію, але також змінюють склад КМ і жовчної мікробіоти та її взаємодії з господарем.
Відповідно до тісної асоціації ПСХ та ЗЗК, поліклональної відповіді гіпер-IgM на ПБХ та аутоантитіл, які перехресно реагують на мікробні антигени при обох захворюваннях, поширення окремих мікробів призводить до змін у складі КМ або жовчної мікробіоти з подальшою зміною цілісності епітеліальних шарів, що сприяє транслокації бактерій.
У пацієнтів із холестатичними захворюваннями печінки склад КМ відрізняється від здорового контролю. У КМ пацієнтів із ПСХ і ПБХ є деякі відмінні мікробні особливості, що частково збігаються, і це вказує на подібність холестатичних захворювань, хоча можлива патогенетична участь цих загальних мікробних змін невідома. Передбачається, що КМ діє по-різному залежно від механізмів розвитку аутоімунних холестатичних захворювань печінки.
КМ може впливати на холестатичне захворювання печінки через ендогенні молекули, які вона продукує:
- ендобіом: усі біохімічні шляхи у КМ роблять внесок у фізіологію господаря або за рахунок синтезу найважливіших сполук, або спільного метаболізму молекул, що продукуються господарем (наприклад, коротколанцюгових жирних кислот SCFA або вторинних жовчних кислот);
- імунобіом: включає складні взаємодії між імунною системою господаря та КМ, що врівноважує імунну толерантність до коменсальних бактерій з одного боку та захист від патогенів та порушення регуляції імунних відповідей з іншого);
- ксенобіом: КМ бере участь у трансформації екзогенних сполук, включаючи поживні речовини, ліки та негативний вплив навколишнього середовища, що призводить до утворення широкого спектру метаболітів, які виявляються в крові господаря (наприклад, триметиламін, дигоксин та 5-аміносаліцилова кислота; рис. 2).
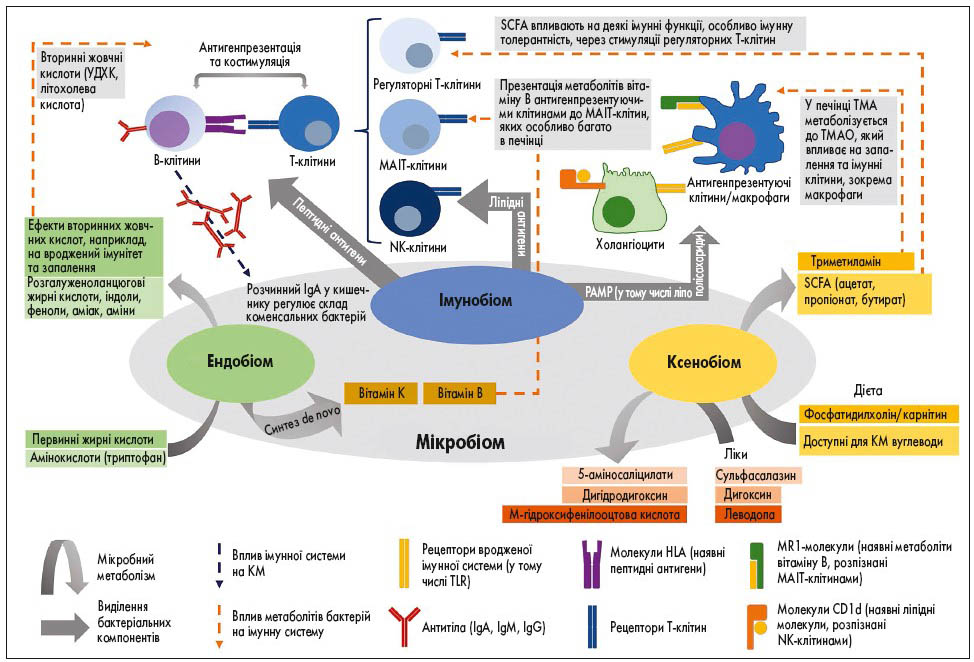
Рис. 2. Взаємодія КМ та господаря: імунобіом, ендобіом та ксенобіом (M. Kummen et al., 2019)
* SCFA – коротколанцюгові жирні кислоти; PAMP – патогенасоційовані молекулярні патерни; TLR – толл-подібні рецептори; HLA – людський лейкоцитарний антиген; MAIT – особливий підтип Т-клітин, асоційованих зі слизовою оболонкою; MR1 – пов’язаний із головним комплексом гістосумісності білок 1; NK-клітини – природні кіллери; TMA – триметиламін; TMAO – триметиламін-N-оксид.
Експериментальні дані та результати спостережень за пацієнтами дають підстави припустити, що змінена видова різноманітність та функції КМ мають відношення до тяжкості та прогресування холестатичних захворювань печінки (рис. 3) [10].
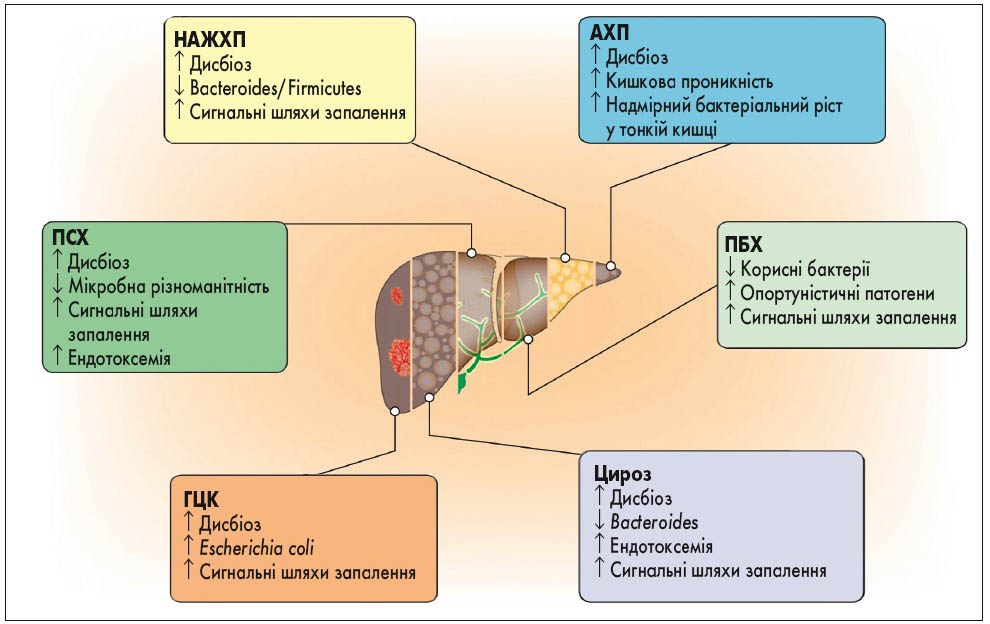 Рис. 3. Роль КМ при захворюваннях печінки (K. Schwenger et al., 2019)
Рис. 3. Роль КМ при захворюваннях печінки (K. Schwenger et al., 2019)
При оцінці КМ у пацієнтів із ПСХ було виявлено низьку бактеріальну різноманітність і надмірну присутність бактерій роду Rothia, Enterococcus, Streptococcus, Clostridium, Veillonella, Haemophilus Fusobacterium та Lactobacillus [2]. У кишечнику пацієнтів із ПСХ також виявлено збагачення ентерококами, що корелює із сироватковими рівнями лужної фосфатази (ЛФ) – клінічного маркера холестазу.
Дослідження M. Kummen та співавт. (2017) підтвердило, що чисельність Veillonella була помітно більшою у пацієнтів із ПСХ порівняно зі здоровим контролем [13].
Біопсія кишечнику показала, що загальний профіль КМ людей із ПСХ характеризувався збагаченням Barnesiellaceae та зниженням Clostridiales [24, 26, 27]. Згідно з даними досліджень, ці зміни призводять до дисбіозу кишечнику та пов’язані з патогенезом ПСХ, викликаючи бактеріобілії, які, у свою чергу, активують прозапальний шлях у холангіоцитах, що веде до фіброзу та запалення. Бактеріобілії також можуть грати роль у молекулярній мімікрії через ендотоксемію, призводячи до утворення антитіл і викликаючи імуноопосередковане пошкодження жовчних шляхів [10, 27].
Дисбіоз при ПСХ та ПБХ пов’язаний із дефіцитом інфламасом, зокрема NLRP 3 та 6, що призводить до підвищеної експресії фактору некрозу пухлини альфа (ФНП-α). Підвищена активація та продукція TLR4 та прозапальних цитокінів при дисбіозі також можуть призводити до залучення та активації імунних клітин печінки, що сприяє прогресуванню аутоімунних захворювань печінки [10]. Повногеномні асоціативні дослідження виявили локуси ризику розвитку ПСХ, пов’язані з імунорегуляцією: прикладом є фукозилтрансфераза-2, яка впливає на мікробний склад, модулює сприйнятливість до інфекції та пов’язана із ЗЗК.
ПСХ пов’язаний із портальною бактеріємією, бактеріобіліями та 16s рибосомальною рибонуклеїновою кислотою в жовчі [27]. Мікробні тригери впливають на прогресування ПСХ, змінена КМ може викликати клінічні ускладнення у пацієнтів із ПСХ.
Подібно до ПСХ, КМ у пацієнтів із ПБХ характеризується зниженим бактеріальним альфа-різноманіттям і великими відмінностями в бета-різноманітності у декількох родах, у тому числі Haemophilus, Veillonella і Streptococcus. Ці мікробні маркери (наприклад, чисельність Veillonella, яка позитивно корелює з інтерлейкіном (IL) 1β, IL-8 та імуноглобуліном A) можуть бути використані як потенційні терапевтичні або прогностичні біомаркери у майбутньому. Пацієнти з ПСХ демонструють значне зменшення бактеріальної різноманітності, яке менш виражене при ПБХ, але в обох випадках спостерігається збагачення специфічних таксонів, наприклад Streptococcus, Haemophilus та Veillonella. Ці зміни можуть бути пов’язані з розвитком цирозу [13].
K. Schwenger та співавт. повідомили про проведене дослідження (2019), яке показало, що у пацієнтів із ПБХ були низькі рівні потенційно корисних кишкових бактерій, включаючи Acidobacteria, Lachnobacterium spp., Bacteroides eggerthii та Ruminococcus bromii, але більш високі рівні патогенних мікроорганізмів, таких як Veillonella, Proteobacteria, Enterobacteriacea, Neisseriaceae, Spirochaetaceae, Streptococcus, Klebsiella, Actinobacillus pleuropneumoniae, Anaeroglobus geminatus, Enterobacter asburiae, Haemoo. Вони також виявили, що ці зміни в КМ були пов’язані з підвищеними показниками ураження печінки та запальними цитокінами сироватки, що дозволяє припустити, що змінений КМ може бути залучений до розвитку ПБХ [10]. Виявлені зміни (особливо змінена кількість Veillonella) пов’язані з прогресуванням фіброзу, цирозу печінки, іншими нециротичними запальними та фіброзними захворюваннями (ідіопатичним та кістозним фіброзом легень, ревматоїдним артритом, хворобою Крона, ураженням клубової кишки), прогнозом хвороби. Вони можуть бути використані надалі як потенційні терапевтичні або прогностичні біомаркери. Дані, отримані у ході досліджень за участю пацієнтів із ПСХ та ПБХ, дають підстави припустити, що імунореактивність щодо бактеріальних антигенів, тобто імунобіому, може бути залучена до патогенезу захворювання.
У патогенезі ПБХ антимітохондріальні антитіла відіграють ключову роль. Ці та інші антитіла перехресно реагують із бактеріальними білками бактерій, що свідчить про імунну відповідь, спрямовану проти мікробіому. При розвитку ПСХ перинуклеарні антинейтрофільні цитоплазматичні антитіла (p-ANCA) перехресно реагують з білком поділу мікробних клітин FtsZ, який має структуру, аналогічну ізотипу людського аутоантигену β-тубуліну, що може відображати аномальну імунну відповідь на коменсальні бактерії у пацієнтів.
Індуковані мікробіомом γδ Т-клітини продукують IL-17, який може бути причиною хронічного запалення при захворюваннях печінки, таких як ПСХ, припускаючи, що імунобіом кишечнику змінює фенотип захворювання. Було показало, що γδ Т-клітини з печінки пацієнтів із ПСХ продукують IL-17, на відміну від γδ Т-клітин пацієнтів з іншими захворюваннями печінки, і лікування блокаторами γδ Т-клітинних рецепторів послаблює фіброз і запалення печінки [12].
У дослідженні J. Tabibian та співавт. (2016) було показано, що у пацієнтів із ПСХ зміни у гомеостазі жовчних кислот через відсутність мікробів та виробництво вторинних жовчних кислот ендобіомами є рушійною силою цього захворювання [26].
Існує концепція, що запалення жовчовивідних шляхів у пацієнтів із ПСХ може бути викликане Т-клітинами у кишечнику, які згодом переміщуються в печінку [27]. Вважається, що білок-1 судинної адгезії (VAP-1) відіграє важливу роль у передачі лімфоцитів з кишечнику в печінку, що є важливим етапом у патогенезі ПСХ та ЗЗК. Відомо, що Veillonella та інші роди, асоційовані з ПСХ, мають гени, що кодують аміноксидази, які продукують первинні аміни, наприклад метиламіни, які діють як субстрати для VAP-1. Триметиламін (ТМА), повністю залежний від їжі та бактерій метаболіт, також викликає холестаз, проліферацію холангіоцитів та холангіофіброз в експерименті. ТМА перетворюється печінкою на триметиламін-N-оксид (ТМАО), який асоціюється з більш коротким виживанням без трансплантації при ПСХ. Більш того, сироваткові аутоантитіла проти глікопротеїну-2 підшлункової залози (GP2), білка, який сприяє імунним відповідям проти бактерій та зв’язуванню бактеріальних білків, виявляються у більшості пацієнтів із ПСХ і пов’язані з підвищеним ризиком розвитку холангіокарциноми.
У сукупності ці дані показують взаємозв’язок ендобіому, ксенобіому, імунобіому та підкреслюють важливість подальших досліджень, які включатимуть дані про усі ці біоми для з’ясування ролі кишкових мікробів, їх функцій і метаболітів як основних патогенетичних ланок при холестатичних захворюваннях.
Концепція кишкової транслокації бактеріальних продуктів як фактора хронічного запалення становить великий інтерес для розширення терапевтичних можливостей у лікуванні аутоімунних холестатичних захворювань печінки – ПСХ, ПБХ, IgG-асоційованого склерозуючого холангіту. Гепатобіліарні ушкодження при ПСХ та ПБХ виникають через підвищену ентерогепатичну циркуляцію мікробних молекул, аномального мікробного складу (метаболітів), аберантної реакції господаря на мікробні молекули або через комбінації цих факторів. Ці дані можуть бути передумовою для застосування антибіотиків у лікуванні аутоімунних холестатичних захворювань печінки.
Клінічні дослідження, що описують стабілізацію ферментів печінки після лікування антибіотиками, додатково підтверджують гіпотезу про те, що мікробні тригери можуть бути залучені до індукції та/або прогресування ПСХ та ПБХ [8]. Існують переконливі докази того, що мікробні агенти та/або зміни кишкової/жовчної мікробіоти беруть участь у патогенезі ПБХ і ПСХ. Застосування антибіотиків може бути новим та альтернативним варіантом лікування цих аутоімунних холестатичних захворювань.
Рифаксимін альфа – високоефективний селективний кишковий антибіотик-еубіотик із низькою системною абсорбцією (<0,4%), підвищеною концентрацією у випорожненнях, відсутністю системної токсичності та міжлікарських взаємодій. Препарат має широкий бактерицидний спектр дії щодо багатьох кишкових патогенів, включаючи ентеротоксигенні та ентероагрегантні: E. coli, Salmonella, Shigella, Campylobacter. Основними ефектами рифаксиміну альфа є інгібування та зміна кишкових патогенів. Препарат має високий профіль безпеки, не має системних побічних ефектів.
Позитивний ефект рифаксиміну альфа у пацієнтів із ПСХ та ПБХ пов’язаний із модуляцією КМ – зміна її складу може зменшити запалення та фіброз у жовчних протоках [15].
Крім антибактеріальної дії, рифаксимін альфа має протизапальну активність, зменшуючи запалення слизових оболонок, а також відновлює функцію епітеліального бар’єру. Препарат чинить прямий вплив на фізіологію кишкових епітеліальних клітин, пов’язаний зі зниженням прикріплення й інтерналізації бактерій та епітеліальних відповідей на медіатори запалення. Модулює КМ, не впливаючи на її нормальний склад, інгібує бактеріальну транслокацію в кишечнику [29].
Рифаксимін альфа може пригнічувати ріст патогенних бактерій E. coli, Enterococcus faecalis, Staphylococcus aureus, Klebsiella, Enterobacterium, Bacillus filiformis та інших грамнегативних ентеробактерій і збільшувати кількість Lactobacilli та не впливає на нормальний склад МК [29].
Рифаксимін альфа викликає помірне зниження Veillonellaceae та Streptococcus і збільшення Eubacteriaceae, тим самим сприяє зниженню маркерів холестазу при ПСХ та ПБХ [13]. Рифаксимін альфа модулює місцеве імунне середовище у шлунково-кишковому тракті, а також чинить прямий вплив на епітеліальні клітини кишечнику, модулювання прикріплення та інтерналізації бактерій, інгібування бактеріальної транслокації в кишечнику. У цьому сенсі зміни у взаємодії господаря та бактерії за рахунок модуляції КМ є привабливим альтернативним механізмом дії, оскільки тільки прикріплені до епітелію бактерії здатні передавати сигнал господарю, що призводить до імунних відповідей (рис. 4).
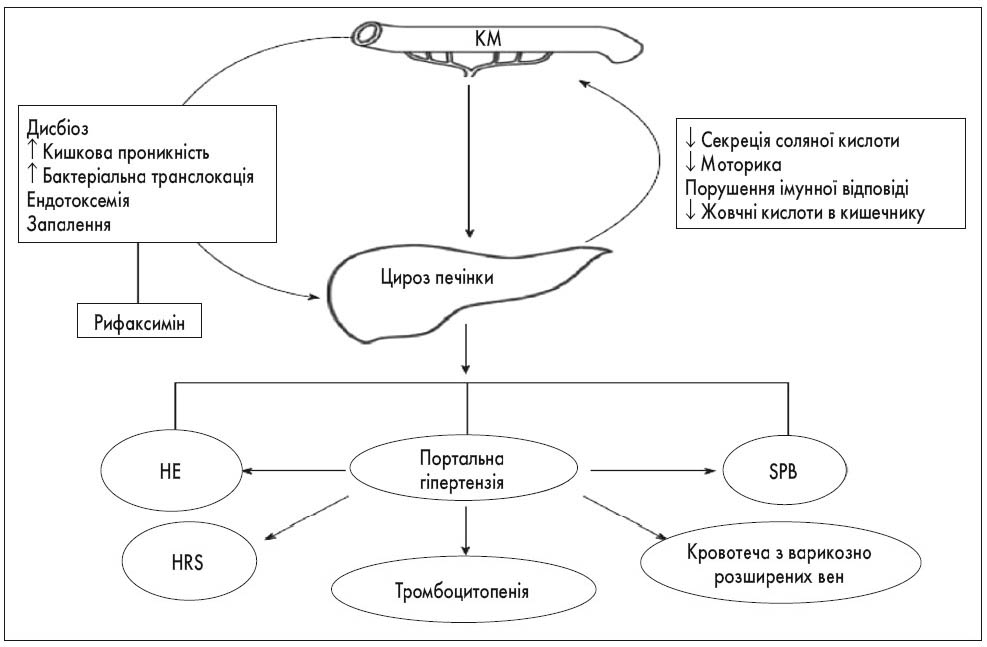 Рис. 4. Вплив рифаксиміну на вісь «печінка – кишечник» (F. Ponziani et al., 2015)
Рис. 4. Вплив рифаксиміну на вісь «печінка – кишечник» (F. Ponziani et al., 2015)
* HE – енцефалопатія; HRS – гепаторенальний синдром; SPB – спонтанний бактеріальний перитоніт.
Рифаксимін зменшує ендотоксемію, бактеріальну транслокацію, протидіє розвитку синдрому підвищеного бактеріального росту, модулює склад та функцію КМ. Дослідження підтвердили, що рифаксимін альфа пригнічує адгезію та переміщення бактерій, знижує їх вірулентність та регулює метаболізм КМ у пацієнтів з ураженням печінки. Дослідження S. Maccaferri та співавт. (2010) показали збільшення концентрації Bifidobacterium та Lactobacillus у випорожненнях пацієнтів із ЗЗК після лікування рифаксиміном альфа [17]. Таким чином, рифаксимін альфа спричинює імуномодулювальну дію на склад і функцію КМ, покращує бар’єрну функцію кишечнику, знижує вірулентність бактерій, усуває дисбіоз кишечнику при патології печінки, сприятливо впливає на сироваткові прозапальні цитокіни й рівні вторинних жовчних кислот у випорожненнях, що дає підстави для застосування препарату для зниження маркерів холестазу у пацієнтів з аутоімунними холестатичними захворюваннями печінки.
Література
- Shah A., Macdonald G., Morrison M. et al. Targeting the Gut Microbiome as a Treatment for Primary Sclerosing Cholangitis: A Conceptional Framework. // Am. J. Gastroenterol. – 2020. – Vol. 115 (6). – Р. 814-822.
- Bajer L., Kverka M., Kostovcik M., Macinga P., Dvorak J., Stehlikova Z. Distinct gut microbiota profiles in patients with primary sclerosing cholangitis and ulcerative colitis // World J. Gastroenterol. – 2017. – Vol. 23. – P. 4548-4558.
- Blesl A., Stadlbauer V. The Gut-Liver Axis in Cholestatic Liver Diseases. // Nutrients. – 2021. – Vol. 13 (3). – Р. 1018. doi: 10.3390/nu13031018.
- Wolf D. What is the role of antibiotics in the treatment of encephalopathy in cirrhosis? // Medscape, Sunday, September 26, 2021.
- Gao J., Gilliland M., Owyang C. Rifaximin, gut microbes and mucosal inflammation: uncovering a complex relationship. // Intestinal Microbes. – 2014. – Vol. 5. – P. 571-575.
- Jepsen P., Gronbeck L., Vilstrup H. Worldwide incidence of autoimmune diseases. // Dig. – 2015. – Vol. 33, Suppl. 2. – Р. 334.
- Tabibian J., Gossard A., El-Youssef M. et al. Prospective clinical trial of rifaximin therapy for patients with primary sclerosing cholangitis. //Am. J. Ther. – 2017. – Vol. 24 (1). – P. 56-63. doi: 10.1097/MJT.0000000000000102.
- Mattner J. Impact of Microbes on the Pathogenesis of Primary Biliary Cirrhosis (PBC) and Primary Sclerosing Cholangitis (PSC). // Int. J. Mol. Sci. – 2016, 17, 1864; doi:10.3390/ijms1711186.
- Jiao Y., Wu L., Huntington N., Zhang X. Crosstalk Between Gut Microbiota and Innate Immunity and Its Implication in Autoimmune Diseases. // Front Immunol. – 2020 Feb 21; 11: 282. doi:10.3389/fimmu.2020.00282. Collection 2020.
- Schwenger K., Clermont-Dejean N., Allard J. The role of the gut microbiome in chronic liver disease: the clinical evidence revised. // JHEP Rep. – 2019. – Vol. 1 (3). – P. 214-226.
- Kaji K., Saikawa S., Takaya H. et al. Rifaximin Alleviates Endotoxemia with Decreased Serum Levels of Soluble CD163 and Mannose Receptor and Partial Modification of Gut Microbiota in Cirrhotic Patients. //Antibiotics. – 2020, 9, 145. – P. 1-13. doi:10.3390/antibiotics9040145; www.mdpi.
- Khan M., Wang H. Environmental Exposures and Autoimmune Diseases: Contribution of Gut Microbiome. // Front Immunol. – 2020. – Vol. 10: 3094. 10.3389/fimmu.2019.03094.
- Kummen M., Holm K., Anmarkrud J., Nygard S., Vesterhus M., Hoivik M. The gut microbial profile in patients with primary sclerosing cholangitis is distinct from patients with ulcerative colitis without biliary disease and healthy controls. // Gut. – 2017. – Vol. 66. – Р. 611-619.
- You L., Tang R., Leung P. et al. Bile acids and intestinal microbiota in autoimmune cholestatic liver diseases. // Autoimmun Rev. – 2017. – Vol. 16 (9). – P. 885-896. doi:10.1016/j.autrev.2017.07.002.
- Mazzetti M., Marconi G., Mancinelli M. et al. The Management of Cholestatic Liver Diseases: Current Therapies and Emerging New Possibilities. // J. Clin. Med. – 2021. – Vol. 8. – Р. 1763. doi: 10.3390/jcm10081763.
- Kummen M. The gut microbial influence on cholestatic liver disease. // Liver International. – 2019. – Vol. 39. – P. 1186-1196.
- Maccaferri S., Vitali B., Klinder A. et al. // Journal of Antimicrobial Chemotherapy. – 2010. – Vol. 65, Iss. 12. – P. 2556-2565. https://doi.org/10.1093/jac/dkq345.
- Giuffre M., Campigotto M., Campisciano G. et al. A story of liver and gut microbes: how does the intestinal flora affect liver disease? A review of the literature. // Am. J. Physiol. Gastrointest. Liver Physiol. – 2020. – Vol. 318. – P. 889-906. doi:10.1152/ajpgi.00161.2019.
- Bass N., Mullen K., Sanyal A. et al. Rifaximin Treatment in Hepatic Encephalopathy. // The New England Journal of Medicine. – 2010. – Vol. 362, no. 12. – Р. 1071-1081.
- Kimer N., Gudmann N. et al. No effect of rifaximin on soluble CD163, mannose receptor or type III and IV neoepitope collagen markers in decompensated cirrhosis: Results from a randomized, placebo controlled trial. // PLoS One. – 2018. – Vol. 13 (9): e0203200.
- Caraceni P., Vargas V., Sola E. et al. The Use of Rifaximin in Patients With Cirrhosis. // Hepatology. – 2021. – Vol. 74, Issue 3. – P. 1660-1673.
- Santiago P., Scheinberg A. and Levy C. Cholestatic liver diseases: new targets, new therapies. // Therapeutic Advances in Gastroenterology. – 2018. – Vol. 11: 1-15. doi:10.1177/ 1756284818787400.
- Rivkin A., Gim S. Rifaximin – new therapeutic indication and future direction. // Clinical therapeutics. – 2011. – Vol. 33. – Is. 7. – P. 812-827.
- Rossen N., Fuentes S., Boonstra K., D’Haens G., Heilig H., Zoetendal E. The mucosa-associated microbiota of PSC patients is characterized by low diversity and low abundance of uncultured Clostridiales II. // J. Crohns Colitis. – 2015. – Vol. 9. – Р. 342-348.
- Iravani S., Dooghaie-Moghadam A. et al. An update on treatment options for primary sclerosing cholangitis. // Gastroenterol. Hepatol. Bed. Bench. – 2020. – Vol. 13 (2). – P. 115-124.
- Tabibian J., O’Hara S., Trussoni C. et al. Absence of the intestinal microbiota exacerbates hepatobiliary disease in a murine model of primary sclerosing cholangitis. // Hepatology. – 2016. – 63: 185-196.
- Tabibian J., O’hara S., Lindor K. et al. Primary sclerosing cholangitis and the microbiota: current knowledge and perspectives on etiopathogenesis and emerging therapies. // Scand. J. Gastroenterol. – 2014. – Vol. 49 (8). – P. 901-908.
- Torres J., Bao X., Goel A., Colombel J., Pekow J., Jabri B. The features of mucosa-associated microbiota in primary sclerosing cholangitis. // Aliment. Pharmacol. Ther. – 2016. – Vol. 43. – Р. 790-801.
- Xin-Yue Lv, Hui-Guo Ding, Jun-Fu Zheng. Rifaximin improves survival in cirrhotic patients with refractory ascites: A real-world study. // WJG. – 2020. – Vol. 26, Is. 2. – Р. 199-218.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 4 (62) 2021 р.



