31 жовтня, 2020
Невирусологические лабораторные маркеры в контексте COVID‑19
 Более 100 лет назад, в 1918 году, пандемия гриппа (т. н. испанка) унесла по меньшей мере 50 млн жизней по всему миру (по некоторым данным, 100 млн). Теперь человечество сталкивается с другой пандемией – вспышкой нового коронавируса SARS-CoV‑2, с которым, возможно, придется сосуществовать в течение длительного времени.
Более 100 лет назад, в 1918 году, пандемия гриппа (т. н. испанка) унесла по меньшей мере 50 млн жизней по всему миру (по некоторым данным, 100 млн). Теперь человечество сталкивается с другой пандемией – вспышкой нового коронавируса SARS-CoV‑2, с которым, возможно, придется сосуществовать в течение длительного времени.
С декабря 2019 года ученым и врачам много стало известно о COVID‑19 [1]. Уровень смертности вследствие данного заболевания оценивается в диапазоне от 0,5 до 3,5%, а клинический прогноз составляет 40% (легкая форма), 40% (умеренная), 15% (тяжелая), 5% (критическая). К группам повышенного риска относятся лица с коморбидностью и пожилые люди (сердечно-сосудистые заболевания, диабет, гипертензия, респираторные заболевания), лица с иммунодефицитом (ВИЧ-инфекция, низкий уровень CD4), беременные.
На данном этапе в борьбе с COVID‑19 очень важным является определение лабораторных предикторов, которые позволят стратифицировать риск развития легких и тяжелых форм заболевания, дифференцировать низкий и высокий риск смертности, что предоставит возможность оптимизировать лечение [2].
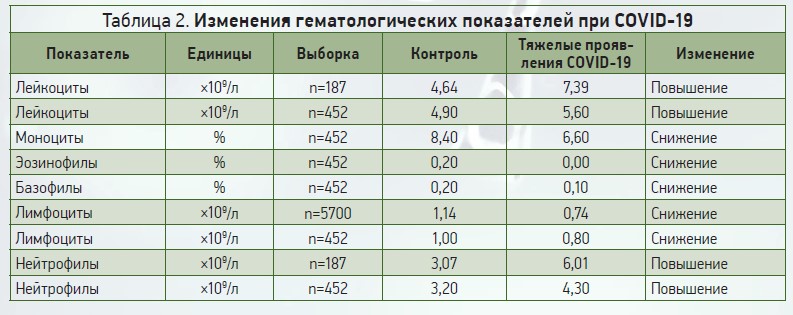
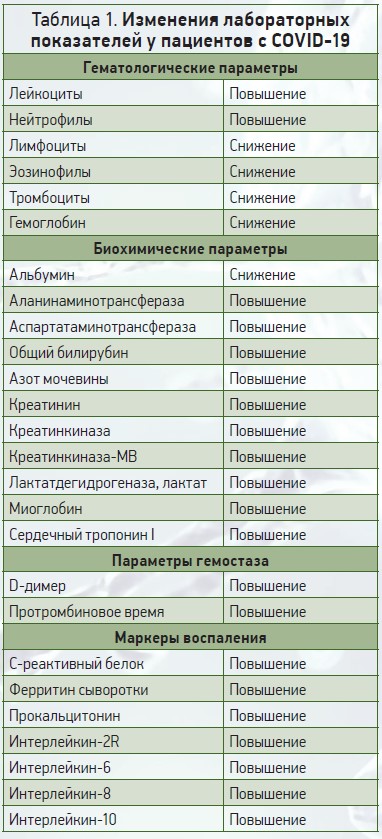
Важные лабораторные показатели, которые изменяются у пациентов с COVID‑19, представлены в таблице 1.
Гематологические параметры
Изменения гематологических параметров были описаны в первых исследованиях у пациентов с COVID‑19 (табл. 2) [3]. Наиболее распространенные гематологические изменения включают лимфоцитопению [4, 5], нейтрофилию [6-8], легкую тромбоцитопению (35%) или реже тромбоцитоз [9]. О присутствии атипичных реактивных лимфоцитов имеются лишь единичные сообщения [10].
Лимфоцитопения
Лимфоцитопения – это снижение количества лимфоцитов в абсолютных значениях в общем анализе крови ниже 1,0×109/л. Лимфоциты играют решающую роль в поддержании иммунного гомеостаза организма и принимают участие в ответе на действие внешних патогенных факторов. В основе возможности обеспечить эффективную стратегию лечения COVID‑19 лежит понимание механизмов снижения уровня лимфоцитов в крови.
Было предложено четыре потенциальных механизма, ведущих к дефициту лимфоцитов [11, 12]:
1) вирус может напрямую воздействовать на лимфоциты, что приводит к их гибели;
2) лимфоциты экспрессируют коронавирусный рецептор – ангиотензинпревращающий фермент-2, который является мишенью вируса;
3) вирус может непосредственно разрушать лимфатические органы;
4) острое снижение лимфоцитов связано с дисфункцией лимфоцитов при прямом повреждении вирусом таких органов, как тимус и селезенка.
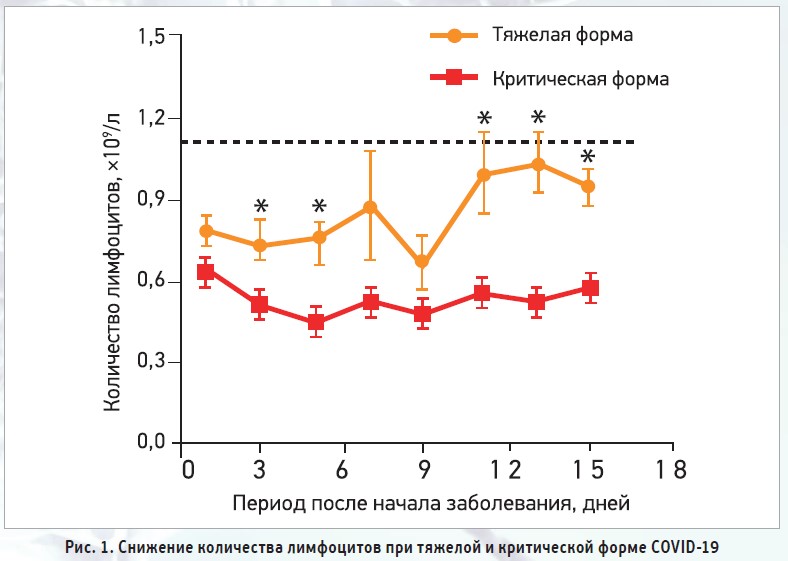
Фундаментальные исследования подтвердили, что фактор некроза опухоли (ФНО), интерлейкин‑6 (ИЛ‑6) и другие провоспалительные цитокины могут индуцировать дефицит лимфоцитов [13]. Ингибирование лимфоцитов возможно под влиянием метаболических молекул при гиперлактической ацидемии, связанной с повышенным уровнем лактата, что приводит к подавлению пролиферации лимфоцитов [14]. Именно поэтому показатель лимфоцитопении является надежным и эффективным маркером тяжести течения COVID‑19 (рис. 1).
У детей лимфопения встречается значительно реже. В одном из метаанализов [15] сообщается о выявлении лимфоцитопении только у 3% детей в отличие от других подобных вирусных инфекций (таких как SARS), при которых лимфоцитопения была значительно более распространенным явлением у детей.
Лейкоцитоз
Лейкоцитоз (независимо от того, представляет ли он нейтрофилию, лимфоцитоз или оба вместе) отмечается у немногих пациентов, инфицированных SARS-CoV‑2. Так, лейкоцитоз был выявлен у 11,4% пациентов с тяжелой формой заболевания по сравнению с 4,8% пациентов с легкой или средней формой [16].
Нейтрофилия
Данные по нейтрофилии являются неполными. Тем не менее полученные результаты свидетельствуют о том, что нейтрофилия является выражением «цитокинового шторма» и гипервоспалительного состояния, которые играют важную роль в патогенезе COVID‑19 [17]. Описаны циркулирующие гранулоциты с цитоплазматическими и ядерными морфологическими аномалиями. Они обычно предшествуют увеличению реактивных лимфоцитов [18]. Нейтрофилия может также указывать на наложение бактериальной инфекции.
Тромбоцитопения
Тромбоцитопения является показателем тяжелого течения COVID‑19, о чем свидетельствует недавний обзор доступных рецензируемых данных. Это неудивительно, поскольку подсчет тромбоцитов используется такими системами, как Multiple Organ Dysfunction Score, Simplified Acute Physiology Score II, Acute Physiology и Chronic Health Evaluation II (как индикатор тяжести заболевания). Метаанализ 9 исследований показал, что тромбоцитопения отмечалась у большинства пациентов. У пациентов с тяжелой формой тромбоцитопения выявляется в 57,7% случаев против 31,6% с менее значительными симптомами [19]. Кроме того, развернутый общий анализ крови, при котором определяются средний объем тромбоцитов и количество ретикулярных тромбоцитов, может быть полезен при стратификации риска и принятии клинического решения.
NLR – коэффициент соотношения нейтрофилов к лимфоцитам как индикатор прогноза COVID‑19
Исследования в Китае в период борьбы с коронавирусом показали, что пороговое значение NLR=3,13 (чувствительность – 0,87, специфичность – 0,71).
Рекомендации:
- если NLR >3,13 (возраст >50 лет), то пациенты должны быть переведены в палату интенсивной терапии;
- если NLR <3,13 (возраст <50 лет), то пациенты могут самоизолироваться дома или в стационаре больницы.
NLR считается важным параметром для прогнозирования и управления рисками при COVID‑19.
Биохимические параметры
Биохимический мониторинг пациентов с COVID‑19 с помощью диагностических исследований in vitro имеет решающее значение для оценки тяжести и прогрессирования заболевания, а также помогает вести наблюдение при терапевтическом вмешательстве. К таким тестам относятся лактатдегидрогеназа (ЛДГ), аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза, азот мочевины, креатинин, креатинкиназа, общий билирубин, миоглобин, тропонины, С-реактивный белок (СРБ), ферритин, альбумин, калий, лактат.
Лактатдегидрогеназа
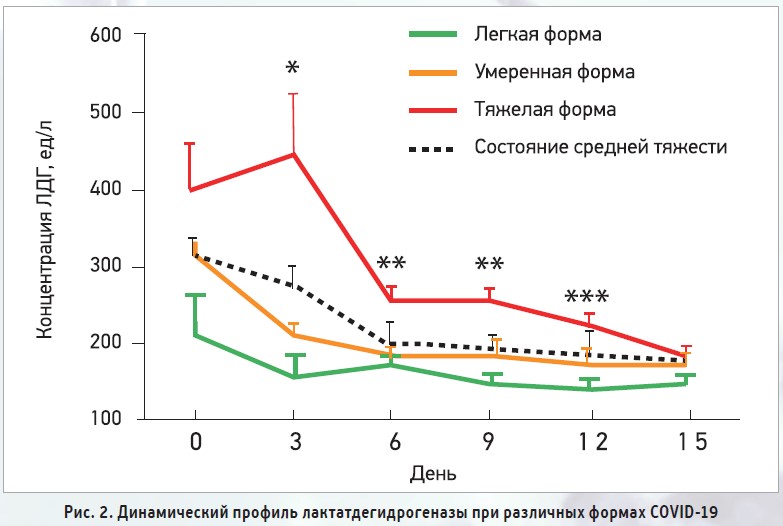
ЛДГ представляет собой фермент, экспрессируемый почти во всех клетках организма человека (включая клетки сердца, печени, мышц, легких, почек), который катализирует превращение пирувата в лактат. Повышенный уровень ЛДГ в сыворотке может быть выявлен после повреждения любого из множества типов клеток, которые обычно экспрессируют ЛДГ. Как и следовало ожидать, повышение ЛДГ часто встречается у пациентов с COVID‑19 в отделениях интенсивной терапии и указывает на неблагоприятный прогноз [20] (рис. 2).
Аланинаминотрансфераза
АЛТ является ферментом, который продуцируется гепатоцитами и повышается при заболевании печени. АЛТ (как и многие другие биохимические маркеры) увеличена у пациентов с тяжелой формой COVID‑19. Измерение активности фермента может быть полезно при наблюдении за пациентами, поступившими в отделение интенсивной терапии.
Билирубин
Повышение уровня билирубина сыворотки отмечается при ряде заболеваний, связанных с печенью и желчевыводящей системой. Отмечены увеличенные уровни билирубина у пациентов, поступивших в отделение интенсивной терапии, по сравнению с пациентами, имеющими менее тяжелые формы.
Креатинин
Креатинин сыворотки является важным показателем функции почек. Это продукт постоянного метаболизма белка в печени, который выводится почками. Повышение уровня креатинина в сыворотке указывает на снижение скорости клубочковой фильтрации. Повышенный креатинин чаще выявляется у пациентов с хронической почечной недостаточностью в сочетании с увеличением азота мочевины в сыворотке.
Альбумин
Альбумин относится к водорастворимым белкам. Снижение альбумина в сыворотке крови связано с различными заболеваниями, такими как недоедание, ожоги, сепсис, повреждение почек. У пациентов с COVID‑19 уровень сывороточного альбумина свидетельствует о плохом прогнозе.
Тропонины
Повышенные уровни в сыворотке специфичных для сердца тропонинов (тропонин I и тропонин Т) являются основными индикаторами для диагностики инфаркта миокарда и острого коронарного синдрома. Сейчас известно, что тропонины являются значимым показателем при тяжелой форме у больных COVID‑19. У пациентов с гипертензией и другими сопутствующими сердечно-сосудистыми заболеваниями необходимо проводить исследование уровней тропонина для оценки повреждения миокарда [21].
Параметры гемостаза
COVID‑19 предрасполагает как к венозному, так и артериальному тромбоэмболизму из-за активации коагуляции, вызванной сочетанием чрезмерного воспаления, активации тромбоцитов, эндотелиальной дисфункции, поэтому измерение маркеров коагуляции очень важно для лучшего понимания патогенеза тромбоэмболических заболеваний у пациентов с COVID‑19. Кроме того, нарушение параметров гемостаза служит важным показателем заболевания, начиная от незначительного увеличения D-димера и пролонгирования времени коагуляционных тестов и заканчивая диссеминированным внутрисосудистым свертыванием (ДВС-синдром).
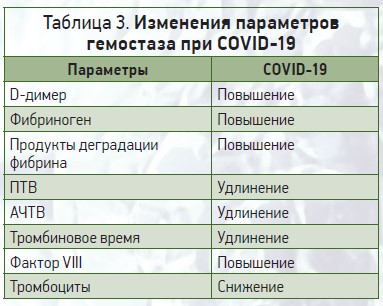 Наиболее общие нарушения параметров изменения гемостаза у пациентов с COVID‑19 включают повышение уровней D-димера, фибриногена, продуктов деградации фибрина, протромбинового времени (ПТВ), активированного частичного тромбопластинового времени (АЧТВ), фактора Виллебранда, фактора VIII, снижение количества тромбоцитов и нормальные уровни природных антикоагулянтов (протеины С и S, антитромбин III) (табл. 3). Для мониторинга тяжести заболевания рекомендовано прежде всего измерить уровни D-димера, фибриногена, ПТВ и количество тромбоцитов.
Наиболее общие нарушения параметров изменения гемостаза у пациентов с COVID‑19 включают повышение уровней D-димера, фибриногена, продуктов деградации фибрина, протромбинового времени (ПТВ), активированного частичного тромбопластинового времени (АЧТВ), фактора Виллебранда, фактора VIII, снижение количества тромбоцитов и нормальные уровни природных антикоагулянтов (протеины С и S, антитромбин III) (табл. 3). Для мониторинга тяжести заболевания рекомендовано прежде всего измерить уровни D-димера, фибриногена, ПТВ и количество тромбоцитов.
В совокупности все эти гемостатические изменения указывают на некоторые формы коагулопатии, которые могут свидетельствовать о предрасположенности к тромбоэмболическим проявлениям.
Маркеры воспаления
Воспаление, подавление иммунной системы и активация цитокинов играют ключевую роль в протекании COVID‑19. На ранних стадиях коронавирусной инфекции происходит активация эпителиальных и дендритных клеток, которые экспрессируют провоспалительные цитокины и хемокины, включая ИЛ‑1β, ‑2, ‑6, ‑8, интерферон-α/β (ИФН-α/β), ФНО, хемокины (CCL2, CCL3, CCL5), IP‑10 и т. д., что находятся под контролем иммунной системы. В большинстве случаев этот процесс предотвращает дальнейшее развитие инфекции. Однако иногда возникает дисфункциональный иммунный ответ, который может вызвать тяжелую системную патологию [25-27]. Это происходит при усилении воспалительного ответа, что приводит к апоптозу клеток или некрозу с последующим увеличением проницаемости кровеносных сосудов и накоплением макрофагов, моноцитов и нейтрофилов в альвеолах легких [28].
«Цитокиновый шторм»
Синдром высвобождения цитокинов (CRS), также известный под названием «цитокиновый шторм», – это одно из явлений, которое играет существенную роль при COVID‑19. CRS был описан как острый системный воспалительный синдром или чрезмерный иммунный ответ, характеризующийся лихорадкой и полиорганной дисфункцией. CRS-подобный синдром, который развивается после тяжелой вирусной инфекции, часто называют «цитокиновым штормом», а не CRS. Патология «цитокинового шторма» до конца не изучена, однако известно, что вирусы обычно атакуют клетки респираторного эпителия, которые запускают цитокиновый ответ. При этом рецепторы иммунных клеток распознают вирус и высвобождают провоспалительные цитокины, такие как ИФН-γ, ФНО, интерлейкины и хемокины. ИФН-γ активирует макрофаги, которые продуцируют ИЛ‑6, ФНО и ИЛ‑10. Макрофаги являются основными клетками, рекрутируемыми первоначально в альвеолярное пространство в ответ на вирусную инфекцию; они увеличивают выработку цитокинов, а также привлекают дополнительные иммунные клетки в пораженную область (CD4 и CD8). На рисунке 3 представлена модель «цитокинового шторма» и Т-клеточной лимфопении, связанной с COVID‑19. По сравнению с неинфицированными пациентами умеренные формы COVID‑19 демонстрируют увеличение ИЛ‑6 и снижение общего количества Т-лимфоцитов (особенно CD4+ и CD8+ T-клеток). Тяжелые формы COVID‑19 дополнительно увеличивают продуцирование ИЛ‑6, ‑2R, ‑10 и ФНО, в то время как количество Т-лимфоцитов (особенно CD4+ и CD8+, а также ИФН-γ) существенно снижается. Уровень «цитокинового шторма» и Т-клеточная лимфопения связаны с повреждением легких, дыхательной недостаточностью и неблагоприятным исходом.
Как только происходит очищение организма от вируса, иммунная система прекращает свою деятельность. Однако при «цитокиновом шторме» этот процесс не завершается как обычно. Воспалительные цитокины проникают в кровообращение, вызывая системные цитокиновые бури и в конечном итоге полиорганную дисфункцию. В этом случае ИЛ‑6 влияет на процесс свертывания крови, вызывая ДВС-синдром и кардиомиопатию, ИФН-γ может вызвать лихорадку, озноб, головную боль, головокружение и усталость, тогда как ФНО приводит к лихорадке, недомоганию, кардиомиопатии и повреждению клеток. Генетические особенности организма могут быть одним из факторов, которые объясняют, почему у некоторых людей развиваются только легкие формы, в то время как у других – тяжелые.
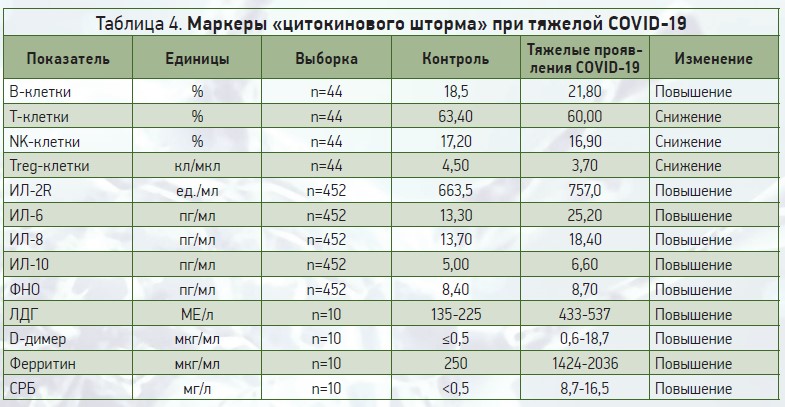
Маркеры «цитокинового шторма» при тяжелой COVID‑19 представлены в таблице 4.
Нерегулируемый и избыточный иммунный ответ потенциально может привести к повреждению легких и снижению выживаемости.
При инфицировании SARS-CoV‑2 характерны следующие изменения показателей иммунной системы:
- уровни ИЛ‑6, ИЛ‑10 и ФНО возрастают во время болезни и снижаются при выздоровлении;
- пациенты, нуждающиеся в госпитализации, имеют значительно более высокие уровни ИЛ‑6, ИЛ‑10 и ФНО и сниженное количество CD4 и CD8 T-клеток;
- уровни ИЛ‑6, ИЛ‑10 и ФНО обратно коррелирует с количеством CD4 и CD8, ассоциированных с лимфопенией.
Выводы
Спустя более чем полгода от выявления первых случаев COVID‑19, которые обусловлены наличием в организме вируса SARS-CoV‑2, применение методов лабораторной диагностики может служить надежной системой для оценки тяжести и последствий этого нового заболевания. В клинической практике врачам необходимо обращать внимание на изменение гематологических, биохимических, гемостазиологических параметров и маркеров воспаления у носителей SARS-CoV‑2.
Список литературы находится в редакции.
Медична газета «Здоров’я України 21 сторіччя» № 18 (487), 2020 р.