14 січня, 2021
Трансатлантичний круглий стіл «COVID‑19: що наразі відомо?»
2 листопада відбувся трансатлантичний круглий стіл «COVID-19: що наразі відомо?» в режимі веб-конференції. Програма заходу була дуже насиченою, учасники мали змогу ознайомитися з доповідями вітчизняних і зарубіжних фахівців, які детально розглянули актуальні питання менеджменту пацієнтів із тяжким перебігом COVID-19.
Асистент-професор госпіталю Mount Sinai (Нью-Йорк, США), лікар-пульмонолог-реаніматолог Євгеній Пінеліс детально описав нинішню ситуацію щодо поширеності COVID‑19 у Нью-Йорку. Історично склалося, що Нью-Йорк виявився одним із перших мегаполісів США, удар на систему охорони здоров’я якого був найбільшим. Про це свідчать надзвичайно високі показники госпіталізації під час розпалу епідемії. Варто зазначити, що на той час однією з основних проблем, яка найбільше погіршувала ситуацію боротьби з епідемією, була відсутність адекватної системи тестування, а також наявність обмежених даних, необхідних для оптимальної організації точної роботи медичного персоналу в інфекційних відділеннях і відділеннях інтенсивної терапії. Однак з досвідом клініцист дійшов висновку, що проведення потенційно етіотропної фармакологічної терапії COVID‑19 не має жодного значення незалежно від механізму дії препаратів і тяжкості стану пацієнта. Натомість вирішальне значення у веденні тяжких хворих, інфікованих COVID‑19, має проведення адекватної патофізіологічної підтримувальної терапії.
Варто зазначити, що досвід Нью-Йорку в боротьбі з поширеністю COVID‑19 виявився успішним; про це свідчить незначна кількість пацієнтів в інфекційних відділеннях і відділеннях інтенсивної терапії опорних лікарень станом на сьогодні. На думку спікера, основні чинники, завдяки яким епідемічна ситуація в місті є відносно сприятливою, – повільне зняття обмежень, масове тестування, відслідковування контактів і дотримання соціальної дистанції. Саме тому такий досвід може бути корисним для тих місцевостей, де ситуація з поширеністю нової коронавірусної хвороби є критичною.
Президент Федерації анестезіологів і реаніматологів Росії, доктор медичних наук, професор Костянтин Лебединський представив доповідь, яка стосувалася патофізіологічних особливостей розвитку дихальної недостатності у хворих на COVID‑19 і методів її лікування.
Наразі існує велика кількість запитань щодо раціонального менеджменту дихальної недостатності, що з’являються в пацієнтів на тлі тяжкого перебігу COVID‑19. Відповіді на них й досі є суперечливими та невизначеними. Саме тому одне з найважливіших завдань для кожного клініциста – детальне розуміння основи патогенезу порушень дихання в таких хворих.
На початку пандемії медики усього світу тривожно очікували напливу великої кількості пацієнтів з гострим респіраторним дистрес-синдромом (ГРДС). Однак більшість тяжких хворих мали м’які піддатливі легені, розправлення яких не потребує механічної роботи, достатньо хороше самопочуття аж до дуже низьких цифр SpО2 та раптове погіршення стану в подальшому, виражену тромбофілію і ризик тромботичних ускладнень, а також хорошу відповідь на застосування високих концентрацій кисню та прон-позиції. Наявність таких клінічних характеристик пацієнтів пов’язана насамперед з унікальними механізмами патогенезу дихальних порушень, відмінних від тих, які розвиваються за інфікування схожими коронавірусами – SARS-CoV і MERS. Так, на увагу заслуговує унікальність патофізіологічної основи ГРДС, асоційованого з СOVID‑19. Зокрема, F. Ciceri та співавт. (2020) припустили, що найімовірнішою причиною уражень легень, які спостерігаються в таких хворих, є розвиток мікроваскулярного легенево-судинного обструктивного тромбоваскуліту, що може мати суттєвий вплив на розвиток дихальної недостатності, а також підтверджує важливість застосування антикоагулянтної терапії за тяжкого перебігу захворювання.
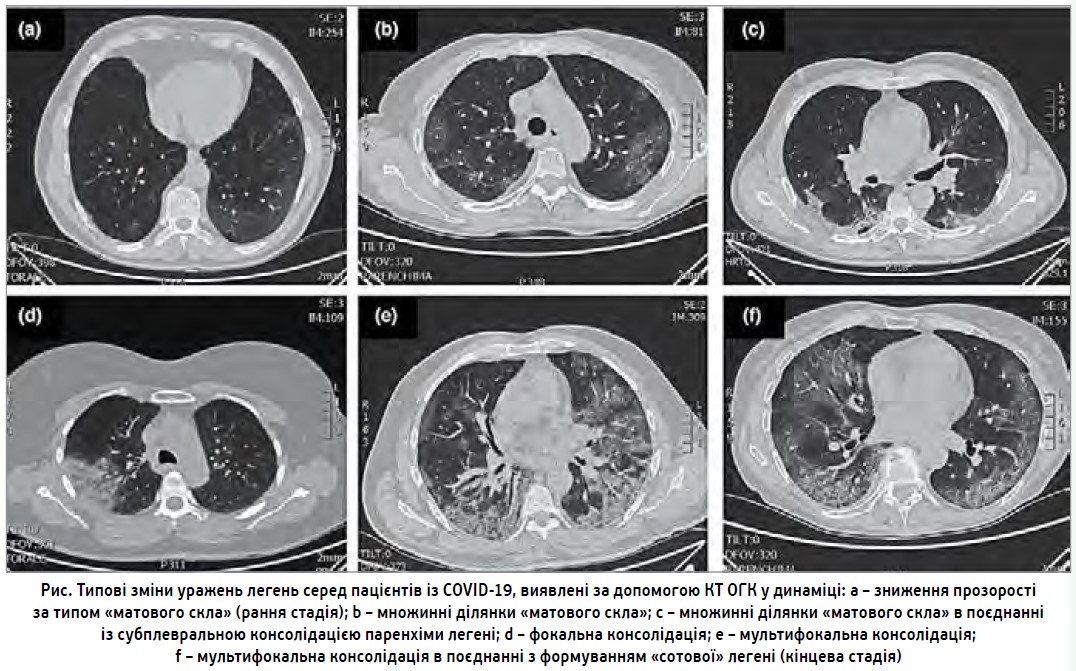
Слід зазначити, що найтиповішими змінами легень, які можна спостерігати на зображеннях комп’ютерної томографії (КТ) органів грудної клітки пацієнтів, інфікованих SARS-CoV‑2, є затемнення у вигляді «матового скла» (рис.). Патофізіологію появи цього феномена було детально описано A. S. Reynolds і співавт. (2020). Так, за допомогою транскраніальної доплерографії з контрастним посиленням автори дослідження встановили, що патогенетичне підґрунтя таких змін – не інтерстиційний набряк легеневої тканини (як вважалося раніше), а наявність паретичної вазодилатації – гіперперфузії васкулярного русла легень. Це спричиняє посилений приток крові до уражених легеневих одиниць, що зумовлює невідповідність вентиляції та перфузії, отже, розвиток гіпоксемії. Саме такі зміни можуть пояснити виникнення тяжкої дихальної недостатності на тлі практично нормальної еластичності легень.
На завершення свого виступу К. Лебединський зазначив, що під час лікування тяжких пацієнтів із COVID‑19 клініцисти всього світу зіштовхнулися з моделлю «чистої» гіпоксемії. Основним фактором, що відрізняє останню від рестриктивної ГДН, є відсутність грубих порушень механіки дихання та відносно хороша компенсація за зростання екстракції кисню й серцевого викиду.
Член екзаменаційного комітету Європейського товариства анестезіології Андрій Варвинський у своїй доповіді ретельно розглянув особливості підходу до ведення дихальних шляхів у хворих на COVID‑19.
На початку пандемії досвід щодо проведення інтубації трахеї серед пацієнтів з COVID‑19 був украй обмеженим. Китайські дослідники W. Yao та співавт. (2020) виявилися одними з тих, хто вперше надав дані, необхідні для подальшого планування ведення хворих у критичному стані й організації превентивних заходів для медичного персоналу. Саме на основі цього досвіду було розроблено перші консенсусні настанови щодо менеджменту дихальних шляхів у пацієнтів з COVID‑19 (Cook T. M. et al., 2020). Так, згідно із цим документом, підхід до ведення дихальних шляхів має бути насамперед безпечним, надійним і виконаним без зволікань. Основними пунктами, виконання яких передбачено цими рекомендаціями, є:
- адекватна підготовка медичного персоналу та забезпеченість необхідними ресурсами установи, що надає медичну допомогу хворим на COVID‑19;
- залучення найменшої кількості медичного персоналу, необхідної для ведення дихальних шляхів (3 особи (інтубатор, асистент і третя особа для моніторингу стану пацієнта та введення седативних засобів), а також +1 особа поза межами палати, необхідна для виклику підмоги);
- використання одноразового набору для проведення інтубації трахеї;
- надання переваги проведенню інтубації трахеї за допомогою відеоларингоскопії;
- проведення штучної вентиляції легень двома особами для утримування маски двома руками в положенні VE одним з асистентів та одночасного стиснення мішка Амбу – іншим;
- застосування медичним персоналом належних засобів індивідуального захисту.
Окрему увагу спікер приділив особливостям проведення аерозоль-генеруючих процедур (АГП) серед пацієнтів, інфікованих SARS-CoV‑2, які, як відомо, складають високий ризик інфікування медичного персоналу. Саме тому в приміщеннях, де здійснюють АГП, має бути хороша система вентиляції. До АГП належать інтубація трахеї, трахеостомія, неінвазивна ШВЛ (у т.ч. CPAP) і маскова вентиляція. До інших процедур, які потенційно можуть сприяти утворенню аерозолів, відносять екстубацію трахеї, проведення серцево-легеневої реанімації (перед інтубацією), відкритої санації дихальних шляхів без замкнутої лінійної системи та бронхоскопію.
Ризик інфікування COVID‑19 під час проведення інтубації трахеї в потенційно інфікованих пацієнтів був вивчений у дослідженні K. El-Boghdadly та співавт. (2020). Виявилося, що приблизно в 1 з 10 медичних працівників, залучених до інтубації трахеї пацієнтів з підозрою або підтвердженим COVID‑19, згодом було встановлено інфікування. Цікавими виявилися й дані J. Brown і співавт. (2020), які здійснили кількісну оцінку утворення аерозолю під час інтубації та екстубації трахеї з метою визначення їхньої належності до АГП. У результаті виявилося, що інтубація трахеї, включаючи вентиляцію лицевою маскою, спричиняє викид малої кількості аерозольних часток. Натомість проведення екстубації трахеї зумовлює у 15 разів більший викид аерозольних часток порівняно з інтубацією (р=0,0004), однак у 35 разів менший, ніж вольовий кашель (р<0,0001). Отже, результати цього дослідження не підтримують визначення планової інтубації трахеї (як АГП), якщо вона виконується згідно із правилами проведення процедури в приміщенні.
Доповідь завідувача відділенням анестезіології та інтенсивної терапії новонароджених Обласної дитячої клінічної лікарні (м. Дніпро), доктора медичних наук Дениса Сурікова була присвячена методам респіраторної підтримки у хворих на COVID‑19. На початку виступу спікер зазначив, що задля адекватної первинної оцінки тяжкості дихальних порушень, асоційованих з тяжким перебігом COVID‑19, надзвичайно важливо враховувати показники рівня свідомості, функції дихання, насиченості киснем крові, а також зміни легень, виявлені за допомогою УЗД. Окремо варто відзначити те, що в багатьох пацієнтів із COVID‑19 спостерігається т. зв. щаслива гіпоксемія, що характеризується відсутністю відчуття задишки, розвитку втрати свідомості та зростання частоти дихання за низьких рівнів сатурації крові. Довготривалу компенсацію порушень дихання та (в подальшому) раптову декомпенсацію стану може пояснити особливість роботи дихального центра, який насамперед реагує на зміну рівнів pH і РCO2, лише згодом – на рівень РО2. Так, за компенсованої форми респіраторного ацидозу відбувається зсув дисоціації насиченого киснем гемоглобіну вліво внаслідок гіпокапнії, що й зумовлює невідповідність між показниками PO2 і SpO2.Саме тому, незважаючи на першочергове зниження парціального тиску кисню у крові, порушення вентиляційно-перфузійних відношень, проблеми з легеневою механікою та елімінацією вуглекислого газу в таких хворих з’являються набагато пізніше.
З огляду на вищезазначене підтверджується доцільність обов’язкового визначення рівнів концентрації кисню крові (PO2) незалежно від тяжкості стану пацієнта. Однак, ураховуючи відсутність широкого доступу до постійної оцінки PO2, в сучасних умовах було запропоновано застосування т. зв. кисневої «ціни» сатурації, що являє собою показник співвідношення рівня сатурації та FiO2 (SpO2/FiO2). Вважається, що за SpO2/FiO2 <315 (SpO2 <95% за FiO2 >0,30) розвиток ГРДС є високоімовірним (включаючи пацієнтів на самостійному диханні).
Окремо варто зазначити те, що патогенез ГРДС, асоційованого з COVID‑19, у багатьох аспектах є схожим із класичною формою ГРДС і характеризується зниженням легеневого комплаєнсу, який відповідає ступеню гіпоксемії, а також варіабельністю респіраторної механіки (Grieco D. L. et al., 2020). Усього виокремлюють 4 стадії ГРДС: ателектази (зворотна), ексудація (частково зворотна), гіалінові мембрани (незворотна) та проліферація. Саме тому основна мета лікування цього порушення – якнайшвидше проведення адекватної респіраторної підтримки з метою відкриття первинного ателектазу та профілактики розвитку незворотних уражень легеневої тканини. Так, до найоптимальніших методів респіраторної підтримки хворих на COVID‑19 відносять низькопотоковий кисень ± СPAP, високопотоковий кисень ± СPAP, неінвазивну вентиляцію, ШВЛ ± iNO, HFOV ± iNO, ЕКМО. Згідно з настановами Європейського товариства інтенсивної терапії, у разі гострої гіпоксемічної дихальної недостатності рекомендується надати перевагу застосуванню високопотокової назальної канюлі (ВПНК) замість проведення низькопотокової кисневої терапії. Обрання респіраторної підтримки хворих з дихальною недостатністю також слід завершити на ВПНК замість неінвазивної вентиляції легень з позитивним тиском. Натомість за відсутності доступу до ВПНК і показань до термінової ендотрахеальної інтубації трахеї перевагу слід надати застосуванню неінвазивної вентиляції з позитивним тиском та одночасним ретельним моніторингом стану хворого й оцінкою показників сатурації.
Не менш актуальним є питання обрання оптимального методу візуалізації у хворих на COVID‑19. Так, КТ ОГК дає змогу отримати чи не найдостовірніші дані щодо величини та характеру ураження легеневої тканини. Однак, зважаючи на високу вартість та високе променеве навантаження, його використання має свої обмеження. Крім того, результати, отримані за допомогою КТ ОГК, ніяк не вплинуть на тактику лікування, адже першочерговими клінічними орієнтирами тяжкості стану таких хворих є загальне самопочуття, ознаки ДН і SpO2/FiO2.
Значну увагу варто приділити перевагам застосування ультразвукового дослідження (УЗД) легень cеред пацієнтів із COVID‑19. Так, зображення, отримані за допомогою цього методу, мають чіткі та типові ультрасонографічні закономірності. Це можуть підтвердити результати одноцентрового дослідження BLUE (Bedside Lung Ultrasound in Emergency), які продемонстрували високу чутливість, специфічність та діагностичну точність УЗД легень при плевральному випоті, альвеолярній консолідації та інтерстиційних синдромах. Зазначені дані стали основою протоколу LUS (Lung Ultrasound), який на сьогодні знайшов широке застосування при веденні хворих на COVID‑19. Окремо варто зупинитися й на деталях протоколу СLUE (COVID‑19 Lung Ultrasound in Emergency Department), де надзвичайно детально описано покроковий підхід до проведення УЗД легень у хворих на COVID‑19. У його основу покладено бальну систему УЗД легень (lung ultrasound scoring system, LUSS), що являє собою ефективний інструмент, розроблений для оцінки повітряності легень при ГРДС та пневмоніті, асоційованому з COVID‑19. Так, найпоширенішими знахідками, які дають змогу оцінити характер ураження легеневої тканини у хворих на COVID‑19, є:
- підвищена кількість В-ліній (дискретних або таких, які зливаються, багатовогнищевих і зазвичай двосторонніх) (LUSS0);
- потовщення плеври з ознаками рваної плевральної лінії (LUSS1);
- невеликі субплевральні консолідації (<1 см) (LUSS2), які прогресують до великих, маловаcкуляризованих або безсудинних ущільнень (>1 см), іноді з наявністю безповітряних бронхограм (LUSS3).
Так, за допомогою шкали LUSS можна оцінити тяжкість стану пацієнта на основі загальної кількості балів, розрахованої у 12 легеневих зонах. Саме ці дані надалі дозволяють ухвалювати правильні клінічні рішення на різних етапах медичної допомоги.
На завершення свого виступу лектор наголосив, що час початку респіраторної підтримки має надзвичайно критичне значення. Так, до основних ознак, які свідчитимуть про ефективність проведеної методики, належать адекватний рівень свідомості, відсутність збудження чи пригнічення свідомості, зниження роботи дихання, оптимальні показники кисневої «ціни» сатурації, зниження показників, виявлених за допомогою шкали LUSS, і зменшення консолідації В-ліній. Натомість важливим тригером, який свідчитиме про доцільність зміни тактики лікування, є відсутність позитивної динаміки протягом 1-2 год.
Регіональний керівник системи Кайзер Перманенте (Окленд, США) Олександр Ракул присвятив свій виступ темі клінічних та організаційних проблем щодо підготовки до подвійного вірусного зимового сезону COVID‑19 та грипу. Спікер зазначив, що сьогоднішні статистичні дані щодо поширеності COVID‑19 у світі свідчать про пришвидшення темпів зростання захворюваності та є невтішними порівняно з тими, що були на початку року.
З огляду на це найбільший страх наразі полягає у виникненні т. зв. твіндемії, за якої спалах COVID може припасти на епідемію грипу.
На думку експертів, зростання захворюваності на грип у поєднанні з продовженням спалаху COVID‑19 може спровокувати збільшення навантаження на систему охорони здоров’я різних країн і підвищення рівня смертності серед населення. Саме тому сьогодні надзвичайно важливою є стратегія імунізації не менше ніж 60% населення від вірусу грипу, що дозволить захистити сприйнятливі верстви населення від ускладненого перебігу коінфекції грипу та COVID‑19.
Завідувач кафедри анестезіології, інтенсивної терапії та медицини невідкладних станів Одеського національного медичного університету, член Комітету європейської освіти в анестезіології ESA, доктор медичних наук, професор Олег Тарабрін представив доповідь «Патофізіологічні маркери порушень системи гемостазу при COVID‑19. Огляд рекомендацій та перший досвід. Роль імуномодулювальної терапії».
Спікер зазначив, що патогенетичною основою порушень системи гемостазу при COVID‑19 є розвиток т. зв. цитокінового шторму, який супроводжується відхиленням збудника від клітинної імунної відповіді. Так, існує думка, що тяжкість ураження легень безпосередньо корелює зі ступенем інфільтрації легеневої тканини нейтрофілами та макрофагами, а також їх значною кількістю в периферичній крові, тому є велика ймовірність участі нейтрофілів як безпосереднього джерела вироблення хемокінів і цитокінів у розвитку цитокінового шторму, який, своєю чергою, може зумовити ГРДС. Окрім того, описано асоціацію тяжкого перебігу COVID‑19 та його ускладнень зі змінами в системі гемостазу. Зазначене підтверджує наявність у таких хворих дисфункції ендотелію, що спричиняє надмірне утворення тромбіну, зниження фібринолізу, отже, гіперкоагуляцію.
Окрему роль у виникненні порушень коагуляції хворих варто надати й розвитку гіпоксії, яка може безпосередньо провокувати зростання ризику тромбоутворення шляхом збільшення в’язкості крові й активації шляхів передачі сигналів т. зв. індукованими гіпоксією факторами. Саме тому механізм ураження легень у хворих на COVID‑19 здебільшого може пояснити ендотеліальне ушкодження альвеолярних капілярів, що зумовлює прогресуючий ендотеліальний легеневий синдром з мікросудинним легеневим тромбозом (Ciceri F. et al., 2020).
Варто зауважити, що сьогодні існує безліч припущень щодо первинної ланки патогенезу легеневих ушкоджень у хворих на COVID‑19. Однією з таких є думка про роль пневмонії, асоційованої з COVID‑19, як головного чинника розвитку ускладненого перебігу захворювання. Слід зазначити, що у випадку COVID‑19 виникнення пневмонії є вторинним і спостерігається не завжди. Натомість, з огляду на патофізіологію захворювання, до першопричини ураження легеневої тканини в таких хворих слід віднести ушкодження клітин крові та запалення ендотелію, що провокує розвиток гемолітичного тромбоваскуліту легеневих судин. Так, Z. Varga та співавт. (2020) є одними з перших, хто припустив, що наявність ендотеліальної дисфункції, яка з’явилася в результаті прямої вірусної інвазії, лежить в основі мікросудинного ушкодження та мікроциркулярного тромбозу, що спричиняє розвиток системних проявів інфекції та поліорганну недостатність. Зазначене підтверджує посмертний аналіз результатів електронної мікроскопії та гістологічний аналіз зразків тканин органів пацієнтів, які померли від COVID‑19. Зокрема, було виявлено наявність вірусних включень в ендотеліальних клітинах клубочкових капілярів, а також накопичення запальних клітин, пов’язаних з ендотелієм, й апоптозних тілець у зрізах із міокарда, тонкої кишки та легень.
Наразі немає жодного сумніву, що тромботичні процеси є однією з основних причин смертності пацієнтів із COVID‑19. Так, D. Wichmann і співавт. (2020) провели посмертне дослідження 12 пацієнтів з COVID‑19. У результаті встановлено, що основною причиною летального наслідку серед інфікованих була масивна легенева емболія, яка виявлялася у 33% випадків і супроводжувалася верифікованим тромбозом глибоких вен нижніх кінцівок. Натомість ще у 25% було встановлено ознаки тромбозу глибоких вен без явищ легеневої емболії. З огляду на це проведення адекватної діагностики коагулопатії та профілактики тромбоемболічних ускладнень, асоційованих з COVID‑19, є однією з найактуальніших проблем сьогодення.
Варто звернути увагу на те, що порушення коагуляції при COVID‑19 характеризуються розвитком активації системи згортання крові зі зростанням рівнів фібриногену та D-димеру, а також наявністю кореляції з маркерами запалення. Так, основна лабораторна відмінність, яка відрізняє такі порушення від ДВЗ-синдрому при сепсисі та травмі, – подовження АЧТЧ, що часто є порівняно меншим, ніж зростання ПТІ; це пояснюється підвищенням рівнів фактора VIII. Крім того, ще однією особливістю порушень коагуляції при COVID‑19 є розвиток тромбоцитопенії та наявність мікроангіопатії (Lee A. et al., 2020). Часті лабораторні знахідки серед пацієнтів з летальним наслідком – вираженіша лімфопенія, а також вищі показники нейтрофілів і лейкоцитів, D-димеру та концентрації сечовини крові та креатиніну (Wang D. et al., 2020). Згідно з рекомендаціями щодо профілактики та лікування венозної тромбоемболії у хворих на COVID‑19, розробленими спеціальним комітетом Американського венозного форуму (Sub-Committee of the American Venous Forum), рекомендовано проводити всім госпіталізованим хворим такі лабораторні тести:
- клінічний аналіз крові з акцентом на рівень тромбоцитів;
- протромбіновий час (дослідження при госпіталізації та в динаміці);
- продукти деградації фібрину (критерій розвитку ДВЗ-синдрому);
- рівень D-димеру (високі рівні визначають несприятливий наслідок захворювання);
- інструментальні методи дослідження, включаючи проведення тромбоеластографії.
Із метою вирішення питання щодо доцільності призначення профілактичної антикоагулянтної терапії доцільною є оцінка ризику венозної тромбоемболії та геморагічних ускладнень за допомогою шкал Падуа й IMPROVE. Варто відзначити, що практично кожен пацієнт з COVID‑19, госпіталізований до стаціонару, має дуже високий ризик розвитку венозних тромбоемболічних ускладнень і мікроциркуляторного тромбозу. Саме тому застосування антиагрегантів у профілактичних дозах рекомендується всім пацієнтам за відсутності до цього протипоказань.
Окремо слід зупинитися на перспективах застосування імуномодулювальної терапії при COVID‑19 як ад’ювантного та патогенетичного лікування, спрямованого проти потенційно летальних механізмів COVID‑19. Зокрема було встановлено, що ранній початок антикоагулянтної терапії разом із застосуванням внутрішньовенного імуноглобуліну (ВВІГ) ефективно покращував прогноз захворювання в пацієнтів із тяжкою та критичною формами COVID‑19. Саме цей факт став причиною щодо розгляду внесення препаратів ВВІГ до майбутнього оновленого національного клінічного протоколу лікування COVID‑19.
Підготувала Лілія Нестеровська
Медична газета «Здоров’я України 21 сторіччя» № 23 (492), 2020 р.