19 травня, 2021
Практична оцінка ефективності, доцільності та безпечності застосування вакцин від COVID‑19
 Уже другий рік поспіль триває пандемія коронавірусної хвороби (COVID‑19), спричиненої SARS-CoV‑2. Як і будь-яка інша респіраторна інфекція, вона має розвиватися згідно з основними законами епідемічного процесу в середовищі сприйнятливої до неї людської популяції. Особливість епідемічного процесу COVID‑19 полягає в тому, що ми не лише спостерігаємо, але й є його безпосередніми учасниками, маючи унікальну можливість відстежувати та аналізувати власне інфекційний процес у людини і динаміку епідемічного процесу коронавірусної хвороби в суспільстві. Дійсно, формально COVID‑19 – це нова інфекція для людини, але фактично це вже третя відома нам коронавірусна хвороба, якій зовсім недавно передували SARS (2002 р.) і MERS (2012-2015 рр.).
Уже другий рік поспіль триває пандемія коронавірусної хвороби (COVID‑19), спричиненої SARS-CoV‑2. Як і будь-яка інша респіраторна інфекція, вона має розвиватися згідно з основними законами епідемічного процесу в середовищі сприйнятливої до неї людської популяції. Особливість епідемічного процесу COVID‑19 полягає в тому, що ми не лише спостерігаємо, але й є його безпосередніми учасниками, маючи унікальну можливість відстежувати та аналізувати власне інфекційний процес у людини і динаміку епідемічного процесу коронавірусної хвороби в суспільстві. Дійсно, формально COVID‑19 – це нова інфекція для людини, але фактично це вже третя відома нам коронавірусна хвороба, якій зовсім недавно передували SARS (2002 р.) і MERS (2012-2015 рр.).
Ключові слова: респіраторні інфекції, пандемія, COVID‑19, SARS-CoV‑2, вакцінація проти COVID-19, антиковідні антитіла, діагностичні тест-системи, мінімальний захисний рівень антитіл
За своєю суттю COVID‑19 є інфекцією дихальних шляхів з основним аерозольним і додатковим фекально-оральним механізмами передачі. Тому вона має підкорятися основним законам розвитку епідемічного процесу для цієї групи інфекцій, маючи, природно, свої особливості, пов’язані як з властивостями самого збудника, так і з особливостями популяції чутливих до неї макроорганізмів, а також зі спробами людини активно втручатися в епідемічний процес, використовуючи карантинні заходи і вакцинацію.
На жаль, широкомасштабні карантинні заходи в континентальних і навіть у планетарному масштабах не забезпечили відчутних успіхів, а насправді лише затягнули й видозмінили перебіг епідемічного процесу.
На сьогодні в пандемії COVID‑19 чітко не простежується сезонність і циклічність, а сам епідемічний процес досі є безперервним із незначними коливаннями рівня захворюваності, зумовленими передусім запровадженням і послабленням жорстких карантинних обмежень.
Зараз на епідемічний процес почала активно впливати вакцинація, але, ураховуючи обмежену тривалість активного природного (післяінфекційного) і штучного (поствакцинного) імунітету, що в середньому не перевищує 6 міс, це може привести до того, що SARS-CoV‑2 стане збудником рутинної сезонної, за типом грипу, гострої респіраторної вірусної інфекції (ГРВІ). Але й досі, незважаючи на триваючу широкомасштабну вакцинацію, епідемічний процес неухильного активно прогресує. Ми ж наразі навчилися створювати досить ефективні прогностичні регресійні математичні моделі його еволюції.
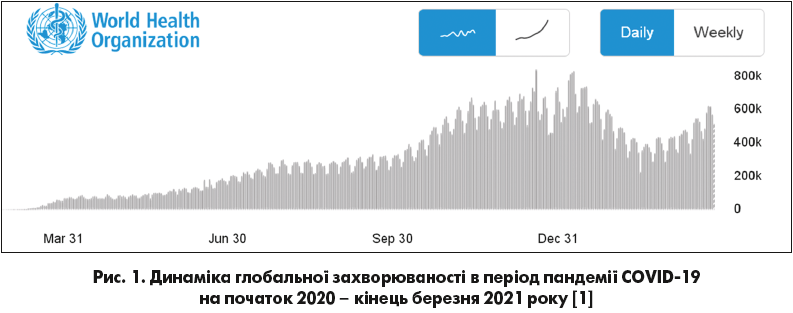
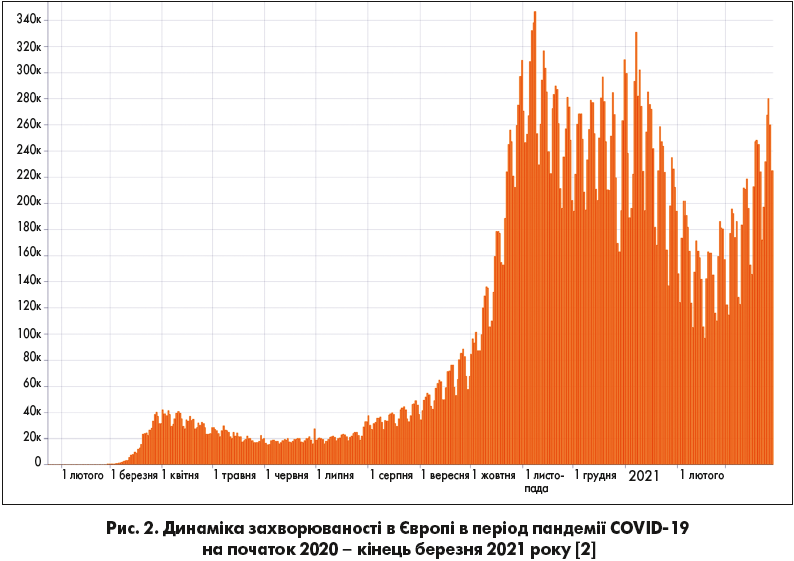
Станом на 29.03.2021 р. у світі на COVID‑19 захворіло 126 697 603 людини, померло – 2 776 175 (смертність 2,19%), введено 462 824 374 дози вакцини, з яких хоча б одну дозу отримало 261 431 795 осіб. В Європі захворіло 44 255 230 людей, померло – 955 232 хворих (смертність 2,16%). В Україні захворіло 1 652 409 людей, померло – 32 132 особи (смертність 1,94%), одну дозу вакцини отримали 155 587 осіб.
Діаграми Всесвітньої організації охорони здоров’я (ВООЗ) демонструють динаміку глобальної та європейської захворюваності на COVID‑19 (рис. 1, 2).
Навіть поверхневий аналіз цих даних виявляє очевидний факт: для COVID‑19 усе ж притаманна двохвилева сезонність – жовтень-січень + лютий-квітень, тобто інфекція пов’язана переважно з холодною порою року. А з огляду на те що пандемія триває вже другий рік, можна зазначити й циклічність епідемічного процесу з тривалістю циклу приблизно 1 рік. Але це тільки дуже приблизні дані, особливо з урахуванням раніше наведених чинників, що активно впливають на епідпроцес.
Цікаво, що навіть на тлі активної вакцинації, що почалася ще в грудні 2020 року й досі набирає темпи, на тлі вже майже 400 млн уже імунних щодо SARS-CoV‑2 осіб (які перехворіли) активність епідпроцесу COVID‑19 продовжує неухильно зростати!
Зрозуміло, що для більшості вакцинокерованих інфекцій, до яких, сподіваємося, буде віднесена й COVID‑19, потрібний не менше 80-процентний рівень імунних осіб у людській популяції (так званий колективний імунітет).
Важливо зазначити, що в епідеміології вакцинокерованих інфекцій є кілька дуже схожих, але по суті неідентичних показників, які характеризують стан колективного імунітету. Це показник колективного імунітету (ПКІ) – власне процентний показник охоплення активною імунізацією (вакцинацією) осіб у популяції і показник осіб із реальним індивідуальним рівнем імунного захисту (РІЗ).
Рівень ПКІ, що здатен запобігти навіть епідемічним спалахам, коливається від 80 до 95%, але він не може бути ідентичним РІЗ, оскільки завжди при вакцинації певна частина людей залишатиметься неімунною.
Тому ПКІ завжди буде вищим за РІЗ, щоправда, без урахування вже імунних осіб, які раніше перенесли інфекцію. Одразу ж необхідно навести і показники РІЗ при окремих «керованих» інфекціях, наприклад у дитячій популяції: поліомієліт – >80% до кожного штаму; епідпаротит – >85-90%; дифтерія – >90%; кір – >93%; краснуха – >96%.
На початок 2021 населення Землі, за даними Вікіпедії, становило приблизно 7 836 525 000 осіб. Як уже згадувалося, на кінець березня 2021 число імунних відносно SARS-CoV‑2 досягло приблизно 124 300 000, а число вакцинованих від COVID‑19 – 261 431 795. На сьогодні число вакцинованих трохи перевищує 3,33%, а число імунних осіб, можливо, досягає тільки 5% (із них усього 1,6% перехворіли).
Таким чином, стає очевидним, що до мінімально необхідних показників ПКІ і РІЗ, рівних хоча б 80%, ще дуже далеко, навіть із супутніми темпами захворюваності й наростаючими темпами вакцинації!
Проте не все так сумно. Є країни, той же Ізраїль, які вже закінчили вакцинацію і досягли необхідного рівня ПКІ. Але, ураховуючи досить короткий період (3-6 міс) збереження захисного активного (постінфекційного та поствакцинного) імунітету, цю перемогу в окремій країні також можна вважати лише короткостроковим успіхом і, фактично, тактичною удачею.
На сьогодні у світі переважно використовують три основні вакцини – виробництва США і Великої Британії:
- «BNT 162b2/COMIRNATY Tozinameran (INN)», Pfizer-BionTech (США).
- «AZD1222», AstraZeneca, University of Oxford (UK).
- «mRNA‑1273», Moderna (США).
В Україні застосовують дві вакцини:
- «BNT 162b2/COMIRNATY Tozinameran (INN)», Pfizer-BionTech (США).
- «Covishield (ChAdOx1_nCoV‑19», Serum Institute of India (її постачання вже припинене).
Найближчим часом очікується ще й «CoronaVac», Sinovac (Китай).
ВООЗ і більшість країн світу схвалили і дозволили для застосування 9 вакцин:
- «BNT 162b2/COMIRNATY Tozinameran (INN)», Pfizer-BionTech (US), Nucleoside modified mNRA (основа – нуклеозидмодифікована мРНК).
- «mRNA‑1273» (Moderna, USA), mNRA-based vaccine encapsulated in lipid nanoparticle (основа – мРНК, інкапсульована в ліпідні наночастинки).
- «AZD1222», AstraZeneca, University of Oxford (UK), Recombinant ChAdOx1 adenoviral vector encoding the Spike protein antigen of the SARS-CoV‑2 (основа – рекомбінантний аденовірусний вірус-вектор ChAdOx1, що кодує S- або Spike-білковий антиген SARS-CoV‑2).
- «AZD1222», SK BIO, AstraZeneca (Korea), Recombinant ChAdOx1 adenoviral vector encoding the Spike protein antigen of the SARS-CoV‑2 (основа – рекомбінантний аденовірусний вірус-вектор ChAdOx1, що кодує S- або Spike-білковий антиген SARS-CoV‑2).
- «Covishield ChAdOx1_nCoV‑19 (India)», (Serum Institute of India), Recombinant ChAdOx1 adenoviral vector encoding the Spike protein antigen of the SARS-CoV‑2 (основа – рекомбінантний аденовірусний вірус-вектор ChAdOx1, що кодує S- або Spike-білковий антиген SARS-CoV‑2).
- «Ad 26.COV2.S», Johnson & Johnson, Janssen Infection Diseases & Vaccines (USА) Recombinant, replication-incompetent adenovirus type 26 (Ad26) vectored vaccine encoding the (SARS-CoV‑2) Spike (S) protein (основа – рекомбінантна вакцина, що не реплікується, на базі аденовірусного вектора типу 26 (Ad26), що кодує Spike або S-білок SARS-CoV‑2).
- «Sputnik V», The Gamaleya National Center (Russian Federation), Human Adenovirus Vector – based COVID‑19 vaccine (основа – 2 вірусні вектори на базі аденовірусів людини (26 і 5 серотипів – rAd26 і rAd5, що несуть ген вірусу SARS-CoV‑2, який кодує його S-білок).
- «SARS-CoV‑2 Vaccine (Vero Cell), Inactivated (lnCoV)» or «BBIBP-CorV», Sinopharm/BBIBP (Beijing Bio-Institute of Biological Products Co-Ltd, China), Inactivated, produced in Vero cells (основа – інактивований SARS-CoV‑2, вирощений на культурі клітин Vero).
- «SARS-CoV‑2 Vaccine (Vero Cell), Inactivated (lnCoV)», (Sinovac), Inactivated, produced in Vero cells (основа – інактивований SARS-CoV‑2, вирощений на культурі клітин Vero) [3].
Але насправді у світі вже застосовують значно більше вакцин, дозволених органами влади окремих держав. Йдеться про РФ, Китай, Індію і низку інших країн. Це такі вакцини:
- «EpiVacCorona» (Vector State Research Centre of Viralogy and Biotechnology, Russian Federation), Peptide antigen (основа – білковий антиген).
- «COVID‑19 Inactivated Vaccine» (Wuhan’s subdivision of CNBG (China National Biotech Group), subsidiary of China National Pharmaceutical Group (Sinopharm), Inactivated (основа – хімічно інактивований культивований цілісний SARS-CoV‑2).
- «COVID‑19 Inactivated Vaccine» (Beijing’s Wuhan’s subdivision of CNBG (China National Biotech Group), subsidiary of China National Pharmaceutical Group (Sinopharm), Inactivated (основа – хімічно інактивований культивований цілісний SARS-CoV‑2).
- «CoronaVac» (Sinovac, China), Inactivated (основа – хімічно інактивований культивований цілісний SARS-CoV‑2).
- «Covaxin» (Bharat Biotech, India), Inactivated SARS-CoV‑2 Vaccine (Vero Cell) (основа – інактивований SARS-CoV‑2, вирощений на культурі клітин Vero).
За даними ВООЗ, на сьогодні на етапі доклінічних досліджень перебуває 184 ковідні вакцини, 83 – на стадії клінічних досліджень, очікують дозволів і впровадження в клінічну практику – 8.
Нижче наведено джерело із сайту ВООЗ, в якому вказані також можливі кандидати на впровадження в клінічну практику, які ще перебувають на стадії розробки, доклінічних і початкових етапів клінічних випробувань. Це «COVID‑19 – Landscape of novel coronavirus candidate vaccine development worldwide. WHO» (COVID‑19 – ситуація у світі з розробкою нової вакцини-кандидата від коронавірусу) [3-5].
Наведені дані показують, що, незважаючи на активну боротьбу людства з COVID‑19, поки перемагає вірус. Із уже наявного досвіду стає зрозуміло, що в умовах глобалізації, активної міграції людей через економічні і військові катаклізми карантинні й інші заходи обмеження, особливо на тлі мутацій SARS-CoV‑2, не дали значущого ефекту. Залишилася тільки надія на те, що населенню планети вдасться все ж досягти необхідного рівня РІЗ для створення хоча б тимчасового активного колективного імунітету. По суті його можна досягти двома шляхами: «пасивним» – тобто очікувати, коли на COVID‑19 перехворіє і збереже тимчасовий імунітет понад 80% світової популяції; «активний» варіант – це вакцинація.
Ми досі не знаємо, скільки насправді тих, хто перехворів і хворіє на COVID‑19 щодня. І сьогодні, навіть за наявності численних діагностичних систем, є дуже приблизні дані щодо захворюваності на COVID‑19. Насправді реальні цифри значно перевищують офіційні як в окремих країнах, регіонах, так і у світі. Просте математичне моделювання епідпроцесу та епідеміологічна практика показують, що справжні показники захворюваності на COVID‑19 перевищують офіційні мінімум у декілька разів, а можливо, і на порядок (за винятком невеликих країн і регіонів, де практично все населення охоплене діагностичними дослідженнями стосовно SARS-CoV‑2).
Тому важко сказати, який зі згаданих двох шляхів успішніший. Якщо брати до уваги офіційні дані, то це вакцинація, а якщо спиратися на реалії, то надійнішим здається природне зростання рівня захворюваності і формування постінфекційного імунітету. Крім того, ефективність вакцин, їх безпечність, адекватність доз і режимів застосування далекі від заявлених розробниками і виробниками. Адже раніше для створення ефективної і, головне, безпечної вакцини потребувалося не менше 10 років. По суті, нічого в цій сфері не змінилося, крім зниження жорстких вимог до виробництва самих вакцин і значної «лібералізації» в проведенні до- і клінічних досліджень їхньої ефективності і безпечності застосування! Проте всього за рік у світі з’явилося понад 10 ковідних вакцин, які пройшли етапи від розробки до широкого практичного застосування, – усього за декілька місяців. Здійснити всі необхідні експертизи хоча б виходу вакцин на початковий етап клінічних випробувань за такий короткий термін фізично неможливо! Проте вони вже впроваджені в найширшу клінічну практику – більш як 260 млн осіб уже вакциновано.
Така надшвидкість стала можливою тільки через серйозну загрозу внаслідок інфекції SARS-CoV‑2 для здоров’я і життя людей. Однак чи є ця загроза такою насправді? Якщо відсторонитися від морально-етичних аспектів, які, по суті, і стали відправною точкою для пом’якшення вимог до вакцин і багато в чому навіть «істерії» з боку влади багатьох, передусім «розвинених» країн, а провести неупереджений аналіз, спираючися лише на об’єктивні дані статистичних досліджень, можна з упевненістю стверджувати, що проблема COVID‑19 доволі серйозна, але не настільки трагічна.
За офіційними даними, смертність від COVID‑19 не перевищує 2,5%. При цьому необхідно визнати, що на сьогодні в нас немає реальних даних для об’єктивної характеристики як самої COVID‑19, так і її епідемічного процесу.
Що ж до вакцинації, тут з об’єктивністю ще гірше.
У разі будь-якої вакцинальної кампанії, яку, ба більше, проводять у таких глобальних масштабах, мають бути чітко визначені три основні аспекти, а саме:
- ефективність;
- безпека;
- доцільність застосування.
Нині про жоден із них стосовно вакцин немає достовірної та об’єктивної інформації! Довіра до багатьох організацій міжнародного рівня, зокрема до ВООЗ, значуще ослаблена. Варто тільки згадати корупційні скандали довкола ВООЗ із препаратом Таміфлю (Oseltamivir) у 2010 р. на тлі пандемії грипу (H1N1), фактичну безпорадність цієї організації як флагмана боротьби з пандемією COVID‑19 із постійною, нерідко кардинальною, зміною рекомендацій з етітропної терапії SARS-CoV‑2-інфекції, невмілу координацію протиепідемічних заходів, доволі сумнівні, з точки зору навіть рядового епідеміолога, основні протиепідемічні рекомендації, як-от «миття рук», «дотримання дистанції» та інші, у тому числі курйозні, способи захисту. Вагомим аргументом щодо неспроможності ВООЗ була також відмова США від подальшого фінансування цієї організації – начебто з міркувань прагматизму і практичності американської влади та й самих американців. Підтвердженням зниження авторитету ВООЗ стала також і нинішня кампанія з вакцинацією від коронавірусної інфекції. Багато країн розпочали вакцинацію без офіційного дозволу ВООЗ і схвалення нею використовуваних вакцин.
Але є й об’єктивні причини для лібералізації ВООЗ нормативних вимог задля забезпечення максимального доступу до безпечних і ефективних вакцин, які відповідають міжнародним стандартам якості й виробництва. Це надзвичайна ситуація, пов’язана з пандемією COVID‑19, і відсутність на сьогодні вакцин із реально доведеною високою ефективністю й безпекою. Тому ВООЗ і почала процедуру PQ/EUL (Requalification / Emergency Use Listing) – тобто прекваліфікацію вакцин і правил їх використання в надзвичайних ситуаціях.
Проте навіть в умовах зниження вимог до якості і безпеки досі немає реальних і об’єктивних даних стосовно оцінки ефективності вакцин і постінфекційного імунітету до SARS-CoV‑2.
У доступній літературі є заяви виробників про той чи інший рівень ефективності, виражений у відсотках. Імовірніше за все, йдеться про рівень формування після вакцинації протекторного імунітету від SARS-CoV‑2 у певної частки осіб, які отримали конкретну вакцину. Ці цифри дуже різняться – від 50 до 95%. Але жоден із виробників не повідомляє про ті критерії і показники, якими він керувався для визначення такої ефективності.
Найпростішим, достовірнішим, об’єктивнішим, загальновизнаним і обов’язковим для будь-якої вакцини є оцінка її ефективності після досягнення певного рівня поствакцинного імунітету, вираженого в рівні імуноглобулінів класу G у МО/мл (IU/ml) або, рідше, – у титрах сумарних антитіл. Ці дані має наводити у своїх інструкціях сам виробник вакцин, і таку ж інформацію у діагностичних тест-системах нерідко надають і виробники цих тестів. Але стосовно COVID‑19 таких даних досі немає.
Про об’єктивні причини ми ще скажемо. Але все ж треба зазначити, що до недавнього часу ні у виробників вакцин, ні в дослідників через відсутність методів і способів кількісної оцінки рівня гуморального імунітету не було інструменту для отримання таких даних. Якісні і напівкількісні методи для таких досліджень фактично непридатні, навіть у разі використання «усіляких хитрощів», про які також буде сказано нижче.
Таким чином, на сьогодні відсутні дані про так званий захисний рівень IgG від SARS-CoV‑2. Тому поки що ми не можемо реально оцінити таке:
- Яким має бути мінімальний захисний рівень антиковідних IgG?
- Чи забезпечує вакцинація захисний імунітет у конкретної людини?
- Чи є в конкретної особи захист від COVID‑19 у вигляді мінімального захисного рівня антитіл?
- Яким має бути пороговий рівень антиковідних антитіл, при якому вакцинація ще безпечна, і коли вона вже небезпечна, з огляду на можливий розвиток алергічних і анафілактичних реакцій?
- Нижче за який рівень антиковідних антитіл пацієнт матиме високий ризик розвитку феномену «антитілозалежного посилення інфекції»?
Це короткий список необхідних показників, які базуються всього лише на єдиному показнику – рівні або концентрації в крові пацієнта антиковідних антитіл певного класу (найчастіше IgG), вираженого в МО/мл, згідно з «універсальним міжнародним стандартом (стандартами)» для таких антитіл або ж у вигляді титрів (також згідно з аналогічним стандартом, але для оцінки в титрах). Забігаючи наперед, зазначимо, що не можна сприймати серйозно дослідження, в яких результати оцінки рівня антиковідних антитіл виражаються у вигляді «відносних», «довільних» і, ще гірше, «оптичних» одиниць (OU/ml, OD/ml, AU/ml, опт. од./мл та ін.).
Украй важливо, що для якісного і, особливо, кількісного визначення рівня антиковідних антитіл виробники діагностичних систем використовують різні вірусні білки (найчастіше структурні), або навіть якщо використовується той самий білок (наприклад, Spike-білок SARS-CoV‑2), то як діагностичний антиген у системі різні виробники використовують різні структурні компоненти такого білка.
Тобто немає єдиного або хоча б однакового діагностичного стандарту, який би приводив до виявлення антиковідних антитіл різної специфічності фактично до різних антигенів SARS-CoV‑2.
Саме цей факт не дає можливості стандартизувати результати таких тестів, і це наочно проілюстровано в ще неопублікованому дослідженні, де тест-системи різних виробників, які навіть використовують позитивний антитільний «контроль» і «калібратори», створені на базі чинних міжнародних стандартів (NIBSC code: 20/136 і 20/268). Такі тест-системи дають суперечливі результати, які складно зіставити [6].
На жаль, відповідей на ці питання до сьогодні немає. Тому й оцінити ефективність, безпеку й доцільність застосування ковідних вакцин ми не можемо. Проте такі дослідження вже започаткували!
Незважаючи на те що пандемія COVID‑19 триває вже другий рік, а рік тому почали застосовувати й перші імуноферментні (ІФА), імунохроматографічні (ІХА) та імунохемілюмінесцентні (ІХЛА) тест-системи для якісного виявлення в крові людини імуноглобулінів класів IgG та IgМ до різних антигенів (найчастіше до нуклеокапсидного антигену і Spike-білка) SARS-CoV‑2, тільки недавно почали з’являтися тест-набори, у тому числі й українських виробників, для кількісної оцінки вмісту антиковідних антитіл класу IgG.
Це стало можливим тільки після того, як наприкінці 2020 року на біотехнологічному ринку з’явилися розроблені NIBSC (The National Institute for Biological Standards and Control, Велика Британія) і затверджені ВООЗ стандарти:
- «WHO International Standard First WHO International Standard for anti-SARS-CoV‑2 immunoglobulin (human) NIBSC code: 20/136 Instructions for use (Version 2.0, Dated 17/12/2020)» [7] і
- «WHO Reference Panel First WHO International Reference Panel for anti-SARS-CoV‑2 immunoglobulin NIBSC code: 20/268 Instructions for use (Version 3.0, Dated 17/12/2020)» [8].
Перший (код 20/136 за NIBSC) є стандартом для сумарних (усіх класів) нейтралізувальних антиковідних до різних антигенів і білків SARS-CoV‑2 антитіл (в 1 ампулі в ліофілізованому вигляді міститься 250 МО антитіл). При відновленні стандарту 0,25 мл дистильованої води отримуємо готовий стандартний зразок із умістом антитіл у концентрації 1000 МО/мл. Саме на базі цього стандарту було запропоновано створювати нові стандарти для різних класів імуноглобулінів до різних антигенів SARS-CoV‑2. Але в цьому разі пропонувалося переводити МО (IU) в довільні зв’язувальні одиниці або «Binding antibody units» (BAU), де 1 МО стандарту сумарних зв’язувальних антитіл першого стандарту з кодом 20/136 буде еквівалентна 1 BAU вже конкретного класу імуноглобулінів, специфічних до різних антигенів SARS-CoV‑2.
Тому на базі першого стандарту був розроблений другий стандарт із кодом 20/268 за NIBSC, який по суті є панеллю стандартів із відомим умістом антиковідних антитіл, як сумарних нейтралізувальних (Neut Ab), так і специфічних до конкретних антигенів SARS-CoV‑2, а саме anti-RBD IgG (антитіла до рецептор-зв’язувального домену (RBD) поверхневого глікопротеїну S або Spike-білка SARS-CoV‑2), anti-S1 IgG (антитіла до S1 субодиниці S-білка SARS-CoV‑2), anti-Spike IgG (антитіла до власне Spike або S-білка SARS-CoV‑2) і anti-N IgG (антитіла до нуклеокапсиду SARS-CoV‑2). Уміст зазначених антитіл у цій панелі виражений не в МО/мл чи IU/ml, а в BAU/ml, тобто в довільних одиницях зв’язування, за винятком сумарних нейтралізувальних антитіл, уміст яких, згідно зі стандартом із кодом 20/136, виражений у вигляді МО/мл або IU/ml.
Пропозиція використовувати стандарт 20/136 як еталон (тобто замість МО/мл чи IU/ml – BAU/ml) має важливе смислове навантаження, оскільки в першому стандарті вказаний уміст anti-SARS-CoV‑2 імуноглобулінів сумарного пулу різних класів і різної специфічності (до різних антигенів SARS-CoV‑2). А окремих стандартів для конкретних класів імуноглобулінів із конкретною специфічністю до окремих антигенів SARS-CoV‑2, рівень яких можна було б виразити в МО/мл, ще немає. Тому другий стандарт 20/268 у вигляді панелі IgG, спрямованих до окремих антигенів вірусу, є першим кроком для створення серії або панелей стандартів для окремих класів імуноглобулінів до різних окремих антигенів SARS-CoV‑2, де їхній уміст буде виражений у вигляді МО/мл. Проте необхідно зазначити, що на сьогодні розробка таких вузькоспрямованих стандартів і недоцільна, і навіть марнотратна.
Важливо, що в другому стандарті (20/268), на відміну від першого (20/136), навіть у назві файлу для скачування із сайту NIBSC – «20-268_WHO_panel_neutralization_Ab» вказані не «зв’язувальні», а саме «нейтралізувальні» антитіла. Водночас файл для скачування першого стандарту має назву «20-136_WHO_Standart_Immunoglobulin» і відображає суть самого стандарту як «стандарту імуноглобуліну». Можливо, розробники цих стандартів використовували терміни «зв’язувальні» і «нейтралізувальні» як синоніми, що допустимо для лабораторних діагностичних методів дослідження, але в імунології ці терміни мають різне значення, оскільки зв’язувальні і нейтралізувальні антитіла за своїми функціями в імунному та інфекційному процесах значуще відрізняються. Для стандартів міжнародного рівня така двоїстість неприпустима і має бути усунена або досконало роз’яснена. Але цю неточність можна тимчасово проігнорувати, з огляду на те що це перші стандарти anti-SARS-CoV‑2 імуноглобулінів.
Ці стандарти дали можливість розробникам і виробникам діагностичних тест-систем зробити принциповий перехід від тест-систем із якісного і «напівкількісного» виявлення антиковідних антитіл до діагностичних наборів для їх кількісного визначення.
Дійсно, такі тест-системи вже з’явилися, і вони не поодинокі, але все ще далекі від уніфікації. Передусім це стосується різноманіття використовуваних діагностичних антигенів. Так, різні виробники у своїх діагностичних системах використовують різні компоненти SARS-CoV‑2 або їхні генно-інженерні аналоги, такі як Spike-структурний білок (глікопротеїн) вірусу, S1 субодиницю S-білка, RBD домен S-білка, нуклеокапсидний або N-білок та ін. [6].
Відсутність уніфікації спостерігається і щодо внутрішніх контролів, калібраторів, формул розрахунку і меж обліку показників результатів досліджень у цих тест-системах. Тому такий детальний опис стандартів NIBSC‑20/136 і -20/268, їх характеристика й аналіз були потрібні для адекватної повноцінної та, головне, однакової оцінки показників результатів кількісних тест-систем різних виробників, оскільки навіть при використанні ними цих стандартів результати досліджень згаданих тест-систем дуже відрізняються і потребують серйозної корекції.
Тому не варто сподіватися, що використання новітніх діагностичних тест-систем із кількісного виявлення антитіл до компонентів SARS-CoV‑2 навіть авторитетних виробників дасть можливість уже сьогодні оцінювати динаміку антитілоутворення в процесі недуги і подальше формування активного післяінфекційного чи післявакцинного імунітету, розробку показників захисного індивідуального і популяційного рівня антитіл до SARS-CoV‑2, ефективність, доцільність і, головне, – безпеку різних коронавірусних вакцин.
Саме для усунення цієї проблеми в стандарті NIBSC‑20/136 і було запропоновано замінити показник рівня антитіл МО/мл (чи IU/ml) на умовні одиниці – BAU/ml, а також застосовувати стандарт 20/268. Це не вирішує проблему кардинально, проте дає можливість максимально уніфікувати результати оцінки рівня антиковідних антитіл для тест-систем різних виробників, що використовують різні структурні білки (гліко- і нуклеопротеїди) SARS-CoV‑2.
Але якщо для оцінки постінфекційного імунітету можна продовжувати використовувати напівкількісні методи дослідження без жорсткої уніфікації, то для оцінки поствакцинного протекторного рівня антитіл і безпечності вакцинації одноманітність використовуваних діагностичних тестів не просто необхідна, а обов’язкова!
Чи можливе розв’язання зазначеної проблеми вже зараз? Так, але тільки за умови використання тих самих діагностичних систем конкретного виробника (краще навіть однієї партії продукції), що дотримується єдиного стандарту, наприклад 20/136, із виявлення рівня сумарних антитіл до SARS-CoV‑2 (у МО/мл або BAU/ml) чи IgG до його S-глікопротеїну (у BAU/ml), застосовуючи стандарт 20/268. Однак, з огляду на надзвичайну актуальність проблеми, необхідно прагнути до повної уніфікації використовуваних діагностичних тестів.
Проблему «кількісної», а не якісної оцінки протекторного антиковідного імунітету, ефективності щеплення та вибору вакцин, режимів і доз їх застосування, безпеки й доцільності вакцинації вже неодноразово намагалися вирішувати, використовуючи діагностичні тести за якісним і напівкількісним визначенням антитіл. Але через недосконалу технологію створення діагностичних наборів для ІФА та ІХЛА зробити це практично неможливо. Постає питання – чому?
Обидва методи передбачають облік спектрофотометрії результатів – або при прямому порівнянні оптичної щільності (ОЩ) зразка (показання приладу) і «позитивного» контролю, або перерахувавши ОЩ зразка за пропонованою виробником формулою в так званий коефіцієнт позитивності. У першому випадку розраховується «пограничний» (або «критичний»)рівень (його ще позначають як «Cut off» чи «індекс переривання») для обліку результатів ОЩ зразка. Якщо вона буде рівна «критичному» рівню або вища за нього, результат такого зразка буде позитивним, якщо нижча – негативним. Розрахунок критичної ОЩ нескладний: ОЩкрит = ОЩсер НК + А, де ОЩсер НК – це середнє арифметичне значення ОЩ негативних контролів тест-набору (їх зазвичай 3), а «А» – число, розраховане виробником. ОЩ негативних контролів зазвичай не перевищує 0,02-0,05, а при ОЩ >0,1 такий контроль не враховується і підлягає заміні, хоча бувають і вищі значення (наприклад, 0,15). Число «А», як правило, змінюється в інтервалі від 0,1 до 0,4 (можуть бути й інші показники). У другому випадку розрахунок і облік складніші, але базуються також на ОЩкрит. У цьому разі розраховують індекс обліку, який найчастіше називають «індекс (або коефіцієнт) позитивності» (ІП). ІП = ОЩвзірця/ОЩкрит. Далі виробник розраховує і наводить облікові показники ІП (вони можуть бути в кожного виробника і кожній тест-системі того ж виробника різними!). Найчастіше є три інтервали обліку – позитивний результат, негативний і такий, що не враховується, – «сіра зона». Як приклад можна навести такі показники обліку ІП для тест-набору «Vitrotest® SARS-CoV‑2 IgG»: якщо ОЩвзірця <0,9 – це негативний результат; якщо лежить в інтервалі 0,9 ≤ОЩвзірця≤1,1 – це «сіра зона»; якщо ОЩвзірця >1,1 – результат позитивний. Зазначимо, що бувають і тест-системи зі «зворотним обліком», наприклад де ОЩвзірця <1 – це позитивний, а не негативний результат. Лабораторія видає саме показники ОЩвзірця, а не реальний результат, щоправда, зазначаючи інтервали обліку ІП, щоб клініцист сам зміг інтерпретувати результати пацієнта. На жаль, це часто вносить серйозну плутанину, а нерідко і помилки!
Також необхідно визначитися і з можливими показниками ІП. Для кожного тест-набору вони можуть бути різними, оскільки багато показників. Наприклад, «А» у формулі розрахунку ОЩкрит розраховує сам виробник. Отже, нам треба визначитися з граничними показниками ІП. Але спочатку визначимо межі ОЩкрит (ОЩкрит = ОЩсер НК + А). Оскільки ОЩНК лежить у межах 0,02-0,1 і, рідше, вище (0,15), то середнє арифметичне зазвичай трьох ОЩНК буде також в інтервалі 0,02-0,1-0,15. Тоді ОЩкрит = 0,02-0,15 + 0,2-0,4 або 0,22-0,55.
ОЩвзірця не може перевищувати 3,0 (лежить в інтервалі від 0 до 3,0), оскільки спектрофотометр технічно не розрахований на вищі показники. Підставляючи у формулу ІП = ОЩвзірця/ОЩкрит інтервальні значення ОЩвзірця та ОЩкрит, отримуємо мінімальне значення ІП, близьке до нуля, а максимальне – в інтервалі 5,5-13,5 (0≤ІП≤13,5). Якщо розрахувати можливий інтервал ІП для напівкількісної тест-системи «Vitrotest® SARS-CoV‑2 IgG», він буде рівний; виходячи з того, що ОЩкрит= ОЩсер НК + А = 0,02-0,03 + 0,3 = 0,32-0,33, то ІП буде в інтервалі від 0 до 9,1 і вище. Ці дані важливі і будуть дуже потрібні для подальшого аналізу проблеми.
Саме такий інтервал значень ІП і саме показник ІП дає можливість деяким авторам використовувати його для можливої кількісної, а точніше – «напівкількісної» оцінки вмісту в крові пацієнтів імуноглобулінів різних класів, часто це тільки IgG. Деякі дослідники [9] навіть пропонують новий показник у вигляді індексу або коефіцієнта «серопозитивності» та активно його використовують. Але простий аналіз дає підстави стверджувати, що цей «новий» показник являє собою лише підміну слова «позитивності» шляхом додавання до нього префіксу «серо-», що фактично є розрахунковим ІП, розробленим виробником для внутрішнього обліку результатів діагностичного дослідження тест-системи.
Тому «коефіцієнт серопозитивності» – не новий, а всього лише «придуманий» показник або нова назва ІП. Проте варто віддати належне авторам досліджень імунітету при COVID‑19 в тому, що вони зважилися на використання хоч якихось даних і спробували максимально «витиснути» з наявних тест-систем хоча б якісь показники, нехай примарні, так званої напівкількісної оцінки рівня антиковідних антитіл класу IgG.
Пояснимо, чому згадані цифрові показники не можна застосовувати для конкретної числової оцінки рівня, або концентрації, антитіл. У тест-системах для ІФА і подібних до них зазвичай використовують один «позитивний» контроль, що містить специфічні антитіла, які виявляються цією тест-системою. Але рівень зазначених антитіл у цьому контролі може істотно змінюватися в різних партіях тест-наборів того ж виробника. Тим більше він серйозно відрізнятиметься від рівня антитіл у наборах різних виробників тестів для ІФА! Крім того, залежність ОЩ різних концентрацій антитіл навіть у стандартах при одномоментному дослідженні не є лінійною (лінійність можлива тільки в окремих інтервалах концентрацій антитіл).
Для побудови графіка або комп’ютерного розрахунку формули концентрацій потрібний «калібратор» – набір стандартизованих взірців із відомим рівнем специфічних антитіл. Тільки тоді можна або побудувати «примітивний» графік для обліку, або комп’ютер запропонує регресійну математичну модель у вигляді формули або самостійно розраховуватиме рівень антитіл у досліджуваному зразку за його ОЩ. Без «калібратора» та уніфікованого стандарту для його приготування кількісний і, головне, достовірний облік рівня антитіл у зразках неможливий. Мовитися може тільки про більший або менший його рівень, і все!
А якщо з «якісних» і «напівкількісних» наборів для ІФА створити кількісні тест-набори, виразивши рівень антитіл або в «титрах», що простіше і достовірніше, або в умовних чи довільних одиницях? Деякі виробники саме це й зробили, позначаючи ці одиниці як АU («Arbitrary Units»). Але це можливо лише за умови, якщо для оцінки рівня антитіл використовуватимуть тест-системи тільки однієї партії того самого виробника, який має власний або уніфікований стандарт із конкретним і постійним умістом досліджуваних специфічних антитіл.
До грудня 2020 такого стандарту не було. Тому всі дослідження кількісної оцінки імунітету при COVID‑19, зокрема й поствакцинного, до впровадження в практику міжнародних уніфікованих стандартів WHO NIBSC код 20/136 і 20/268 були лише орієнтовними. Така можливість з’явилася тільки зараз, разом із появою тест-систем для кількісного визначення рівня специфічних антиковідних антитіл, що опираються на вказані стандарти. Це вкрай важливо, особливо для оцінки ефективності вакцин, корекції режимів їх застосування і безпеки.
Сьогодні такі тест-системи мають комерційне застосування. Зокрема, набори вітчизняних виробників – «Vitrotest® SARS-CoV‑2 IgG QuantiSpikeтм» і «DIA®-SARS-CoV‑2-NP-IgG», де рівень антитіл виражений відповідно в BAU/ml і титрах. Зазначимо, що тест-система «Vitrotest® SARS-CoV‑2 IgG QuantiSpikeтм» виявляє рівень IgG, специфічних до S-білка коронавірусу, а «DIA®-SARS-CoV‑2-NP-IgG» – до його нуклеокапсидного антигена.
У ще офіційно неопублікованому дослідженні, розміщеному на одному з інтернет-ресурсів MedRvix (сервер препринта (передпублікацій) для дослідників у галузі охорони здоров’я) [6] оцінювали характеристики 5 тест-систем для кількісної оцінки рівня IgG. Наводимо їх характеристики.
Roche Elecsys® Anti-SARS-CoV‑2 S (Roche S tAb): виробник – Roche Diagnostics (м. Роткрейц, Швейцарія); метод дослідження – хемілюмінесцентний аналіз; виявляє сумарні антитіла проти рецептор-зв’язувального домена (RBD) S-білка SARS-CoV‑2; діапазон вимірів – 0,4-2 500 Од/мл; порогове значення чутливості – 0,8 Од/мл.
Abbott SARS-CoV‑2 IgG II (Abbott S IgG): виробник – DiaSorin (м. Стілуотер, США); метод дослідження – ІФА хемілюмінесцентних мікрочастинок (квантовий тест); виявляє IgG проти RBD S-білка SARS-CoV‑2; діапазон вимірів – 21-40 500 Од/мл (довільних одиниць AU/ml); порогове значення чутливості ≥50 Од/мл.
DiaSorin LIAISON SARS-CoV‑2 TrimericS IgG (DiaSorin TriS IgG): виробник – DiaSorin (м. Стілуотер, США); метод дослідження – хемілюмінесцентний аналіз; виявляє IgG проти тримерного S-білкового антигена SARS-CoV‑2; діапазон вимірів – 1,68-800 Од/мл (довільних одиниць AU/ml); порогове значення чутливості ≥13 Од/мл.
DiaSorin LIAISON SARS-CoV‑2 S1/2 CLIA (DiaSorin S1/2 IgG): метод дослідження – хемілюмінесцентний аналіз; виявляє IgG проти комбінованого антигена S1/S2 субодиниць S-білка SARS-CoV‑2; діапазон вимірів – 3,8-400 Од/мл (довільних одиниць AU/ml); порогове значення чутливості ≥12-15 Од/мл.
Virion\Serion ELISA agile SARS-CoV‑2 IgG (Serion IgG): виробник – Institut Virion-Serion (м. Вюрцбур, Німеччина); метод дослідження – ІФА; виявляє IgG проти загального S-білка SARS-CoV‑2; діапазон вимірів – 3-250 Од/мл (довільних одиниць AU/ml); порогове значення чутливості ≥10-15 Од/мл.
Під час оцінки результатів дослідження в цих тест-системах виявилось, що за міжнародним стандартом WHO NIBSC‑20/136 із умістом нейтралізувальних антитіл 1000 МО/мл (для уніфікації і як еквівалент запропоновані замість МО довільні зв’язувальні одиниці BAU) ці результати далекі від стандарту, а їх облік підлягає серйозній корекції – потребує поправочних коефіцієнтів. Результати лише однієї тест-системи – «Roche S tAb» практично повністю відповідали стандарту.
Облік результатів за стандартом для «Abbott S IgG», «DiaSorin TriS IgG» і «Serion IgG» потребував поправочних коефіцієнтів, які становили 0,143; 2,1 і 2,6 відповідно, для того щоб отримані результати можна було якось уніфікувати і погоджувати зі стандартом WHO NIBSC‑20/136 і перевести результати тестів з їх довільних одиниць (AU/ml) в єдиний для всіх тест-систем показник – BAU/ml.
Причина таких відмінностей у результатах оцінки тих самих зразків сироваток у різних тест-системах пояснюється таким чином. Це не відмінності в технологічних процесах чи методах дослідження, а виявлення в зразках хоч і антиковідних IgG, але різної специфічності, тобто спрямованих до різних антигенів або до епітопів цих антигенів SARS-CoV‑2. Тому вирішенням проблеми буде уніфікація використання в різних тест-системах єдиного стандартизованого діагностичного антигена, що особливо важливо для оцінки поствакцинного імунітету. Перш за все це стосується S-білка SARS-CoV‑2, оскільки практично всі ковідні вакцини стимулюють синтез імуноглобулінів до SARS-CoV‑2 саме специфічних до його S-білка чи до його компонентів.
Наведені дані показують, що в згаданому дослідженні всі проаналізовані тест-системи показали хорошу кореляцію, але й у разі застосування поправочних коефіцієнтів показники різних тестів не були повністю взаємозамінними, навіть при перерахунку в BAU/мл із використанням міжнародного стандарту ВООЗ для специфічних імуноглобулінів анти-SARS-CoV‑2. Використовуючи поправочні коефіцієнти, узгодження цих різних тестів із наведенням їхніх показників до єдиної розмірності в BAU/мл, ми в короткостроковій перспективі вирішили тактичне завдання уніфікації та узгодження. Але це лише наголошує на необхідності подальшої стандартизації кількісної оцінки постінфекційного і поствакцинного імунітету до SARS-CoV‑2 як за стандартами імуноглобулінів людини, так і за діагностичними антигенами для відповідних тест-систем [10, 11].
Алгоритм оцінки доцільності і безпечності застосування вакцинації від COVID‑19 з урахуванням відсутності даних про мінімальний захисний рівень антитіл до SARS-CoV‑2
У ситуації, що склалася, необхідно виходити з того, що в осіб, які перенесли COVID‑19 і одужали, імунітет до SARS-CoV‑2 зберігається протягом 3-6 міс, а активний – не менше 3 місяців. Врахуймо й те, що в багатьох пацієнтів була безсимптомна форма COVID‑19, а також той факт, що значна частина осіб, які перенесли за останні 6 міс ГРВІ, на момент захворювання не обстежені щодо COVID‑19. Не варто забувати і про серйозну небезпеку розвитку на тлі вакцинації так званого антитілозалежного ефекту посилення інфекції [12].
Передусім необхідно розділити пацієнтів на 2 групи: перша – це ті, хто перехворів на COVID‑19, друга – особи, які не хворіли на COVID‑19.
Тепер необхідно оцінити доцільність і необхідність вакцинації для кожної з двох груп.
Для першої групи
- Вакцинація недоцільна, якщо людина перенесла COVID‑19, що підтверджено даними ПЛР-аналізу і/або наявністю в неї антитіл до SARS-CoV‑2, причому від моменту одужання минуло не більше 3 місяців. З огляду на теоретичну можливість розвитку серйозних побічних ефектів у вигляді анафілактичних реакцій, вакцинація може бути навіть небезпечною.
- Якщо людина хворіла на COVID‑19, що підтверджено даними ПЛР-аналізу і/або наявністю в неї антитіл до SARS-CoV‑2 і з моменту одужання минуло понад 3 міс, – потрібен моніторинг наявності в пацієнта антиковідних антитіл. Якщо IgG до SARS-CoV‑2 у такої особи зберігаються – вакцинація недоцільна, якщо ж антитіла зникають – щеплення показане.
Для другої групи перед вакцинацією обов’язковою умовою є дослідження на наявність у пацієнтів антиковідних антитіл класів IgM і IgG.
- Якщо одночасно виявлені IgM і IgG до SARS-CoV‑2, то з високою ймовірністю така особа перенесла COVID‑19 упродовж останніх 3 місяців. За таких обставин вакцинація недоцільна і навіть небезпечна – через уже згадану причину.
- Якщо ж у пацієнта виявлені тільки IgM до SARS-CoV‑2 (за умови абсолютної достовірності даних, коли лабораторна помилка виключена), то, вірогідно, він хворіє на гостру форму COVID‑19. У такому разі вакцинація протипоказана й небезпечна.
- Якщо виявлені тільки IgG до SARS-CoV‑2 (за умови абсолютної достовірності даних, коли лабораторна помилка виключена), то з високою ймовірністю коронавірусна хвороба була перенесена понад 3 міс тому. Для таких людей вакцинація недоцільна.
- Якщо ані IgM, ані IgG до SARS-CoV‑2 у пацієнта не виявлені, найімовірніше він не хворів на COVID‑19. Тому вакцинація потрібна.
У пацієнтів першої і другої групи, в яких виявлені IgG до SARS-CoV‑2 і яким вакцинація визнана недоцільною, потрібен динамічний контроль відповідних IgG з інтервалом 1 раз в 1-2 міс впродовж не менше 3 міс, а пізніше – не рідше 1 разу на місяць.
За відсутності таких антитіл вакцинація показана.
Алгоритм оцінки доцільності і безпечності застосування вакцинації від COVID‑19 з урахуванням наявності даних про мінімальний захисний рівень антитіл до SARS-CoV‑2
Пацієнтів так само необхідно розділити на дві групи: перша – ті, хто перехворів на коронавірусну хворобу, друга – особи, які не хворіли на COVID‑19.
Для першої групи
- Через 3 міс після одужання потрібен динамічний контроль рівня IgG до SARS-CoV‑2 в МО/мл.
- Якщо рівень зазначених IgG нижчий від мінімального захисного – вакцинація показана.
- Якщо він дорівнює мінімальному захисному або перевищує його – вакцинація недоцільна.
- Якщо цей рівень украй високий – вакцинація не показана і дуже небезпечна, з огляду на можливість розвитку анафілактичних реакцій.
Для другої групи обов’язковою умовою перед вакцинацією є дослідження на наявність антитіл класів IgM і IgG до SARS-CoV‑2. Якщо IgG виявлені – обов’язково визначають їх рівень у МО/мл.
Далі – алгоритм, ідентичний описаному раніше для другої групи (з урахуванням відсутності даних про мінімальний захисний рівень антитіл до SARS-CoV‑2), за винятком пункту 3, який треба викласти в такій редакції.
Якщо в пацієнта достеменно виявлені тільки IgG до SARS-CoV‑2 (лабораторна помилка абсолютно виключена) і їхній рівень:
- нижчий від мінімального захисного – вакцинація показана;
- дорівнює мінімальному захисному або перевищує його – вакцинація недоцільна;
- украй високий – вакцинація не показана і дуже небезпечна з урахуванням високої ймовірності розвитку анафілактичних реакцій.
Оцінка ефективності вакцин
З появою міжнародних стандартів (NIBSC‑20/136 і -20/268) кількісного вмісту в крові пацієнтів антиковідних антитіл (сумарних або IgG), що мають різну специфічність до різних антигенів SARS-CoV‑2 або до їхніх окремих компонентів, у клінічній практиці застосовують доступні діагностичні тест-системи з кількісним визначенням рівня антиковідних антитіл. Ці тест-системи дають можливість кількісно визначити в крові людини саме IgG, специфічні до S-білка SARS-CoV‑2 (до повного глікопротеїду, його субодиниць або окремих сегментів білка).
Таким чином, з’явилася реальна можливість достовірної оцінки активності й тривалості активного постінфекційного і поствакцинного індивідуального і колективного імунітету.
Ми не враховуватимемо той факт, що ці діагностичні системи ще недосконалі, оскільки далекі від уніфікації і стандартизації. Зараз цією обставиною можна нехтувати, хоча згодом все ж необхідно опиратися на жорстку стандартизацію для реальної і достовірної кількісної оцінки імунітету до SARS-CoV‑2. Описані вище 5 тест-систем від чотирьох виробників за умови дотримання офіційного стандарту WHO NIBSC‑20/136 із умістом нейтралізувальних антитіл 1000 МО/мл (для уніфікації стандартів МО/мл запропоновано виражати в довільних зв’язувальних одиницях BAU/ml) показали, що облік їх результатів потребує корекції і поправочних коефіцієнтів від 0,143 до 2,6 (0,143; 2,1; 2,6). Результати лише однієї тест-системи повністю відповідали міжнародному стандарту WHO NIBSC‑20/136.
Вихід із цієї ситуації простий, хоч і досить умовний. Нині вимагати від виробників діагностичних систем змінювати технологію і кардинально корегувати самі тест-системи недоцільно хоча б через брак часу. Оптимально обрати ту тест-систему, результати якої відповідатимуть уже наявним стандартам WHO NIBSC‑20/136 і -20/268 або будуть максимально наближені до них. Нарешті у використовуваній тест-системі можна визначити стандартний поправочний коефіцієнт.
Таким чином, водночас вирішується проблема стандартизації та уніфікації діагностичних тест-систем для кількісної оцінки гуморального антиковідного імунітету. Щоправда, для уніфікації необхідно обирати стандарт WHO NIBSC‑20/268, оскільки в ньому враховані й сумарні нейтралізувальні антитіла до SARS-CoV‑2, і специфічні IgG до різних антигенів SARS-CoV‑2 чи їхніх частин. Оптимально враховувати і порівнювати результати тих тест-систем, в яких використовують тотожні діагностичні антигени незалежно від виробника. Інакше доведеться перераховувати результати за стандартом, оскільки антитіла різної специфічності матимуть і різний уміст.
У такий спосіб розв’язано проблему порівнюваності, відтворюваності та, головне, – стандартизації результатів оцінки активності імунітету вже наявними тест-системами.
Склалося так, що стандартом кількісної оцінки специфічного гуморального імунітету є визначення в крові пацієнта рівня специфічних або сумарних антитіл у вигляді титру чи (сучасніший варіант) рівня IgG у МО/мл (за міжнародним стандартом), а в нашому випадку – у вигляді «довільних зв’язувальних одиниць» (BAU/ml).
Зазвичай мінімальний захисний рівень специфічних IgG вже давно відомий і офіційно використовується для більшості «керованих» інфекцій. Тому не має стати винятком і COVID‑19. Для цього й розроблені описані раніше тест-системи.
Проте за надзвичайних умов сьогодення вимоги до ковідних вакцин і критеріїв їхньої ефективності надміру лібералізовані (навіть при збереженні контрольної і регулювальної функції ВООЗ). Чого вартий тільки офіційний критерій ефективності вакцинації, виражений не в числі захищених від COVID‑19 після щеплення (що є загальновідомим й усіма визнаним), а в рівні осіб, яким «пощастить» хворіти на нетяжку форму, яка не потребує ушпиталення. Дослівно: «Efficacy against severe disease, which includes COVID‑19 – related hospitalization, varies by age and by time after vaccination» («Ефективність стосовно тяжкого захворювання, яке включає госпіталізацію, пов’язану з COVID‑19, залежить від віку і часу після вакцинації»). Це пояснення до колонки таблиці «Efficacy against severe COVID‑19» («Ефективність стосовно тяжких форм COVID‑19»), що чітко зазначено в примітці, надрукованій дрібним шрифтом [13].
Безсумнівно, украй важливо зменшити кількість хворих на COVID‑19 із тяжким і середньотяжким ступенем до ≤5%. Але потрібна реальна класична оцінка ефективності вакцинації. А з огляду на очікуваний вал вакцин із різним механізмом дії від різних виробників – і поготів.
Для динамічної оцінки активності антиковідного імунітету треба було б набрати статистично значущі групи хворих на COVID‑19 з урахуванням статі, віку, ступеня тяжкості недуги. А далі через певні часові інтервали визначати в пацієнтів рівень антиковідних антитіл. Для оцінки активності постінфекційного імунітету, його напруженості й тривалості в указаних групах також періодично необхідно визначати рівень антитіл із подальшою статистичною обробкою даних.
А ось для оцінки мінімального захисного рівня антиковідних IgG потрібний кардинально інший підхід. Який поки ще не розроблено.
Тому сьогодні необхідно працювати за двома напрямами: використовувати дані осіб, які вже перенесли COVID‑19 і захворіли повторно, а також досліджувати групи хворих на COVID‑19, які занедужали після вакцинації.
За таких обставин потрібна динамічна оцінка активності постінфекційного антиковідного імунітету в осіб першої групи з певними часовими інтервалами та аналіз таких рівнів антиковідних IgG, при яких уможливлюється повторне захворювання на COVID‑19.
У другій групі (вакцинованих) потрібна динамічна оцінка активності поствакцинного імунітету – також із певними часовими інтервалами – і аналіз рівня зазначених IgG, за якого вакциновані особи можуть захворіти на COVID‑19.
Дослідження мають тривати не менше 6 міс (середній показник максимальної тривалості імунітету при COVID‑19) або довше. Таким чином упродовж 6-12 міс можна буде достовірно оцінити показник мінімального захисного рівня антиковідних IgG.
Чи є сьогодні можливість оцінити доцільність і необхідність вакцинації від SARS-CoV‑2, спираючися на стан антиковідних IgG без знання їхнього мінімального захисного рівня? Так, це можливо, якщо брати до уваги дані стандартів WHO NIBSC‑20/136 і -20/268, де вказано, що рівень антитіл ≥700 BAU/ml вважається високим; ≥20-300 BAU/ml – середнім, а 10-50 BAU/ml – низьким. Зазначені дані отримані при аналізі сироваток пацієнтів, які перенесли COVID‑19.
Тому можна умовно вважати, що:
- у разі «середнього» і «вищого від середнього» рівня антиковідних IgG (>200 BAU/ml) – вакцинація недоцільна;
- у разі «високого» рівня (>400-500 BAU/ml) – вакцинація може бути небезпечною;
- «низький» рівень антиковідних IgG (≤50 BAU/ml) жодної практичної інформації не дає. У цьому разі для з’ясування доцільності вакцинації треба знати мінімальний індивідуальний захисний рівень антиковідних IgG.
Список літератури – у редакції.