27 жовтня, 2021
Серцево-судинні ускладнення коронавірусної хвороби: на що необхідно звернути увагу сімейному лікарю?
 Зазвичай медичними термінами користуються лише лікарі та медичний персонал, але такі нові поняття, як коронавірус (SARS-CoV-2) й коронавірусна хвороба (COVID-19), відомі не лише представникам сфери охорони здоров’я, а й дітям, підліткам і дорослим (навіть дуже далеким від медицини). В переважній більшості випадків термін COVID-19 асоціюється з ураженням легень та розвитком гострого респіраторного дистрес-синдрому. Незважаючи на це, перебіг COVID-19 часто ускладнюється залученням серцево-судинної системи (ССС) до патологічного процесу.
Зазвичай медичними термінами користуються лише лікарі та медичний персонал, але такі нові поняття, як коронавірус (SARS-CoV-2) й коронавірусна хвороба (COVID-19), відомі не лише представникам сфери охорони здоров’я, а й дітям, підліткам і дорослим (навіть дуже далеким від медицини). В переважній більшості випадків термін COVID-19 асоціюється з ураженням легень та розвитком гострого респіраторного дистрес-синдрому. Незважаючи на це, перебіг COVID-19 часто ускладнюється залученням серцево-судинної системи (ССС) до патологічного процесу.
На початку пандемії цей факт констатували китайські лікарі, згодом його визначали спеціалісти інших країн. Протягом цього року опубліковано значну кількість рандомізованих клінічних досліджень (РКД), систематичних оглядів і метааналізів, за допомогою яких розкрито вплив COVID‑19 на кардіоваскулярну систему як під час гострої фази, так і за тривалого перебігу захворювання (т. зв. постковідного синдрому). В цьому огляді пропонуємо читачам ознайомитися із ключовими положеннями зазначених документів, які допоможуть сімейним лікарям, кардіологам і терапевтам визначитися з тактикою ведення хворих на COVID‑19.
Гостра COVID‑19: вплив на серцево-судинну систему
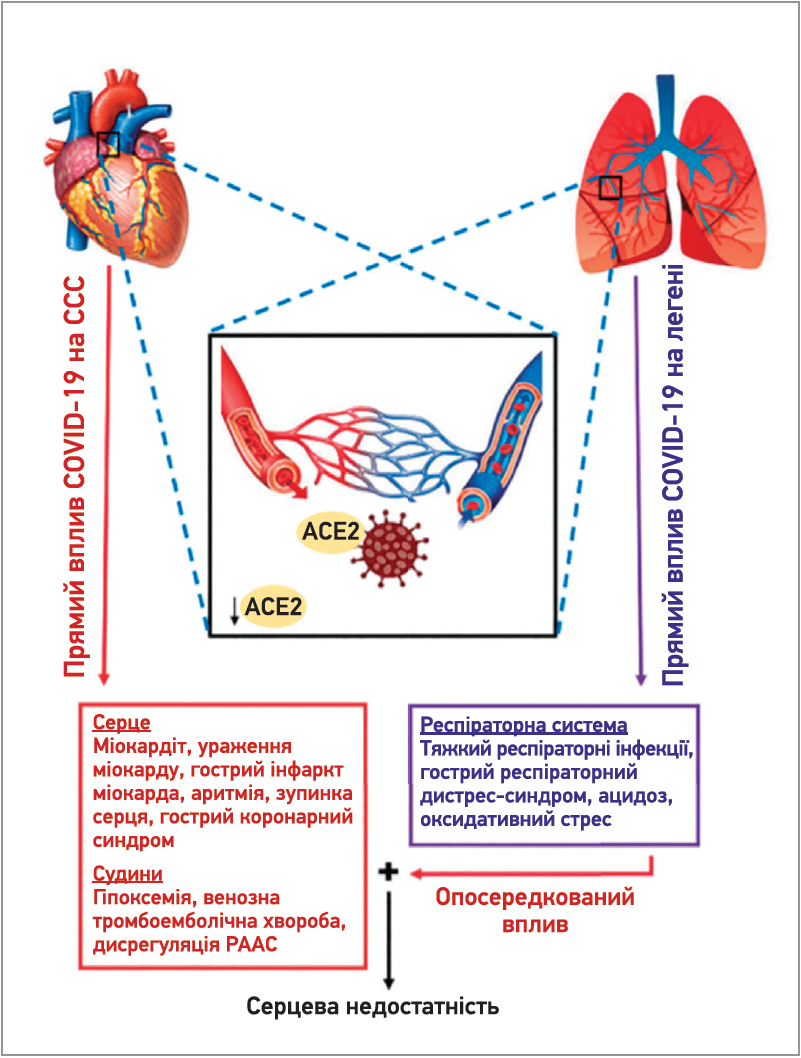
Відомо, що SARS-CoV‑2 насамперед атакує дихальну систему, але водночас здатен спровокувати ураження ССС завдяки прямому й опосередкованому механізмам (рис. 1), тому у хворих на COVID‑19 часто діагностують міокардит, гострий коронарний синдром, гострий інфаркт міокарда (ІМ), різноманітні порушення серцевого ритму, раптову зупинку серця, венозну тромбоемболію, серцеву недостатність (СН). COVID‑19-асоційоване ураження ССС супроводжується підвищенням рівня високочутливого серцевого тропоніну I, МВ‑фракції креатинкінази, С‑реактивного білка (СРБ), N‑термінального прогормона натрійуретичного пептиду (NT-proBNP) та відповідними змінами на електрокардіограмі (ЕКГ), під час проведення ехокардіографії (ЕхоКГ), магнітно-резонансної томографії (МРТ).
Рис. 1. Механізми впливу SARS-CoV-2 на ССС
(за Adu-Amankwaah J. et al., 2021)
Примітка: РААС – ренін-ангіотензин-альдостеронова система.
Кардіоваскулярні ускладнення на тлі COVID‑19 описані як у молодих пацієнтів, котрі не мали раніше жодних скарг на серцеві хвороби чи діагностованого серцево-судинного захворювання (ССЗ), так і в літніх осіб з великою кількістю різноманітної супутньої патології. Наразі переконливо доведено, що наявність існуючого ССЗ значно підвищує імовірність несприятливого перебігу COVID‑19 (сумарне відношення шансів (ВШ) 1,41; 95% довірчий інтервал (ДІ) 1,32-1,51), незважаючи на вік, стать, тип захворювання, географічний регіон і наслідки захворювання (Xu J. et al., 2021). Супутня СН також визнана предиктором госпіталізації, тяжкого перебігу та смерті від COVID‑19 (Yonas E. et al., 2021).
Лікарям первинної ланки необхідно пам’ятати, що в осіб з наявною патологією ССС (сукупний відносний ризик (ВР) 3,2; 95% ДІ 2,3-4,5), гіпертензією (ВР 2,6; 95% ДІ 2,0-3,4), цереброваскулярними захворюваннями (ВР 2,7; 95% 95% ДІ 1,7-4,1) та ураженням нирок (ВР 2,5; 95% ДІ 1,8-3,4) слід очікувати на тяжкий перебіг COVID‑19 (Fernández Villalobos N. V. et al., 2021). При госпіталізації до відділення реанімації несприятливий прогноз мають особи похилого віку (стандартизована середня різниця 0,65; 95% ДІ 0,53-0,77), курці (ВШ 1,40; 95% ДІ 1,03-1,90), хворі на цукровий діабет (ВШ 1,41; 95% ДІ 1,22-1,63), пацієнти із супутньою патологією органів дихання (ВШ 1,75; 95% ДІ 1,33-2,31), нирок (ВШ 2,39; 95% ДІ 1,68-3,40), неопластичними захворюваннями (ВШ 1,81; 95% ДІ 1,30-2,52): ризик летального випадку в них є надзвичайно високим (Taylor E. et al., 2021). Результати метааналізу також красномовно свідчать, що ймовірність смерті від COVID‑19 значно зростає в осіб, котрі страждають на ССЗ (ВШ 1,91; 95% ДІ 1,52-2,38) та гіпертонію (ВШ 1,54; 95% ДІ 1,29-1,85) (Taylor E. et al., 2021).
Уже немає сумнівів, що наявність ССЗ, гіпертензії, ожиріння, хронічного обструктивного захворювання легень, цукрового діабету, гострого ушкодження нирок, підвищення рівня D‑димеру асоціюються з високим ризиком смерті в госпіталізованих хворих на COVID‑19 (Dessie Z. G. et al., 2021). На думку С. Shi та співавт. (2021), необхідно прогнозувати перебіг COVID‑19 з урахуванням таких предикторів летального випадку, як похилий вік, чоловіча стать, активне куріння, супутні захворювання нирок, дихальних шляхів і особливо ССЗ.
Детальніший аналіз впливу окремої існуючої кардіальної нозології на стан пацієнтів з COVID‑19 провели А. Hessami та співавт. (2021). Після аналізування даних 56 досліджень вони встановили, що ризик смерті під час COVID‑19 є надзвичайно високим у хворих на СН (ВШ 6,72; 95% ДІ 3,34-13,52), ішемічну хворобу серця (ВШ 3,78; 95% ДІ 2,42-5,90), дещо нижчим в осіб із гіпертонією (ВШ 2,60; 95% ДІ 2,11-3,19), аритмією (ВШ 2,75; 95% ДІ 1,43-5,25) та іншими ССЗ (ВШ 2,61; 95% ДІ 1,89-3,62). Найнесприятливіший прогноз притаманний пацієнтам з гострим ураженням міокарда: ймовірність летального випадку зростає майже в 13 разів (ВШ 13,29, 95% ДІ 7,35-24,03) (Hessami А. et al., 2021). Аритмія (ВШ 7,03; 95% ДІ 2,79-17,69), ішемічна хвороба серця (ВШ 2,61; 95% ДІ 1,09-6,26), ССЗ (ВШ 3,11; 95% ДІ 1,59-6,09) та артеріальна гіпертензія (ВШ 1,95; 95% ДІ 1,41-2,68) визнані факторами, що визначають високу ймовірність госпіталізації до відділення інтенсивної терапії (Hessami А. et al, 2021).
Постковідний синдром: кардіальні прояви
Термін «постковідний синдром» застосовують для пояснення ґенезу клінічних ознак, що з’являються під час або після перенесеної COVID‑19, зберігаються протягом >3-12 тиж, які не можна пояснити альтернативним діагнозом (Carod-Artal F.J., 2021).
Згідно з даними систематичного огляду та метааналізу 16 досліджень (n=890), майже в 46,4% (95% ДІ 43,2-49,7%) пацієнтів, які одужують після перенесеної COVID‑19, знаходять ≥1 патологічної ознаки при проведенні МРТ серця та судин (Kim J. Y. et al., 2021). Сукупна поширеність міокардиту та пізнього контрастування складає 14,0 (95% ДІ 11,6-16,8) та 20,5% (95% ДІ 17,7-23,6) відповідно (Kim J. Y. et al., 2021).
Автори систематичного огляду 35 досліджень (n=52 609) наводять переконливі факти несприятливого впливу перенесеної COVID‑19 на стан серцевого м’яза (Ramadan M. S. et al., 2021). Після аналізу даних МРТ, ЕхоКГ, ЕКГ і вмісту серцевих біомаркерів учені довели, що COVID‑19 асоціюється з ураженням серця de novo та прогресуванням існуючої кардіальної патології. У ранній фазі постковідного синдрому домінують такі клінічні ознаки, як біль у грудях (25%) та задишка (36%); на МРТ фіксують подовження фаз Т1 (30%), Т2 (16%), появу перикардіального випоту (15%), пізнє контрастування гадолінієм (11%) (Ramadan М. et al., 2021). Через 3-6 міс після одужання при проведенні МРТ відзначають зменшення глобальної поздовжньої деформації лівого шлуночка (30%), пізнє контрастування гадолінієм (10%), на ЕхоКГ знаходять ознаки діастолічної дисфункції (40%), а при лабораторному обстеженні фіксують підвищення рівня NT-proBNP (18%). Доведено, що після одужання від COVID‑19 ризик розвитку СН, аритмії та ІМ зростає у 3 рази (95% ДІ 2,7-3,2) (Ramadan M. S. et al., 2021).
Канадські кардіологи підкреслюють значну поширеність кардіоваскулярних скарг у хворих з постковідним синдромом і рекомендують за наявності персистуючого болю в грудях або появи незрозумілих та неприємних відчуттів у ділянці серця, задишки, аритмії, постурального запаморочення пропонувати реконвалесцентам після COVID‑19 негайно звернутися до кардіолога (Paterson I. et al., 2021).
SARS-CoV‑2: механізми впливу на ССС
Згідно з домінуючою теорією патофізіологічного впливу SARS-CoV‑2 на організм людини, вірус знижує рівень ангіотензинперетворювального ферменту‑2 (АПФ‑2) та створює передумови для дисфункції міокарда й усього судинного русла (Kaye A. et al., 2021). У випадку захворювання на COVID‑19 вірус SARS-CoV‑2 здатен безпосередньо уражати кардіоміоцити й ендотеліальні клітини, приєднуючись до АПФ‑2-рецепторів через білок-шип і проникаючи до клітин шляхом злиття вірусної та клітинної мембран; цей механізм впливу розглядають як пряму патогенну дію. Своєю чергою, непрямий негативний вплив на кардіоміоцити пов’язують з розвитком системної запальної відповіді, зменшенням кровопостачання (Adu-Amankwaah J. et al., 2021).
Водночас описана SARS-CoV‑2-індукована дисліпідемія зі значним підвищенням умісту лізофосфатидилхоліну, вільних жирних кислот, фосфатидилгліцерину, яка значно збільшує ризик ураження серцевого м’яза через дисбаланс між потребою тканин у кисні та його постачанням, активацію запалення, розрив коронарної бляшки (Adu-Amankwaah J. et al., 2021).
Крім ураження ССС і легеневої системи, COVID‑19 провокує довгострокове ушкодження імунної системи (здебільшого у вигляді її гіперактивації) – цитокіновий шторм. Значна кількість цитокінів відповідає за інфікування SARS-CoV‑2: суттєво зростає уміст первинних прозапальних цитокінів (феритин, СРБ, інтерлейкін‑6, інтерлейкін‑1β, інтерферон-γ, фактор некрозу пухлини-α), які індукують та посилюють запалення не лише в легенях, а й в кардіоміоцитах та ендотеліоцитах, сприяючи ураженню ССС і виникненню поліорганної недостатності (Kaye A. et al., 2021).
Значну увагу у прогресуванні COVID‑19 та появі тривалого постковідного синдрому приділяють ураженню ендотеліальних клітин. Ендотелій (як легені та ССС) має високу щільність розташування АПФ‑2-рецепторів, через які SARS-CoV‑2 проникає в ендотеліальну систему та порушує її роботу (Kaye A. et al., 2021).
Зміна функціональної активності такого важливого ендокринного органа, як ендотелій, зумовлює втрату контролю над згортанням крові, порушення регуляції судинного тонусу й артеріального тиску, зменшення фільтраційної функції нирок, скорочувальної активності серця, метаболічного забезпечення мозку. Порушення регуляції таких протилежних процесів, як вазодилатація і вазоконстрикція, синтез та інгібування факторів проліферації, фібринолізу й агрегації тромбоцитів, дисбаланс у виробленні про- та протизапальних цитокінів позначається на стані всіх органів і систем (Kaye A. et al., 2021). Вагому роль у цих патологічних процесах має зниження синтезу оксиду азоту (NO) в ендотеліоцитах, який бере участь у регуляції коронарного кровотоку, розширюючи чи звужуючи просвіт судин відповідно до фізіологічної потреби. SARS-CoV‑2-індуковане ушкодження ендотелію асоціюється з появою ендотеліальної дисфункції у вигляді вазоконстрикції, активації згортання крові та цитокінового шторму.
Нормалізація функції ендотелію для швидкого одужання від COVID‑19
Можливість прискорення одужання від COVID‑19 досліджується в багатьох РКД; значну увагу приділяють стабілізації та відновленню функції ендотелію. В деяких роботах відзначена доцільність використання інгібіторів ренін-ангіотензину та статинів як препаратів, що зменшують прояви ендотеліальної дисфункції завдяки нівелюванню запалення, відновленню ендотеліоцитів і попередженню тромбоутворення.
Крім цих ліків, великі надії пов’язують з умовно незамінною амінокислотою L‑аргініном. Відомо, що аргінін є попередником синтезу білків, NO, сечовини, поліамінів, проліну, глутамату, креатину й агматину (Di Renzo L. et al., 2021). Навіть ще до появи пандемії COVID‑19 учені довели, що аргінін посилює імунітет завдяки стимулювальному впливу на лімфоцити, макрофаги та дендритні клітини. Покращення кровообігу на рівні мікросудинного русла при застосуванні аргініну пояснюють наявністю в молекулі цієї амінокислоти 4 атомів азоту, а також синтезом достатньої кількості NO – відомого сильнодіючого судинорозширювального засобу. Додаткові антиоксидантні, протибактеріальні й антивірусні можливості NO разом з його дезінтоксикаційними властивостями (Wu G. et al., 2021) вплинули на те, що L‑аргінін є одним з потенційних засобів для корекції серцево-судинних ускладнень в осіб з COVID‑19.
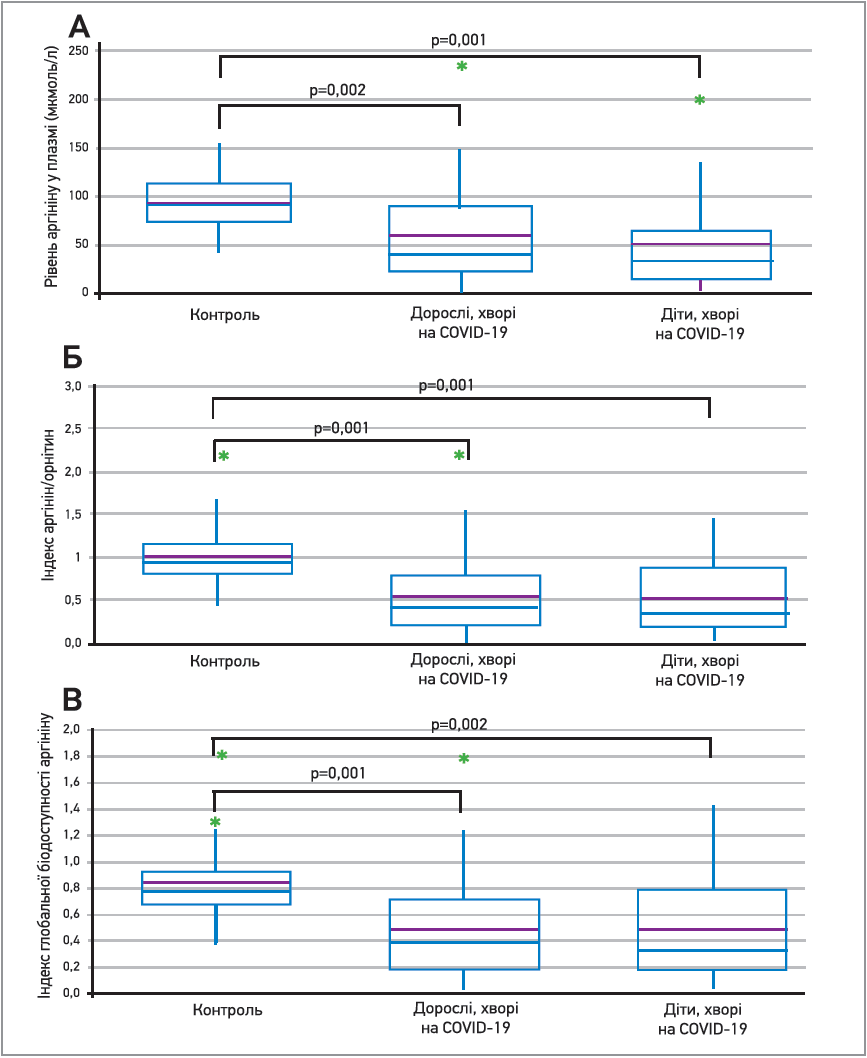
Згідно з даними проспективного обсерваційного дослідження, біодоступність аргініну у хворих на COVID‑19, котрі перебували на стаціонарному лікуванні з тяжким перебігом хвороби, значно знижена (Rees С. et al., 2021). Уміст аргініну, значення індексу аргінін/орнітин і глобальний індекс біодоступності аргініну в дорослих (n=32), дітей (n=20) були достовірно нижчими, ніж у здорових волонтерів (n=28) (рис. 2).
Рис. 2. Біодоступність аргініну у хворих на COVID-19 порівняно зі здоровими добровольцями: біодоступність аргініну в плазмі (а);
індекс аргінін/орнітин (б), індекс глобальної біодоступності аргініну (в)
(за Rees С. et al., 2021)
Зафіксоване зниження індексу аргінін/орнітин свідчило про підвищення активності аргінази – ферменту, що каталізує розщеплення аргініну. Отримані дані вчені пояснили значною імунною дисрегуляцією та ендотеліальною дисфункцією в хворих на COVID‑19, а також припустили, що виснаження внутрішніх запасів аргініну при COVID‑19 може сприяти ендотеліальній дисфункції, дисрегуляції Т‑клітин і коагулопатії (Rees С. et al., 2021).
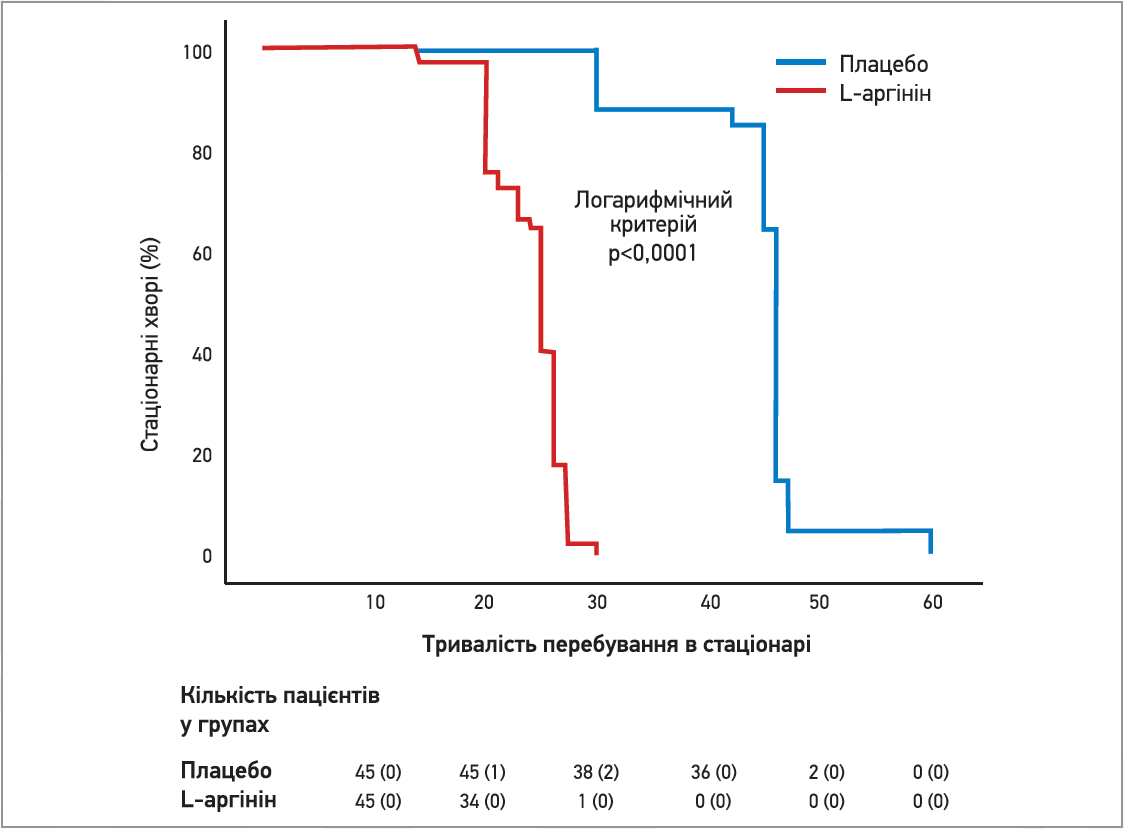
Усі вищенаведені дані щодо властивостей L‑аргініну стали підставою для проведення подвійного сліпого рандомізованого плацебо-контрольованого дослідження, в якому госпіталізованим хворим з тяжким перебігом COVID‑19 (n=90) додатково призначали пероральний L‑аргінін (1,66 г 2 р/добу) чи плацебо (Fiorentino G. et al., 2021). Як первинну кінцеву точку обрали зниження необхідності в респіраторній підтримці через 10 та 20 діб після лікування; вторинну кінцеву точку склали тривалість перебування в стаціонарі, час до нормалізації кількості лімфоцитів і час отримання негативного результату полімеразної ланцюгової реакції щодо наявності SARS-CoV‑2 в мазках з носоглотки.
На 10-ту добу лікування лікарі відзначили зниження активності респіраторної підтримки в 71,1% пацієнтів із групи L‑аргініну та в 44,4% хворих із групи плацебо (р<0,01). На 20-ту добу лікування зазначена достовірна міжгрупова різниця нівелювалася. Середня тривалість перебування в стаціонарі стрімко знизилася в хворих, які додатково отримували L‑аргінін: вона склала 25 днів в основній групі та 46 діб у групі плацебо (р<0,0001). Внесення поправки на вік, стать пацієнтів, тривалість існування симптомів, наявність супутніх захворювань, рівень D‑димеру, прийом противірусних засобів та антикоагулянтів не вплинуло на наведені дані: пероральний прийом L‑аргініну суттєво зменшував тривалість стаціонарного лікування (рис. 3).
Рис. 3. Вплив L-аргініну на тривалість стаціонарного лікування хворих на COVID-19
(за Fiorentino G. et al., 2021)
Отже, додаткове призначення перорального L‑аргініну значно зменшує тривалість стаціонарного лікування хворих з тяжким перебігом COVID‑19 та достовірно знижує необхідність у респіраторній підтримці після 10 діб лікування.
Нині триває подвійне сліпе плацебо-контрольоване РКД, в якому аналізують коротко- та довготривалі ефекти додавання перорального L‑аргініну до стандартної терапії у хворих на COVID‑19. Учені сподіваються отримати дані щодо здатності L‑аргініну зменшувати тривалість перебування в стаціонарі, збільшувати кількість лімфоцитів у сироватці крові й індекс оксигенації (РаO2/FiO2). Перші результати лікарі планують отримати цієї осені.
Тівортін – незамінний донатор оксиду азоту
Перебіг як гострої фази COVID‑19, так і постковідного синдрому може супроводжуватися розвитком ускладнень з боку ССС. Уведення аргініну до раціону харчування реконвалесцентів від COVID‑19 потенційно може збільшити кількість популяції Т‑лімфоцитів і їхню відповідь, що сприятиме нівелюванню проявів постковідного синдрому та нормалізуванню функціонування ССС (Di Renzo L. et al., 2021).
Покращити клінічний стан хворих на COVID‑19, попередити ураження кардіоваскулярної системи та зменшити тягар супутніх ССЗ можна за допомогою Тівортіну – препарату, що містить умовно незамінну амінокислоту (L‑аргінін). Розчин Тівортін®, який презентує вітчизняна фармацевтична компанія «Юрія-Фарм», доцільно застосовувати в гострому періоді COVID‑19 у вигляді внутрішньовенних інфузій у добовій дозі 100-200 мл. Інша форма випуску препарату (розчин Тівортін® Аспартат) призначена для перорального прийому та може бути рекомендована хворим з постковідним синдромом.
Незважаючи на тимчасову відсутність доказових даних найвищого рівня (які можна знайти у РКД, метааналізах, систематичних оглядах) доцільності призначення L‑аргініну хворим на COVID-19, дозволимо собі процитувати авторів систематичного огляду «Вплив мікронутрієнтів або умовно незамінних амінокислот на COVID‑асоційовані наслідки» (2021)» М. Rozga та співавт.: «В умовах відсутності прямих доказів, здатних підтвердити ефективність додавання мікроелементів / умовно незамінних амінокислот до стандартного лікування COVID‑19, лікарям слід керуватися клінічним досвідом і непрямими доказами їхньої результативності». Накопичений клінічний досвід переконливо свідчить на користь призначення L‑аргініну (Тівортін®) хворим і реконвалесцентам від COVID‑19.
Отже, COVID‑19 не лише обтяжує перебіг існуючих ССЗ, а й створює передумови для виникнення кардіоваскулярної патології de novo через низку прямих та опосередкованих механізмів (особливо розвиток ендотеліальної дисфункції). Можна сподіватися, що терапія L‑аргініном (Тівортін®) сприятиме відновленню функціонального стану ендотеліоцитів, попередить тромбоутворення та розвиток серцево-судинних ускладнень, покращить клінічний стан пацієнтів і зменшить тривалість стаціонарного лікування.
Список літератури знаходиться в редакції.