21 грудня, 2022
Скелетно-м’язовий біль у постковідному періоді: що потрібно знати клініцисту
 Хоча при COVID-19 зазвичай домінують респіраторні прояви, клінічний досвід і дані літератури свідчать, що всі органи та системи можуть бути прямо чи опосередковано (наприклад, через ушкодження цитокінами) залучені до перебігу коронавірусної інфекції. Крім того, часто має місце широкий спектр клінічних станів, котрі розвиваються після перенесеної гострої фази COVID-19. До них відноситься скелетно-мязовий біль (СМБ), який виникає більш ніж у половини пацієнтів, котрі перенесли коронавірусну інфекцію. У цьому матеріалі представлено огляд нових даних щодо больового синдрому, який спостерігається в постковідному періоді, його розповсюдженості, патогенезу, факторів ризику, а також шляхів оптимізації терапії.
Хоча при COVID-19 зазвичай домінують респіраторні прояви, клінічний досвід і дані літератури свідчать, що всі органи та системи можуть бути прямо чи опосередковано (наприклад, через ушкодження цитокінами) залучені до перебігу коронавірусної інфекції. Крім того, часто має місце широкий спектр клінічних станів, котрі розвиваються після перенесеної гострої фази COVID-19. До них відноситься скелетно-мязовий біль (СМБ), який виникає більш ніж у половини пацієнтів, котрі перенесли коронавірусну інфекцію. У цьому матеріалі представлено огляд нових даних щодо больового синдрому, який спостерігається в постковідному періоді, його розповсюдженості, патогенезу, факторів ризику, а також шляхів оптимізації терапії.
Тривалі симптоми, які часто мають місце у хворих на COVID-19 (так званий Long COVID), є розповсюдженим явищем і викликають неабияке занепокоєння лікарів. Відповідно до визначення Національного інституту охорони здоров’я та вдосконалення клінічної практики Великої Британії (NICE), під Long COVID слід розуміти симптоми, які розвиваються під час або після перенесеної гострої коронавірусної інфекції і зберігаються понад 4 тижні [1]. Long COVID зазвичай характеризується значним розмаїттям клінічних проявів, серед яких найчастіше зустрічаються втома, задишка, біль, нездужання після фізичного навантаження, тривале підвищення температури тіла, когнітивна дисфункція [2-4].
За оцінками експертів, на початку грудня 2021 року 1,3 млн осіб у приватних домогосподарствах Великої Британії мали ознаки Long COVID, із них 64% повідомили про несприятливий вплив симптомів на здатність виконувати повсякденну роботу [5]. Є кілька теорій, які пояснюють етіологію Long COVID: тривала присутність вірусу, повторне інфікування тим самим або, можливо, іншим штамом SARS-CoV-2, ушкодження ендотелію, гіперкоагуляція, дизавтономія, дисфункція імунної відповіді, що призводить до розвитку хронічного запалення [6-9].
Дуже поширеним проявом Long COVID є СМБ, котрий характеризується залученням суглобів, м’язів, сухожиль і зв’язок [10]. Систематичний огляд і метааналіз (35 досліджень) продемонстрували, що загальна поширеність СМБ може досягати 65,2%. При цьому досить часто біль виникав через 16 тижнів після виписки зі стаціонару [11].
Окрім негативного впливу на функціональний стан людини та якість її життя, пов’язану зі здоров’ям, СМБ завдає значних економічних збитків, зумовлених зниженням продуктивності праці та витратами на лікування болю [12-14]. Враховуючи значну поширеність СМБ, існує нагальна потреба в цілісному розумінні механізмів розвитку цього болю з метою розроблення відповідних терапевтичних підходів.
Ймовірні патофізіологічні механізми розвитку СМБ
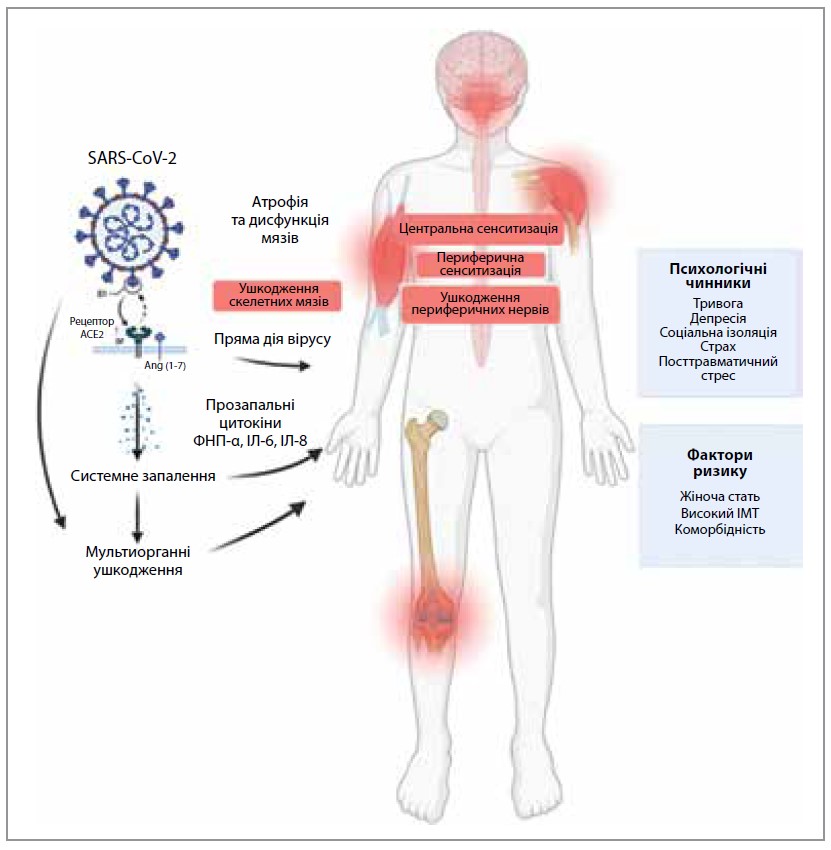
Більшість дослідників пов’язують СМБ у хворих на COVID-19 із розвитком тривалого запального процесу, асоційованого з прозапальними цитокінами та гіперактивацією імунної системи. Іншим механізмом формування СМБ вважається пряме проникнення вірусу в клітини м’язів і нервової системи за допомогою рецептора ангіотензинперетворювального ферменту 2 (АСЕ2) [15, 16]. Також було продемонстровано, що виникненню ноципластичного СМБ сприяє індукована запаленням і нейротропним вірусом підвищена збудливість нейронів периферичної та центральної нервової систем. Певну роль можуть відігравати й обтяжливі психосоціальні фактори, такі як соціальна ізоляція, страх і тривога [17].
На можливість прямого вірусного ушкодження м’язів вказує підвищення рівня сироваткової креатинінкінази (маркер ушкодження м’язів) при COVID-19, особливо в пацієнтів із симптомами міалгії [18-21]. Ознаки ушкодження м’язів було виявлено шляхом гістологічного та гістохімічного дослідження скелетної м’язової тканини, отриманої при автопсії померлих унаслідок COVID-19. Зокрема, дослідники зафіксували патологічні ознаки, характерні для міопатій, а також ознаки периферичної нейропатії [22-24]. Ці результати були додатково підтверджені даними електроміографії й дослідженнями нервової провідності [25]. Так, нещодавнє дослідження, проведене за участю пацієнтів із Long COVID, у більшості з них підтвердило наявність нейропатії дрібних волокон [26]. Міопатія й периферична нейропатія також можуть спричиняти міалгію та розвиток нейропатичного болю при Long COVID.
SARS-CoV-2 зумовлює надмірну запальну реакцію (так званий цитокіновий шторм) [27-30]. При цьому аномальне підвищення рівнів прозапальних цитокінів (включаючи інтерлейкін-1β) зберігається навіть через 6 місяців після появи симптомів COVID-19, а також у пацієнтів із безсимптомним перебігом гострої фази захворювання [31]. Відомо, що тривалий вплив прозапальних медіаторів, особливо фактора некрозу пухлини-α, інтерлейкіну-6, інтерлейкіну-1β і хемокінів, сприяє периферичній сенсибілізації й підвищеній збудливості ноцицепторів шляхом взаємодії з мембранними рецепторами, а також підвищенню чутливості спинного мозку та вищих мозкових центрів, залучених до обробки больових відчуттів, тобто центральній сенсибілізації [32-35].
Наявність емоційних стресових факторів у контексті COVID-19 може призвести до погіршення вже існуючого СМБ або підвищити ризик розвитку нового болю після гострої інфекції. Добре відомо, що високі рівні тривоги, депресії, соціальна ізоляція, страх і симптоми посттравматичного стресу посилюють больові відчуття та сприяють хронізації болю. На рисунку 1 узагальнено гіпотетичні механізми та фактори ризику СМБ у пацієнтів із Long COVID.
Рис. 1. Патофізіологічні механізми розвитку СМБ у пацієнтів із Long COVID
Примітки: ФНП-α – фактор некрозу пухлини-α; ІЛ – інтерлейкін.
Фактори ризику
Лише 6 із 35 досліджень повідомили про фактори ризику, пов’язані з поширеністю симптомів СМБ у пацієнтів із Long COVID [36-41]. У 3 дослідженнях було виявлено статеві відмінності, причому жінки значно частіше повідомляли про міалгію й артралгію, ніж чоловіки [41-43]. Це очікуваний результат, оскільки СМБ загалом є більш поширеним у жінок [44]. Іншим поясненням можуть бути біологічні статеві відмінності щодо експресії рецепторів АСЕ 2, а також трансмембранної серинової протеази (TMPRSS) [45].
У 2 дослідженнях було виявлено протилежні тенденції зв’язку між віком і поширеністю СМБ різного походження: збільшення віку асоціювалося зі зростанням поширеності артралгії (p<0,001) та зниженням поширеності міалгії (p<0,05) [41, 42].
Дослідження Karaarslan і співавт. виявило статистично значущий зв’язок між високим індексом маси тіла (ІМТ) і підвищеним ризиком розвитку стійкої артралгії (p=0,012) та міалгії (p=0,015), що узгоджується з висновками інших дослідників [43].
Дослідження, які вивчали зв’язок між тяжкістю гострої фази COVID-19 (надходження до відділення інтенсивної терапії) та ризиком СМБ, показали суперечливі результати. Leite та співавт. виявили, що надходження до відділення інтенсивної терапії пов’язане з більшою поширеністю болю через 1 місяць після госпіталізації, тоді як Taquet і співавт. вказують на нижчу поширеність міалгії через 6 місяців [41, 46].
Наявність міалгії під час госпіталізації або розвитку гострої інфекції COVID-19 було визначено Fernández-de-las-Peñas і співавт. як фактор ризику СМБ у пацієнтів із Long COVID. За їхніми даними, 42,5 % пацієнтів із міалгією під час гострої фази захворювання повідомили про тривалий СМБ у віддаленому періоді порівняно з 34,5 % осіб без міалгії (відносний ризик 1,41; 95% довірчий інтервал 1,04-1,904; p=0,02) [47].
Гіпотезу про те, що міалгія як початковий симптом є фактором ризику болю після COVID-19, нещодавно підтверджено дослідженням типу «випадок – контроль» [17]. Це дослідження вказує на те, що не лише міалгія, а й наявність головного болю під час гострої COVID-19 також є фактором ризику розвитку СМБ.
Переважна локалізація болю у пацієнтів із Long COVID
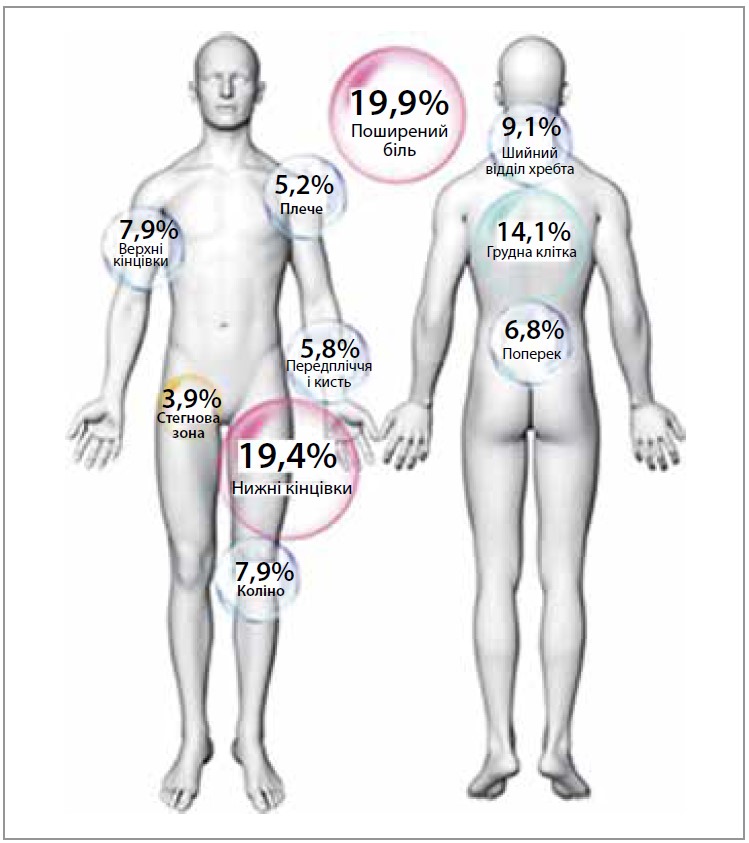
При опитуванні учасників, які перенесли COVID-19, у часовому проміжку від 6 до 10 місяців (в середньому 8,4 місяця) після виписки зі стаціонару 887 (45,1%) осіб повідомили про симптоми з боку опорно-рухового апарату після COVID-19. Основною локалізацією СМБ була шия, спина, суглоби кінцівок (рис. 2).
Рис. 2. Локалізація СМБ у пацієнтів, котрі перенесли COVID‑19, через 8 міс після виписки зі стаціонару (n=887)
Лікування СМБ у пацієнтів із Long COVID
Оскільки, згідно з результатами досліджень, постковідний СМБ є переважно запальним за етіологію, а також може бути як локальним, так і поширеним, у його лікуванні доцільно використовувати системні й топічні протизапальні препарати.
Місцеве лікування СМБ
Сьогодні, відповідно до нових рекомендацій Американського коледжу лікарів і Американської академії сімейних лікарів, місцеві нестероїдні протизапальні препарати (НПЗП) із ментоловим гелем або без нього мають бути першою лінією лікування гострого болю внаслідок травм опорно-рухового апарату [51]. Для посилення ефективності терапії болю й поліпшення фізичної функції рекомендується додатковий прийом пероральних НПЗП або ацетамінофену.
Наразі одними із найзатребуваніших топічних НПЗП для місцевого лікування СМБ залишаються гелі, до складу яких входить кетопрофен. Добре відомо, що гелі з кетопрофеном характеризуються високою проникною спроможністю, здатні створювати високі концентрації активної речовини в тканинах і забезпечують виражену знеболювальну дію. Зокрема, дослідження з вивчення швидкості проникнення топічних НПЗП за відсотком потрапляння активної речовини в місце ураження продемонструвало перевагу топічного кетопрофену порівняно з іншими НПЗП. Серед іншого було показано, що кетопрофен у формі гелю мав проникну здатність in vitro 21,9%, натомість емульсія диклофенаку, гелі ніфлумової кислоти та піроксикаму вивільняли діючу речовину з набагато меншою швидкістю: 11,2%, 4,4% та 0,5% відповідно [48]. Дифузія кетопрофену з гелю була також значно швидшою й інтенсивнішою, ніж в інших місцевих гелів НПЗП (диклофенак у вигляді гелю або емульгелю, гелі піроксикаму та ніфлумової кислоти) [49]. До того ж кетопрофен має найнижче значення коефіцієнта розподілу (logP=0,97) з-поміж інших місцевих НПЗП, тобто майже однаково виражені гідрофільні й гідрофобні властивості, що робить його ідеальним засобом для ефективної трансдермальної доставки [50].
Системне лікування СМБ
У випадках, коли СМБ є розповсюдженим або коли на тлі прийому топічних НПЗП купірування болю є недостатнім, доцільно призначати пероральний НПЗП. Обираючи між представниками цієї групи, варто зупинитися на німесуліді, який має потужну знеболювальну, протизапальну й антипіретичну активність.
Цей препарат довів свою ефективність і безпечність у хворих на COVID-19 у ході ретроспективного обсерваційного дослідження F. Suter та співавт. (2021). Крім того, німесулід (оригінальний препарат Німесил®) рекомендується італійськими експертами з метою раннього лікування амбулаторних пацієнтів із підозрою на COVID‑19.
Терапевтичний ефект німесуліду пояснюється впливом на метаболізм арахідонової кислоти, зниженням біосинтезу простагландинів шляхом пригнічення циклооксигенази (ЦОГ). Крім того, німесуліду притаманна низка фармакологічних ефектів, які не залежать від клас-специфічного впливу на ЦОГ-2. Зокрема, препарат пригнічує гіперпродукцію головних прозапальних цитокінів (інтерлейкіну-6, фактора некрозу пухлини-α), знижує активність металопротеїназ, чинить антигістамінну дію. До не-ЦОГ-2-асоційованих ефектів німесуліду також належить його здатність пригнічувати фермент фосфодіестеразу-4 і завдяки цьому знижувати активність макрофагів і нейтрофілів, які відіграють визначальну роль у патогенезі гострої запальної реакції.
Німесулід зменшує утворення супероксидних аніонів нейтрофільними гранулоцитами та пригнічує продукування вільних радикалів при запаленні. Останнє є особливо актуальним для терапії коронавірусної інфекції, перебіг якої супроводжується розвитком оксидативного стресу.
Слід зазначити, що німесулід чинить вплив на обидві ізоформи ЦОГ із переважним інгібуванням ЦОГ-2. У терапевтичних концентраціях німесулід пригнічує 88% активності ЦОГ-2 і 45% активності ЦОГ-1. Така збалансована дія німесуліду на ізоформи ЦОГ пояснює знижений ризик ускладнень із боку шлунково-кишкового тракту (ШКТ) порівняно з традиційними НПЗП, а також відсутність вираженої кардіоваскулярної токсичності (на відміну від високоселективних інгібіторів ЦОГ-2 – коксибів).
Беззаперечною перевагою Німесилу в контексті призначення пацієнтам із COVID-19 є його здатність перешкоджати зв’язуванню вірусу з рецептором АСЕ2 – «вхідними воротами» для SARS-CoV-2. Крім того, німесулід є потужним інгібітором субодиниці B0AT1 рецептора АСЕ2. Нещодавно отримано 3D-структуру АСЕ2, а також встановлено, що саме B0AT1 є «містком», необхідним для зв’язування вірусу з АСЕ2 і його транспортування всередину клітини. В роботі M. Scalise, C. Indiveri (2021) продемонстровано, що німесулід порушував транспортну функцію B0AT1, котра перериває молекулярний механізм розвитку COVID-19-асоційованого болю [52]. Здатність Німесилу зв’язуватися з рецептором АСЕ2 дозволяє перервати молекулярний механізм формування болю й попередити розвиток хронізації больового синдрому. Таким чином, застосування цього препарату є доцільним у лікуванні як гострого, так і хронічного COVID-19-асоційованого болю.
Висновки
Таким чином, серед пацієнтів із Long COVID досить поширеним станом є СМБ, що може проявлятися як локалізований біль у певній ділянці або мати поширений (генералізований) характер. СМБ може існувати тривалий час і здатен суттєво порушувати якість життя та працездатність пацієнтів, тому потребує своєчасного адекватного лікування. Оскільки провідним механізмом формування СМБ вважається запалення, в основі лікування цього різновиду болю має лежати призначення місцевих і системних НПЗП.

Медична газета «Здоров’я України 21 сторіччя» № 14 (531), 2022 р.