16 жовтня, 2023
Гострі респіраторні вірусні інфекції: лікувати не треба чекати
Початок осені традиційно асоціюється з початком нового навчального року для школярів та студентів, але вересень також символізує повернення до навчального процесу і лікарів. Цього місяця вже стартувало декілька спеціалізованих освітніх заходів, один із найочікуваніших – великий майстер-клас із серії «Респіраторні захворювання. Лікуй респіраторно» під тематичною назвою «Гострі респіраторні вірусні інфекції (ГРВІ): лікувати не треба чекати», під час проведення якого провідні експерти з різних галузей медицини представили нові погляди на лікування та профілактику різноманітних проявів ГРВІ.
Майстер-клас розпочала завідувачка кафедри інфекційних хвороб Національного медичного університету ім. О. О. Богомольця (м. Київ), президент ГО «Всеукраїнська асоціація інфекціоністів», доктор медичних наук, професор Ольга Анатоліївна Голубовська з доповіддю «ГРВІ: підходи до діагностики та принципи терапії».
 Нагадавши етіологічну структуру ГРВІ, в якій домінують віруси грипу, парагрипу, риновіруси, коронавіруси, реовіруси, аденовіруси, деякі серотипи ентеровірусів, доповідачка підкреслила, що діагноз ГРВІ підтверджується лише при виявленні в хворого ознак ураження дихальних шляхів (ДШ). Незважаючи на значну кількість респіраторних вірусів, особлива увага лікарів і науковців усього світу зосереджена на SARS-CoV‑2 – збуднику COVID‑19. Нещодавно знову виявлено декілька нових мутацій цього вірусу: один із них, який походить від варіанта Omicron, отримав назву EG.5 (Eris) та нині домінує у світі; спричинив чергове зростання інфікування із 7,6% у червні до 17,4% у липні. У США цей збудник став причиною 20,6% випадків COVID‑19 у серпні. Порівняно зі штамами-попередниками варіант EG.5 має нову мутацію S‑білка, яка може допомагати вірусу уникати імунного захисту. Симптоми COVID‑19 за інфікування EG.5 залишаються незмінними, причому наразі немає даних щодо тяжчого й більш ускладненого перебігу захворювання.
Нагадавши етіологічну структуру ГРВІ, в якій домінують віруси грипу, парагрипу, риновіруси, коронавіруси, реовіруси, аденовіруси, деякі серотипи ентеровірусів, доповідачка підкреслила, що діагноз ГРВІ підтверджується лише при виявленні в хворого ознак ураження дихальних шляхів (ДШ). Незважаючи на значну кількість респіраторних вірусів, особлива увага лікарів і науковців усього світу зосереджена на SARS-CoV‑2 – збуднику COVID‑19. Нещодавно знову виявлено декілька нових мутацій цього вірусу: один із них, який походить від варіанта Omicron, отримав назву EG.5 (Eris) та нині домінує у світі; спричинив чергове зростання інфікування із 7,6% у червні до 17,4% у липні. У США цей збудник став причиною 20,6% випадків COVID‑19 у серпні. Порівняно зі штамами-попередниками варіант EG.5 має нову мутацію S‑білка, яка може допомагати вірусу уникати імунного захисту. Симптоми COVID‑19 за інфікування EG.5 залишаються незмінними, причому наразі немає даних щодо тяжчого й більш ускладненого перебігу захворювання.
Характерна сучасна ознака перебігу ГРВІ – висока ймовірність виникнення вірусної пневмонії. Це збільшення зумовлено не лише підвищенням якості діагностики, а й справжнім зростанням кількості хворих за рахунок збільшення кількості пацієнтів з ослабленим імунітетом. Загалом, залежно від вірулентності мікроорганізму, віку та супутніх захворювань пацієнта, тяжкість перебігу вірусної пневмонії варіює від легкого самообмежувального до захворювання, яке загрожує життю. Вірусні пневмонії часто виникають за грипу А/Н1N1/09, COVID‑19, інфекції MERS або SARS, перебіг яких може ускладнюватися також гострим респіраторним дистрес-синдромом.
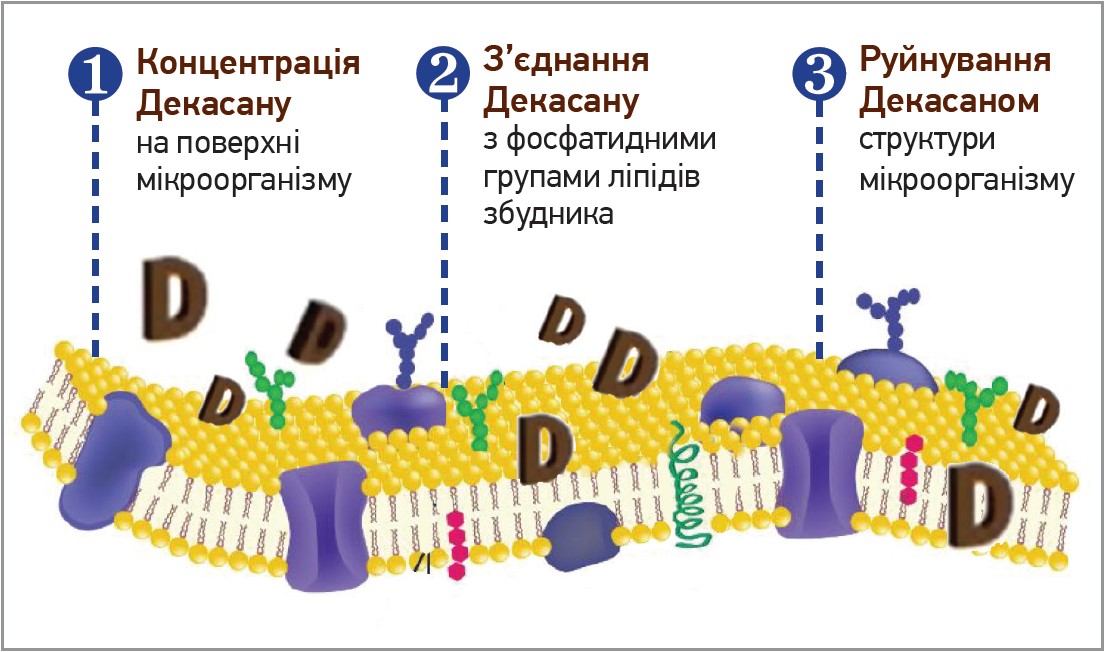
Основний принцип лікування будь-якого інфекційного процесу, в т. ч. COVID‑19, – раннє застосування етіотропних або специфічних препаратів, здатних пригнічувати реплікацію збудника. Метою лікування хворих на COVID‑19 вважають не лише їхнє одужання, а й одужання без ускладнень та/або наслідків. Терапія COVID‑19 ґрунтується на призначенні етіотропних засобів (балаксовір, паксловід, молнупіравір, ремдесивір, рибавірин, ацикловір), при виникненні ускладнень – на застосуванні антибактеріальної терапії. Стратегія зниження вірусного навантаження передбачає застосування антисептиків групи поверхнево-активних речовин, що гальмують процес депротеїнізацїї вірусу в клітині шляхом зниження рН, мають лізосомотропні властивості, тому пригнічують репродукцію вірусу в клітині. Одним із найвивченіших представників цієї групи є декаметоксин (Декасан). Декасану властиві віруліцидна, бактерицидна, фунгіцидна, протистоцидна дії. Механізм протимікробної дії декаметоксину умовно розподіляють на 3 етапи: концентрацію препарату на поверхні мікроорганізму, з’єднання із фосфатидними групами ліпідів збудника, руйнування структур мікроорганізму (рис. 1). Противірусу активність пов’язують із впливом лікарського засобу (ЛЗ) на позаклітинні віруси, ушкодженням їхніх протеаз. Поверхнева активність декаметоксину перешкоджає взаємодії вірусних і клітинних рецепторів, тобто Декасан протидіє адсорбції, проникненню та депротеїнізації вірусу. Зазначені ефекти сприяють зменшенню вірусного навантаження та зниженню ризику тяжкого перебігу COVID‑19.
Рис. 1. Механізм протимікробної дії Декасану
Спікерка підкреслила, що Декасан впливає лише на клітинну стінку бактерій та вірусів, не уражаючи клітини людини. Концентрації декаметоксину, які застосовуються в однодозових контейнерах Декасан, не мають токсичної дії, не завдають місцевих побічних ефектів, не подразнюють слизові оболонки, не всмоктуються з поверхні шкіри та слизових. Декасану притаманні також протизапальний, протиексудативний, десенсибілізувальний та спазмолітичний ефекти. Доведено противірусну ефективність декаметоксину (Декасан), що надає підстави для його застосування в разі інфекційних уражень ДШ, у т. ч. COVID‑19. Застосування Декасану дозволяє знизити вірусне навантаження мокротиння, зменшити виділення вірусу в навколишнє середовище, мінімізувати ризик зараження інших. Комбіноване застосування Декасану з іншими противірусними ЛЗ на ранньому етапі захворювання може покращити терапевтичну ефективність.
Продовжила роботу майстер-класу завідувачка кафедри педіатрії № 2 Львівського національного медичного університету ім. Д. Галицького, доктор медичних наук, професор Леся Василівна Беш, яка представила доповідь «Кашель у практиці сімейного лікаря та педіатра: вибір раціональної тактики муколітичної терапії».
 На початку свого виступу Л. В. Беш підкреслила, що кашель – це захисна реакція організму, спрямована на звільнення ДШ від слизу, мокротиння, різних хімічних речовин, механічних часточок; з іншого боку, головними причинами гострого респіраторного кашлю в дітей є інфекції, гіперреактивність бронхів, синусит, алергія, стороннє тіло ДШ. Лікування кашлю при ГРВІ проводиться одночасно зі зміною вологості та температури повітря, котрим дихає дитина, забезпеченням адекватного надходження рідини до організму та носового дихання.
На початку свого виступу Л. В. Беш підкреслила, що кашель – це захисна реакція організму, спрямована на звільнення ДШ від слизу, мокротиння, різних хімічних речовин, механічних часточок; з іншого боку, головними причинами гострого респіраторного кашлю в дітей є інфекції, гіперреактивність бронхів, синусит, алергія, стороннє тіло ДШ. Лікування кашлю при ГРВІ проводиться одночасно зі зміною вологості та температури повітря, котрим дихає дитина, забезпеченням адекватного надходження рідини до організму та носового дихання.
Підбір ЛЗ для нівелювання кашлю залежить від його типу – вологого продуктивного, сухого непродуктивного та кашлю, пов’язаного із бронхоспазмом або подразненням рефлексогенних зон. Лікарі часто спостерігають ситуацію, коли кашель є проявом бронхообструкції. У таких випадках застосовується особлива тактика лікування: призначаються бронхолітики у вигляді β2-агоністів короткої дії (БАКД; сальбутамол), холінолітики (іпратропію бромід), комбіновані препарати (фенотерол + іпратропію бромід), метилксантини (за тяжкого перебігу хвороби, внутрішньовенно). Призначення мукоактивних препаратів (ацетилцистеїн, амброксол, карбоцистеїн), з одного боку, є патогенетично обґрунтованим через їхню здатність покращувати мукоциліарний транспорт; з іншого боку, вони стимулюють синтез секрету, збільшуючи його об’єм та/або рідку частину, що може спричинити посилення бронхообструкції. Саме тому деякі лікарі-практики, науковці вважають недоцільним призначення мукоактивних препаратів дітям перших 2 років життя через небезпеку розвитку синдрому «затоплення легень». Їх несвоєчасне призначення (за непродуктивного кашлю) може супроводжуватися розвитком низки побічних ефектів (бронхоспазму в дітей раннього віку) та пригніченням мукоциліарного транспорту.
Інгаляційне лікування є дуже привабливим через його фізіологічність, швидку доставку ЛЗ безпосередньо до вогнища патологічного процесу, низький ризик розвитку системних побічних ефектів. Для лікування кашлю навіть у маленьких дітей може бути використаний Лорде Гіаль, який містить гіпертонічний розчин хлориду натрію, збагачений гіалуроновою кислотою, та дозволений до застосування з періоду новонародженості. Він призначений для інгаляційного застосування, посилює виведення слизу із ДШ, сприяє поліпшенню мукоциліарного кліренсу, має додаткові антимікробні та протизапальні властивості. Гіалуронова кислота покращує зволоження слизової оболонки бронхів під час запального процесу, зменшення подразнювальної дії гіпертонічного розчину при небулайзерній терапії. Лорде Гіаль може бути застосований для лікування бронхіоліту в маленьких дітей: зараз широко обговорюються доцільність застосування інгаляції сольових розчинів за цієї патології. У деяких рекомендаціях гіпертонічний сольовий розчин розглядають як можливий метод терапії, адже його небулайзерне застосування при бронхіоліті може значно зменшити тяжкість респіраторного дистрес-синдрому, скоротити термін перебування в стаціонарі, поліпшити якість нічного сну.
Наступну доповідь представив ректор Івано-Франківського національного медичного університету, доктор медичних наук, професор Микола Миколайович Островський, який у рамках свого виступу «Можливості використання декаметоксину в пацієнтів із хронічними неспецифічними захворюваннями ДШ при ГРВІ» ознайомив слухачів із результатами одноцентрового відкритого спостереження за хворими на хронічне обструктивне захворювання легень (ХОЗЛ) та хронічний бронхіт (ХБ) з ознаками ГРВІ.
 ХОЗЛ – поширене неінфекційне захворювання із періодичними загостреннями. Вірус-спровоковані загострення можуть супроводжуватися тяжчими респіраторними симптомами, ніж загострення бактеріальної етіології. ГРВІ порушують різні ланки локального захисту легень, порушують мукоциліарний кліренс, сприяючи в такий спосіб посиленню бактеріальної колонізації слизових оболонок і збільшуючи ризик розвитку вторинних бактеріальних інфекцій. Це все може зумовити необхідність призначення антибіотиків і зростання ризику госпіталізації. Зараз у всьому світі активно проводяться дослідження, присвячені пошуку ЛЗ із противірусною, антибактеріальною та протигрибковою дією, здатних зменшити вираженість і тривалість клінічної симптоматики, запобігти використанню антибіотиків. Саме таким вимогам відповідає антисептик декаметоксин (Декасан), який має антибактеріальну, противірусну та протигрибкову активність. Віруліцидні властивості Декасану зафіксовані проти вірусів герпесу, грипу А (H1N1, H3N2), В і SARS-CoV‑2. Завдяки протимікробному ефекту декаметоксин покращує природну та специфічну імунологічну реактивність.
ХОЗЛ – поширене неінфекційне захворювання із періодичними загостреннями. Вірус-спровоковані загострення можуть супроводжуватися тяжчими респіраторними симптомами, ніж загострення бактеріальної етіології. ГРВІ порушують різні ланки локального захисту легень, порушують мукоциліарний кліренс, сприяючи в такий спосіб посиленню бактеріальної колонізації слизових оболонок і збільшуючи ризик розвитку вторинних бактеріальних інфекцій. Це все може зумовити необхідність призначення антибіотиків і зростання ризику госпіталізації. Зараз у всьому світі активно проводяться дослідження, присвячені пошуку ЛЗ із противірусною, антибактеріальною та протигрибковою дією, здатних зменшити вираженість і тривалість клінічної симптоматики, запобігти використанню антибіотиків. Саме таким вимогам відповідає антисептик декаметоксин (Декасан), який має антибактеріальну, противірусну та протигрибкову активність. Віруліцидні властивості Декасану зафіксовані проти вірусів герпесу, грипу А (H1N1, H3N2), В і SARS-CoV‑2. Завдяки протимікробному ефекту декаметоксин покращує природну та специфічну імунологічну реактивність.
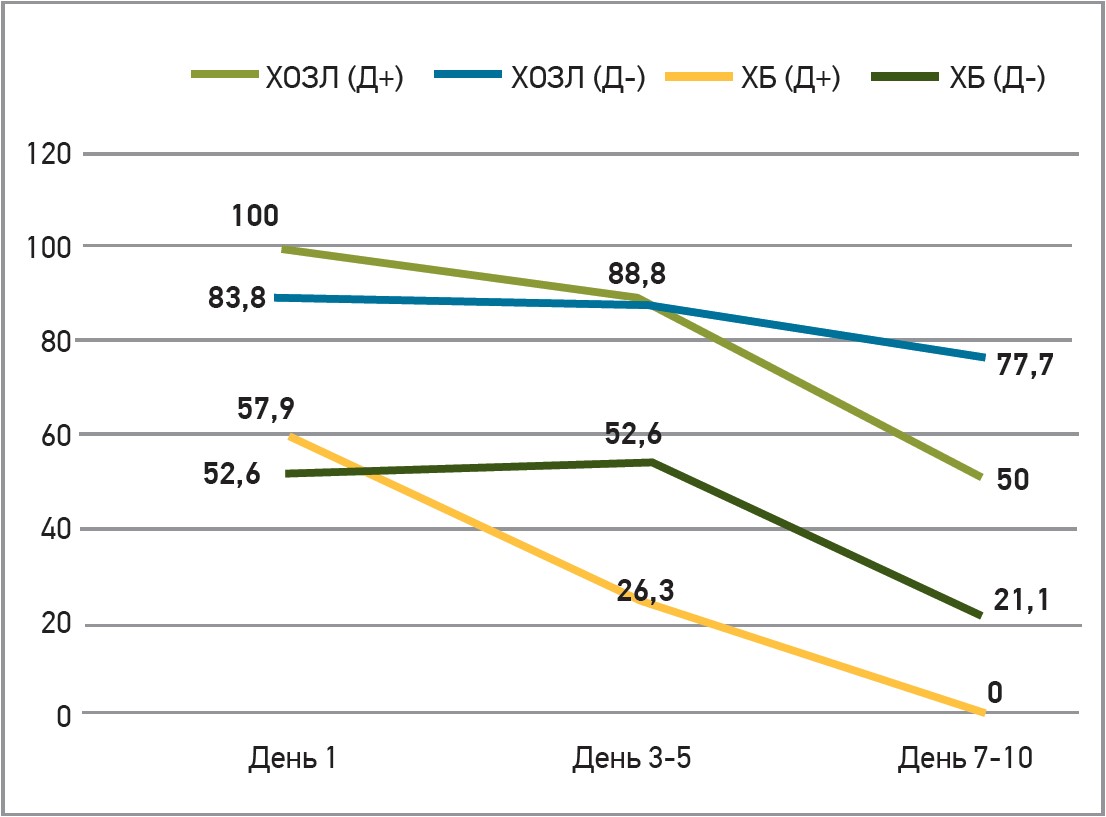
Мета проведеного дослідження – оцінка ефективності та безпеки інгаляцій декаметоксину (Декасан) у хворих із загостренням ХОЗЛ та ХБ. У дослідженні взяли участь 19 хворих на ХОЗЛ, 38 пацієнтів із ХБ (середній вік складає 58 років). На момент первинного візиту до сімейного лікаря хворим призначали симптоматичне лікування ГРВІ згідно з уніфікованим клінічним протоколом первинної медичної допомоги. Пацієнтів розподілили на 2 групи: хворі 1-ї групи додатково отримували інгаляції декаметоксину (Декасан; 0,2 мг/мл, 2 мл) за допомогою небулайзера протягом 7 діб, а 2-ї групи – лише симптоматичну терапію ГРВІ. Залежно від домінувального захворювання основну та контрольну групу розподілили на підгрупи: 1а (n=10) та 2а (n=9) підгрупи були представлені хворими на ХОЗЛ, тоді як 1б (n=19) і 2б (n=19) підгрупи склали хворі на ХБ. Установлено, що інгаляції декаметоксину сприяли зниженню температури тіла, болю в горлі, загальної слабкості. До призначення лікування основною скаргою був кашель, який турбував 100% хворих в 1а підгрупі; через 7-10 діб інгаляцій Декасану їхня кількість знизилася до 52,6%. Переважна більшість пацієнтів з підгрупи 1б (57,9%) на початку дослідження скаржилася на кашель; застосування Декасану сприяло нівелюванню цього симптому в усіх хворих цієї підгрупи (рис. 2).
Рис. 2. Динаміка кашлю на тлі лікування Декасаном
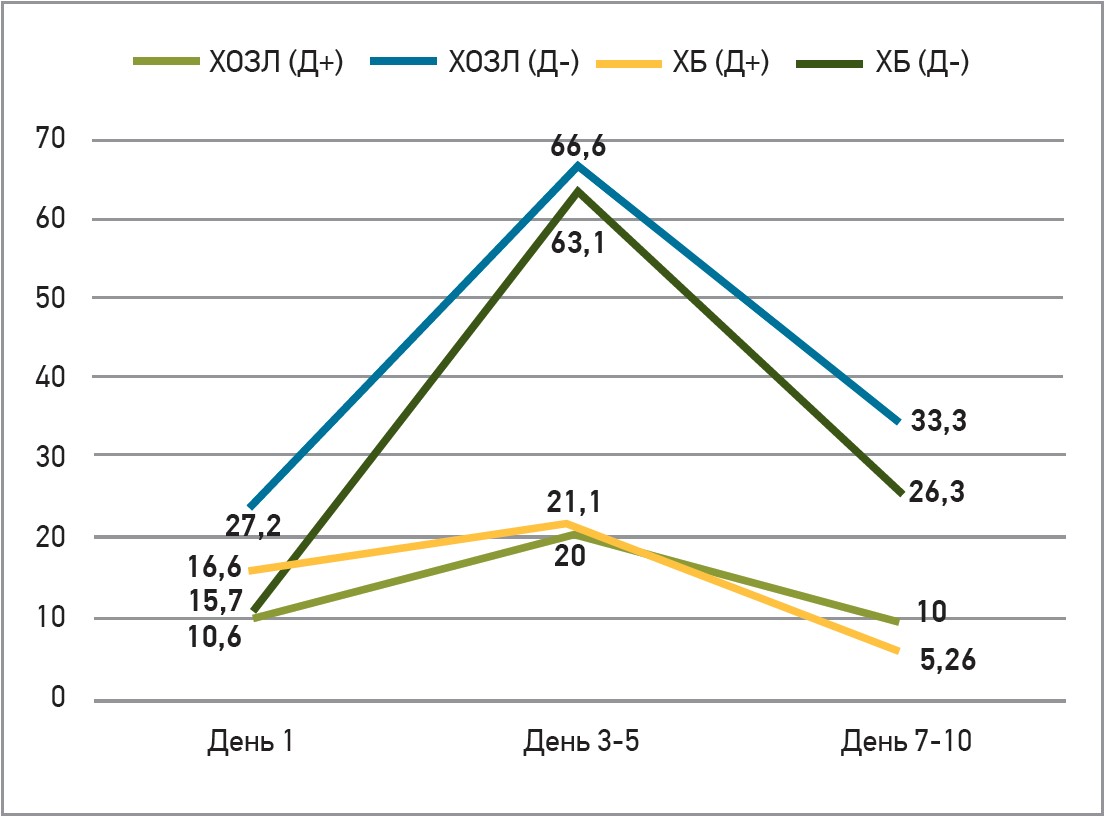
В когорті хворих на ХОЗЛ, які отримували декаметоксин, констатували зниження потреби в призначенні антибіотиків удвічі порівняно із групою контролю. Призначення Декасану асоціювалося зі зменшенням частоти появи гнійного мокротиння та зниженням випадків призначення антибактеріальної терапії (рис. 3). Крім того, хворі на ХОЗЛ удвічі рідше мали потребу в госпіталізації, якщо до схеми їхнього лікування входили інгаляції Декасаном. Додавання декаметоксину до терапії хворих на ХБ дало змогу запобігти погіршенню стану пацієнтів: жоден із них не потребував госпіталізації. Отже, включення інгаляцій декаметоксину (Декасан) до комплексного лікування ГРВІ хворих на ХОЗЛ, ХБ у 1,5-3 рази зменшувало тривалість кашлю, задишки, знижувало імовірність появи гнійного мокротиння, ринофарингеального синдрому, а також зменшувало потребу в призначенні антибіотиків і ризик госпіталізації. Схожий ефект спостерігається в хворих на ХБ: інгаляції декаметоксином дали змогу зменшити призначення антибіотиків у 2,2 раза та нівелювати потребу в госпіталізації.
Рис. 3. Інгаляції Декасаном проти появи гнійного мокротиння
Стерильні однодозові контейнери Декасану призначені для використання за допомогою небулайзера; їх можна призначати дітям віком >12 років і дорослим по 1-2 контейнери 2 р/добу завдяки хорошій переносимості та відсутності токсичної дії.
Завідувачка кафедри педіатрії та інфекційних дитячих хвороб Буковинського державного медичного університету (м. Чернівці), доктор медичних наук, професор Олена Костянтинівна Колоскова продовжила роботу майстер-класу доповіддю «Гіперсприйнятливість бронхів у дітей: місце респіраторної цитопротекції». Згідно із сучасною концепцією розвитку бронхіальної астми (БА), в основі виникнення бронхоспазму лежать гіперсприйнятливість та гіперреактивність бронхів, формуванню яких сприяють зменшення калібру ДШ, підвищення скоротливості, зміна проникності слизової бронхів, гуморальні, а також клітинні медіатори запалення, дисфункціональна нервова регуляція. Епітеліальні клітини, які устилають слизову ДШ, у т. ч. бронхів усіх щаблів, утворюють перші фізичний, хімічний та імунологічний бар’єри – невід’ємну частину вродженого імунітету. Існують докази, що дефектна бар’єрна функція разом з аномальною імунною відповіддю сприяють появі алергічних розладів.
продовжила роботу майстер-класу доповіддю «Гіперсприйнятливість бронхів у дітей: місце респіраторної цитопротекції». Згідно із сучасною концепцією розвитку бронхіальної астми (БА), в основі виникнення бронхоспазму лежать гіперсприйнятливість та гіперреактивність бронхів, формуванню яких сприяють зменшення калібру ДШ, підвищення скоротливості, зміна проникності слизової бронхів, гуморальні, а також клітинні медіатори запалення, дисфункціональна нервова регуляція. Епітеліальні клітини, які устилають слизову ДШ, у т. ч. бронхів усіх щаблів, утворюють перші фізичний, хімічний та імунологічний бар’єри – невід’ємну частину вродженого імунітету. Існують докази, що дефектна бар’єрна функція разом з аномальною імунною відповіддю сприяють появі алергічних розладів.
Респіраторна цитопротекція вважається обґрунтованою стратегією ефективного лікування та профілактики неспецифічної бронхіальної гіперсприйнятливості. Ектобріс – один із перших цитопротекторів на основі ектоїну (екстромоліту), який являє собою природну молекулу, що утворюється всередині екстремофільних мікроорганізмів. Ектоїн – циклічна амінокислота, яка сприяє стабілізації молекул води та нормалізації молекулярних взаємодій у біомолекулах. Ектоїн оточує сусідні білки / клітинні мембрани водним шаром, не взаємодіє з білками, не потрапляє усередину клітини, але сприяє стабілізації макромолекул, розташованих на зовнішній поверхні клітини. Ектоїн здатний стабілізувати клітинні мембрани, захищати епітелій від алергенів, вірусів, бактерій, хімічних агентів, зменшувати запальний процес завдяки інгібуванню прозапальних медіаторів, гіперсприйнятливості ДШ.
Доповідачка навела доказові дані ефективності ектоїну: в плацебо-контрольованому рандомізованому дослідженні (РКД) установлено позитивний вплив інгаляцій ектоїну на функцію легень, запальні маркери, вміст нейтрофілів у мокротинні порівняно із плацебо. В систематичному огляді продемонстровано докази ефективності ектоїну при гострих, хронічних запальних захворюваннях легень (алергічний риніт (АР), гострий риносинусит (РС), сухий риніт, фарингіт, ларингіт). В іншому проспективному РКД доведено, що призначення ектоїну хворим на гострий бронхіт і ГРВІ сприяє усуненню всіх симптомів захворювання, значному покращенню стану після 7 днів терапії та супроводжується стійким лікувальним ефектом, який зберігається протягом 3 тиж після закінчення використання ЛЗ. Ефективність монотерапії ектоїном у хворих на АР визнано зіставною з результативністю препаратів першої лінії (антигістамінні ЛЗ), а комбінація ектоїну з антигістамінними засобами чи інтраназальними кортикостероїдами сприяє швидшому нівелюванню патологічних симптомів.
Ектобріс – респіраторний цитопротектор на основі ектоїну, який використовується для збереження цілісності, захисту та відновлення клітин при захворюваннях ДШ. Ектобріс захищає клітинну мембрану епітеліоцитів слизової, сприяє зменшенню запалення та полегшенню симптомів за різноманітної респіраторної патології, запобігає появі клінічних ознак алергічних реакцій у разі алергічної БА, відновленню слизових оболонок.
Вірус-індукований синдром бронхіальної обструкції був у центрі уваги доповіді, яку представила професор кафедри пропедевтики внутрішньої медицини № 2 та медсестринства Харківського національного медичного університету, доктор медичних наук Галина Володимирівна Єрьоменко.
 Доповідачка підкреслила, що запалення та гіперреактивність бронхіального дерева спричиняють і посилюють органічні, неорганічні речовини і тригери: холодне повітря, бензалколонію хлорид, сірчана кислота, віруси, бактерії, пилок тощо; вони зумовлюють запалення слизової та ушкодження війчастого епітелію. Бронхоспазм розвивається за стійкого збудження парасимпатичних нейронів, яке супроводжується підвищеним виведенням ацетилхоліну, що зумовлює спазм гладкої мускулатури бронхів, підвищення бронхіальної секреції, посилення бронхообструкції. Активація блукаючого нерва зумовлює бронхіальну гіперсекрецію, бронхоспазм, кашель. Описаний механізм бронхобструкції притаманний як БА, так і ХОЗЛ. Найефективнішим сучасним способом нівелювання бронхоспазму визнано інгаляційне введення ЛЗ за допомогою небулайзера. Небулайзерна терапія дозволяє доставляти високі дози ЛЗ до ДШ за нетривалий період, максимально швидко усуває напади ядухи та утрудненого дихання, не потребує виконання форсованих маневрів, чіткої координації вдиху з вивільненням ЛЗ. Небулайзерну терапію можна застосовувати на всіх етапах надання медичної допомоги з мінімальним ризиком виникнення системних побічних ефектів.
Доповідачка підкреслила, що запалення та гіперреактивність бронхіального дерева спричиняють і посилюють органічні, неорганічні речовини і тригери: холодне повітря, бензалколонію хлорид, сірчана кислота, віруси, бактерії, пилок тощо; вони зумовлюють запалення слизової та ушкодження війчастого епітелію. Бронхоспазм розвивається за стійкого збудження парасимпатичних нейронів, яке супроводжується підвищеним виведенням ацетилхоліну, що зумовлює спазм гладкої мускулатури бронхів, підвищення бронхіальної секреції, посилення бронхообструкції. Активація блукаючого нерва зумовлює бронхіальну гіперсекрецію, бронхоспазм, кашель. Описаний механізм бронхобструкції притаманний як БА, так і ХОЗЛ. Найефективнішим сучасним способом нівелювання бронхоспазму визнано інгаляційне введення ЛЗ за допомогою небулайзера. Небулайзерна терапія дозволяє доставляти високі дози ЛЗ до ДШ за нетривалий період, максимально швидко усуває напади ядухи та утрудненого дихання, не потребує виконання форсованих маневрів, чіткої координації вдиху з вивільненням ЛЗ. Небулайзерну терапію можна застосовувати на всіх етапах надання медичної допомоги з мінімальним ризиком виникнення системних побічних ефектів.
Спікерка представила сучасну схему лікування бронхообструкції за допомогою ЛЗ вітчизняного виробника; передбачає застосування Небутамолу (сальбутамол) для усунення бронхоспазму протягом 4-5 хв інгаляції; для цього використовується 1 контейнер Небутамолу 2-4 р/добу без розведення. Другим інгаляційним препаратом із цієї схеми є Небуфлюзон, якому притаманна потужна протизапальна дія небулізованого гормона флютиказону. Небуфлюзон призначається дітям віком <16 років по ½ контейнера 2 р/добу, підліткам віком >16 років; дорослим застосовують для інгаляцій 1 контейнер 2 р/добу без розведення. Небутамол і Небуфлюзон виготовляють у сучасних однодозових контейнерах без додавання токсичних консервантів, що дозволяє проводити інгаляцію без подразнення слизової оболонки та виникнення парадоксального бронхоспазму. Значною перевагою Небутамолу та Небуфлюзону є безпечність додаткових речовин: вони містять натрію хлорид, воду для ін’єкцій, полісорбат‑80 (Небуфлюзон). Доведено, що консервант динатрію едетат подразнює слизову бронхів, збільшує їхню гіперреактивність, зумовлює кашель і парадоксальний бронхоспазм. Порівняно з будесонідом флютиказон має вищі коефіцієнт ліпофільності (3,89 vs 2,32) та індекс місцевої активності (1,7 vs 1), більшу тропність до рецепторів (1775 vs 855), меншу системну біодоступність (5 vs 40-70%).
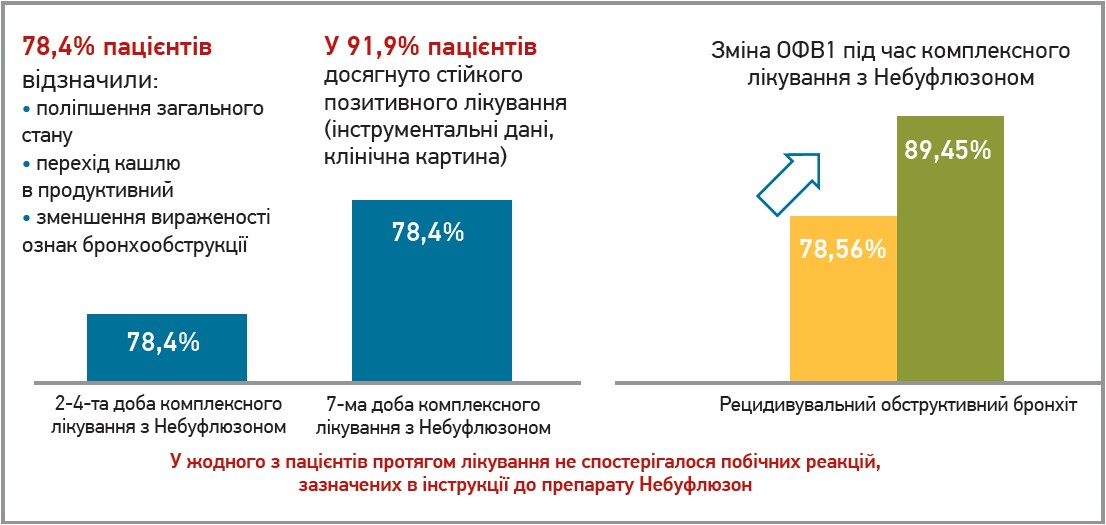
Г. В. Єрьоменко поділилася власним досвідом застосування Небуфлюзону в лікуванні обструктивного синдрому: призначення цього препарату сприяло поліпшенню загального стану, переходу сухого кашлю в продуктивний, зменшенню вираженості ознак бронхообструкції, зростанню об’єму форсованого видиху за 1 хв (рис. 4).
Рис. 4. Ефективність Небуфлюзону в лікуванні обструктивного синдрому в дітей
Небулайзерна терапія запобігає прогресуванню захворювання, зменшує вираженість симптомів, покращує показники функції зовнішнього дихання та переносимість фізичних навантажень, запобігає виникненню загострень. Небулайзерна терапія із застосуванням сальбутамолу (Небутамол) та флютиказону пропіонату (Небуфлюзон) – результативна і безпечна стратегія, яка має наукове обґрунтування й доведену ефективність.
Питання щодо «Лікування БА в дітей» розглянула завідувачка відділення дитячої пульмонології та алергології ДУ «Національний інститут фтизіатрії і пульмонології ім. Ф. Г. Яновського НАМН України» (м. Київ), доктор медичних наук Олена Олександрівна Речкіна.
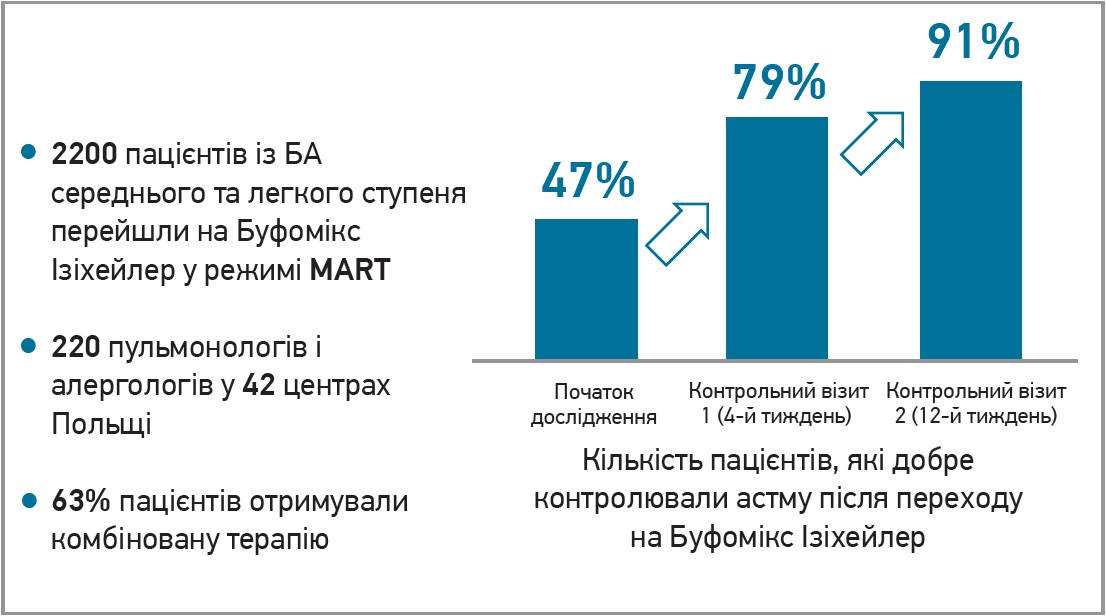
 Медикаментозне лікування БА в дітей відбувається згідно з міжнародними стандартами, наприклад відповідно до настанови GINA (2023), де зазначено, що перший крок у лікуванні БА в дітей віком 6-11 років полягає у призначенні інгаляційних кортикостероїдів (ІКС) завжди, коли приймається БАКД, тоді як крок 2 передбачає щоденний прийом ІКС із БАКД для полегшення симптомів. Крок 3 вже передбачає призначення середніх доз ІКС або комбінації низьких доз ІКС/БА тривалої дії (БАТД) із БАКД. Необхідність ескалації терапії та перехід на крок 4 асоційовано із призначенням середніх доз ІКС/БАТД із БАКД для полегшення симптомів. Провідні експерти підкреслюють неефективність використання інгаляторів для інгаляційної терапії: застосування 2 окремих інгаляторів (сальбутамол, ІКС) супроводжується формуванням низької прихильності, надмірним використанням сальбутамолу та пропусками прийому ІКС. Найдоцільнішим визнано застосування небулайзерної терапії з технологією ізіхейлер. Буфомікс ізіхейлер – протизапальний бронхолітик швидкої дії, що містить формотерол, який забезпечує швидкий бронхолітичний ефект, а також будесонід, що чинить сильну протизапальну дію на ДШ. Буфомікс ізіхейлер 4,5/80 застосовується для терапії БА в дітей у режимі одного інгалятора, інгаляції проводиться 1 раз уранці та ввечері. Буфомікс ізіхейлер можна використовувати замість сальбутамолу при гострому виникненні симптомів, максимальна кількість повторних інгаляцій за 1 раз не має перевищувати 6 інгаляцій, протягом доби – 12. Доведено, що застосування Буфомікс ізіхейлер у режимі MART достовірно підвищує контроль над перебігом БА (рис. 5).
Медикаментозне лікування БА в дітей відбувається згідно з міжнародними стандартами, наприклад відповідно до настанови GINA (2023), де зазначено, що перший крок у лікуванні БА в дітей віком 6-11 років полягає у призначенні інгаляційних кортикостероїдів (ІКС) завжди, коли приймається БАКД, тоді як крок 2 передбачає щоденний прийом ІКС із БАКД для полегшення симптомів. Крок 3 вже передбачає призначення середніх доз ІКС або комбінації низьких доз ІКС/БА тривалої дії (БАТД) із БАКД. Необхідність ескалації терапії та перехід на крок 4 асоційовано із призначенням середніх доз ІКС/БАТД із БАКД для полегшення симптомів. Провідні експерти підкреслюють неефективність використання інгаляторів для інгаляційної терапії: застосування 2 окремих інгаляторів (сальбутамол, ІКС) супроводжується формуванням низької прихильності, надмірним використанням сальбутамолу та пропусками прийому ІКС. Найдоцільнішим визнано застосування небулайзерної терапії з технологією ізіхейлер. Буфомікс ізіхейлер – протизапальний бронхолітик швидкої дії, що містить формотерол, який забезпечує швидкий бронхолітичний ефект, а також будесонід, що чинить сильну протизапальну дію на ДШ. Буфомікс ізіхейлер 4,5/80 застосовується для терапії БА в дітей у режимі одного інгалятора, інгаляції проводиться 1 раз уранці та ввечері. Буфомікс ізіхейлер можна використовувати замість сальбутамолу при гострому виникненні симптомів, максимальна кількість повторних інгаляцій за 1 раз не має перевищувати 6 інгаляцій, протягом доби – 12. Доведено, що застосування Буфомікс ізіхейлер у режимі MART достовірно підвищує контроль над перебігом БА (рис. 5).
Рис. 5. Ефективність Буфомікс ізіхейлер у лікуванні БА в дітей
Система ізіхейлер – сухопорошковий інгалятор, характеристики якого максимально наближені до вимог концепції «ідеальний інгалятор». Нині в родині ізіхейлер представлені 4 монопрепарати та 2 комбіновані продукти для лікування БА і ХОЗЛ. Основною перевагою пристрою ізіхейлер є стабільна доставка разових доз ЛЗ, незалежно від віку пацієнта, тяжкості перебігу БА, що дозволяє досягти найкращих результатів лікування. Пристроєм ізіхейлер легко користуватися, його нескладно тримати чистим і завжди мати поряд; діти та підлітки швидко навчаються правильно ним користуватися. Раннє використання ІКС у разі погіршення симптомів БА запобігає збільшенню симптомів, тому призначення Буфомікс ізіхейлер допомагає знизити частоту загострень БА та госпіталізацій.
Завідувач кафедри клінічної фармакології та клінічної фармації Національного медичного університету ім. О. О. Богомольця (м. Київ), доктор медичних наук, професор Микола Валентинович Хайтович презентував доповідь «Ефективність застосування ксилітолового зрошення при респіраторних захворюваннях».
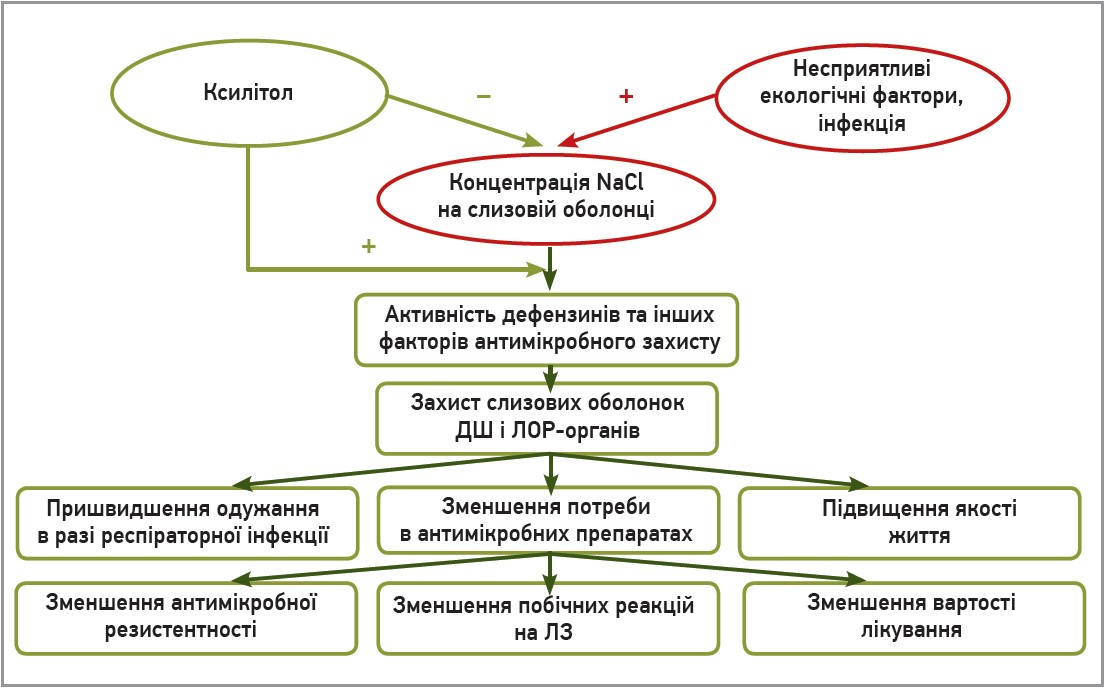
 Центром доповіді Миколи Валентиновича став ксилітол – речовина з низкою сприятливих властивостей (рис. 6). Як хороший осмоліт ксилітол приєднує значну кількість води, захищаючи клітини від проникнення патогенів, алергічних факторів. Ксилітол покращує мукоциліарний кліренс, зменшуючи в’язкість вологого слизу(порівняно із фізіологічним розчином). Ксилітолу притаманна противірусна активність, він сприяє швидшому відновленню слизової оболонки носа та нюхової функції після перенесеної інфекції, спричиненої COVID‑19. У низці досліджень зафіксовано вищу антибактеріальну активність ксилітолу щодо коагулозонегативних стафілококів, пневмококів, гемофільної палички та мораксел порівняно із фізіологічним розчином. Доведено, що застосування ксилітолу дозволяє запобігти виникненню гострого отиту в дітей, зменшує ризик виникнення РС і тривалість його перебігу. Ксилітол ефективний при АР: за його комбінації з антигістамінним ЛЗ ксилітол сприяє відновленню функціональної здатності, носового дихання в хворих на АР. Застосування назального спрею із ксилітолом значно покращує якість життя в хворих на ринокон’юнктивіт (порівняно з контролем).
Центром доповіді Миколи Валентиновича став ксилітол – речовина з низкою сприятливих властивостей (рис. 6). Як хороший осмоліт ксилітол приєднує значну кількість води, захищаючи клітини від проникнення патогенів, алергічних факторів. Ксилітол покращує мукоциліарний кліренс, зменшуючи в’язкість вологого слизу(порівняно із фізіологічним розчином). Ксилітолу притаманна противірусна активність, він сприяє швидшому відновленню слизової оболонки носа та нюхової функції після перенесеної інфекції, спричиненої COVID‑19. У низці досліджень зафіксовано вищу антибактеріальну активність ксилітолу щодо коагулозонегативних стафілококів, пневмококів, гемофільної палички та мораксел порівняно із фізіологічним розчином. Доведено, що застосування ксилітолу дозволяє запобігти виникненню гострого отиту в дітей, зменшує ризик виникнення РС і тривалість його перебігу. Ксилітол ефективний при АР: за його комбінації з антигістамінним ЛЗ ксилітол сприяє відновленню функціональної здатності, носового дихання в хворих на АР. Застосування назального спрею із ксилітолом значно покращує якість життя в хворих на ринокон’юнктивіт (порівняно з контролем).
Рис. 6. Ефективність Буфомікс ізіхейлер у лікуванні БА в дітей
Доведено доцільність застосування ксилітолу з метою відтермінування призначення антибіотиків. На думку експертів Кокранівсього товариства, відтерміноване застосування антибіотиків у разі ГРВІ сприяє зменшенню їхнього використання порівняно з негайним призначенням (31 vs 93%) за відсутності різниці в контролі симптомів. Згідно з положеннями сучасних настанов, відтермінувати призначення антибіотиків можна в дітей віком від 3 міс до 2 років за постійного спостереження, в дітей віком >2 років – з урахуванням домашніх обставин, у дітей-підлітків віком 12 років, а також у дорослих – з огляду на клінічний перебіг.
Компанія «Юрія-Фарм» пропонує спрей Снотті, в 1 мл якого міститься 120 мг ксилітолу. Застосування спрею Снотті сприяє очищенню носових ходів і приносових пазух, усуненню закладеності носа. Снотті може бути рекомендований при інфекціях верхніх відділів ДШ та АР; може застосовуватися в дітей, підлітків, дорослих і літніх осіб. Захисна дія ксилітолу проявляється в підтримці діяльності мукоциліарного кліренсу, підвищенні активності вродженого імунітету, збереженні високої активності антимікробних речовин (лізоциму, лактоферину, інгібітора секреторної лейкопротеїнази), які знаходяться в шарі рідини, що покриває поверхню ДШ. Застосування спрею ксилітолу (Снотті) протидіє розвитку гострого середнього отиту, сприяє прискоренню одужання в разі РС, зменшенню симптомів АР, відновленню після оперативного втручання в носоглотці.
Доповідь «Антисептикотерапія в отоларингології» представив доцент кафедри оториноларингології Національного університету охорони здоров’я України ім. П. Л. Шупика (м. Київ), кандидат медичних наук Богдан Назарович Біль.
 Лікарі різних спеціальностей часто мають справу з неспецифічним запаленням мигдаликів (НЗМ) або рецидивувальним тонзилітом, виникненню якого сприяють мікробні комбінації (80%), а також грибково-бактеріальні асоціації з грибами роду Candida, різні віруси (аденовіруси, цитомегаловірус, вірус Епштейна – Барр). За відсутності показань до хірургічного лікування проводиться консервативна терапія НЗМ, яка ґрунтується на підвищенні загальної резистентності організму, застосуванні гіпосенсибілізувальних та імунокорегувальних ЛЗ; загальна антибіотикотерапія показана лише при лікуванні стрептококової ангіни. Необґрунтоване застосування антибіотиків системної дії у разі НЗМ зумовлює порушення мікробіоценозу, появу стійких штамів мікроорганізмів, збільшення ризику виникнення побічних дій.
Лікарі різних спеціальностей часто мають справу з неспецифічним запаленням мигдаликів (НЗМ) або рецидивувальним тонзилітом, виникненню якого сприяють мікробні комбінації (80%), а також грибково-бактеріальні асоціації з грибами роду Candida, різні віруси (аденовіруси, цитомегаловірус, вірус Епштейна – Барр). За відсутності показань до хірургічного лікування проводиться консервативна терапія НЗМ, яка ґрунтується на підвищенні загальної резистентності організму, застосуванні гіпосенсибілізувальних та імунокорегувальних ЛЗ; загальна антибіотикотерапія показана лише при лікуванні стрептококової ангіни. Необґрунтоване застосування антибіотиків системної дії у разі НЗМ зумовлює порушення мікробіоценозу, появу стійких штамів мікроорганізмів, збільшення ризику виникнення побічних дій.
Ефективний метод лікування – місцева санаційна терапія, яка включає промивання лакун піднебінних мигдаликів розчинами антисептиків. «Ідеальні» антисептики мають ефективно зменшувати кількість умовно патогенних і патогенних мікроорганізмів, не чинити місцевої подразнювальної, мутагенної, канцерогенної, тератогенної дії, а також мають демонструвати додаткову активність проти вірусів, грибів, спор. Зазначеним вимогам відповідає препарат Декасан – 0,02% водний розчин декаметоксину. Антисептик Декасан використовується для санації лакун піднебінних мигдаликів: промивання лакун проводиться 0,02% розчином Декасану, розведеним у співвідношенні 1:1 (із фізіологічним розчином). Виконують 7-10 процедур з інтервалом через добу, які дозволяють достовірно зменшити кількість загострень тонзиліту, а також знизити необхідність застосування антибіотиків. Декасану притаманні бактерицидна, фунгіцидна, вірусоцидна, спороцидна дії; він не всмоктується через шкіру та слизові оболонки, забезпечує локальний протизапальний і протинабряковий ефекти, чинить десенсибілізувальну дію, потенціює дію антибіотиків, зберігає антисептичну активність за наявності білків сироватки крові. Водночас Декасан зменшує адгезію мікроорганізмів до поверхні рани, створює оптимальні умови для їх загоєння. Віруліцидна активність щодо ВІЛ, вірусу гепатиту В, грипу, вірусів герпесу, коронавірусів реалізується через руйнування ліпідного шару суперкапсидної оболонки вірусів. Декасан впливає лише на ті віруси, що розташовані на поверхні шкіри, слизової або рани, оскільки не проникає усередину клітин людини. Фунгіцидна активність поширюється на дріжджі, збудники епідермофітії, трихофітії, мікроспорії, еритразми, деякі види пліснявих грибів (аспергіли, пеніцили). Декасан пригнічує ексудативну фазу запалення, нейтралізуючи дію медіаторів запалення (серотонін, гістамін), чинить протинабряковий ефект. Десенсибілізувальна дія проявляється уповільненням розвитку анафілактичного шоку в експериментальних тварин. Декасан визнано цитобезпечним, адже він не чинить цитотоксичної та проапоптотичної дії на епітелій, зменшує мікробну контамінацію, знижує мікробний вплив на клітини епітелію, зменшує запалення, прискорює відновлення, залишаючись безпечним для здорових клітин. Саме тому Декасан можна вважати «ідеальним» антисептиком в оториноларингології.
Підготувала Тетяна Можина