20 лютого, 2024
Розширення терапевтичних можливостей реабілітації пацієнтів із перенесеним ішемічним інсультом
Глобальний тягар інвалідності після інсульту зростає попри терапевтичні досягнення. Інсульт залишається другою провідною причиною інвалідності в усьому світі. Кожна четверта доросла людина має інсульт; ≈63% цих випадків трапляється до 70 років. 87% інвалідності, пов’язаної з інсультом, припадає на країни з низьким і середнім рівнем доходу, де доступ до втручань у разі гострого інсульту часто обмежений. Це робить ефективну реабілітацію потенційно найкращим доступним втручанням для сприяння відновленню після інсульту, а також є глобальним пріоритетом охорони здоров’я [1, 2].
Мета реабілітації хворих після інсульту – зменшення вираженості функціональних обмежень. На жаль, у значної частки пацієнтів повне відновлення втрачених функцій неможливе [3]. І саме ефективні реабілітаційні заходи в ранньому відновлювальному періоді інсульту сприяють мінімізації функціональних обмежень [4].
Незважаючи на те що смертність від інсульту знижується, кількість людей, яким доведеться жити з наслідками інсульту, зростатиме протягом подальших 20 років, що матиме величезні суспільні та економічні наслідки, тому покращення одужання і довгострокових результатів реабілітації є нагальною клінічною й науковою метою. Розуміння основ нейробіології може прискорити пошук шляхів удосконалення результатів відновлення після інсульту [5].
В основі відновлення і збереження сенсомоторних функцій після інсульту насамперед лежить феномен нейрональної пластичності, який залежить від пропріо- та екстероцептивної інформації, що надходить до головного мозку (ГМ) [6]. Також велике значення має заміщення клітин у периінфарктних ішемізованих зонах і нейрогенез [7]. Для досягнення найкращих результатів процес реабілітації слід розпочинати якнайраніше [8] з використанням міждисциплінарного підходу [4, 9], а також рухових [10, 11], когнітивних [12], фармакологічних [13, 14], активувальних [15, 16], нейрорегенеративних методик [17, 18].
Як відомо, гіперліпідемія має неабияку роль у патогенезі ушкодження ГМ за низки захворювань нервової системи (НС), а порушення ліпідного метаболізму відіграє важливу роль у загибелі нейронів за церебральної ішемії [19, 20]. Препаратом, що впливає на метаболізм фосфоліпідів у ГМ, нейротрансмітерну передачу, є цитиколін [21].
Цитиколін впливає на різні ланки ішемічного каскаду; крім інших ефектів, збільшує нейрональну пластичність. Нейропротекторний ефект цитиколіну добре відомий і багаторазово описувався в літературі. Показано, що цитиколін зменшує обсяг ураження мозку за експериментальної ішемії та гіпоксії, підвищує здатність до навчання і сприятливо впливає на пам’ять в експериментальних тварин із віковими змінами ГМ. На різних експериментальних моделях цитиколін продемонстрував здатність відновлювати активність мітохондріальної АТФази та мембранної Na+/K+АТФази, пригнічувати активацію деяких фосфоліпаз і зменшувати вираженість набряку мозку.
У роботі O. Hurtado та співавт. [22] вивчали вплив тривалого застосування цитиколіну на функціональний результат і морфологічні зміни після інсульту. Цитиколін призначали через 24 год після оклюзії середньої мозкової артерії протягом 28 днів, що зумовило поліпшення функціонального результату. Для уточнення морфологічних основ поліпшення функції досліджували морфологічні характеристики пірамідних клітин у V шарі неушкодженої моторної кори за допомогою забарвлення за Ґольджі – Коксом. На тлі застосування цитиколіну спостерігалася вища щільність дендритів порівняно із фізіологічним розчином.
Ці результати свідчать про таке: використання цитиколіну із 24 год після розвитку інсульту сприяє збільшенню пластичності нейронів і відновленню їхніх функцій.
Функціонування НС (як у нормі, так і за різних патологічних станів) забезпечується тісною взаємодією між нейронами та гліальними клітинами [23]. Важливу роль в активації нейроглії відіграє ацетилхолін. V. Bramanti та співавт. [24] вивчали вплив ацетилхоліну та його попередників (холіну, цитиколіну, α-гліцерилфосфорилхоліну) на експресію трансглутамінази і цикліну D1 у культурах астроцитів.
Введення цитиколіну спричиняло збільшення трансглутамінази, причому цей ефект мав дозозалежний характер. Вплив цитиколіну в сумарній дозі 1 мкмоль протягом 14 днів на культуру астроцитів in vitro зумовлював збільшення рівня цитофлюоресценції. Після впливу сумарної дози α-гліцерилфосфорилхоліну в сумарній дозі 1 мкмоль упродовж 24 год спостерігалося підвищення цитофлюоресценції як у цитозолі, так і в ядрах.
Вестерн-блот виявляв підвищену експресію трансглутамінази при впливі 1 мкмоль холіну чи α-гліцерилфосфорилхоліну протягом 24 год. Водночас застосування 1 мкмоль цитиколіну й ацетилхоліну впродовж 24 год не впливало на рівень експресії трансглутамінази. Вплив 1 мкмоль ацетилхоліну спричиняв зниження експресії трансглутамінази на 21-й день in vitro. Введення попередника ацетилхоліну in vitro протягом 24 год зумовило виражене пригнічення експресії цикліну D1 і зниження експресії цикліну D1 в астроцитах через 14 і 35 днів. Ці дані свідчать про вплив попередників ацетилхоліну на процеси розвитку та диференціювання астроглії in vitro. З огляду на отримані результати автори дійшли висновку, що застосування досліджуваних речовин може сприяти відновленню неврологічних функцій після церебральних ушкоджень, зокрема судинної етіології.
Хронічна ішемія ГМ зумовлює формування змін білої речовини (лейкоареоз), клінічним проявом яких є когнітивні порушення. H. Lee та співавт. [25] досліджували профілактичний ефект цитиколіну щодо лейкоареозу та пов’язаних із ним когнітивних розладів на моделі хронічної церебральної гіпоперфузії у щурів. Експериментальним тваринам проводили двобічну оклюзію сонних артерій. Цитиколін (500 мг/кг/добу) або фосфатно-сольовий буферний розчин призначали внутрішньоочеревинно в найгострішому періоді церебральної ішемії або відтерміновано (з 8-го дня після операції) протягом 21 дня. Для оцінки когнітивних здібностей використовували тест із лабіринтом. Тестування проводили із 17-го дня терапії. Після завершення терапії проводилося морфологічне дослідження. У групі з більш раннім початком терапії когнітивні функції залишалися відносно збереженими, не спостерігалося також значних змін білої речовини. Відтермінована терапія не впливала на вираженість змін білої речовини, проте сприяла меншій вираженості когнітивних розладів порівняно із фосфатно-сольовим буферним розчином. Автори дійшли висновку, що цитиколін чинить профілактичний ефект щодо розвитку лейкоареозу та когнітивних розладів, зокрема й за відтермінованого застосування.
Цитиколін сприяв значному поліпшенню когнітивної здатності за шкалою оцінки хвороби Альцгеймера (ADAS) у пацієнтів із позитивним генотипом APOE ε4. L. Feng і співавт. (2017) встановили, що лікування цитиколіном може зумовлювати поліпшення зв’язності мережі мозолистого тіла в пацієнтів із лейкоареозом [26].
Відомо, що стимуляція ендогенних нейротрофічних факторів або введення екзогенних мезенхімальних стовбурових клітин сприятливо впливають на нейрональні репаративні процеси, а також сприяють значнішому відновленню функцій після ішемічного інсульту (ІІ). M. Gutierrez і співавт. [27] досліджували вплив дії цитиколіну, мезенхімальних стовбурових клітин та їхніх комбінацій на репаративні процеси, відновлення неврологічних функцій після інфаркту ГМ у щурів.
У проведеному дослідженні самці щурів лінії Sprague Dawley були розподілені на 5 груп:
- Симуляція: операція без інфаркту.
- Контроль: операція + інфаркт.
- Цитиколін: операція + інфаркт + цитиколін внутрішньоочеревинно (500 мг/кг).
- Мезенхімальні стовбурові клітини: операція + інфаркт + мезенхімальні стовбурові клітини внутрішньовенно (2×106 клітин).
- Комбінація: операція + інфаркт + мезенхімальні стовбурові клітини внутрішньовенно (2×106 клітин) + цитиколін внутрішньоочеревинно (500 мг/кг).
Ефективність терапії оцінювали через 24 год і 14 днів на підставі неврологічного дослідження, магнітно-резонансної томографії, морфологічного дослідження із забарвленням гематоксиліном еозином, а також імуногістохімічних методів. У групах цитиколіну, мезенхімальних стовбурових клітин і комбінованої терапії спостерігалася менша вираженість неврологічних порушень порівняно з контрольними групами (p<0,05). Відмінностей між терапевтичними групами не спостерігалося. Також не було відзначено зменшення обсягу інфаркту мозку на тлі будь-якої терапії. Водночас імуногістохімічні методи дослідження свідчили про підвищення активності нейрогенезу й ангіогенезу і в периінфарктній зоні на тлі терапії. Використання цитиколіну сприяло зниженню запальної відповіді. На підставі отриманих результатів автори дійшли висновку, що цитиколін і мезенхімальні стовбурові клітини мають зіставну ефективність щодо відновлення неврологічних функцій після інфаркту мозку. В основі цього ефекту лежать зменшення загибелі нейронів і стимуляція репаративних процесів ГМ. Комбінована терапія (цитиколін + мезенхімальні стовбурові клітини) виявилася найефективнішою.
Цитиколін пройшов численні дослідження на здорових добровольцях і пацієнтах із церебральною ішемією. Показано, що препарат має хороший профіль переносимості та безпеки [21, 28]. Ці результати мають важливе практичне значення, оскільки розширюють терапевтичні можливості реабілітації пацієнтів після інсульту. Проведені дослідження свідчать про доцільність використання цитиколіну в разі ІІ та при хронічній церебральній ішемії, що супроводжується когнітивними порушеннями.
Клінічні дослідження цитиколіну свідчать про безпеку цього препарату за різних неврологічних захворювань [21]. Препарат показав свою ефективність при ІІ, про що свідчить метааналіз 10 досліджень за участю 2279 пацієнтів [28, 29]. Показано, що в хворих, які отримували цитиколін, рівні смертності та інвалідизації були достовірно меншими, що мало, зокрема, і сприятливий економічний ефект [30].
Проведений об’єднаний аналіз [28] даних свідчить, що відновлення через 3 міс було досягнуто у 25,2% пацієнтів, яким призначали цитиколін, а також у 20,2% учасників, котрі отримували плацебо. Ефективність цитиколіну відзначали також за тривалості терапії 6 тиж. Однак передбачається, що триваліше лікування чинить більшу дію [31].
В основі сприятливого ефекту цитиколіну щодо неврологічних функцій лежить збільшення кількості ендотеліальних стовбурових клітин у результаті впливу препарату на репаративні процеси [32].
Згідно з Кокранівським оглядом [33], цитиколін чинить позитивний ефект при когнітивних і поведінкових розладах, пов’язаних із хронічними захворюваннями ГМ, особливо ішемічного ґенезу, в літніх пацієнтів.
У клінічному дослідженні ефективності цитиколіну при постінсультних когнітивних порушеннях критерієм включення був первинний характер інсульту [34]. Нейропсихологічне тестування проводилося через 6 тиж (±3 дні), 6 (±7 днів) та 12 міс (±14 днів) після інсульту. Всі хворі отримували лікування цитиколіном у дозі 2 г/добу до 6 тиж, а половина вибірки – цитиколін (1 г/добу) протягом 12 міс. Зв’язок проведеної терапії та когнітивних функцій оцінювався методом логістичної регресії. У дослідженні брали участь 347 пацієнтів, середній вік яких становив 67,2 року. 172 учасники (49,6%) отримували цитиколін протягом 12 міс. Порівнювані групи були зіставними за статтю, віком і рівнем освіти. За час спостереження померло 38 пацієнтів, у 49 хворих відзначалися повторні судинні події. 54 пацієнти вийшли зі спостереження. Достовірної різниці між порівнюваними групами за вищезазначеними параметрами не спостерігалося. У 4 хворих (2,33%) були небажані явища, пов’язані з цитиколіном, що зумовило скасування терапії у 2 випадках. Через 6 міс після інсульту в 43,5% пацієнтів відзначалися порушення пам’яті, у 31,5% – порушення сприйняття та візуально-просторових функцій, у 40,5% – порушення уваги, керувальних функцій, у 54,8% – психомоторна сповільненість, у 34,5% – розлади мовлення, у 24,5% – порушення орієнтування в часі.
У хворих, які не отримували лікування цитиколіном, поширеність порушень уваги, керувальних функцій та орієнтування в часі була достовірно більшою. Через 12 міс після інсульту в 40,5% пацієнтів зберігалися порушення пам’яті, у 29,5% – порушення сприйняття та візуально-просторових функцій, у 39,5% – порушення уваги, керувальних функцій, у 52% – психомоторна загальмованість, у 33% – порушення мовлення, у 20% – порушення орієнтування в часі. Водночас відмінності між групою цитиколіну та контрольною групою залишалися достовірними. Автори дійшли висновку, що в хворих із первинним ІІ лікування цитиколіном протягом 12 міс є безпечним та ефективним щодо когнітивних порушень, що пояснюється нейрорепаративними властивостями препарату, а також його впливом на ацетилхолінергічну систему. Вплив цитиколіну на когнітивні функції зберігався після року спостереження.
Інфаркт ГМ – важливий фактор ризику розвитку когнітивних порушень та деменції судинного ґенезу (Jaillard et al., 2010). У цьому контексті J. Alvarez-Sabín і співавт. (2013) провели дослідження з метою оцінки профілю безпеки й ефективності тривалого введення цитиколіну для зменшення когнітивного погіршення в осіб з ІІ в анамнезі. Когнітивні функції поліпшилися через 6 та 12 міс після інсульту серед усіх пацієнтів; найкращі результати спостерігалися в разі тестування уваги та функції часової орієнтації [26].
Надалі автори опублікували результати зазначеного дослідження після 2 років лікування цитиколіном (Alvarez-Sabín et al., 2016). Вік і відсутність терапії цим препаратом були пов’язані з гіршою якістю життя. Використання цитиколіну сприяло значущому поступовому поліпшенню когнітивного статусу під час спостереження [26].
Інші дослідники також повідомили про корисні ефекти цитиколіну при лікуванні когнітивних порушень після інсульту (Lobjanidze et al., 2010; Maslarov, 2016). J. Leon-Carrion і співавт. (2000) спостерігали позитивні ефекти цитиколіну в серії випробувань щодо посттравматичних порушень пам’яті [26].
Активно вивчається ефект цитиколіну щодо рухових порушень після інсульту. У 1980 р. T. Hazama та співавт. [35] опублікували результати рандомізованого подвійного сліпого плацебо-контрольованого дослідження ефективності цитиколіну при постінсультній геміплегії. У випробуванні брали участь 165 пацієнтів з інсультом тривалістю від 3 до 51 міс (у середньому 6 міс). Усі хворі проходили необхідні реабілітаційні заходи. Крім того, 55 пацієнтів отримували високу дозу цитиколіну (1 г/добу протягом 8 тиж), 56 учасників – меншу дозу цитиколіну (250 мг/добу впродовж 8 тиж), а 54 хворих – плацебо. Поліпшення не менше ніж на 1 бал за шкалою рухових порушень на 4-му та 8-му тиж спостереження відзначалися в 44,4 та 53,3% пацієнтів відповідно, яким призначали високу дозу цитиколіну, а також у 29,3 і 54,8% хворих, котрі отримували здебільшого низьку дозу цитиколіну. В групі плацебо покращення спостерігалося в 29,3 та 31,8% учасників відповідно. Відмінність між активною терапією та контрольною групою досягала статистичної значущості на 8-му тиж спостереження (p=0,006). Автори дійшли висновку, що цитиколін сприяє відновленню рухових функцій у пацієнтів із геміплегією.
Вплив лікування цитиколіном на рухові функції досліджувався також S. Ueda та співавт. [36]. У рандомізованому подвійному сліпому плацебо-контрольованому дослідженні брали участь 258 пацієнтів, які перенесли інсульт у термін від 4 тиж до 1 року перед включенням. Хворим призначали цитиколін (1 г/добу протягом 8 тиж) або плацебо разом зі стандартними реабілітаційними заходами. На тлі застосування цитиколіну поліпшення функції верхньої кінцівки не менше ніж на 1 бал за 12-бальною шкалою рухових порушень відзначалося у 67,8%, а на тлі плацебо – в 55,4% випадків (p=0,047). Препарат продемонстрував задовільний рівень безпеки та переносимості. Автори дійшли висновку, що цитиколін сприяє покращенню рухових функцій у пацієнтів із постінсультною геміплегією при використанні одночасно із традиційними реабілітаційними заходами.
Метааналіз вищезазначених досліджень ефективності цитиколіну при рухових розладах свідчить про високу ефективність його застосування в дозі 1 г/добу протягом 8 тиж для відновлення рухових функцій у верхній кінцівці.
F. Iranmanesh та A. Vakilian [37] досліджували ефективність цитиколіну при рухових порушеннях унаслідок нетравматичного внутрішньомозкового крововиливу. В подвійному сліпому рандомізованому клінічному дослідженні брали участь 32 пацієнти з геморагічним нетравматичним супратенторіальним крововиливом. Їх розподілили на 2 групи по 16 осіб. Перша група отримувала лікування цитиколіном (250 мг внутрішньовенно 2 р/добу) протягом 14 діб, другій призначили плацебо. В пацієнтів вимірювали м’язову силу до лікування та через 3 міс терапії. Групи були зіставними за віком, статтю та обсягом гематоми. Статистичний аналіз проводився методом Манна – Уїтні. Половина пацієнтів – чоловіки. Середня м’язова сила в обох групах до лікування становила 2,5 бала, а на тлі терапії – 4 бали в групі цитиколіну, 3,12 – у групі плацебо. Відмінність між терапевтичними групами була достовірною (p=0,019). Отже, цитиколін може бути ефективним щодо рухових розладів у хворих із внутрішньомозковим крововиливом.
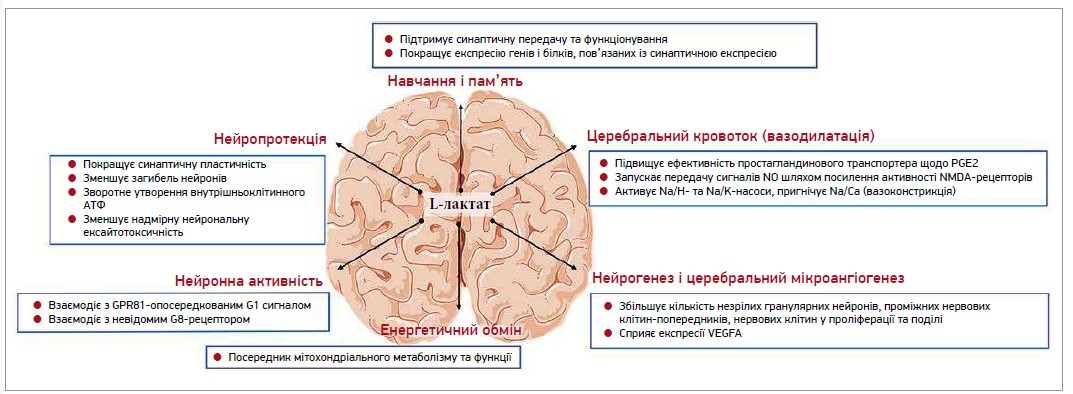
Варто зазначити, що дослідження, проведені на сьогодні, надали нові знання про позитивну роль лактату в багатьох нейрофункціях і деяких захворюваннях мозку. Лактат регулює різноманітні функції мозку: зокрема, впливає на навчання та пам’ять, церебральний кровоток, нейрогенез, церебральний мікроангіогенез, енергетичний обмін, активність нейронів, а також чинить нейропротекторну дію (рис.) [38].
Рис. Можливі механізми впливу L-лактату на мозок
Лактат бере участь у координації різних функцій мозку як у здоровому, так і в хворому станах. Задіяні механізми є набагато складнішими, ніж вважалося спочатку. L-лактат не лише є енергетичним субстратом, а й також діє як гормоноподібна речовина (лактормон) у регуляції нижніх каскадних сигнальних шляхів [38].
Транспорт лактату через гематоенцефалічний бар’єр (ГЕБ) забезпечують монокарбоксилатні транспортери. Процес двобічного руху лактату між кров’ю та мозком є важливим для метаболізму мозку, особливо в умовах обмеженого надходження глюкози або під час інтенсивної нейронної активності.
Лактат – це не просто продукт метаболізму; він також слугує важливим енергетичним субстратом для нейронів. За деяких умов, як-от інтенсивні фізичні вправи чи гіпоглікемія, лактат може бути важливим паливом для мозку, що особливо підкреслює важливість його здатності перетинати ГЕБ [39].
Також на етапі відновлення в пацієнтів із перенесеним ІІ є важливим використання методів покращення припливу кисню та поживних речовин до мозку, щоб нейрони, яким загрожувала смерть, могли вижити. Саме для цього давно застосовують у практичній медицині розведення крові (гемодилюцію) – як у вигляді водного навантаження (посилене пиття), так і парентерального введення водно-електролітних і плазмозамінних розчинів. Гемодилюція може бути досягнута кровопусканням, введенням розчинів у вигляді інфузій чи шляхом комбінації обох методів. Розчини, які використовуються при гемодилюції, можуть бути сольовими та колоїдними. Колоїдні розчини, які складаються з більшості нерозчинних молекул і призначення яких – збереження інтраваскулярної рідини, є ефективнішим засобом гемодилюції.
Методика гемодилюції залежить від початкового стану, зокрема об’єму циркулювальної крові. За початкової нормоволемії для отримання гемодилюції необхідна попередня ексфузія відповідного об’єму крові з одночасним замісним переливанням розчинів (ізоволемічна гемодилюція, ІГ). При початковій гіповолемії замісні розчини переливають без кровопускання (гіперволемічна гемодилюція, ГГ).
У дослідженні Ю.І. Маланкевич і співавт. (2018) проаналізовано ефективність усунення гемоконцентрації у 212 хворих із судинною й іншою патологією, що лікувалися в ангіоневрологічному відділенні клініки нейрохірургії та неврології. Відбір пацієнтів для включення до обстеження проводився на підставі анамнестичних даних, клінічних і лабораторних показників, інструментальних методів обстеження, зокрема комп’ютерної томографії ГМ, електроенцефалографії. Враховували вік, стать, основне захворювання, наявність ознак гемоконцентрації, зміни лабораторних показників при посиленому питному режимі, ІГ, ГГ.
Після проведення ГГ або ІГ спостерігалися нормалізація показників гемоглобіну, гематокриту, зниження протромбіну, незначне підвищення тромбоцитів без суттєвих змін електролітного обміну.
Відзначалося, що порушення реологічних властивостей крові з тенденцією до гемоконцентрації є найхарактернішим для пацієнтів віком 40-50 років чоловічої статі з ІІ та наслідками перенесеного ІІ. Питний режим недостатньо ефективний за такої патології. У таких випадках показана ГГ чи ІГ. За неефективності ГГ доцільно застосовувати ІГ, що ефективна навіть у разі одного сеансу. Також зазначено, що застосування цих методів лікування є безпечним [40].
Проведені клінічні дослідження в пацієнтів з ІІ показали, що цитиколін покращує функціональне відновлення, прискорює реабілітацію цих хворих, має задовільний профіль безпеки та переносимості. Використання цитиколіну є доцільним за ІІ, а також хронічної церебральної ішемії, що супроводжується когнітивними порушеннями. Застосування ІГ розчинами із цитиколіном і лактатом має важливе практичне значення, оскільки розширює терапевтичні можливості реабілітації пацієнтів після інсульту.
Довідка «ЗУ»
В Україні розчин для інфузій зі збалансованим вмістом електролітів, цитиколіном і лактатом представлений компанією «Юрія-Фарм» під назвою Нейроцитин®. Препарат рекомендований для проведення парентерального застосування в лікуванні таких станів, як:
- інсульт, гостра фаза порушень мозкового кровообігу, ускладнення та наслідки порушень мозкового кровообігу;
- черепно-мозкова травма та її неврологічні наслідки;
- неврологічні порушення (когнітивні, сенситивні, моторні) внаслідок хронічних судинних і дегенеративних церебральних розладів.
Нейроцитин® діє комплексно на передачу нервового імпульсу (за рахунок унікального складу – електролітів, цитиколіну та лактату), відновлюючи когнітивні, сенситивні й моторні функції ЦНС. Застосування препарату Нейроцитин® у терапії:
- сприяє збереженню загального водно-електролітного балансу та кровотоку в головному мозку;
- забезпечує енергетичну підтримку тканин мозку та коригування метаболічного ацидозу в умовах ішемії завдяку лактату в складі;
- сприяє швидшій функціональній реабілітації пацієнтів за рахунок максимальної добової дози цитиколіну.
Нейроцитин® призначений для внутрішньовенного (в/в) введення. Рекомендована доза для дорослих становить 50-200 мл/добу у формі крапельного в/в вливання (40-60 крапель/хв). При гострих і невідкладних станах максимальний терапевтичний ефект досягається при застосуванні в перші 24 години. Дози препарату та термін лікування залежать від тяжкості уражень мозку та визначаються індивідуально.
Список літератури знаходиться в редакції.
Підготувала Олена Костюк