22 березня, 2024
Ефективність терапії сертраліном для функціонального відновлення після гострого ішемічного інсульту
Як відомо, селективним інгібіторам зворотного захоплення серотоніну (СІЗЗС) притаманні нейропротекторні та нейровідновлювальні ефекти. Метою дослідження I. Stuckart et al., результати якого опубліковано в статті «Sertraline for functional recovery after acute ischemic stroke: a prospective observational study» видання Front Neurol (2021 Oct 5; 12: 734170), було вивчення ефективності сертраліну. Для нього характерні менш серйозні побічні ефекти та стабільніша фармакокінетика, ніж для класичних СІЗЗС, за поліпшення функціонального відновлення у пацієнтів після гострого ішемічного інсульту (ГІІ) із порушеннями моторики. Пропонуємо до вашої уваги огляд цієї статті.
Найчастішою причиною набутої інвалідності в дорослому віці є інсульт (Virani et al., 2020). Останніми роками невідкладне лікування інсульту значно вдосконалено завдяки терапевтичним досягненням, проте лише для кількох препаратів отримано багатообіцяльні клінічні результати щодо нейропротекції (Zhao et al., 2020; Goyal et al., 2016; Chamorro et al., 2021). Вважається, що СІЗЗС мають як нейропротекторний, так і нейровідновлювальний ефекти, які сприяють функціональному відновленню після інсульту через модуляцію асоційованого з ішемією гіперзбудження, постінсультного запалення та нейроґенезу гіпокампа (Chollet et al., 2011; Siepmann et al., 2015). Крім того, СІЗЗС можуть посилювати церебральний кровотік і протидіяти розвитку ядра інфаркту (Siepmann et al., 2015; Elzib et al., 2015; Guirado et al., 2016). Дані дослідження на тваринних моделях також підтвердили, що СІЗЗС стимулюють гіпокампальну експресію нейротрофінів, зокрема нейротрофічного фактора головного мозку – важливого медіатора церебральної пластичності та нейроґенезу (Siepmann et al., 2015; Elzib et al., 2015; Liu et al., 2017; Kraus et al., 2017).
У рандомізованому контрольованому дослідженні (РКД) ефективності флуоксетину для відновлення рухової активності після ГІІ (FLAME), результати якого було опубліковано 2011 р., вивчали вплив флуоксетину на показники рухової функції. Через 90 днів у пацієнтів, які отримували флуоксетин, спостерігалося зменшення ознак моторних порушень і поліпшення загальних результатів щодо функціонування порівняно з тими, хто приймав плацебо (Chollet et al., 2015). Водночас за даними трьох масштабних багатоцентрових РКД було зроблено висновок, що одноразове щоденне застосування флуоксетину протягом 6 міс. не чинить сприятливого впливу на функціонування пацієнтів після ГІІ (Dennis et al., 2019; Hankey et al., 2020; Lundstrцm et al., 2020). Проте попередні клінічні дослідження переважно зосереджувались на використанні флуоксетину, попри на обнадійливі результати доклінічних досліджень інших СІЗЗС (Legg et al., 2019). Втім, питання про доцільність застосування флуоксетину в пацієнтів із ГІІ досі лишається дискусійним. З одного боку, флуоксетину притаманний вищий потенціал взаємодії з ізоферментною системою цитохрому Р450 порівняно з іншими СІЗЗС, що пов’язано з високим ризиком несприятливих ефектів, особливо в осіб похилого віку та пацієнтів із поліпрагмазією (Hemeryck and Belpaire, 2002). А з іншого боку, вказаний препарат є єдиним СІЗЗС, який вважається непридатним для пацієнтів літнього віку (Holt et al., 2020). Крім того, флуоксетин, судячи з усього, поступається іншим СІЗЗС щодо ефективності лікування депресії, яка розвивається майже в третини всіх пацієнтів після інсульту і її наявність пов’язана з несприятливим результатом незалежно від тяжкості інсульту та ступеня інвалідизації (Cipriani et al., 2018; Towfighi et al., 2017; Hackett et al., 2014). Фармакотерапевтичні підходи з використанням антидепресантів (АД) продовжують відігравати важливу роль у профілактиці та лікуванні постінсультної депресії (ПІД) (Towfighi et al., 2017).
Мета дослідження – вивчити вплив сертраліну на функціональне відновлення і розвиток ПІД у пацієнтів із ГІІ. Оскільки клінічні дані про потенційний вплив вказаного засобу на відновлення рухових функцій після ГІІ обмежені, отримані результати можуть слугувати основою для оцінювання розміру вибірки, необхідного для РКД (Legg et al., 2019).
Матеріали та методи дослідження
Дизайн дослідження та учасники
До проспективного неінтервенційного спостережного дослідження залучали пацієнтів із ГІІ з інсультного центру (закладу високоспеціалізованої медичної допомоги). Критеріями включення були: вік ≥18 років; підтверджений методом візуалізації діагноз ГІІ із відповідним руховим дефіцитом (≥2 бали за пунктами щодо моторних функцій шкали оцінювання тяжкості інсульту Національного інституту охорони здоров’я США [NIHSS]); призначення сертраліну після ГІІ. До контрольної групи увійшли пацієнти, які не приймали сертралін. Показання до застосування сертраліну ґрунтувалися на даних рутинної клінічної практики: лікування пацієнтів із клінічно підозрюваною ПІД і високим ризиком її розвитку (наприклад, із тяжким руховим дефіцитом, функціональною залежністю, депресією в анамнезі). Остаточне рішення про призначення сертраліну приймали на розсуд невролога, який вів пацієнта з ГІІ, і не залежало від специфічних процедур дослідження (тобто результатів застосування інструментів для оцінювання депресії). Критерії виключення: відсутність моторного дефіциту (або легкий моторний дефіцит), преморбідний показник за модифікованою шкалою Ренкіна (mRS) ≥2 бали або наявність супутніх захворювань, ймовірно пов’язаних з обмеженням участі в подальших тестах (як-от афазія або тяжка деменція [за короткою шкалою для оцінювання психічного стану [MMSE] <10 балів]). Після госпіталізації пацієнтам призначали сертралін (50 мг/добу) та фізіотерапію. Учасники, які відповідали вищезазначеним критеріям включення до дослідження і яким сертралін не призначали з клінічних причин (немає показань, відмова пацієнта, медичні протипоказання), увійшли до контрольної групи.
Процедури дослідження
На початку дослідження реєстрували демографічні характеристики, інформацію про попередні супутні захворювання та приймання ліків і дані щодо інсульту (симптоми, етіологія, локалізація, гостра реперфузійна терапія). Оцінювали неврологічний і функціональний статус (показник за NIHSS, преморбідний показник за mRS), симптоми депресії (за шкалою депресії Бека [BDI]) і нейрокогнітивні функції (за MMSE). На момент виписки фіксували оцінки за NIHSS та mRS. Через 3 міс. (90±14 діб) проводили структуроване телефонне інтерв’ю для оцінювання первинного кінцевого результату дослідження (показник за mRS), під час якого ставили додаткові запитання щодо приймання сертраліну після виписки та дати й причини його припинення (по можливості). Також було задокументовано будь-які нові судинні події, які трапилися за цей час (інсульт, транзиторна ішемічна атака [ТІА] або інфаркт міокарда). Повторне оцінювання депресії виконували за допомогою BDI та опитувальника щодо здоров’я пацієнта (PHQ‑9).
Критерії ефективності
Основним первинним результатом був сприятливий функціональний стан через 3 міс. (90±14 днів), визначений як показник за mRS ≤2 бали. Вторинні результати охоплювали частоту будь-якої ПІД (як показник за BDI ≥10 балів або за PHQ‑9 ≥10 балів) та вперше виявленої ПІД (як de novo підвищення показника за BDI ≥10 балів або за PHQ‑9 ≥10 балів) через 3 міс. Крім того, через 3 міс. оцінювали результати безпеки лікування (частоту повторних ішемічного або геморагічного інсультів, повторних ТІА, інфарктів міокарда та смертей).
Статистичний аналіз
Для статистичного аналізу використовували програмне забезпечення STATA (версія 12.1, StataCorp, College Station, TX). Непараметричні безперервні дані визначали за допомогою тесту Шапіро–Вілка, які представлено у вигляді медіани (міжквартильний інтервал, IQR). Ранговий сумарний тест Вілкоксона використовували для міжгрупового порівняння показників. Критерій хі-квадрат Пірсона або точний тест Фішера застосовували для порівняння таких характеристик, як стать, супутні захворювання, премедикація АД, екстрена терапія інсульту, етіологія інсульту, депресія на початковому рівні хвороби та в період спостереження, безпека та результати щодо функціонування через 3 міс. в обох групах.
Тест Мак-Немара – для внутрішньогрупового порівняння відмінностей щодо сприятливого впливу на функціонування та наявності ПІД після виписки (під час подальшого спостереження). Скориговане відношення шансів (ВШ) із 95% довірчим інтервалом (ДІ), визначали за допомогою багатофакторного регресійного аналізу сприятливого впливу сертраліну на функціонування та частоту ПІД через 3 міс.
Результати дослідження
У період від 13.03.2017 до 28.12.2018 серед пацієнтів із ГІІ, які отримували лікування у відділенні неврології Університетської лікарні Дрездена, було відібрано 114, що відповідали критеріям дослідження та погодилися брати в ньому участь; 72 особи – група застосування сертраліну, 42 – контрольна група. Причинами вторинного виключення з дослідження були призначення флуоксетину (n=1), непідтверджений діагноз інсульту (n=2), відкликання згоди на участь у дослідженні (n=5). Вихідні характеристики добре збалансували між двома групами, за винятком показників за NIHSS (загального та щодо рухових функцій), які були вищими для групи приймання сертраліну порівняно з контрольною: 8 балів (IQR5‑11) проти 5 балів (IQR4‑7); p=0,002, і 4 бали (IQR2‑7) проти 2 балів (IQR2‑4); p=0,001, відповідно. Середній вік пацієнтів на початку дослідження становив 70,5 року (IQR58‑79), 48 осіб (42,1%) були жіночої статі, усі учасники до ГІІ були функціонально незалежними. Час між появою симптомів ГІІ та першим прийманням сертраліну (50 мг) становив 4 доби (IQR3‑7). Через симптоми депресії дозу сертраліну під час госпіталізації було змінено до 75 мг (n=1) або 100 мг (n=5). На момент включення в дослідження між групами не виявлено різниці щодо частоти симптомів депресії (показник за BDI ≥10 балів) (32/72 [44,4%] проти 15/42 [35,7%]; p = 0,936).
Середня тривалість приймання сертраліну становила 82 дні (IQR64‑90). Із 72 пацієнтів у групі застосування сертраліну 46 (63,9%) продовжували його приймати до телефонного інтерв’ю, тоді як 25 (34,7%) припинили приймання препарату передчасно; один пацієнт (1,4%) не зміг надати інформації щодо приймання ліків. Найчастішими причинами передчасного припинення терапії були побічні ефекти (n=8), зокрема зміни особистості (n=3), судоми (n=1), гіпонатріємія (n=1), запаморочення (n=1) і когнітивні порушення (n=1), а також зміна препарату лікарем загальної практики (n=5) та неуточнені причини (n=8).
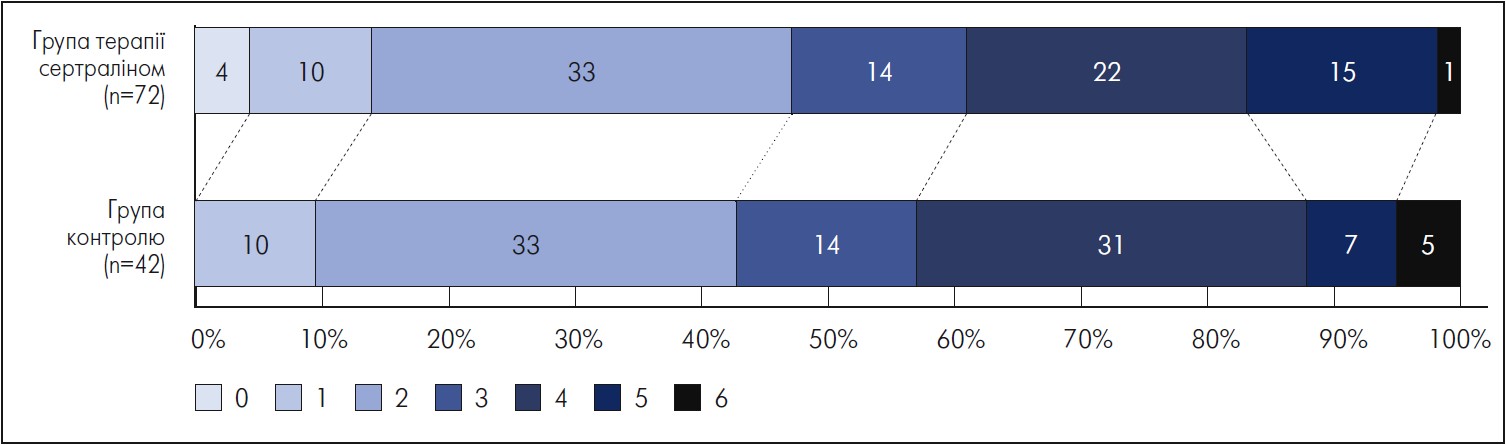
Показники за mRS через 3 міс. були доступними для всіх пацієнтів. Їхні середні значення були порівнянними в обох групах (3 бали [IQR2‑4] проти 3 балів [IQR2‑4]; p=0,67) (рисунок). Частота сприятливого впливу на функціонування також не відрізнялася між групою терапії сертраліном і контрольною групою (34/72 [47,2%] проти 18/42 [42,9%]; p=0,65). У групі лікування сертраліном порівняно з контрольною в більшої частки пацієнтів функціональний стан поліпшився до сприятливого (за mRS ≤2 бали) у період подальшого спостереження після виписки (19/72 [26,4%] проти 5/42 [11,9%]; p<0,001). Зокрема, після поправки на вік і початковий рівень показника за NIHSS дані багатофакторного регресійного аналізу засвідчили зв’язок між прийманням сертраліну та сприятливим впливом на функціонування через 3 міс. (ВШ 3,10; 95% ДІ 1,02‑9,41; p=0,045). Результати застосування моделі наведено в таблиці.
Примітка. Значення в кожній кольоровій зоні відповідають частці (%) пацієнтів із відповідним показником за mRS.
Рис. Розподіл показників за шкалою mRS через 90 днів
Адаптовано за Stuckart I. et al. Sertraline for functional recovery after acute ischemic stroke: a prospective observational study. Front Neurol. 2021 Oct 5. Vol. 12: 734170.
|
Таблиця. Результати багатофакторного регресійного аналізу відношення шансів досягнення функціонального відновлення та розвитку ПІД через 3 місяці |
|||
|
Змінна |
Порівняння |
ВШ (95% ДІ) |
Значення p |
|
Терапія сертраліном |
Так проти ні |
3,10 (1,02‑9,41) |
0,045 |
|
Вік |
Збільшення на рік |
0,88 (0,84‑0,93) |
<0,001 |
|
Показник за NIHSS на початковому рівні |
Збільшення на бал |
0,74 (0,63‑0,86) |
<0,001 |
|
Примітки: сприятливий результат щодо функціонування (за mRS ≤2 бали) є залежною змінною; змінні, додані до моделі, включали вік, показник за NIHSS на початку дослідження, призначення препаратів та екстрену терапію (останню вилучено з остаточної моделі за p=0,596); ПІД – постінсультна депресія; ВШ – відношення шансів; ДІ – довірчий інтервал; mRS – модифікована шкала Ренкіна; NIHSS – шкала оцінювання тяжкості інсульту Національного інституту охорони здоров’я США. |
|||
Адаптовано за I. Stuckart et al. Sertraline for functional recovery after acute ischemic stroke: a prospective observational study. Front Neurol. 2021 Oct 5. Vol. 12: 734170.
Зокрема, після додавання до моделі частоти ПІД (за BDI ≥10 балів) під час подальшого спостереження з’ясувалося, що наявність ПІД знижувала на 65% імовірність досягнення сприятливого результату щодо функціонування порівняно з пацієнтами без неї (ВШ 0,35; 95% ДІ 0,13‑0,97; p=0,043). У разі використання такої ретроспективної моделі терапія сертраліном все ще була пов’язана з тенденцію до поліпшення частоти функціонального відновлення порівняно з групою контролю (ВШ 3,06; 95% ДІ 0,99‑9,49; p=0,052).
Не виявлено відмінностей між двома групами щодо середнього показника за PHQ‑9 (5 балів [IQR3‑8] проти 6 балів [IQR3,5‑10]; p=0,399) або середнього показника за BDI (9 балів [IQR5‑13] проти 10 балів [IQR5,5‑15]; p=0,57) через 3 міс. До того ж не було різниці між частотою депресії (показник за BDI ≥10 балів) через 3 міс. (26/53 [49,1%] проти 14/28 [50,0%] пацієнтів; p=0,643). Також не було різниці між групами за врахування порогових значень показників за PHQ‑9 (p>0,05). У багатофакторному регресійному аналізі, скоригованому з урахуванням розподілу по групах, віку та вихідного рівня NIHSS, не виявлено зв’язку між прийманням сертраліну та наявністю ПІД через 3 міс., ані за PHQ‑9 (ВШ 1,35; 95% ДІ 0,28‑6,4; p=0,708), ані за BDI (ВШ 0,99; 95% ДІ 0,37‑2,61; p=0,980).
Однак коли через 3 місяці враховували випадки вперше виявленої ПІД, їх не було підтверджено в групі терапії сертраліном, тоді як у контрольній групі мали п’ять таких випадків (за BDI), що відповідає зростанню частоти на 17,9% (p=0,004).
Обговорення
За результатами неінтервенційного дослідження, ранній початок терапії сертраліном може сприяти функціональному відновленню у пацієнтів з ГІІ, що підтверджується показниками за mRS. Крім того, у групі приймання сертраліну через 3 міс. після ГІІ у меншої кількості пацієнтів розвинулася вперше виявлена депресія. Це свідчить про потенційну користь цього препарату для осіб з тяжким інсультом, які мають високий ризик розвитку ПІД.
На відміну від FOCUS, AFFINITY та EFFECTS, критерії відбору пацієнтів у цьому дослідженні були схожими на застосовувані у FLAME, яке налічувало лише осіб із ГІІ (Chollet et al., 2015; Dennis et al., 2019; Hankey et al., 2020; Lundstrцm et al., 2020).
У доклінічних дослідженнях потенційні нейропротекторні та нейропластичні ефекти СІЗЗС, що сприяли відновленню після інсульту, загалом пояснювалися модифікацією патогенних механізмів (пов’язаного з ішемією гіперзбудження, запалення після гострої фази, посиленням мозкового кровотоку та експресії нейротрофічного фактора головного мозку, стимуляцією нейроґенезу в субепендимальній зоні та в зубчастій звивині гіпокампа) (Liu et al., 2017; Kraus et al., 2017; Elzib et al., 2019; Chamorro et al., 2021).
На думку I. Stuckart et al., залучення пацієнтів саме з ГІІ може забезпечити високу внутрішню валідність дослідження нейропротекторних ефектів СІЗЗС.
Абсолютної різниці між обома досліджуваними групами за результатами нескоригованого аналізу сприятливого впливу на функціональне відновлення через 3 міс. після ГІІ не виявлено. Проте автори зазначають, що значна частка пацієнтів групи контролю вже була функціонально незалежною на момент виписки, що залишало менший потенціал для поліпшення стану. Втім, з іншого боку, для понад чверті пацієнтів, які приймали сертралін, продемонстровано значуще поліпшення показника за mRS упродовж перших тижнів після виписки, попри серйозний дефіцит на вихідному рівні (про що свідчили як загальні, так і рухові показники за NIHSS). У контрольній групі таких ефектів не виявлено. Зважаючи на відмінності, за яких початкова тяжкість інсульту терапія сертраліном асоціювалася з більш ніж утричі вищою ймовірністю досягнення відновлення функціонування через 3 міс., що узгоджується з результатами ретроспективного аналізу даних дослідження FLAME (показник за mRS0‑2 бали) через 3 міс.: у 26% осіб групи терапії флуоксетином проти 9% контрольної групи) (Chollet et al., 2015).
Сертраліну може бути притаманний особливий вплив, зокрема, на моторні дефіцити, як раніше було запропоновано щодо флуоксетину (на підставі результатів FLAME), але дані досліджень FOCUS, AFFINITY та EFFECTS цього не підтвердили. Втім, середні показники за NIHSS учасників досліджень (FOCUS і AFFINITY – 6 балів, EFFECTS – 3 бали) засвідчили переважання легких інсультів на момент включення, особливо порівняно з пацієнтами в дослідженні FLAME (12,8 балів у групі флуоксетину).
I. Stuckart et al. зазначають, що учасники їхнього дослідження, як і FLAME, були функціонально незалежними на початковому рівні, тоді як до 8% пацієнтів у РКД ефективності флуоксетину страждали від функціональної залежності до інсульту (Chollet et al., 2015; Dennis et al., 2019; Hankey et al., 2020; Lundstrцm et al., 2020). Отже, результати цих досліджень можуть бути обмежені недостатнім розмежуванням пацієнтів, потенційно чутливих до сприятливого ефекту СІЗЗС.
Відповідно до результатів експериментів на тваринних моделях, приймання сертраліну слід розпочинати якомога раніше після неврологічної події, щоб опосередкувати нейропротекторний ефект щодо церебральної гемодинаміки та перешкодити розвитку ішемічної напівтіні навколо інфарктного ядра (Acler et al., 2009; Shin et al., 2009; Elzib et al., 2019). У дослідженні I. Stuckart et al. пацієнти починали приймати сертралін у середньому через 4 доби (близько третини учасників – упродовж 3 діб) після ГІІ, що значно менше відповідного інтервалу в дослідженні FLAME (у середньому 8,9 доби) (Chollet et al., 2015). Крім того, у дослідженнях FOCUS, AFFINITY та EFFECTS інтервал до початку лікування був значно більшим (максимально 15 діб після ГІІ) (Dennis et al., 2019; Hankey et al., 2020; Lundstrцm et al., 2020). Власне, ранній початок лікування СІЗЗС за гострої фазиі інсульту є доволі проблематичним. Як зазначають дослідники, СІЗЗС не слід застосовувати рутинно для сприяння відновленню після інсульту, і депресія наразі є єдиним показанням, яке виправдовує ранній початок терапії СІЗЗС у пацієнтів з інсультом (Legg et al., 2019; Towfighi et al., 2017).
Однак за гострої фази симптоми депресії можуть бути масковані неврологічним дефіцитом, що ускладнює її розпізнавання. Необхідність фази голодування у пацієнтів, які перенесли ГІІ, і дисфагія після нього також можуть затримати початок лікування СІЗЗС (Martino et al., 2005). Адже потенційні нейропротекторні ефекти СІЗЗС є першочерговими за ішемічного інсульту, I. Stuckart et al. акцентують, що в майбутніх дослідженнях необхідно забезпечити ранній початок їх застосування за гіпергострої фази інсульту, коли вразливість до необоротного ушкодження є найвищою. Третина пацієнтів припинили приймання сертраліну до закінчення 90-денного спостереження; більшість причин передчасного припинення не обов’язково були пов’язані з фармакологічними небажаними ефектами (за винятком епілептичного нападу та гіпонатріємії).
За даними літератури, переломи кісток, епілептичні напади та гіпонатріємія можуть траплятися у 4% пацієнтів, які отримували флуоксетин (Dennis et al., 2019; Hankey et al., 2020; Lundstrцm et al., 2020).
Відповідних даних щодо приймання сертраліну пацієнтами з інсультом немає, проте подібні ризики можна припустити. Крім того, значна частина (>40%) пацієнтів у цьому дослідженні мали певні симптоми депресії на момент включення до дослідження (за BDI ≥10 балів), що могло мати вплив на результати щодо потенційного профілактичного ефекту сертраліну стосовно ПІД. Проте в численних дослідженнях описано як профілактичну дію певних СІЗЗС щодо ПІД, так і їхню ефективність для її лікування (Cipriani et al., 2018; Allida et al., 2020, Sun et al., 2017). Коли уперше виявлену депресію вважали випадковою змінною, з’ясувалося, що через 3 міс. після ГІІ вона спостерігалася в меншої кількості пацієнтів, які приймали сертралін, порівняно з контрольною групою. Подібні дані отримано для флуоксетину в дослідженнях FOCUS і EFFECTS (Dennis et al., 2019; Lundstrцm et al., 2020).
Обмеженнями дослідження I. Stuckart et al. вважають те, що розподіл до груп не був випадковим, проте упередженість щодо відбору пацієнтів могла радше відхилити результати в бік хибнонегативних, оскільки частіше отримували сертралін пацієнти з тяжчими ГІІ (про що свідчать показники за NIHSS на вихідному рівні). Отже, сприятливий ефект сертраліну мав бути сильним, щоб стати очевидним у цьому дослідженні. Значна частка пацієнтів, які страждали від депресії будь-якого ступеня на момент початку дослідження, ускладнювала диференціацію між потенційно нейропротекторним ефектом сертраліну на відновлення після ГІІ та його природною антидепресивною дією, яка могла посилити мотивацію пацієнтів і сприяти співпраці під час реабілітації. Будь-які симптоми депресії на початку дослідження могли підвищити ймовірність ПІД і несприятливого результату щодо функціонування через 3 міс. (Towfighi et al., 2017). Проте однаковий розподіл симптомів депресії між групами міг мінімізувати це джерело упередженості. Зокрема, після внесення поправки щодо ПІД приймання сертраліну більше не асоціювалося зі сприятливим результатом щодо функціонування, тобто несприятливі ефекти ПІД могли переважити потенційно сприятливий вплив сертраліну на функціонування після ГІІ. На думку авторів, у майбутніх дослідженнях слід зосередити увагу на пацієнтах з інсультом, у яких на початку дослідження немає ознак депресії, щоб вивчити вплив раннього застосування сертраліну на відновлення після інсульту. Використання інструментів самооцінювання замість психіатричних інтерв’ю для діагностування депресії могло змінити достовірну частоту ПІД (Bovim et al., 2019).
Зрештою, отримані дані дають змогу зробити висновки лише щодо застосування сертраліну. Окрім флуоксетину, єдиного СІЗЗС, клінічну ефективність якого перевірено у масштабному РКД, щодо інших СІЗЗС (як-от циталопраму), також отримано обнадійливі результати щодо впливу на моторні функції у пацієнтів з інсультом. У майбутніх клінічних дослідженнях варто оцінити їхні нейропротекторні та нейровідновні ефекти (Savadi et al., 2017). Сильними аспектами дослідження I. Stuckart et al. вважають проспективний підхід, добре охарактеризовану досліджувану популяцію з моторними дефіцитами, пов’язаними з ГІІ, і повноту даних, отриманих під час подальшого спостереження щодо первинного кінцевого результату.
Висновки
Ранній початок приймання сертраліну був пов’язаний із тенденцією до поліпшення функціонального відновлення пацієнтів після гострого ішемічного інсульту та запобігання розвитку в цій популяції хворих постінсультної депресії. На думку авторів, попри те, що отримані дані обмежені характером спостережувального дослідження, вони можуть стати основою для проведення підтверджувального рандомізованого контрольного дослідження другої фази.
Підготувала Наталія Купко
Тематичний номер «Інсульт» №1 2024 р.