30 грудня, 2025
Ревматологічні прояви хвороби Лайма: межа між реальністю та гіпердіагностикою
 Хвороба Лайма – це запальне захворювання, яке уражає численні органи та системи, зокрема нервову й серцево-судинну, суглоби та м’язи. Збудниками патології є бактерії, але на пізніх стадіях залучені автоімунні процеси. В доповіді, представленій у межах наукової школи «Академія сімейного лікаря. Больовий синдром у практиці внутрішніх хвороб» у травні 2025 р., керівниця навчального центру Інституту ревматології (м. Київ), д.мед.н., професорка Єлизавета Давидівна Єгудіна розглянула питання діагностики та лікування хвороби Лайма.
Хвороба Лайма – це запальне захворювання, яке уражає численні органи та системи, зокрема нервову й серцево-судинну, суглоби та м’язи. Збудниками патології є бактерії, але на пізніх стадіях залучені автоімунні процеси. В доповіді, представленій у межах наукової школи «Академія сімейного лікаря. Больовий синдром у практиці внутрішніх хвороб» у травні 2025 р., керівниця навчального центру Інституту ревматології (м. Київ), д.мед.н., професорка Єлизавета Давидівна Єгудіна розглянула питання діагностики та лікування хвороби Лайма.
Хвороба Лайма: сучасне бачення патогенезу, клінічних стадій і діагностики
Хвороба Лайма передається через укус кліща Ixodes scapularis і є найпоширенішим трансмісивним захворюванням у США, Канаді та Європі (Orloski et al., 2000). Ця бактеріальна інфекція спричинена шістьма видами спірохет родини Borreliaceae. Таксономію цих спірохет було переглянуто, а назва роду в літературі представлена як Borrelia або Borreliella (в обох випадках скорочення роду – «В.»). У Північній Америці інфекцію спричиняє переважно В. burgdorferі та рідше – B. mayonii, у Європі та Азії – B. afzelii або B. garinii, рідше – В. burgdorferі, нечасто – B. spielmanii чи B. bavariensis. Доповідачка зауважила, що, скеровуючи пацієнта на лабораторне дослідження, найдоцільніше призначати виявлення сумарних антитіл до В. burgdorferі, B. afzelii та B. garinii. Поширеність хвороби Лайма є однаковою серед жінок і чоловіків; найімовірніший час її виникнення – із травня по жовтень, що головним чином пов’язано зі збільшенням активності на свіжому повітрі (Nadelman et al., 2001).
Патогенез захворювання на ранніх стадіях значною мірою пов’язаний із наявністю життєздатних бактерій у ділянці запалення, тоді як на пізніх спостерігаються автоімунні процеси. Вважається, що хронічна персистенція B. burgdorferi в уражених тканинах є значущою для патогенезу. Тривалий вплив спірохет та/або бореліальних сполук на імунну систему господаря може викликати хронічне автоімунне захворювання. Вивчення взаємодії бактерій і господаря виявило різноманітні прозапальні та імуномодулювально-імуносупресивні ознаки, спричинені збудником. Імунна реакція господаря на Borrelia об’єднує як клітинно-опосередкований, так і гуморальний механізми. У більшості пацієнтів виникає імунна відповідь із продукуванням антитіл IgM проти зовнішнього поверхневого білка (OspC) або протеїну джгутиків (41-kDa) Borrelia протягом декількох днів від початку інфікування. Рання антибіотикотерапія може призвести до затримання або анулювання В-лімфоцитарної відповіді. У хронічній фазі починають визначатися антитіла проти різних епітопів Borrelia. Хронічні клінічні симптоми, як-от хронічне запалення суглобів, пов’язані з автоімунною відповіддю. Активовані Т-лімфоцити і лімфокіни Т-хелперного типу (CD4-клітини) відіграють важливу роль у патогенезі артриту при хворобі Лайма (Singh et al., 2004).
Хворобу Лайма у дорослих можна розділити на три клінічні стадії, які можуть перетинатися одна з одною. Перші дві стадії, що тривають кілька тижнів або місяців після інфікування B. burgdorferi, являють собою ранню фазу захворювання. Третя, або пізня, фаза починається через кілька місяців чи років (Hengge et al., 2003). Ранні ознаки захворювання зазвичай є самообмежувальними, але пізні можуть стати хронічними та прогресуючими. Інкубаційний період при ранній локалізованій стадії бореліозу триває в середньому 2‑3 тижні. Ранніми проявами є характерна мігруюча еритема і рання дисемінація інфекції. Мігруюча еритема виникає у 50‑90% пацієнтів, розвивається на місці укусу кліща, до того ж часто виявляється у пахвовій западині або поблизу неї, в паховій ділянці, підколінній ямці або на лінії пояса. Вона не обов’язково є болісною, іноді викликає свербіж, є гарячою на дотик. У 59% випадків еритема однорідна, центральна зустрічається у 32%, із центральним очищенням – у 9%. Спонтанне купірування мігруючої еритеми не є свідченням одужання хворого і може відображати перехід до наступної стадії розвитку захворювання (Smith et al., 2002).
Пані Єгудіна наголосила: якщо у пацієнта наявні ознаки мігруючої кільцеподібної еритеми та встановлений контакт із кліщем в ендемічній зоні, цих даних достатньо для клінічного встановлення діагнозу Лайм-бореліозу і початку специфічної антибіотикотерапії без подальших обстежень. Результати серологічних досліджень на ранній локалізованій стадії Лайм-бореліозу часто негативні. Перші антитіла зазвичай з’являються лише через 3‑6 тижнів від моменту укусу кліща (Lantos et al., 2021).
Якщо лікування не розпочате, рання локалізована стадія переходить у ранню дисеміновану стадію Лайм-бореліозу тривалістю 3‑6 тижнів, для якої характерна полісистемність уражень. Відзначаються гематогенне поширення збудника і генералізація інфекційного процесу. На тлі генералізації процесу можлива поява нових плям, зазвичай менших розмірів, ніж первинна мігруюча еритема; ймовірне виникнення плям на різних ділянках тіла – множинні мігруючі еритеми. На ранній дисемінованій стадії Лайм-бореліозу можливі неврологічні прояви, такі як менінгіт, краніальна нейропатія та моторна або сенсорна радикулонейропатія. Ймовірний розвиток міокардиту, що проявляється коливанням ступенів атріовентрикулярної блокади серця. Серед уражень шкіри, окрім мігруючої еритеми, можливе виникнення лімфоцитоми. Захворювання очей може проявлятися як кон’юнктивіт, кератит, іридоцикліт, хоріоїдит, нейропатія зорового нерва та увеїт (Lantos et al., 2021).
Надалі розвивається персистуюча пізня стадія. Хронічне ураження органів інколи розвивається через роки після укусу кліща. Якщо пацієнт не отримує лікування, борелії можуть тривало персистувати в організмі людини завдяки своїй здатності до внутрішньоклітинного паразитування. Це зумовлює виникнення імунопатологічних реакцій, що лежать в основі хронічних форм захворювання. Для пізньої стадії Лайм-бореліозу (через понад три місяці після інфікування) характерне ураження переважно однієї системи на тлі автоімунних реакцій. Найчастіше розвиваються Лайм-артрит, хронічний атрофічний акродерматит та нейробореліоз – множинний мононеврит, сенсорна аксональна периферична нейропатія, енцефаломієліт. Хронічний атрофічний акродерматит починається як запальний дерматит. Пізніше це ураження переростає в атрофічне ураження шкіри. При огляді відзначаються склеродермоподібні зміни шкіри, локальна атрофія шкіри, лущення, блискучі світлі плями в центрі червонувато-синюшних плям, можлива наявність ущільнень. Інші шкірні прояви при Лайм-бореліозі нерідко потребують диференційної діагностики із локалізованою склеродермією, панікулітом Вебера – Крісчена, вузлуватою еритемою (Stanek et al., 2003).
Клінічний випадок № 1
Пацієнтка віком 44 років звернулася до лікаря-ревматолога зі скаргами на біль у гомілковостопних суглобах з обох боків та висип на шкірі. Близько п’яти місяців тому вона відвідала країни Азії, зазначає, що її вкусила комаха, але не пам’ятає, яка саме.
При проведенні лабораторного та інструментального дослідження патологічних змін не виявлено, але клінічно наявний артрит, що не піддається лікуванню протизапальними засобами. Було прийняте рішення про проведення панч-біопсії висипу в місці ймовірного укусу невідомої комахи. При патогістологічному дослідженні виявлено картину неспецифічних ознак атрофії та телеангіектазії, що, з урахуванням клінічної картини, може спостерігатися при хронічному атрофічному акродерматиті, початкових проявах склеродермії та атрофії, викликаній використанням стероїдних лікувальних засобів тощо. При лабораторному тестуванні були виявлені антитіла IgG до Borrelia (В. burgdorferі, B. afzelii, B. garinii): індекс позитивності 1,10 – позитивний результат (норма до 0,8 – негативний). Пацієнтці було призначено антибіотикотерапію, результати лікування артриту – позитивні.
Кістково-м’язові прояви включають артралгії та артрити. Останні зазвичай проявляються рецидивними короткими нападами болю з набряком одного або більше суглобів. Для Лайм-артриту характерний моно- або олігоартрит з ураженням переважно колінних суглобів (одного чи обох), рідше – гомілковостопних, кульшових або плечових. Артрит при бореліозі часто поєднується з ураженнями періартикулярних тканин: тендинітом, теносиновіїтом, бурситом. Після періоду епізодичних атак артрит поступово набуває хронічного персистуючого перебігу (Drouin et al., 2013). Однією з особливостей Лайм-артриту є активація розвитку автоімунних артритів, спондилоартриту, ревматоїдного артриту в пацієнтів, які мають генетичну схильність до них.
Так, у дослідженні S. L. Arvikar et al. (2017) було виявлено 30 осіб, в яких розвинулося нове системне автоімунне захворювання суглобів, у середньому через чотири місяці після появи проявів хвороби Лайма, зазвичай мігруючої еритеми:
- у 15 пацієнтів – ревматоїдний артрит;
- у 13 осіб – псоріатичний артрит;
- у 2 випадках – периферичний спондилоартрит.
Більшість пацієнтів із системним автоімунним захворюванням мали позитивні результати тестів на антитіла IgG до B. burgdorferi, здійснюваних за допомогою імунофлуоресцентного аналізу (ІФА). Проте автоантитіла, пов’язані з хворобою Лайма, виявляли в них із меншою частотою і значно нижчими титрами, ніж у пацієнтів із Лайм-артритом (Arvikar et al., 2017).
Коли з’являються лабораторні зміни при Лайм-бореліозі?
Для вироблення антитіл інколи потрібно кілька тижнів, тому пацієнти можуть мати негативний результат дослідження, якщо інфікування відбулося нещодавно. Антитіла зазвичай зберігаються у крові протягом місяців або навіть років після перенесеної інфекції. Тож спікерка наголосила, що лабораторний тест не може бути використаний для прийняття рішення про призначення лікування. Інші захворювання, зокрема ті, збудники яких передаються кліщами, деякі вірусні й бактеріальні інфекції або автоімунні хвороби можуть призвести до хибнопозитивних результатів тесту на бореліоз. Окремі лабораторні дослідження визначають результати для двох типів антитіл: IgG та Ig M. Позитивні результати щодо IgM не слід брати до уваги у випадку, якщо пацієнт хворіє більш ніж 30 днів. Також не рекомендовано проводити лабораторне тестування на хворобу Лайма як причину опорно-рухових симптомів без історії укусу кліща та відповідних результатів обстеження (Pujalte et al., 2015).
Діагностика Лайм-бореліозу ґрунтується на таких чинниках, як (Wormser et al., 2006):
- Наявність характерної клінічної картини.
- Встановлений факт контакту із кліщем.
- Результати двоетапного серологічного підтвердження.
Підходи Центрів із контролю та профілактики захворювань США (CDC) до серологічної діагностики хвороби Лайма наразі передбачають двоетапну стратегію: сироватку пацієнтів із клінічно підозрюваною хворобою Лайма спочатку тестують за допомогою методу імуноферментного аналізу на основі використання ензим-зв’язаного імуносорбенту (ELISA), ІФА або хемілюмінесцентного аналізу, після чого для підтвердження позитивних або сумнівних результатів першого етапу застосовують другий етап – імуноферментний аналіз чи імуноблотинг. Першоетапні ІФА та хемілюмінесцентні аналізи на полівалентні антитіла IgG та IgM до B. burgdorferi можуть давати хибнопозитивні результати у 2‑5% випадків при використанні рекомбінантних білків і у 10‑15% – лізату цілої клітини (Sfeir et al., 2022; Porwancher et al., 2021). Через занепокоєння щодо хибнопозитивних результатів перших тестів, особливо в умовах низького ризику, CDC рекомендують проведення підтверджувального тесту другого етапу (Mead et al., 2019). На рисунку представлена схема поетапного серологічного дослідження з метою діагностування Лайм-бореліозу (Wormser et al., 2006).
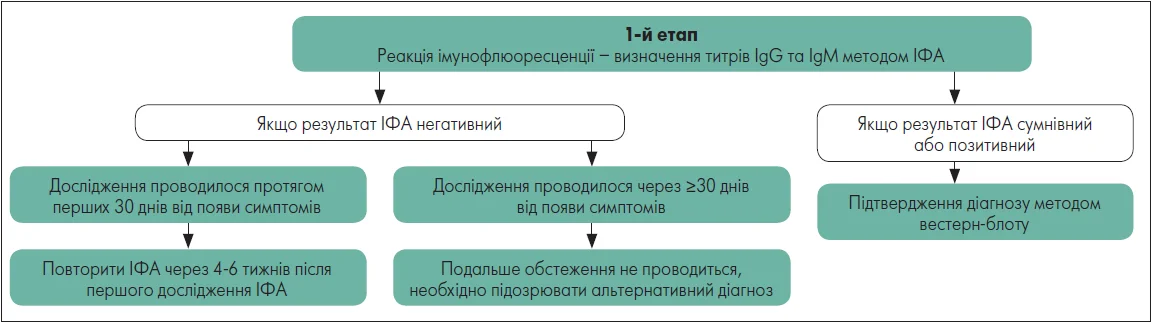 Рисунок. Серологічна діагностика Лайм-бореліозу
Рисунок. Серологічна діагностика Лайм-бореліозу
Адаптовано за G. P. Wormser et al. (2007)
Критерії вестерн-блот діагностики хвороби Лайма
Критерії інтерпретації CDC були обрані для підтримки високої специфічності результатів аналізів другого рівня, зазвичай від 97 до 99% для комбінованих імуноблотів з метою виявлення IgG та Ig M. Критерії CDC для позитивних результатів імуноблотів для виявлення IgM потребують наявності принаймні двох із таких трьох смуг: 23, 39 та 41 кДа. Критерії CDC для позитивних результатів імуноблотів з метою встановлення IgG передбачають наявність щонайменше п’яти із таких десяти смуг: 18, 23, 28, 30, 39, 41, 45, 58, 66 і 93 кДа. Для діагностики рекомендовано використовувати лише імуноблоти для виявлення IgG через 30 днів після початку захворювання, хоча деякі дослідники пропонують брати до уваги імуноблоти для виявлення IgM з метою встановлення нейробореліозу Лайма в період до 6 тижнів після початку хвороби (Porwancher et al., 2023). У таблиці 1 відображено алгоритми інтерпретації результатів дослідження при виявленні антитіл методом вестерн-блоту (NICE, 2018).
|
Таблиця 1. Алгоритми інтерпретації результатів дослідження при виявленні антитіл методом вестерн-блоту |
||
|
Оцінка результатів при виявленні антитіл IgM методом вестерн-блоту |
||
|
позитивний |
сумнівний |
негативний |
|
Виявлено антитіла до антигена OspC Виявлено антитіла до двох та більше антигенів групи р41, р23 (VLsE), p39 |
Виявлено антитіла тільки до одного антигена групи р41, VLsE, p17 Виявлено антитіла в будь-якій кількості до антигенів групи р58, р39, ВВК32 |
Не виявлено жодних антитіл Виявлено антитіла тільки до антигена р83‑100 |
|
Оцінка результатів при виявленні антитіл IgG методом вестерн-блоту |
||
|
позитивний |
сумнівний |
негативний |
|
Виявлено антитіла до антигена VLsE Виявлено антитіла до двох та більше антигенів групи р83‑100, р58, р41, р39, ВВК32, OspC, p17 |
Виявлено антитіла тільки до одного антигена групи р83‑100, р58, р41, р39, ВВК32, OspC |
Не виявлено жодних антитіл Виявлено антитіла тільки до антигена р17 |
Адаптовано за NICE (2018)
Найпоширеніші помилки в інтерпретації результатів серологічного дослідження (Porwancher et al., 2023):
- часті хибнопозитивні результати тестів імуноблотів для виявлення IgM;
- пояснення хронічних нейрокогнітивних та суглобових симптомів наявністю хвороби Лайма виключно на основі позитивних результатів тесту імуноблоту для виявлення IgM, що є відхиленням від чинних рекомендацій;
- встановлення діагнозу хвороби Лайма виключно за даними серологічних досліджень;
- невраховування стадії захворювання під час інтерпретації результатів вестерн-блоту: у пацієнтів із пізньою стадією патології, наприклад Лайм-артритом, результат для виявлення IgG має бути позитивним, а для виявлення IgM – може бути позитивним, а може й ні, тож його не слід використовувати для діагностики.
Клінічний випадок № 2
Пацієнтка віком 30 років звернулася до лікаря-ревматолога зі скаргами на біль та набряклість у ділянках дрібних суглобів кистей, лівого променево-зап’ясткового суглоба, а також на ранкову скутість тривалістю до 1 год. Зі слів жінки, хворіє близько п’яти місяців, протягом яких турбують артралгії, нетривала ранкова скутість. Пацієнтка зазначає, що чотири місяці тому її вкусив кліщ, однак еритеми не було. Стан погіршився впродовж останніх трьох місяців, що проявлялося посиленням суглобового синдрому.
При лабораторному дослідженні зафіксовано підвищення швидкості осідання еритроцитів до 23 мм/год, вміст С-реактивного білка – 12 г/л. За даними ультразвукового дослідження суглобів кистей та стоп виявлено ерозивні зміни та синовіїт 1‑4-х плюснефалангових суглобів обох стоп, ерозивний артрит 1‑2-го п’ястно-фалангових суглобів лівої кисті, ерозивні зміни та синовіїт лівого променево-зап’ясткового суглоба. При лабораторному тестуванні методом вестерн-блоту встановлені антитіла IgМ до антигенів р41, р39, OspC В. burgdorferі. Антитіла IgG до антигенів В. burgdorferі методом вестерн-блоту не були виявлені. Біохімічний аналіз показав, що вміст ревматоїдного фактора становив 165 МО/мл, а рівень антитіл до циклічного цитрулінованого пептиду – 421 Од./мл.
Чи можна діагностувати хворобу Лайма у даної пацієнтки? Ні, оскільки антитіла IgG до В. burgdorferі методом вестерн-блоту не виявлені. Також відомо, що автоімунні захворювання спричиняють отримання хибнопозитивних результатів. До того ж Лайм-артрит переважно уражає суглоби колін, а не кистей. Окрім того, якщо немає сероконверсії антитіл IgG до В. burgdorferі, такі показники не можуть вказувати на пізні прояви хвороби Лайма, а саме Лайм-артрит. Якщо при проведенні тестування виявляються позитивні результати для IgМ та негативні для IgG, необхідно його повторити через 2‑4 тижні. Якщо повторне дослідження продовжує відображати аналогічний результат, його слід розцінювати як хибнопозитивний, що може бути спричинено перехресною реакцією антитіл при сифілісі чи автоімунних захворюваннях. Таким чином, найімовірнішим діагнозом у даної пацієнтки є ревматоїдний артрит.
Лікування Лайм-артриту
Більшість пацієнтів, які лікуються від Лайм-бореліозу, мають позитивний прогноз. Для терапії Лайм-артриту застосовують антибіотики та нестероїдні протизапальні препарати (НПЗП). За потреби можливе виконання аспірації рідини з уражених суглобів. Не рекомендовано використовувати внутрішньосуглобові ін’єкції глюкокортикостероїдів (ГКС). В осіб із Лайм-бореліозом, рефрактерним до застосування антибіотиків, зазвичай спостерігається збереження ознак артриту після 2‑3 місяців пероральної (п/о) та внутрішньовенної (в/в) антибіотикотерапії, розвивається автоімунне запалення. В такому випадку проводять артроскопічну синовектомію та призначають хворобомодифікувальні антиревматичні препарати (ХМАРП), як-от гідроксихлорохін, сульфасалазин або метотрексат (Singh et al., 2004; Drouin et al., 2013). У таблиці 2 наведено схеми антибіотикотерапії за хвороби Лайма.
|
Таблиця 2. Специфічна антибіотикотерапія за хвороби Лайма |
||
|
Клінічна картина |
Лікування вибору |
Альтернативна терапія |
|
Лайм-артрит |
Доксициклін 100 мг двічі на добу п/о або Амоксицилін 500 мг тричі на добу п/о або Цефуроксин 500 мг двічі на добу п/о |
Еритроміцин 500 мг 4 рази на добу п/о або Кларитроміцин 500 мг двічі на добу |
|
Тривалість лікування – 28 днів |
||
|
Рецидивний Лайм-артрит |
Цефтріаксон 2 г в/в |
Доксициклін 100 мг двічі на добу п/о або Амоксицилін 500 мг тричі на добу п/о |
|
Тривалість лікування – 28 днів |
Тривалість лікування – 14‑28 днів |
|
|
Хронічний атрофічний акродерматит |
Цефтріаксон 2 г 1 раз на добу в/в |
|
|
Тривалість лікування – 14‑28 днів |
||
Адаптовано за Lantos et al. (2021)
Пацієнтам, в яких один курс п/о антибіотиків і один курс в/в антибіотиків неефективні, необхідно звернутися до ревматолога для розгляду питання про застосування ХМАРП, біологічних агентів та внутрішньосуглобових ГКС. Очікується, що антибіотикотерапія тривалістю більш ніж вісім тижнів не принесе додаткової користі пацієнтам із персистуючим артритом, якщо це лікування включало один курс в/в препаратів (Lantos et al., 2021).
Для лікування Лайм-бореліозу важливо обрати НПЗП, який буде ефективним та безпечним при довгостроковому використанні. Препаратом вибору для таких пацієнтів може бути Диклоберл® Ретард (диклофенак натрію), який зменшує біль при запальному артриті та може застосовуватися протягом тривалого часу. У мережевому метааналізі даних 8973 досліджень (76 з яких були рандомізованими контрольованими [РКД]) із залученням 58 451 пацієнта було оцінено ефективність семи різних НПЗП, парацетамолу з конкретною добовою дозою або плацебо для лікування болю при остеоартриті (ОА) колінного та кульшового суглобів. Усі препарати, незалежно від дози, поліпшували точкову оцінку симптомів болю порівняно із плацебо. На підставі отриманих даних не було визначено ролі монотерапії парацетамолом для лікування пацієнтів з ОА. Своєю чергою були отримані переконливі докази того, що диклофенак у дозі 150 мг/добу є найефективнішим натепер НПЗП із точки зору як зменшення болю, так і поліпшення функціонування (da Costa et al., 2017).
Систематичний огляд та мережевий метааналіз даних 192 РКД за участю 102 829 пацієнтів був присвячений оцінюванню ефективності й безпеки НПЗП у різних дозах, опіоїдів і парацетамолу для лікування болю при ОА колінних та кульшових суглобів. Було розглянуто 90 різних активних препаратів або доз (68 для НПЗП, 19 для опіоїдів та три для парацетамолу). Застосування пероральних препаратів (150 мг/добу диклофенаку, 60 і 90 мг/добу еторикоксибу, 5 і 50 мг/добу рофекоксибу) забезпечувало ймовірність ≥99% виразнішого ефекту лікування, ніж мінімальне клінічно значуще зменшення болю. Результати показали, що еторикоксиб по 60 мг/добу та диклофенак у дозі 150 мг/добу є найдієвішими пероральними НПЗП для знеболення та поліпшення функціонування у пацієнтів з ОА колінних та кульшових суглобів (da Costa et al., 2021).
Позитивний протизапальний та знеболювальний ефект диклофенаку пов’язаний із тим, що він максимально дієво пригнічує синтез прозапального простагландину Е2 (PGE2). Застосування диклофенаку дозволяє знизити рівень PGE2 на 93%, що є майже на 20% ефективнішим за аналогічні показники при лікуванні інгібіторами циклооксигенази‑2, як селективними (рофекоксиб, мелоксикам), так і неселективними (ібупрофен, напроксен). Окрім того, продемонстровано вищу клінічну ефективність диклофенаку порівняно із мелоксикамом. Згідно з результатами дослідження MELISSA, в якому взяли участь понад 9 тис. осіб з ОА, пацієнти групи мелоксикаму на 38% частіше відмовлялися від лікування через його неефективність порівняно із тими, хто отримував диклофенак (Van Hecken et al., 2000).
При призначенні лікування важливо обирати препарат, який забезпечить найвищу ефективність та найменшу кількість негативних явищ. Пані Єгудіна підкреслила, що абсолютно безпечного НПЗП не існує. В рандомізованому порівняльному дослідженні MEDAL вивчали вплив довгострокового застосування НПЗП у пацієнтів з артритом на серцево-судинну (СС) систему. Програму MEDAL було розроблено для забезпечення точної оцінки тромботичних СС-подій при використанні селективного інгібітора циклооксигенази‑2 еторикоксибу порівняно із традиційним НПЗП диклофенаком. У дослідження було включено 34 701 пацієнта (24 913 з ОА та 9787 із ревматоїдним артритом). Середня тривалість лікування становила 18 місяців. Було проведено об’єднаний аналіз даних трьох досліджень, в яких хворих на ОА або ревматоїдний артрит випадковим чином розподілили на групи для отримання еторикоксибу (60 чи 90 мг/добу) або диклофенаку (150 мг/добу).
За отриманими результатами, у 320 пацієнтів групи еторикоксибу та 323 – диклофенаку спостерігалися тромботичні СС-події. Частота епізодів із боку верхніх відділів шлунково-кишкового тракту (ШКТ), як-от перфорація, кровотеча, непрохідність і виразка, була нижчою при застосуванні еторикоксибу, ніж диклофенаку, але кількість ускладнень із боку верхніх відділів ШКТ – подібною (0,30 і 0,32 відповідно). Таким чином, частота тромботичних СС-подій у пацієнтів з артритом, які застосовують еторикоксиб, подібна до такої у тих, хто тривало використовує диклофенак (Cannon et al., 2006).
Ще один метааналіз, присвячений оцінюванню впливу НПЗП на судини та верхні відділи ШКТ, включав дані 280 досліджень ефективності НПЗП порівняно із плацебо (n=124 513) та 474 випробувань, в яких порівнювали один НПЗП з іншим (n=229 296). Порівняно з учасниками групи плацебо, із 1 тис. пацієнтів, яким призначали коксиб або диклофенак протягом року, в трьох спостерігалися серйозні судинні події. Напроксен суттєво не впливав на цей показник. Частота судинної смерті значно зростала при застосуванні коксибів та диклофенаку, несуттєво – ібупрофену, але не при використанні напроксену. Пропорційний вплив на серйозні судинні події не залежав від вихідних характеристик, включно із судинним ризиком. Імовірність розвитку серцевої недостатності приблизно вдвічі збільшувалася при лікуванні всіма НПЗП. При використанні всіх схем терапії НПЗП зростала кількість ускладнень із боку верхніх відділів ШКТ (Bhala et al,. 2013).
Таким чином, судинні ризики при застосуванні високих доз диклофенаку та ібупрофену не відрізняються від таких при лікуванні коксибами. Хоча використання НПЗП підвищує судинні та шлунково-кишкові ризики, їхні частоту й тяжкість можна передбачити, що може допомогти у прийнятті клінічних рішень.
Диклоберл® Ретард доступний у формі капсул (кожна містить 100 мг диклофенаку натрію). Препарат слід приймати один раз на добу, що підвищує прихильність пацієнтів до лікування. Особливістю лікарського засобу є технологічно вдосконалені капсули із мікрогранулами, що сприяє досягненню оптимальної фармацевтичної стабільності та біодоступності. При розпаданні капсули повна доза діючої речовини вивільняється протягом 4 год. Вивільнення препарату починається у дванадцятипалій кишці, що сприяє зменшенню кількості побічних ефектів.
Для пацієнтів із гострим болем наявний препарат Диклоберл® (диклофенак натрію) у формі розчину для ін’єкцій в ампулах по 75 мг, який можна використовувати у максимальній дозі дві ампули на добу. Такий підхід забезпечує швидке зменшення болю на початку лікування як при гострому запаленні, так і після хірургічних втручань. Результати РКД з оцінки ефективності застосування 75 мг диклофенаку внутрішньом’язово, 1 мг парацетамолу в/в або комбінації цих препаратів що 8 год протягом 24 год після гінекологічної операції у 90 пацієнток із післяопераційним болем показали, що використання диклофенаку сприяє значному зниженню потреби в екстреному знеболювальному засобі (трамадолі) (Pal et al., 2014).
Професорка Є. Д. Єгудіна зазначила, що у ~10‑20% пацієнтів може розвинутися синдром хвороби Лайма після лікування (PTLDS – post-treatment Lyme disease syndrome). Факторами ризику є жіноча стать, наявність супутніх захворювань, затримання встановлення діагнозу, застосування ГКС.
Серед симптомів PTLDS найчастіше відзначаються:
- постійний неспецифічний біль у суглобах і м’язах;
- швидка втомлюваність;
- нейрокогнітивні симптоми після лікування хвороби Лайма.
PTLDS характеризується відсутністю синовіїту або системного запалення. Результат виявлення антитіл IgМ часто буває хибнопозитивним, причому іноді їх виявляють протягом багатьох років після перенесеного лікованого бореліозу. Наразі немає загальноузгоджених симптомів, лабораторних або візуалізаційних знахідок, які були б чутливими та специфічними для допомоги у клінічному оцінюванні пацієнтів зі стійкими симптомами хвороби Лайма. Тому клінічний діагноз PTLDS є, передусім, діагнозом виключення, і поточне захворювання необхідно відрізняти як від інших системних запальних, ревматичних, злоякісних та інфекційних станів, так і від наслідків супутніх або вже наявних патологій (Rebman et al., 2020).
PTLDS зазвичай встановлюється у разі наявності скарг на розвиток втомлюваності, поширеного болю, когнітивних проблем, які почалися і тривають протягом шести місяців після встановлення діагнозу хвороби Лайма. Здійснювати серологічні дослідження недоцільно. Диференційну діагностику необхідно проводити із фіброміалгією, системним червоним вовчаком, міалгічним енцефаломієлітом, іншими ревматичними й інфекційними захворюваннями (Feder et al., 2007).
Натепер немає затвердженого лікування PTLDS. Пацієнтам, які скаржаться на стійкі або рецидивні неспецифічні симптоми, такі як втомлюваність, біль або когнітивні порушення після оптимальної терапії хвороби Лайма, але не мають об’єктивних доказів реінфекції або неефективності препаратів, не рекомендовано додатково застосовувати антибіотики. Підходи до лікування PTLDS можуть включати симптоматичну терапію поширеного болю як при фіброміалгії: трициклічні антидепресанти, селективні інгібітори зворотного захоплення серотоніну й норадреналіну (дулоксетин, мілнаципран), α2δ-ліганди (габапентин, прегабалін). Немедикаментозні методи передбачають фізичні вправи, когнітивно-поведінкову терапію, «медицину розуму і тіла» (практичний підхід, зосереджений на взаємозв’язку психічного стану й фізичного здоров’я) (Lantos et al., 2021).
Висновки
Мігруюча еритема є патогномонічним симптомом Лайм-бореліозу. Її поява при встановленому контакті з кліщем в ендемічній зоні є показанням до початку специфічної антибіотикотерапії і не потребує серологічного підтвердження. Серологічна діагностика Лайм-бореліозу включає два етапи: застосування методів ІФА і вестерн-блоту. Сумнівні й позитивні результати ІФА мають бути підтверджені дослідженням методом вестерн-блоту, тоді як негативні результати ІФА в більшості випадків не потребують проведення подальших тестувань. Для лікування застосовують антибіотикотерапію та НПЗП.
Підготувала Ірина Климась
Тематичний номер «Неврологія. Психіатрія. Психотерапія» № 4 (75) 2025 р.




