23 січня, 2021
Антисенсові олігонуклеотиди – новітній підхід до лікування нейродегенеративних захворювань
.jpg) На сьогодні пошук лікарських речовин для терапії нейродегенеративних захворювань (НДЗ) спрямований на субстанції, що здатні взаємодіяти з мішенями-протеїнами, як-от ензими, рецептори клітин тощо. Крім того, до будь-якого препарату існують вимоги щодо сили, вибірковості цієї взаємодії та біодоступності, тобто здатності досягти своєї мішені у достатній концентрації. Така комбінація вимог робить створення ефективного та безпечного лікарського засобу для пацієнтів із НДЗ надскладним завданням. Додатково воно ускладнюється існуванням гематоенцефалічного бар’єра (ГЕБ) – особливою щільною будовою міжклітинних контактів ендотеліальних клітин судин нервової системи, астроцитів та базальної мембрани. Результатом функціонування ГЕБ стає дуже вибіркове потрапляння до центральної нервової системи (ЦНС) речовин, що містяться у крові.
На сьогодні пошук лікарських речовин для терапії нейродегенеративних захворювань (НДЗ) спрямований на субстанції, що здатні взаємодіяти з мішенями-протеїнами, як-от ензими, рецептори клітин тощо. Крім того, до будь-якого препарату існують вимоги щодо сили, вибірковості цієї взаємодії та біодоступності, тобто здатності досягти своєї мішені у достатній концентрації. Така комбінація вимог робить створення ефективного та безпечного лікарського засобу для пацієнтів із НДЗ надскладним завданням. Додатково воно ускладнюється існуванням гематоенцефалічного бар’єра (ГЕБ) – особливою щільною будовою міжклітинних контактів ендотеліальних клітин судин нервової системи, астроцитів та базальної мембрани. Результатом функціонування ГЕБ стає дуже вибіркове потрапляння до центральної нервової системи (ЦНС) речовин, що містяться у крові.
НДЗ певною мірою становлять найбільший виклик для сучасної фармації. Також вважається, що значна частка НДЗ зумовлена тими чи іншими змінами або особливостями генетичного апарату клітин нервової системи, що донедавна серйозно ускладнювало прогноз та лікування захворювань цієї групи. Поява технології антисенс-олігонуклеотидів (АСО) та її перші практичні досягнення перегортають нову, повну сподівань, сторінку в лікуванні НДЗ.
Піонером технології АСО, що отримав схвалення Управління з санітарного нагляду за якістю продуктів харчування та медикаментів США (FDA) ще 1998 р., став фомівірсен (Вітравен) – препарат для терапії цитомегаловірусного ретиніту як ускладнення СНІД. Наступне схвалення лікарського засобу даної групи сталося майже через 15 років – це був міпомерсен (Кінамро), показаний для застосування в осіб із сімейною гіперхолестеринемією. Але і перший, і другий препарати не мали своєю мішенню ЦНС. Переможцем у багаторічних перегонах із розробки АСО-засобів для лікування захворювань ЦНС 2016 р. став нусінерсен (Спінраза), коли його затвердило FDA і роком пізніше – Агентство з лікарських засобів (ЕМА).
Механізм дії АСО
Що ж таке АСО, і завдяки яким клінічним характеристикам вони ефективні у лікуванні НДЗ? АСО – це штучно синтезована одноланцюгова послідовність нуклеотидів довжиною 15‑50 нуклеїнових кислот, здатна комплементарно взаємодіяти із мРНК відповідно до правил Ватсона – Кріка. Тобто мішенню цих сполук є етап синтезу обраних протеїнів, які відіграють ключову роль у патологічному процесі.
Також в основі технології АСО лежить відкриття здатності олігонуклеотидних послідовностей впливати на експресію генів, яке сталося 1978 р. Спершу було виявлено здатність до пригнічення експресії, пізніше – різноманітні ефекти, якими можна керувати шляхом змін визначених ділянок кодувальних послідовностей. Механізм дії АСО представлений на рисунку 1.
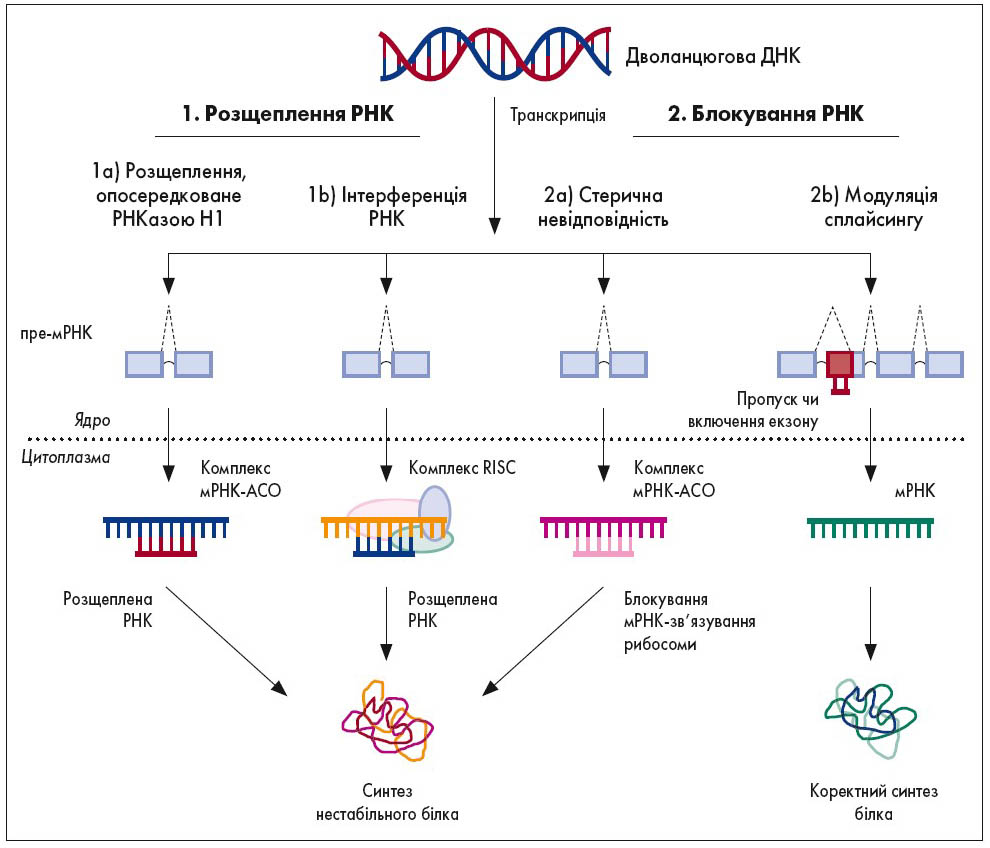 Рис. 1. Механізм дії АСО: розщеплення або блокування РНК
Рис. 1. Механізм дії АСО: розщеплення або блокування РНК
Примітка: Пре-мРНК – попередник матричної РНК, комплекс RISC – індукований РНК сайленсинг-комплекс.
Адаптовано за K. Dhuri et al., 2004.
На перший погляд, для сучасних технологій хімічного синтезу завдання створення вищезгаданих сполук є відносно нескладним, але не все так просто. По-перше, досить скоро було з’ясовано, що природні (немодифіковані) олігонуклеотиди погано потрапляють до клітин та швидко руйнуються нуклеазами як внутрішньоклітинно, так і на всьому шляху з місця надходження до організму. По-друге, занадто короткі ланцюги АСО не можуть забезпечити достатню специфічність взаємодії з мішенню та бажаний вплив на експресію визначеного гену. Тобто керування ефектами АСО потребує деякої мінімальної кількості нуклеотидів та приєднання до олігонуклеотидного ланцюга додаткових хімічних структур. З іншого боку, обмеження щодо максимальної довжини ланцюга АСО є не менш суворим – занадто довгі ланцюги важко доставити до внутрішньоклітинного простору, а ще вони набувають здатності до імуногенності.
На даний час арсенал хімічних засобів щодо керування властивостями АСО є досить великим. До нього входять різноманітні хімічні структури (фосфотіолати, фосфородіамідат морфоліно олігомери, 2’-О-метоксиетил тощо та багато інших), а також місця, куди на олігонуклеотидному ланцюзі їх приєднують (група фосфорної кислоти, молекула цукру/рибози тощо). Таке розмаїття зумовлено тим, що всі ці варіації мають свої недоліки, як-от токсичність, погана водорозчинність або афінність до мішені, та переваги.
Що ж представляє собою успішний АСО-засіб, яким є препарат нусінерсену Спінраза? Нусінерсен створений на основі олігонуклеотидного ланцюга модифікованого 2’-O-метоксиетил фосфоротіолатом. Це одна з найпопулярніших модифікацій – вона має дещо меншу афінність порівняно з іншими вживаними модифікаціями, але позбавлена токсичності, імуногенності та має поліпшену стійкість до нуклеаз.
Ефективність застосування нусінерсену
Перший успіх – спінальна м’язова атрофія
Спінальна м’язова атрофія (СМА) – моногенно зумовлене НДЗ з автосомно-рецесивним типом успадкування. Казуальним геном, який ушкоджується при цьому захворюванні, є SMN1. Втрата функції цього гена призводить до відсутності синтезу однойменного протеїну, що забезпечує виживання мотонейронів (Survival MotoNeuron). Насправді цей білок синтезується в усіх клітинах організму, але з невідомої причини його відсутність спричиняє прогресуючу загибель лише моторних нейронів передніх рогів спинного мозку, у тяжчих випадках – мозкового стовбура.
Цікаво, що мішенню нусінерсену не є SMN1. Його мішень – ген SMN2. Він майже не відрізняється від «головного» гена SMN1, за виключенням короткої послідовності нуклеотидів, що спричиняє синтез нестабільного протеїну. Цей протеїн позбавлений послідовності амінокислот, яка кодується 7-м екзоном гена. Згадана відмінність у послідовності гена впливає на процес сплайсингу – «збірки» шматочків пре-мРНК, синтезованих із відповідних екзонів ДНК. Нусінерсен пригнічує дію певних факторів сплайсингу, що приводить до включення потрібної амінокислотної ділянки, закодованої у 7-му екзоні, до SMN протеїну, і він набуває необхідної стабільності.
Використання нусінерсену в клінічній практиці
Нусінерсен вводять інтратекально шляхом люмбальної пункції. Зрозуміло, що цей процес пов’язаний із певними незручностями, але все ж дозволяє розв’язати кілька важливих питань.
По-перше, вдається швидко досягти ефективної концентрації лікарського засобу в органі-мішені, ЦНС. Необхідність такого «насичення» продиктована як особливістю фармакокінетики нусінерсену, так і намаганням отримати клінічний ефект у стислі строки, що критично важливе для тяжких форм СМА. Крім інтратекального введення, ця мета досягається зменшенням інтервалів між ін’єкціями на початку лікування до двох тижнів.
По-друге, після насичення ЦНС нусінерсеном інтратекальне введення набуває додаткового значення і переваг, адже наявність ГЕБ сприяє підтриманню терапевтичної концентрації протягом тривалого часу – частота введень препарату становить один раз на чотири місяці. Зважаючи на те, що лікування нусінерсеном має характер, так би мовити, замісної терапії, знижена частота вживання препарату є неабиякою перевагою.
По-третє, інтратекальне введення препарату дозволяє звести до мінімуму характерні для інших модифікованих АСО токсичні ефекти, такі як тромбоцитопенія, нефротоксичність та порушення згортання крові.
До того ж певною перевагою нусінерсену можна назвати фіксовану разову дозу препарату – 12 мг. Вона не залежить від ваги й віку хворого, що зменшує імовірність помилок із розрахунком або введенням лікарського засобу.
Особливості лікування АСО у педіатричній популяції
Що на сьогодні відомо про ефективність АСО при НДЗ? Хоча найбільш досліджуваними НДЗ, на які витрачають багато коштів і зусиль, є хвороби дорослих, такі як спадковий домінантний автосомний бічний аміотрофічний склероз та хорея Гентингтона, досвід використання нусінерсену в дитячій популяції все одно є дуже цінним, оскільки демонструє принципову можливість лікування НДЗ за допомогою АСО.
Особливістю оцінки ефективності лікарських засобів у дітей є необхідність використання специфічних функціональних, або інших, шкал, що враховують вік дитини. Зокрема, якщо мова йде про нервово-м’язові захворювання, слід визначити силу, витривалість та відповідність моторного розвитку віку. Досить популярною і широко вживаною із таких шкал є неврологічне обстеження немовлят за Хаммерсмітом (HINE).
На рисунку 2 наведено траєкторію досягнення етапів рухового розвитку в немовлят із найтяжчим першим типом СМА при застосуванні АСО відповідно до показника 2-го розділу HINE (HINE‑2). Дані двох зображених кривих були отримані у процесі дослідження NURTURE, що включало дітей віком до шести тижнів, які не мали симптомів захворювання. Показник 26 балів згідно з HINE‑2 є максимальним, тобто нормою. На рисунку 2 можна бачити, що діти із 3-ма копіями SMN2 досягли цього показника, а з 2-ма – наблизилися дуже близько до нього, тобто до норми.
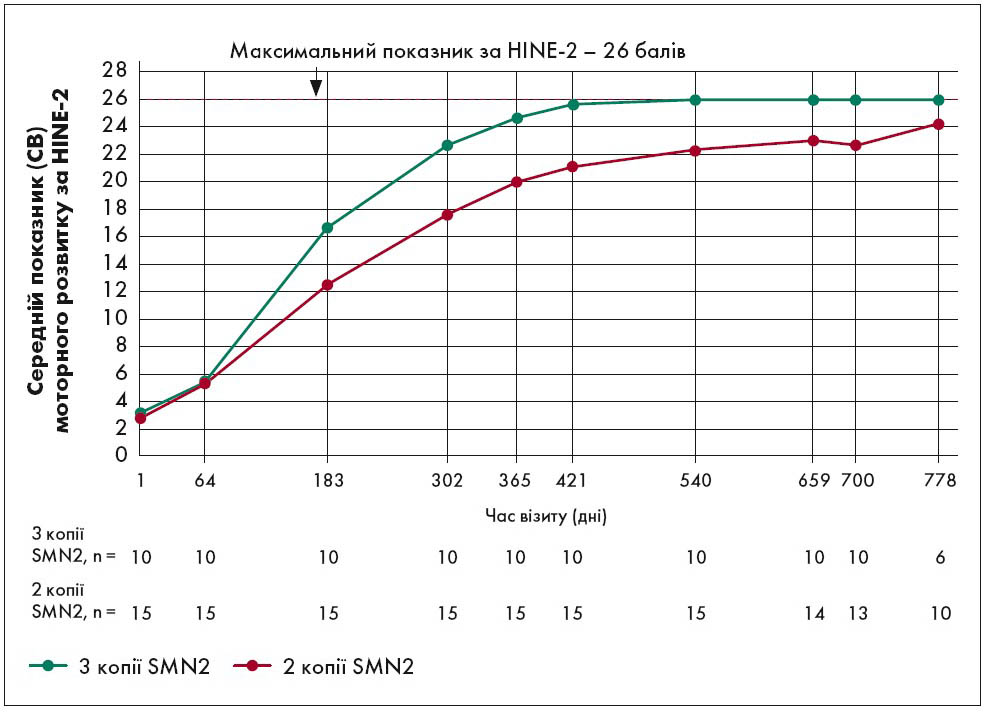 Рис. 2. Середні показники моторного розвитку немовлят із плином часу при застосуванні АСО відповідно до HINE‑2 у межах дослідження NURTURE
Рис. 2. Середні показники моторного розвитку немовлят із плином часу при застосуванні АСО відповідно до HINE‑2 у межах дослідження NURTURE
Примітка: СВ – стандартне відхилення. Включені часові точки при n≥5. Оцінку за шкалою HINE‑2 в учасників дослідження NURTURE проводили до візиту на 778-й день.
Адаптовано за D.C. De Vivo et al., 2019.
Крім сприятливої клінічної ефективності АСО, ці дані цікаві тим, що демонструють своєрідну кореляцію доза/ефект на рівні генетичного апарату хворого. Такий взаємозв’язок зазвичай є найкращим доказом дієвості лікарського засобу.
Слід зауважити, що згаданий вище неповноцінний ген SMN2 може бути наявний у генотипі людини в кількості від 0 до 4‑6 копій. Близько 15% його транскриптів можуть перетворюватися на стабільний повноцінний протеїн. Тому вважається, що діти з гомозиготною мутацією SMN1 та 0 копій SMN2 нежиттєздатні, а ті, хто має багато, хворіють на легкий 3-й тип або взагалі безсимптомні. Зазвичай пацієнти із СМА І типу мають дві, менш поширений варіант – три копії SMN2.
Таким чином, представлені на рисунку 2 сприятливі показники, що виявлені у дітей із трьома копіями за допомогою HINE‑2, є яскравим підтвердженням теоретичних уявлень про механізм дії АСО. Також для повного розуміння даних слід звернути увагу, що графік закінчується точкою 778 днів від початку лікування, що трохи більше ніж два роки. Це – вік загибелі хворих на СМА І типу в разі природного перебігу хвороби.
Подібну закономірність, але у клінічному вимірі, а також в осіб із вже наявними симптомами продемонстровано на рисунку 3. Наведені дані отримані у дослідженнях CS2 (відкрита фаза Іb/ІІa) і CS12 (додаткова фаза) (NCT01703988 та NCT02052791; ClinicalTrials.gov). Ефект лікування було проаналізовано за показниками розширеної шкали оцінки рухової функції за Хаммерсмітом (HFMSE). Це адаптований для СМА і розширений варіант більш універсальної нервово-м’язової шкали, що розрахована для використання у дорослих та дітей, які мають виконувати складніші інструкції та досягти усіх етапів моторного розвитку відповідно до віку. Представлені на рисунку 3 дані цікаві тим, що демонструють достовірне покращення показників із плином часу при застосуванні АСО.
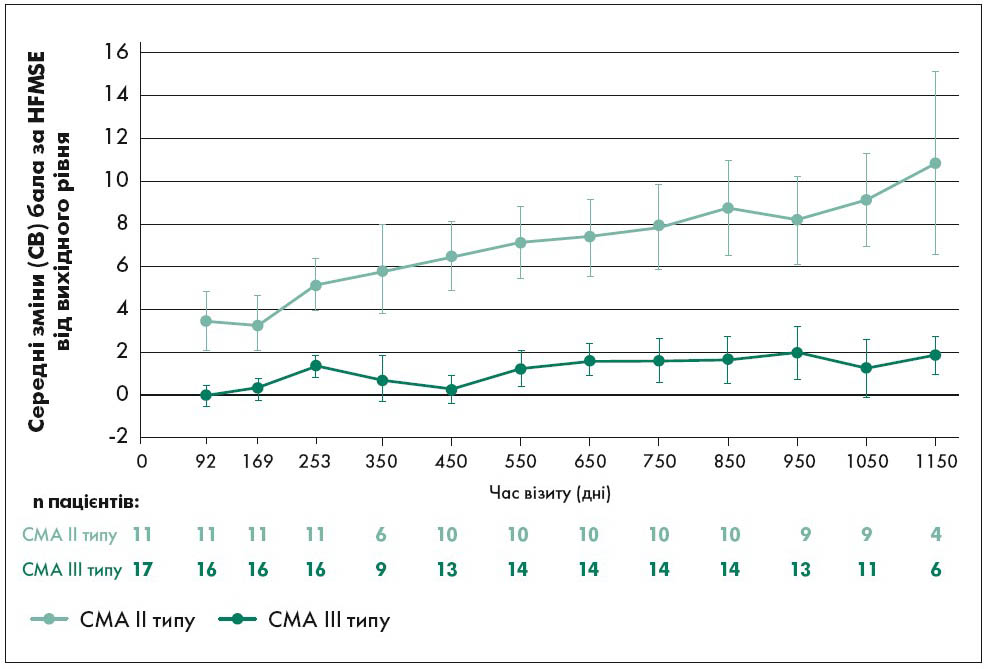 Рис. 3. Середні зміни бала за HFMSE у дітей від вихідного рівня при використанні АСО
Рис. 3. Середні зміни бала за HFMSE у дітей від вихідного рівня при використанні АСО
Примітка: СВ – стандартне відхилення. Через часовий розрив між дослідженнями CS2 і CS12 та проміжки між відвідуваннями зазначені дані не всіх дітей.
Адаптовано за B.T. Darras et al., 2019.
Також вплив нусінерсену проаналізовано у дітей із СМА III типу відповідно до модулю оцінки верхніх кінцівок (ULM) та тесту 6-хвилинної ходьби (6MWT). Із часом було показане поступове підвищення середнього бала за ULM. У дітей, що не вміли ходити, при візиті на 350-й день відзначався максимальний показник 18 балів, і досягнуте поліпшення зберігалося із плином часу (рис. 4).
 Рис. 4. Середні зміни балів від вихідного рівня за модулем ULM та тестом 6MWT
Рис. 4. Середні зміни балів від вихідного рівня за модулем ULM та тестом 6MWT
Примітка: СВ – стандартне відхилення. ULM використовувався для оцінки у дітей, що не вміли ходити, 6MWT – у тих, що вміли ходити. Через часовий розрив між дослідженнями CS2 і CS12 та проміжки між відвідуваннями зазначені дані не всіх дітей.
Адаптовано за B.T. Darras et al., 2019.
На додаток, доступні дані дослідження, в якому вивчали ефективність нусінерсену щодо моторної функції в немовлят із СМА І типу, дітей та молодих людей (віком від трьох місяців до 19 років) при застосуванні впродовж шести місяців (рис. 5). Аналіз рухових функцій проводили за допомогою тесту дитячої лікарні Філадельфії для оцінки моторних функцій при нервово-м’язових захворюваннях (CHOP INTEND). Отримані результати дозволяють припустити, що при лікуванні нусінерсеном можна досягти функціонального поліпшення у пацієнтів із СМА І типу.
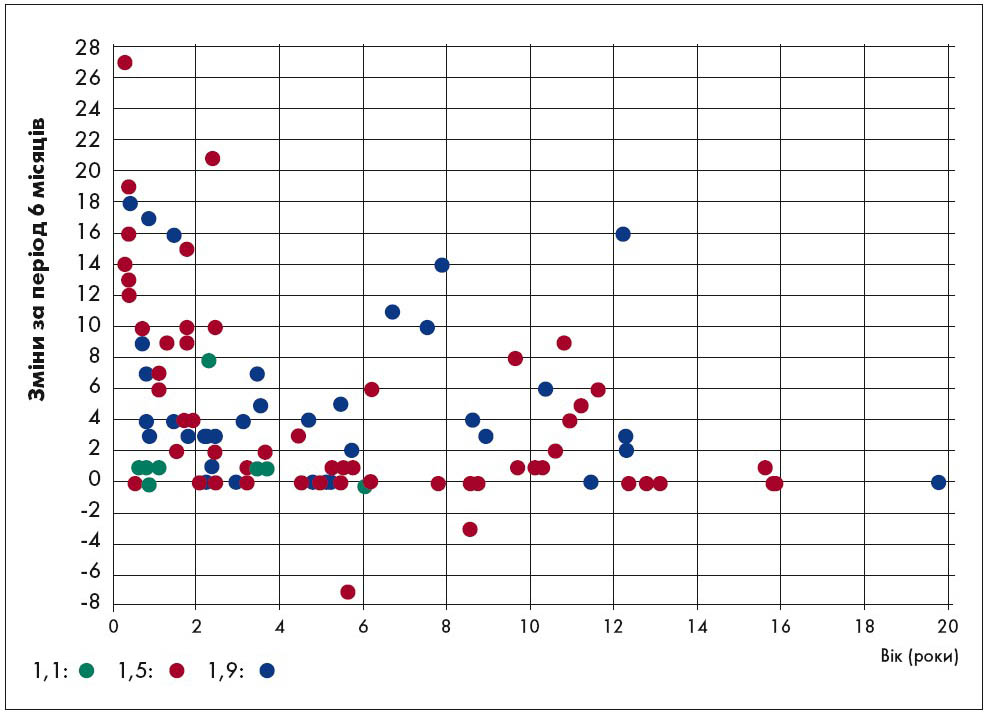 Рис. 5. Індивідуальні зміни показників відповідно до CHOP INTEND з огляду на тяжкість хвороби, вік та оцінку на вихідному рівні у пацієнтів при застосуванні нусінерсену
Рис. 5. Індивідуальні зміни показників відповідно до CHOP INTEND з огляду на тяжкість хвороби, вік та оцінку на вихідному рівні у пацієнтів при застосуванні нусінерсену
Адаптовано за M. Pane et al., 2018.
Висновки
Якщо пригадати загальні патофізіологічні закономірності та патогенез СМА, при використанні АСО більш очікуваним є уповільнення або відсутність прогресування хвороби. Такі результати є дуже обнадійливими і дарують надію пацієнтам із легкими й помірними формами НДЗ повернутися до здорового повноцінного життя.
Список літератури знаходиться в редакції
CP-200906
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 4 (55) 2020 р.



