23 січня, 2021
Хвороба Паркінсона та нейрокогнітивні порушення: чи є світло у темряві?
У межах онлайн-конференції «Нові моделі й технології надання неврологічної, психіатричної та наркологічної допомоги», що відбулася 7‑9 жовтня 2020 року, було реалізовано обмін досвідом лікарів-практиків та висвітлено сучасні підходи до корекції патології центральної нервової системи. Представляємо до вашої уваги огляд доповідей, присвячених ключовим питанням зі сфери екстрапірамідних порушень і деменції.
Складний пацієнт із хворобою Паркінсона: переваги пролонгованої форми праміпексолу
 Керівниця відділу екстрапірамідних захворювань ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України» (м. Київ), д. мед. н., професорка Ірина Миколаївна Карабань присвятила доповідь хворобі Паркінсона (ХП), що є багатогранною за рахунок декількох напрямів патологічної маніфестації. ХП може характеризуватися моторними проявами (брадикінезією, тремором спокою, ригідністю), немоторними симптомами, як-от нейропсихіатричні, розлади сну, порушення вегетативної автономної системи, травного тракту й сенсорної функції, а також синдром хронічної втоми, порушення ходи та рівноваги (Chaudhuri et al., 2006). Серед коморбідних станів зустрічаються артеріальна гіпертензія, остеопороз, деменція, цереброваскулярні патології, виразкова хвороба шлунка та дванадцятипалої кишки, cиндром надлишкового бактеріального росту в тонкому кишечнику тощо.
Керівниця відділу екстрапірамідних захворювань ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України» (м. Київ), д. мед. н., професорка Ірина Миколаївна Карабань присвятила доповідь хворобі Паркінсона (ХП), що є багатогранною за рахунок декількох напрямів патологічної маніфестації. ХП може характеризуватися моторними проявами (брадикінезією, тремором спокою, ригідністю), немоторними симптомами, як-от нейропсихіатричні, розлади сну, порушення вегетативної автономної системи, травного тракту й сенсорної функції, а також синдром хронічної втоми, порушення ходи та рівноваги (Chaudhuri et al., 2006). Серед коморбідних станів зустрічаються артеріальна гіпертензія, остеопороз, деменція, цереброваскулярні патології, виразкова хвороба шлунка та дванадцятипалої кишки, cиндром надлишкового бактеріального росту в тонкому кишечнику тощо.
Будь-який пацієнт із цим нейродегенеративним захворюванням складний, оскільки потребує уваги до кожного патологічного прояву ХП. Додатково прогнозується зростання кількості осіб із ХП, адже, як у період боротьби з іспанським грипом, коронавірусна хвороба є фактором виснаження нейротрансмітерних систем у головному мозку, зокрема дофамінової системи. Саме тому обізнаність щодо можливих терапевтичних стратегій є актуальною як ніколи.
Симптоматична корекція моторних проявів досягається шляхом призначення (Rascol et al., 2008):
- препаратів леводопи у комбінації з інгібіторами декарбоксилази (карбідопа, бензеразид), катехол-O-метилтрансферази (ентакапон, толкапон);
- агоністів дофамінових рецепторів (АДР): неерголінових (праміпексол, ропінерол, ротиготин, апоморфін);
- інгібіторів моноаміноксидази типу Б (іМАО-Б): селегілін, разагілін;
- недофамінергічних препаратів: бензексол, тригексифенідил, агоністи глутамату (амантадин).
Доповідачка проаналізувала роль дофамінових агоністів у лікуванні хворих на ХП. Сучасною концепцією ведення пацієнта з ХП є орієнтація на якість життя та ступінь прогресування інвалідизації. В зазначеному аспекті праміпексол розглядається як лікарський засіб, що має нейропротекторні властивості. Наприклад, на приматах in vivo було показано, що праміпексол частково запобігає ураженню нейронів чорної субстанції в моделі індукування нейротоксичності нейротоксином MPTP (1-метил‑4-феніл‑1,2,3,6-тетрагідропіридин) (Iravani et al., 2006). Отримані дані доповнюють відому властивість праміпексолу зменшувати токсичну дію речовин, що впливають на підкіркові структури.
У межах подвійного сліпого рандомізованого клінічного дослідження за участю 82 хворих порівнювали показники дегенерації дофамінових нейронів за допомогою візуалізації транспортера дофаміну після початкової терапії праміпексолом або леводопою на ранніх стадіях ХП. У пацієнтів, які від початку лікувалися праміпексолом, було продемонстроване менше поглинання маркера дегенерації дофамінових нейронів порівняно з тими, хто від початку отримував леводопу протягом 46 місяців (Parkinson Study Group Investigators, 2002).
Неерготамінові АДР є препаратами першої лінії терапії ХП із раннім початком, оскільки їхнє застосування (Yamamoto et al., 2008; Barone et al., 2009):
- поліпшує контроль моторних симптомів на декілька років;
- характеризується низьким ризиком виникнення моторних ускладнень;
- відтерміновує застосування леводопи та пов’язаних із нею моторних ускладнень;
- редукує депресивну симптоматику;
- потенційно модифікує клінічну прогресію ХП;
- є безпечним і добре переноситься.
Відомо, що стартове лікування праміпексолом порівняно з леводопою запобігає формуванню дискінезій, феномена виснаження дози (wearing-off) – поступовому зменшенню ефективності препарату внаслідок збільшення тривалості застосування.
АДР мають низку суттєвих переваг: стимулюють дофамінові рецептори, не потребують метаболічної конверсії до дофаміну, повністю незалежні від різних метаболічних шляхів, не залучають до взаємодії катехол-О-метилтрансферазу, моноаміноксидазу. Їхній ефект не залежить від пресинаптичного зберігання в дофамінергічних терміналах. Також ці препарати мають тривалий період напіврозпаду, тож довше стимулюють дофамінові рецептори. На додачу, для них характерний специфічний для дофамінових рецепторів субтип (D2/D3), який рідше викликає дискінезії порівняно з D1-рецепторною активністю (Poewe, 2012).
Комбіноване використання АДР та леводопи дозволяє зменшити дозу останньої, виразність моторних флуктуацій, поліпшити та подовжити період «увімкнення» (Lemke, 2008; Barone et al., 2009). Крім того, АДР є допоміжними засобами при корекції леводопа-асоційованих ускладнень на різних етапах терапії (Obeso et al., 2000):
- проміжний період: подовження тривалості моторної відповіді на приймання разової та добової дози, зниження виразності дискінезій;
- віддалений період: подовження тривалості моторної відповіді, зниження виразності дискінезій у періоді «увімкнення».
На жаль, 70% пацієнтів не дотримуються призначеного режиму лікування, внаслідок чого зменшується його ефективність, погіршується симптоматика, формуються пульсуючий ритм дофамінергічної стимуляції та передумови розвитку моторних ускладнень у пацієнтів. Оптимальним та перспективним для підвищення прихильності хворих та потенційної ефективності терапії вважається призначення протипаркінсонічного препарату один раз на добу. Варіантом вибору, за словами доповідачки, може бути застосування праміпексолу XR.
У межах рандомізованого подвійного сліпого плацебо-контрольованого дослідження O. Rascol et al. (2009) детально вивчали ефективність, безпеку та переносимість одномоментного переведення пацієнтів із праміпексолу швидкого вивільнення (IR) на праміпексол пролонгованої дії (XR). Встановлено, що більшість (85%) хворих можуть перейти із праміпексолу IR на праміпексол XR в однаковій добовій дозі без необхідності адаптації (співвідношення 1:1 мг).
Етапи титрування праміпексолу, згідно із затвердженими настановами, представлені в таблиці 1.
Ефективність праміпексолу XR було прицільно вивчено у низці досліджень:
1. Застосування праміпексолу XR на ранніх стадіях ХП. У межах 33-тижневого багатоцентрового подвійного сліпого рандомізованого дослідження у 523 пацієнтів із ранньою стадією ХП, які раніше не отримували леводопу або АДР, порівнювали ефективність праміпексолу XR, IR та плацебо. Вже на 4-му тижні лікування пролонгованою формою праміпексолу достовірно зменшилися прояви моторних симптомів та покращилися показники щоденної активності (Hauser et al., 2009).
2. Застосування праміпексолу XR на пізніх стадіях ХП. Порівняння ефективності праміпексолу XR, IR та плацебо також виконували у дослідженні за участю 507 пацієнтів із пізньою стадією ХП та флуктуаціями, які приймали леводопу. На тлі приймання праміпексолу XR на 4-му тижні достовірно зменшилися прояви моторних симптомів та поліпшилися показники щоденної активності (Schapira et al., 2011).
3. Порівняння праміпексолу пролонгованої дії та швидкого вивільнення. Суб’єктивна оцінка впливу праміпексолу XR та IR, надана пацієнтами, свідчить про переваги праміпексолу XR (Hauser et al., 2009). Даний результат може бути зумовлений зручністю застосування таблетованої форми препарату один раз на добу, що звільняє хворого від постійного відстеження часових інтервалів.
Окрім того, перевагою праміпексолу XR є забезпечення безперервного постачання дофаміну протягом доби після приймання одноразової дози. Це радикально відрізняє праміпексол пролонгованої дії від препарату негайного вивільнення, який потребує застосування тричі на добу і тим самим створює три нефізіологічні піки концентрації дофаміну (Antonioni et al., 2011).
4. Застосування праміпексолу XR при треморі на ранніх та пізніх стадіях ХП. У межах 12-тижневого багатоцентрового подвійного сліпого рандомізованого плацебо-контрольованого дослідження вивчали клінічну ефективність праміпексолу у 84 пацієнтів із ХП (рання/пізня стадія) та резистентним тремором. Було достовірно встановлено сприятливий вплив праміпексолу на тремор при ХП (Pogarell et al., 2002).
5. Застосування праміпексолу XR при депресії на тлі ХП. Депресивні симптоми виявляються приблизно у 50% пацієнтів із ХП. Вони є одним з основних факторів, що погіршують якість життя пацієнтів та можуть бути причиною суб’єктивної неефективності протипаркінсонічних засобів. У низці досліджень показано позитивний вплив праміпексолу на прояви депресії (Левін, 2008).
Додавання праміпексолу до леводопи суттєво знижує частоту депресії та ангедонії в осіб із ХП (Lemke et al., 2014). Праміпексол зменшує середню виразність депресивної симптоматики у хворих на ХП на рівні антидепресанту сертраліну (Barone et al., 2012).
Підсумовуючи, І.М. Карабань зазначила, що праміпексол пролонгованої форми є варіантом вибору для лікування ХП на ранніх стадіях, для корекції моторних порушень у вигляді екстрапірамідного тремору, леводопа-асоційованих пізніх дискінезій та депресії. Одноразове приймання препарату суттєво підвищує комплаєнс, що зумовлює значно більші шанси на ефективну допомогу пацієнту.
Нейрокогнітивні порушення: від механізмів розвитку до клінічної практики
 Завідувач кафедри клінічної неврології, психіатрії та медичної психології Харківського національного університету імені В.Н. Каразіна, д. мед. н., професор, заслужений діяч науки й техніки України Тамара Сергіївна Міщенко розглянула проблему деменції, на яку нині страждають 47,5 млн осіб у світі. Додатково щорічно реєструється 7,7 млн нових випадків, тому до 2030 р. поширеність деменції, за прогнозами, становитиме 75,6 млн, із них 70% у країнах з низьким та середнім рівнем доходів. На жаль, деменція є причиною 11,2% років, що прожиті з обмеженою функціональною спроможністю. Цей показник перевищує такі для інсульту (9,5%), захворювань опорно-рухового апарату (8,9%), серцево-судинних захворювань (5%) і раку (2,4%) (Ferri et al., 2005; Wimo et al., 2007).
Завідувач кафедри клінічної неврології, психіатрії та медичної психології Харківського національного університету імені В.Н. Каразіна, д. мед. н., професор, заслужений діяч науки й техніки України Тамара Сергіївна Міщенко розглянула проблему деменції, на яку нині страждають 47,5 млн осіб у світі. Додатково щорічно реєструється 7,7 млн нових випадків, тому до 2030 р. поширеність деменції, за прогнозами, становитиме 75,6 млн, із них 70% у країнах з низьким та середнім рівнем доходів. На жаль, деменція є причиною 11,2% років, що прожиті з обмеженою функціональною спроможністю. Цей показник перевищує такі для інсульту (9,5%), захворювань опорно-рухового апарату (8,9%), серцево-судинних захворювань (5%) і раку (2,4%) (Ferri et al., 2005; Wimo et al., 2007).
Патогенетична модель деменції залежить від етіологічного фактора (на відміну від судинної деменції), зокрема при хворобі Альцгеймера (ХА):
- На початкових етапах виявляється зменшення числа Н-холінорецепторів, кількості ацетилхоліну та нейротрофічних факторів.
- На більш пізніх стадіях має місце апоптоз холінергічних нейронів, активізується псевдохолінестераза (Ferstl et al., 2012).
- У кінцевому підсумку – «аномальний» аполіпопротеїн Е не виводить β-амілоїд, у речовині головного мозку (особливо лімбічній системі) накопичуються амілоїдні бляшки, що спричиняють перевантаження та загибель нейрона (Stahl, 2005).
Утім деменція є кінцевим наслідком цілого спектра патогенетичних механізмів, що здатні до комбінації та взаємного доповнення.
Діагностика нейрокогнітивних порушень включає клінічні, інструментальні, нейровізуалізаційні (визначення регіонального метаболізму глюкози мозку, позитронна емісійна томографія з 18F-фтордезоксиглюкозою), а також психодіагностичні дослідження. До останніх відносять: коротку шкалу оцінки психічного статусу (MMSE), монреальську шкалу оцінки когнітивних функцій (MoCА-тест), тест малювання годинника, тест для визначення деменції Mini-Cog тощо.
На думку Т.С. Міщенко, кожен лікар, який працює із хворим на деменцію, має керуватися основними постулатами терапії. Це усунення «зворотних» когнітивних розладів (корекція метаболічних порушень, терапія депресії), корекція факторів ризику ішемічних подій (артеріальної гіпертензії, кардіальної патології, гіперліпідемії, гіперкоагуляції), вплив на нейротрансмітерну функцію (дофамін-, ацетилхолін- та глутаматергічну), застосування нейропротекторів (антиоксиданти, нейротрофічні фактори).
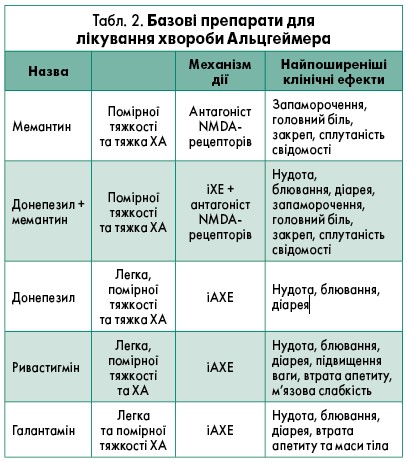 Розподіл фармакологічних засобів (табл. 2) для лікування нейрокогнітивних порушень залежить від клінічної репрезентації (FDA, 2018):
Розподіл фармакологічних засобів (табл. 2) для лікування нейрокогнітивних порушень залежить від клінічної репрезентації (FDA, 2018):
- лікування малих нейрокогнітивних порушень: засоби метаболічної (пірацетам, актовегін, церебролізин, L-карнітин), вазоактивної дії (цинаризин, вінпоцетин, вінкамін, пентоксифлін, екстракт гінкго білоба);
- терапія великих нейрокогнітивних порушень (деменція) передбачає призначення засобів нейромедіаторної дії, як-от інгібітори ацетилхолінестерази (донепезил, ривастигмін, галантамін), антагоністи рецепторів N-метил-D-аспартату (NMDA) (мемантин); дофамінергічні й норадренергічні препарати (пірибедил, ніцерголін), холіну альфосцерат, цитиколін.
Можливими небажаними явищами при застосуванні інгібіторів ацетилхолінестерази (іАХЕ) є: ризик шлунково-кишкової кровотечі, особливо у пацієнтів з виразковою хворобою або у тих, хто приймає протизапальні препарати; брадикардія чи блокада серця у хворих з/без серцевої недостатності; загострення астми або іншого захворювання легень; обструкція відтоку сечі. Саме тому, відповідно до Уніфікованого протоколу медичної допомоги при деменції МОЗ України 2016 р., перевага надається препаратам на основі діючої речовини мемантину (табл. 3).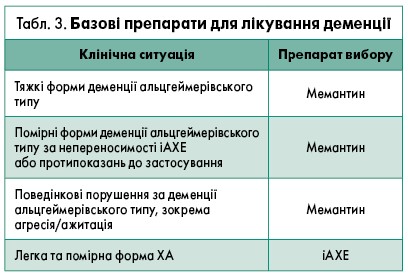
У 2003 р. Управління з контролю за харчовими продуктами та лікарськими засобами США (FDA) схвалило використання мемантину для корекції когнітивних розладів, адже було достовірно доведено, що мемантин сприяє збільшенню повсякденної активності (Winblad et al., 1999).
Для лікування деменції альцгеймерівського типу від легкої до тяжкої стадії мемантин потрібно приймати один раз на добу щодня в однаковий час: у 1-й, 2-й, 3-й та 4-й тиждень – у дозі 5, 10, 15 і 20 мг відповідно. Слід зазначити, що для досягнення терапевтичного ефекту тривалість застосування мемантину має бути прологнована в індивідуалізованому форматі.
Доповідачка закликала лікарів до поширення парадигми додаткових засобів підвищення когнітивного резерву за рахунок: когнітивних тренінгів, розвитку соціальних зав’язків, зниження рівня депресії, виконання розумових і фізичних вправ, тренування утримання балансу і запобігання падінню, арома-, музико-, арт-терапії, масажних технік, психотерапії (Lvingston et al., 2017).
Сучасна концепція «антивікової стратегії» підтримки когнітивного здоров’я передбачає доцільність використання декількох ключових рекомендацій:
- підтримання фізичної та соціальної активності;
- підтримання інтелектуального функціонування;
- лікування та профілактика серцево-судинних та цереброваскулярних захворювань;
- контроль факторів ризику;
- дотримання режиму сну і корекція його порушень;
- контроль психотичних порушень, пов’язаних із деменцією;
- зниження рівня шуму.
Насамкінець професор підкреслила, що психосоціальні фактори, а саме високий рівень освіти і соціально-економічний статус, висока складність роботи, насичена соціальна активність та діяльність, яка стимулює мислення, є основою довготривалого якісного функціонування головного мозку (Winblad et al., 2016).
Підготувала Маргарита Марчук
UA-PRAM-PUB-122020-021
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 4 (55) 2020 р.



