10 квітня, 2021
Двоїння в очах: важливі «дрібниці»
 Дослідження основних нейроофтальмологічних феноменів та адекватне оцінювання їх значення, вміння зіставляти зі станом неврологічного й загальносоматичного статусу важливі не тільки для лікарів-офтальмологів. Клініцистам-неврологам майже щодня доводиться мати справу з пацієнтами, в яких при огляді виявляються різні окуломоторні розлади, що є симптомами багатьох неврологічних захворювань. Одним із таких розладів є диплопія. Свої міркування щодо значення цього симптому при оцінці неврологічного стану пацієнта висловив у межах наукового онлайн-заходу «Міжнародна конференція з доказової неврології» (16 грудня, 2020 року) завідувач кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету, д. мед. н., професор Михайло Михайлович Орос.
Дослідження основних нейроофтальмологічних феноменів та адекватне оцінювання їх значення, вміння зіставляти зі станом неврологічного й загальносоматичного статусу важливі не тільки для лікарів-офтальмологів. Клініцистам-неврологам майже щодня доводиться мати справу з пацієнтами, в яких при огляді виявляються різні окуломоторні розлади, що є симптомами багатьох неврологічних захворювань. Одним із таких розладів є диплопія. Свої міркування щодо значення цього симптому при оцінці неврологічного стану пацієнта висловив у межах наукового онлайн-заходу «Міжнародна конференція з доказової неврології» (16 грудня, 2020 року) завідувач кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету, д. мед. н., професор Михайло Михайлович Орос.
Диплопія та окорухові порушення
Клінічно значущі окорухові порушення можуть бути легко виявлені досвідченим неврологом під час огляду. Зазвичай спочатку оцінюють положення голови, оскільки існує окуломоторний стан, що призводить до її вимушеного нахилу. Далі оцінюють положення та відхилення очних яблук, проводять тест почергового прикривання очей долонею. Вертикальна дивергенція або вертикальна косоокість зазвичай вказує на ураження ЦНС, коса девіація є складовою реакції очей на нахил.
Далі досліджують саккади – швидкі, суворо узгоджені рухи очей, що відбуваються одночасно в одному напрямку. Вони допомагають розглядати деталі візуального світу. При виконанні тесту саккад очі пацієнта повинні стежити за ціллю, створюваною генератором візуальних або звукових стимулів. Пацієнт має спробувати зафіксувати на ній погляд, а потім переводити його на наступну позицію швидкими рухами очей (саккадами). Оцінюють ініціацію, швидкість та обсяг саккадуючих рухів очних яблук. У нормі саккади мають складатися з одного швидкого руху, який дозволяє точно зафіксувати погляд на новій цілі.
При перевірці вертикального плавного стеження необхідно піднімати й утримувати повіки пацієнта, щоб бачити очі при погляді донизу. При цьому відзначають, чи є стеження дійсно плавним або саккадуючим, фіксують обмеження рухів очних яблук і відсутність або наявність диплопії.
Диплопія (двоїння в очах) – порушення зору, при якому об’єкт сприймається як подвоєний. Серед причин диплопії зустрічаються:
- ураження над’ядерних та внутрішньоядерних структур;
- пошкодження окорухових нервів;
- ураження нервово-м’язових з’єднань;
- слабкість навколоочних м’язів.
Зокрема, відмітною особливістю над’ядерного паралічу є порушення плавного стеження за предметом, збереження нормальних вестибулоокулярних рефлексів, спрямування голови для полегшення саккади, супутні ознаки для порушення стовбура мозку. Над’ядерний параліч локалізується у мозочку, півкулі головного мозку, стовбурі мозку. Над’ядерна диплопія характеризується беземоційним обличчям, різким зниженням частоти кліпання, напруженням м’язів лоба.
При паралічі погляду варто враховувати такі основні правила:
- кортикальні та субкортикальні ураження – погляд спрямований у протилежний від геміпарезу бік;
- ураження мосту – погляд спрямований у бік геміпарезу;
- ураження середнього мозку – вертикальний параліч погляду.
У разі порушення погляду при ураженні стовбура мозку саккадичні рухи страждають більше, ніж плавний рух погляду. Отже, зазначені випадки потребують уважного обстеження.
На підставі порушення або відсутності вестибулоокулярного рефлексу можна зробити припущення, яка саме частина мозку зазнала ураження.
Плавне стеження очима за об’єктом – повільний рух очей зі швидкістю 50° за секунду – нормальні саккадичні рухи у вертикальній площині. Натомість при над’ядерному паралічі відбуваються обмеження периметра та збільшення швидкості руху, наприклад обмеження погляду вгору і так званий конвергентно-ретракційний ністагм (утворюються горизонтальні саккади). Основними причинами, що зумовлюють його виникнення, є інсульт, пухлина епіфіза або крововилив, гідроцефалія.
Синдром дорзальної частини середнього мозку – це параліч погляду вгору, дисоціація між освітленістю та реакцією зіниць, рефракція повіки, ретракційно-конвергентні саккади. При ураженні середнього мозку можуть мати місце між’ядерна офтальмоплегія, іпсілатеральне порушення аддукції, затримка приведення, ністагм при відведенні ока. Це відбувається через те, що середній мозок та міст контролюють два основних нерви – третій та шостий відповідно. При ураженні моста може виникати іпсілатеральний горизонтальний параліч погляду, коли пацієнт не може дивитися в бік ураження.
Клінічний випадок
Пацієнт Ю., 56 років. Скарги на двоїння в очах при погляді вперед та вправо.
Анамнез життя. Спадковий та алергологічний анамнез неускладнений, страждає на гіпертонічну хворобу з 50 років.
Анамнез хвороби. Зі слів пацієнта, захворів раптово три дні тому, «думав, що минеться, але не пройшло».
Неврологічний статус. Обмеження погляду правого ока праворуч, дискон’югований горизонтальний ністагм ліворуч.
Діагноз. Гостре порушення мозкового кровообігу за ішемічним типом у вертебробазилярному басейні.
Лікування. Ацетилсаліцилова кислота в дозі 100 мг/добу, цитиколін по 1000 мг/добу.
Терапія тривала один місяць, після чого скарг на двоїння не було.
Цитиколін та нейровідновлення
Цитиколін (цитидин‑5-дифосфохолін, ЦДФ-холін) є важливим проміжним продуктом у шляху біосинтезу структурних фосфоліпідів клітинних мембран, особливо фосфатидилхоліну. Він є донором холіну, що необхідний для синтезу нейротрансмітера ацетилхоліну, стимуляції активності тирозингідроксилази і вивільнення дофаміну (Adibhatla et al., 2002). Отже, за своєю структурою цитиколін сприяє відновленню нейрональних мембран, активізує саме холінергічну передачу та відіграє роль донору холіну для нейронів (Secades, 2016).
Окрім того, цитиколін активує біосинтез структурних фосфоліпідів нейрональних мембран, підвищує інтенсивність метаболізму мозку і впливає на рівні різних нейротрансмітерів. Експериментально було показано, що препарат збільшує вміст норадреналіну і дофаміну в ЦНС. Завдяки зазначеним фармакологічним механізмам, цитиколін (Secades, Lorenzo, 2006):
- чинить нейропротекторну дію при гіпоксичних й ішемічних станах, зменшуючи обсяг ішемічного ураження;
- поліпшує здатність до навчання та пам’ять у моделях старіння мозку на тваринах.
Цитиколін має значний нейрорепаративний потенціал, який може пояснити його довготривалі позитивні ефекти у постінсультних пацієнтів. У доклінічних та клінічних дослідженнях встановлено, що терапія цитиколіном сприяє збільшенню кількості нейрональних синаптичних шипиків (мембранних виростів на поверхні дендриту, які здатні утворювати синаптичні з’єднання) із відповідним поліпшенням рухового й функціонального відновлення (Alvarez-Sabin, 2013).
До того ж терапія цитиколіном асоційована зі зростанням кількості циркулювальних ендотеліальних клітин-попередників (EPCs) протягом першого тижня після інсульту. EPCs допомагають відновлювати капіляри та судини у зоні ішемії, сприяють вивільненню фактора росту й підвищенню нейрогенезу, що корелює із кращим функціональним та неврологічним відновленням.
Цитиколін впливає на основні механізми, що беруть участь у пластичності мозку: він підсилює процеси гальмування апоптозу, а також ангіогенез, нейрогенез, гліагенез, синаптогенез та модуляцію нейротрансмітерів. Усі зазначені ефекти схожі на процеси, що індукуються стовбуровими клітинами.
Таким чином, цитиколіну притаманна нейромодулювальна та нейропластична дія, що сприяє відновленню мозку як у гостру фазу інсульту, так і на пізніших етапах.
Терапія пацієнтів із диплопією та когнітивними порушеннями
Важливим аспектом лікування є комбінація нейромодуляторних ефектів цитиколіну (препарату Цераксон®, виробник «Феррер Інтернаціональ, С.А.», Іспанія) з нейропротекторною дією лікарського засобу Актовегін (виробник «Такеда Австрія ГмбХ», Австрія), особливо у випадках, коли хворі скаржаться на когнітивні порушення внаслідок інсульту. Зокрема, пацієнти із центральним двоїнням часто мають загальмоване обличчя, нахмурений лоб, схильні до плаксивості тощо.
На клітинному рівні Актовегін чинить метаболічні та нейропротекторні ефекти. Препарат покращує утилізацію глюкози, поглинання та утилізацію кисню, а також підсилює енергетичний метаболізм, що сприяє поліпшенню виживання клітин в умовах гіпоксії.
До того ж Актовегін впливає на структуру β-амілоїдних пептидів (Aβ 25‑35), взаємодіє з ядерним фактором NF-κB та ферментом полі(АДФ-рибоза)-полімеразою, регулюючи генні механізми та дозозалежно знижуючи інтенсивність апоптозу нейронів (Machicao et al., 2012).
Своєю чергою Цераксон® зумовлює нейропротекторні та нейрорепаративні ефекти. Зокрема, він стабілізує клітинні мембрани, що сприяє зменшенню вивільнення жирних кислот та продукції вільних радикалів, а також збереженню запасу енергії нейронів і пригніченню апоптозу. Крім того, препарат стимулює біосинтез структурних фосфоліпідів мембран нейронів, завдяки чому поліпшує роботу іонообмінних насосів та рецепторів (Grieb, 2014).
У рандомізованих клінічних дослідженнях продемонстровано ефективність Цераксону та Актовегіну в пацієнтів із когнітивно-емоційними розладами судинного ґенезу (Farooq et al., 2017).
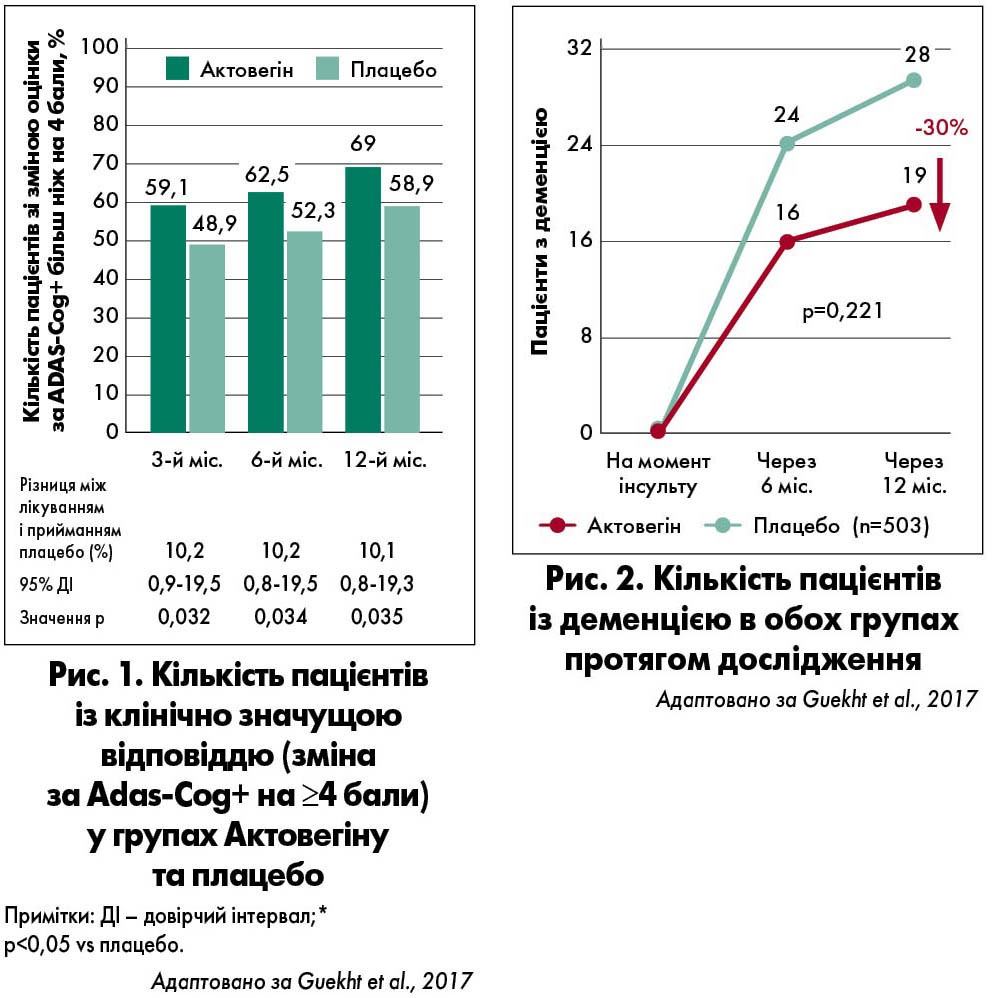
У межах 12-місячного рандомізованого подвійного сліпого плацебо-контрольованого дослідження ARTEMIDA ефект препарату Актовегін у пацієнтів із постінсультними когнітивними порушеннями порівнювали із впливом плацебо (Guekht et al., 2017). У період від 5-го до 7-го дня після виникнення ішемічного інсульту для отримання терапії Актовегіном були рандомізовані 250 хворих, для застосування плацебо – 253. Відповідно до дизайну дослідження, 6-місячний період лікування включав ≤20 інфузій (2000 мг щоденно) з подальшим прийманням препарату в формі таблеток (2 таблетки по 200 мг тричі на добу). Далі протягом 6-місячного спостереження ведення пацієнтів здійснювали відповідно до стандартної клінічної практики.
На 6-му та 12-му місяцях у хворих, які отримували препарат Актовегін, відзначали статистично значущі зміни показників за шкалою оцінки тяжкості хвороби Альцгеймера, розширеною версією когнітивної підшкали (ADAS-cog+) та монреальською шкалою оцінки когнітивних функцій (MoCA) порівняно з пацієнтами групи плацебо.
На 3, 6 та 12-му місяцях у більшої частки осіб, що отримували Актовегін, спостерігалася клінічно значуща відповідь на лікування за показниками ADAS-cog+ (рис. 1). Частота небажаних явищ була подібною в обох групах лікування.
Загалом у пацієнтів після інсульту при застосуванні Актовегіну протягом шести місяців було відзначено тенденцію щодо зниження частоти розвитку деменції на 30% порівняно із плацебо. При цьому позитивний ефект зберігався навіть після припинення приймання препарату (загальний термін спостереження – 6 місяців) (рис. 2).
Таким чином, ефекти Актовегіну, пов’язані з його мультимодальною дією, можуть стати довгоочікуваним сигналом щодо можливого хворобомодифікувального потенціалу препарату, який необхідно вивчати у подальших клінічних дослідженнях.
Підготувала Олександра Демецька
За сприяння ТОВ «Такеда Україна» C-APROM/UA/AVG/0407
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 1 (56) 2021 р.