19 липня, 2021
Перспективи застосування едаравону в клінічній практиці: нові можливості в лікуванні нейродегенеративних, гіпоксичних і запальних патологій
Є досить багато захворювань, у патогенезі яких важливу роль відіграють процеси вільнорадикального окислення, тому в їх лікуванні активно вивчається можливість застосування антиоксидантів, котрі здатні швидко нейтралізовувати вільні радикали, гальмувати перекисне окиснення ліпідів, захищаючи клітини від руйнування, активувати ферменти антиоксидантного захисту. Зазначеним вимогам відповідає едаравон, доказова база якого буде представлена в цьому огляді.
БАС (або хвороба Лу Геріга) – це прогресуюче невиліковне фатальне НДЗ із втратою контролю над м’язами через ураження нейронів головного та спинного мозку. Вперше БАС діагностовано в 1824 р. у пацієнта на ім’я Чарльз Белл, але відомішою хвороба стала після смерті бейсболіста Лу Геріга. В минулому БАС вважався винятково дегенерацією рухових нейронів головного та спинного мозку, що зумовлює параліч і смерть від дихальної недостатності й ускладнення, пов’язані з нерухливістю. Однак, за сучасним визначенням, – це мультисистемне НДЗ зі специфічними клінічними, невропатологічними та генетичними змінами.
Причина БАС невідома, але декілька досліджень вказують на роль мутацій у генах C9orf72 або супероксиддисмутази 1 (СOД1). Найвагомішими є мутації СОД1 – цитозольного ферменту, що усуває надлишок вільних радикалів, перетворюючи їх на O2 і H2O2. За наявності мутацій гена СOД1 накопичується у вигляді глибок у мітохондріях, що спричиняє дисфункцію та загибель нейронів. З’являється все більше доказів щодо впливу зовнішніх факторів, зокрема пестицидів, гербіцидів, важких металів (свинець, кадмій, залізо, ртуть, селен). Важкі метали зменшують клітинний уміст тіолвмісних антиоксидантів і ферментів, збільшуючи тим самим окисний стрес усередині клітин. Дослідження, проведене в США, продемонструвало, що травма голови, електромагнітні поля та деякі професії, пов’язані з механікою, будівництвом і фарбами, підвищують ризик БАС (Andrew A. et al., 2020).
Типовою ознакою БАС вважають дисфункцію рухових нейронів головного та спинного мозку внаслідок окисного стресу, тобто хвороба з’являється через дисбаланс між сприятливими та несприятливими ефектами активних форм кисню. За неконтрольованого окисного стресу шкідливі впливи суттєво переважають, порушується гомеостаз вільних радикалів, що спричиняє ушкодження ліпідів і ДНК.
Невропатологічною ознакою БАС є дегенерація рухового нейрона та втрата аксонів у спинному мозку.
Однією з характерних лабораторних ознак вважають збільшення концентрації 3-нітротирозину (3-NT), специфічного маркера окисного стресу, пов’язаного з дегенерацією нейронів. Цей показник доцільно визначати на початку хвороби та проводити його подальший моніторинг.
Для діагностики БАС запропоновано критерії Ель Ескоріаль (Brooks B. et al., 2000):
- клінічні докази погіршення стану нижніх рухових нейронів у спинному мозку та стовбурі мозку;
- клінічні докази погіршення стану верхніх рухових нейронів у головному мозку;
- постійне поширення симптомів у межах ураженої ділянки та на інші ділянки без ознак інших процесів на підставі результатів електрофізіологічних, патологічних і нейровізуалізаційних досліджень.
Більшість хворих на БАС помирають упродовж 2-5 років після встановлення діагнозу. Симптоматична терапія залишається основним напрямом лікування, оскільки усунення симптомів впливає на рівень виживання та якість життя. Основними причинами смерті є порушення функції дихання та неможливість харчування. Суттєво покращує якість життя лікування в спеціалізованих центрах із застосуванням неінвазивної вентиляції легень. Іншим важливим аспектом є забезпечення достатньої кількості калорій та рідини, що досягається накладанням гастростоми, адже гіпотрофія має центральну роль у прогресуванні хвороби. Крім зазначених симптомів, можуть з’являтися багато додаткових, що спричиняють страждання в пацієнтів і потребують певних впливів.
Нещодавно з’явився ще один засіб для патогенетичної терапії БАС – едаравон (поглинач вільних радикалів, що зменшує окисний стрес і захищає нервові клітини від дегенерації). Уперше його почали застосовувати в Японії, де він отримав офіційне схвалення у 2015 році, а в 2017 році його затверджено для лікування БАС у США. На сьогодні едаравон зареєстрований для лікування БАС у Канаді, Італії, Південній Кореї та Україні. Порівняння рилузолу й едаравону наведено в таблиці 1.
Спосіб застосування та механізм дії едаравону
Едаравон – прозора, безбарвна чи жовтуватого кольору рідина для внутрішньовенного введення (в/в). Рекомендована добова доза при БАС – 60 мг; вводиться шляхом інфузії тривалістю 60 хв упродовж 14 днів, після чого потрібна 14-денна перерва у введенні препарату (Cruz M. P., 2018).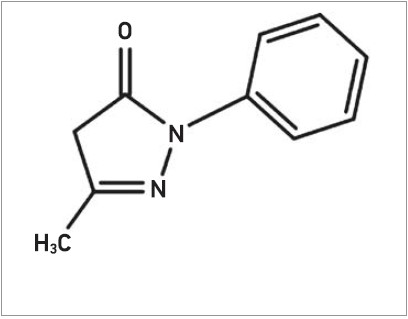
Едаравон має властивості слабкої кислоти з константою дисоціації 7,0 рКа. Кетоенольна таутомерія забезпечує здатність поглинати вільні радикали. Серед багатьох видів активних форм кисню цілеспрямовано взаємодіє з пероксильними радикалами, поглинає як жиро-, так і водорозчинні радикали, передаючи радикалу електрон.
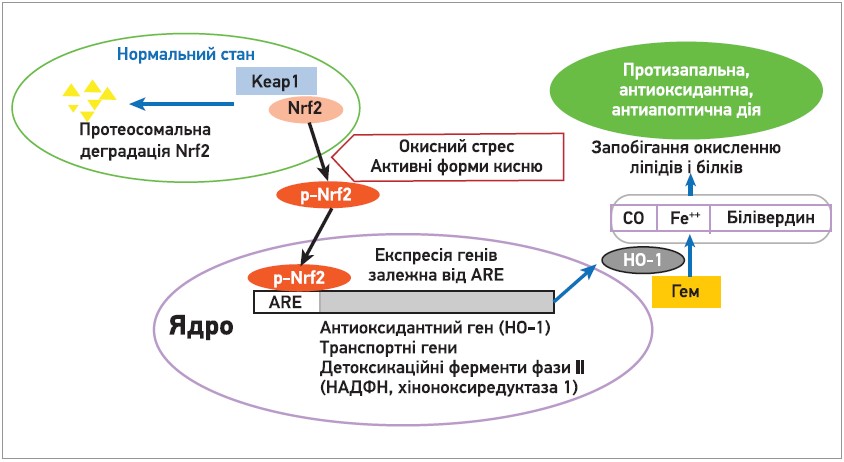
Сучасні докази вказують на роль окисного стресу в патогенезі багатьох НДЗ (включно з БАС). Активні форми кисню (ROS) виробляються клітинними ферментами, які ушкоджують компоненти клітин і посилюють запалення. Надлишок ROS спричиняє окиснення ліпопротеїдів низької щільності та дисфункцію ендотелію, що має важливу роль у патогенезі серцево-судинних захворювань. Основну роль у захисті від окисного стресу має сигнальний шлях Nrf2/ARE/HO‑1 (рис.).
Рис. Роль сигнального шляху Nrf2/ARE/HO‑1 в окисному стресі
У нормі Nrf2 зв’язується з білком Keap1 (Kelch-like ECH-associated protein‑1) і зазнає протеасомальної деградації. В умовах окисного стресу ROS інактивують Keap1, що зумовлює фосфорилювання Nrf2. Фосфорильований Nrf2 (p‑Nrf2) рухається до ядра, де зв’язується з елементом антиоксидантної відповіді (ARE). Отже, активуються численні гени – транспортні молекули, антиоксиданти та детоксикаційні ферменти, що спричиняє апрегуляцію важливого ендогенного антиоксиданта гемоксигенази‑1 (HO‑1). Активована HO‑1 метаболізує гем до основних метаболітів – Fe2+, CO та білівердину. Разом з HO‑1 ці метаболіти запобігають окисленню білків і ліпідних аніонів, поглинаючи супероксид, вільні гідроксильні радикали та синглетний кисень, а також мають важливу роль в антиоксидантних, антиапоптичних і протизапальних процесах.
Декілька досліджень вказують, що захисний антиоксидантний ефект едаравону обумовлений активацією саме цього сигнального шляху. Активація Nrf2 зменшує когнітивні ушкодження та має антиапоптичний вплив (Liu J. et al., 2019; Pan Y. et al., 2020). На тваринній моделі епілепсії продемонстровано, що нейропротекторна дія едаравону в гіпокампі реалізується через сигнальний шлях Nrf2/HO‑1; на молекулярному рівні препарат зменшує рівень мРНК та експресію білків Nrf2 і HO‑1, а також знижує рівень прозапальних цитокінів, експресію NF-κB (P65), запального білка в гіпокампі (Liu Z. et al., 2018), що свідчить про його протизапальні властивості.
За даними Yamamoto та співавт. (2020), швидкість поглинання пероксильних радикалів під впливом едаравону зростає за вищого рН. Порівняння швидкості поглинання радикалів під впливом едаравону й інших сполук продемонструвало, що едаравон мав найбільший поглинальний потенціал (Watanabe K. et al., 2018).
Отже, едаравон чинить цито- та нейропротекторний ефекти, що забезпечує захист нейронів головного і спинного мозку в умовах окисного стресу, усуваючи ROS – гідроксильний та пероксильний радикали, перекис водню, пероксинітрит тощо, які прискорюють й посилюють прогресію нейрональної дегенерації. Саме цей механізм має ключову захисну роль при неврологічному ушкодженні, що зумовлює загибель рухових нейронів. Нейропротекторний вплив едаравону обумовлений здатністю знешкоджувати вільні радикали, а також антиоксидантною та протизапальною дією в умовах окисного стресу. Завдяки антиапоптотичному механізму внаслідок зменшення Fas-асоційованого домену смерті (FADD) він затримує дегенерацію моторних нейронів, подовжуючи виживання пацієнтів і демонструючи значне поліпшення показників шкали ALSFRS-R. Протизапальна й антиоксидантна активність стимулюються еритроїдним фактором‑2, пов’язаним з ядерним фактором транскрипції‑2, який захищає клітини від індукованого окисним стресом ушкодження через антиоксидантні й детоксикаційні ферменти.
Клінічні випробування ефективності та безпеки едаравону при БАС наведено в таблиці 2. Проведено 4 рандомізовані дослідження, під час яких вивчали безпеку й ефективність едаравону. 3 із цих випробувань були подвійно сліпими в паралельних групах і проводилися в Японії; перше клінічне випробування MCI186-16 проводилося з 2006 по 2008 рр.
Вивчення впливу едаравону при БАС на тваринній моделі продемонструвало значне сповільнення зниження сили стискання і маси м’язів та пригнічення дегенерації рухових нейронів спинного мозку (Ikeda K. et al., 2015).
Проведено декілька клінічних випробувань II-III фаз щодо безпеки й ефективності препарату. Результат дослідження II фази продемонстрував значне зниження бала за шкалою ALSFRS-R упродовж 6 міс лікування при застосуванні 60 мг едаравону порівняно з результатами до лікування (Watanabe K. et al., 2018). Рандомізоване подвійне сліпе дослідження III фази з вивчення безпеки й ефективності едаравону в добовій дозі 60 мг в/в упродовж 2 тиж щомісяця на ранніх стадіях БАС також продемонструвало зниження бала шкали ALSFRS-R у групі едаравону порівняно із групою плацебо (Trial C., 2017). У подальшому проведено додаткове дослідження з post-hoc аналізом. Пацієнтів розподілено на 2 підгрупи: субпопуляція очікуваної ефективності (EESP) та точна/ймовірна EESP за 2 роки (dpEESP2y). До субпопуляції EESP віднесено пацієнтів із сумою балів ≥2 за шкалою ALSFRS-R і ≥80% від належної форсованої життєвої ємності легень (ФЖЄЛ). До популяції dpEESP2y віднесено осіб зі встановленим або ймовірним БАС тривалістю ≤2 років. Аналіз включав 181 учасника та 12 циклів лікування. Виявлено, що найбільша різниця за шкалою ASLFRS-R спостерігалася в групі dpEESP2y та між едаравоном і плацебо. Незважаючи на певні обмеження цього дослідження (невелика чисельність груп), усі аналізи post-hoc вказували на переваги едаравону над плацебо та підтвердили його ефективність й безпеку (Takahashi F. et al., 2017).
Під час відкритого випробування III фази вивчали довгострокову ефективність едаравону; було залучено 123 хворих з БАС (65 приймали едаравон упродовж 48 тиж, 58 – плацебо впродовж 24 тиж з подальшим переходом на едаравон упродовж 24 тиж). Установлено, що едаравон є корисним навіть після прийому плацебо впродовж 6 міс; підтримка ефективності спостерігалася впродовж 1 року. Дослідники висловлюють потребу проведення подальших досліджень для кращого вивчення ефективності тривалого введення едаравону (Shefner et al., 2020).
Невелике ретроспективне відкрите дослідження, проведене в Кореї, продемонструвало помірне зниження показника ALSFRS-R без жодної значної побічної події. Зазначено суттєве сповільнення зниження показника ALSFRS-R незалежно від статі, місця ураження та етнічної приналежності. Наголошено на важливості раннього призначення едаравону пацієнтам з показниками ФЖЄЛ ≥60%, що забезпечує більшу ефективність (Park J-M. et al., 2020).
Побічна дія та моніторинг
Дослідження 2017 р. вказує на часті побічні явища (>10%) за терапії едаравоном: синці, закреп, контактний дерматит, дисфагія, екзема та головний біль. Однак, за даними J-M. Park і співавт. (2020), вони зазвичай легкі та добре переносяться більшістю пацієнтів. Серйозні побічні явища: дисфагія, гіперчутливість, сульфітні алергічні реакції та симптоми анафілаксії. Оскільки едаравон містить бісульфіт натрію, перед його введенням важливо перевірити, чи немає у пацієнта алергії (Schultz J., 2018). Призначення едаравону протипоказане хворим із проявами гіперчутливості в анамнезі та тим, хто має алергію на сульфіти (Cruz M., 2018).
Що стосується взаємодії з іншими лікарськими засобами, то терапевтичні дози едаравону не взаємодіють з іншими метаболітами; CYP450 не пригнічує едаравон, CYP1A2, CYP2B6 та CYP3A4 не індукують едаравон, тому загалом препарат є безпечним. Безпечність його застосування в період вагітності, лактації та в дитячому віці не встановлена, але він проникає у грудне молоко, а дослідження на тваринах свідчать про можливість розвитку побічних ефектів (Cruz M., 2018).
Інші можливості використання при НДЗ
Едаравон застосовують при хворобі Паркінсона (ХП). Як відомо, це друге за частотою НДЗ, що характеризується тремором, ригідністю, нестабільністю пози та координації. Точна етіологія хвороби невідома, але є певні докази щодо надмірного утворення ROS, значної втрати дофамінових нейронів і ушкодження нервів унаслідок вичерпання запасів дофаміну в межах чорної субстанції. Можливі механізми утворення вільних радикалів при ХП включають зменшення феритину, накопичення заліза, дефіцит глутатіону, перекисне окислення ліпідів і порушення функції клітинного дихання. Деякі з цих механізмів відіграють роль у патогенезі БАС. Отже, окисний стрес і мітохондріальна дисфункція мають важливу роль у патогенезі ХП. Дослідження, проведене W. Yuan і співавт., демонструє, що едаравон має нейропротекторний вплив на дофамінові нейрони, пригнічуючи надмірне утворення ротенон-індукованих ROS у мозку, а також є поглиначем вільних радикалів з антиапоптотичним ефектом.
Іншим НДЗ, яке має спільну патофізіологію із ХП і БАС, є ХА, якій притаманне погіршення когнітивних функцій із втратою пам’яті та поведінковими розладами. Оскільки ХА також обумовлена надмірною кількістю ROS й утворенням вільних радикалів, що зумовлюють структурну та функціональну дегенерацію клітин, едаравон теж може бути ефективним у сповільненні нейродегенерації.
Ефективність едаравону при гострому ішемічному інсульті
Як поглинач вільних радикалів і нейропротектор едаравон застосовується в комплексній терапії гострого інсульту. Цікаво, що первинно ще наприкінці 80-х років ХХ століття препарат розроблявся в Японії для лікування саме цієї хвороби, а також для запобігання набряку мозку. В одному з досліджень раннє введення едаравону затримувало прогресування інфаркту та набряку в пацієнтів з тяжким інсультом в басейні сонної артерії, що дозволило зменшити рівень смертності в гострій фазі. Однак суттєвого поліпшення функціонального відновлення при цьому не спостерігалося. Отже, для покращення загальної функції рекомендовано поєднувати едаравон з антитромботичними та тромболітичними засобами (Watanabe K. et al., 2018). З 2009 р. препарат внесено до Японських настанов як рекомендацію класу В для лікування гострого ішемічного інсульту. Механізм дії препарату при ішемічному інсульті спрямований на глутаматну ексайтотоксичність і запобігання кальцієвому інфлюксу. Активація Nrf2/HO‑1 під впливом едаравону підвищує цілісність і стабільність гематоенцефалічного бар’єра (Liu J. et al., 2019). При ішемічному інсульті препарат зменшує ушкодження гематоенцефалічного бар’єра та ризик набряку мозку, діє як антиоксидант, захищаючи нейрони, а також впливає на вторинне запалення, зменшуючи міграцію нейтрофілів.
Окрім того, едаравон виявляє позитивний ефект при септичній дисфункції міокарда чи сепсисі, впливаючи на системне запалення внаслідок інфекції (He C. et al., 2018). Описана його здатність зменшувати активність мієлопероксидази, активність запалення й усувати мукозит ротової порожнини – виразкове ураження після хіміо- та променевої терапії (Nakajima N. et al., 2015).
Ефективність едаравону в профілактиці реперфузійних пошкоджень міокарда
Загибель кардіоміоцитів, спричинена масовим утворенням вільних радикалів, є основною причиною ускладнень і смерті від серцево-судинних захворювань після реперфузії міокарда. Відтак, антиоксидантний захист має бути важливим напрямом кардіопротекції в таких пацієнтів. Утім, дані багатьох клінічних досліджень, які вивчали ефективність застосування антиоксидантів при виконанні реперфузії міокарда, не продемонстрували суттєвих переваг цих засобів. Дослідники пов’язують скромні результати з незначним проникненням використовуваних антиоксидантів усередину клітин та їх швидким виведенням з організму.
З появою едаравону, який має низьку молекулярну масу та ліпофільні властивості, ситуація змінилася. Японські дослідники першими продемонстрували, що застосування едаравону перед реперфузією зменшує ризик шлуночкових тахіаритмій і порушень функції серця (Yagi H. et al., 2005). Однак тривалий час були відсутні відповідні метааналізи, котрі дозволили б зробити більш зважені висновки щодо ефективності такого лікувального підходу.
У 2015 р. група китайських дослідників провели метааналіз з оцінки впливу профілактичного прийому едаравону на стан міокарда перед виконанням аортокоронарного шунтування й екстреного лікування гострого інфаркту міокарда (Zheng C. et al., 2005). До метааналізу було включено 9 рандомізованих контрольованих досліджень, у яких оцінювали вплив застосування едаравону на рівень маркерів пошкодження міокарда (активність серцевої фракції креатинкінази (СК-МВ) і тропонін І – ТІ).
Була виявлена достовірна різниця в рівні CK-MB у плазмі крові в групі едаравону порівняно з контрольною групою протягом 6 год і 24 год після відкриття артерії (р<0,05). У 3 дослідженнях повідомлялося про вплив едаравону на CK-MB через 6 год після проведення аортокоронарного шунтування чи екстреної терапії гострого інфаркту міокарда. Об’єднаний аналіз продемонстрував, що едаравон значно знижує рівень циркулюючого CK-MB (стандартизована різниця середніх значень (SMD) -4,16; 95% ДІ від -7,43 до -0,90; р=0,01).
У 4 дослідженнях повідомлялося про вплив едаравону на рівень CK-MB через 24 год в пацієнтів, які перенесли аортокоронарне шунтування чи екстрене лікування гострого інфаркту міокарда. За даними об’єднаного аналізу було виявлено суттєве зниження рівня циркулюючого CK-MB (SMD -2,73; 95% ДІ від -4,29 до -1,16; р=0,0006).
Рівень ТІ також суттєво відрізнявся між групами через 6 год та 24 год після відкриття коронарної артерії (р<0,05). Об’єднаний аналіз продемонстрував значне зниження концентрації ТІ в групі едаравону порівняно з групою контролю через 6 год (SMD -0,30; 95% ДІ від -0,56 до -0,05; р=0,02) та через 24 год (SMD -2,19, 95%; ДІ від -3,76 дo -0,61; р=0,007). Слід зазначити, що найбільш виражене зниження рівня циркулюючого ТІ спостерігалось у разі застосування едеравону в дозі 100 мг/добу.
Таким чином, едаравон продемонстрував потенційну здатність захищати міокард від реперфузійних пошкоджень у пацієнтів із гострим інфарктом міокарда та аортокоронарним шунтуванням.
Потенційні можливості лікування COVID‑19: протидія надмірному запаленню, антиоксидантний вплив і цитопротекція
Зважаючи на небезпеку пандемії коронавірусної хвороби (COVID‑19), котра й досі не стихає, існує потреба в розробленні нових схем лікування, в тому числі в переосмисленні вже знайомих, добре вивчених препаратів і застосуванні їх у новому контексті. Причиною мультиорганного пошкодження та смерті в тяжких випадках COVID‑19 є надмірне та некероване вивільнення певних прозапальних цитокінів і хемокінів (Huang C. et al., 2020), тому зменшення цієї агресивної запальної відповіді потенційно здатне знизити смертність і пошкодження органів.
На думку S. E. Reznik і співавт. (2020), препаратом, який може протидіяти запаленню при COVID‑19, є едаравон (як у монотерапії, так і в комбінації з одним або кількома противірусними препаратами). Едаравон є ліпофільною речовиною, котра легко проникає в низку тканин організму та має значну антиоксидантну та протизапальну активність (Watanabe T. et al., 2008). Системне призначення едаравону сприяє протекторній протизапальній дії в експериментальних моделях хімічного пошкодження легень, нирок, кишечнику, підшлункової залози, мозку та печінки (Kikuchi K. et al., 2012). Едаравон також здатен знижувати вміст певних цитокінів (інтерлейкінів (ІЛ) 2, 6, 1β, фактора некрозу пухлини), хемокінів (ІЛ‑8, моноцитарного хемоатрактантного білка‑1, макрофагального запального білка‑1α тощо), печінкових ферментів, активних форм кисню (АФК) й оксиду азоту – NO (Kikuchi K. et al., 2012).
Доцільність застосування едаравону при COVID‑19 була доведена в подвійному сліпому рандомізованому плацебо-контрольованому клінічному дослідженні за участю дорослих пацієнтів із цим захворюванням, підтвердженим за допомогою полімеразної ланцюгової реакції (ПЛР), і тяжким перебігом, визначеним за критеріями G. Chen і співавт. (2020). Оптимальним режимом призначення едаравону в цьому випадку може бути введення 60 мг препарату внутрішньовенно 1 р/добу протягом 10 днів. У разі успішного застосування едаравону для зменшення мультиорганного пошкодження, кількості ускладнень і смертності при тяжких випадках COVID‑19 доцільно вивчити його ефективність при інших інфекційних захворюваннях, які супроводжуються надмірною запальною відповіддю (Reznik S. et al., 2020).
Досвід застосування препарату едаравон при COVID‑19 мають і вітчизняні лікарі. Завідувачка пульмонологічного відділення Чернівецької обласної клінічної лікарні, лікар-пульмонолог вищої кваліфікаційної категорії, доктор медичних наук, професор Світлана Вікторівна Коваленко провела дослідження за участю 60 пацієнтів (n=30 в основній групі та n=30 у групі контролю) з підтвердженим діагнозом COVID‑19, котрі захворіли на COVID‑19. Пацієнти мали приблизно однакову площу ураження легень за даними КТ (від 50 до 70% площі легеневої тканини). Як контрольні точки були обрані кількість ліжко-днів, сатурація крові, температура тіла, рівень феритину, D-димеру, С-реактивного білка, загальний клінічний аналіз крові з визначенням кількості еритроцитів, лейкоцитів, тромбоцитів, ШОЕ, лейкоцитарної формули, вмісту гемоглобіну.
Пацієнти основної групи поряд зі стандартним лікуванням (антибіотики, антикоагулянти, протизапальні препарати) отримували препарат едаравону Ксаврон (з метою впливу на так званий цитокіновий шторм), Реосорбілакт (препарат, здатний зменшувати частоту легеневих ускладнень і тривалість перебування на ШВЛ), Тіворель (комбінація L-аргініну та L-карнітину для нормалізації вмісту NO в легеневих артеріях і пригнічення медіаторів запалення).
У пацієнтів основної групи спостерігалося більш швидке та виражене зниження рівня С-реактивного білка, що свідчить про виражене пригнічення запального процесу в легенях. Зменшення вмісту D-димеру в пацієнтів основної групи також свідчило про поліпшення їхнього загального стану порівняно з учасниками контрольної групи в динаміці лікування. Як відомо, високий рівень D-димеру у хворих на COVID‑19 є прогностичним маркером тяжкого перебігу захворювання, а також збільшує ризик тромботичних ускладнень.
Терапія препаратами Ксаврон, Тіворель і Реосорбілакт сприяла більш вираженому насиченню крові киснем, супроводжувалася прискоренням нормалізації температури тіла. Загалом термін госпіталізації пацієнтів основної групи склав 13 ліжко-днів, натомість хворих контрольної групи – 15 ліжко-днів. Побічних ефектів лікування не спостерігалося.
Таким чином, застосування препаратів Ксаврон, Тіворель і Реосорбілакт у комплексному лікуванні пневмонії коронавірусної етіології дозволяє зменшити тяжкість перебігу захворювання та прискорює одужання.
У 2018 р. едаравон зареєстровано в Україні для використання при гострому ішемічному інсульті та БАС. На вітчизняному ринку він представлений препаратом Ксаврон (виробництва ТОВ «Юрія-Фарм») в ампулах по 20 мл (1,5 мг едаравону в 1 мл). Рекомендована доза при гострому ішемічному інсульті: 30 мг (1 ампула) 2 р/добу шляхом в/в інфузії упродовж 30 хв. Перед введенням уміст ампули слід розчинити в 100 мл натрію хлориду (0,9%). Рекомендовано розпочинати терапію впродовж 24 год після появи симптомів, тривалість лікування – не менше 14 днів. Рекомендована доза при БАС: 60 мг (2 ампули) необхідно розчинити в достатньому об’ємі натрію хлориду (0,9%), вводити шляхом в/в інфузії упродовж 60 хв (1 р/добу). Перший курс складає 14 днів з подальшою перервою впродовж 14 днів. Тривалість наступних курсів – 10 днів з періодами спокою 14 днів.
За матеріалами:
Cho H., Shukla S. Role of Edaravone as a Treatment Option for Patients with Amyotrophic Lateral Sclerosis. Pharmaceuticals (Basel). 2020; 14 (1): 29. Published 2020 Dec 31. doi:10.3390/ph14010029.
Zheng C., Liu S. Efficacy of edaravone on coronary artery bypass patients with myocardial damage after ischemia and reperfusion: a meta analysis. Int J Clin Exp Med 2015 Feb 15; 8 (2): 2205-11. eCollection 2015.
Коваленко С. В., Мороз Л. В., Тащук В. К., Лоскутов О. А., Ходош Е. М. Потенційні можливості лікування COVID‑19: протидія надмірному запаленню, антиоксидантний вплив і цитопротекція. Медична газета «Здоров’я України», 2020.
Підготувала Ольга Королюк
Медична газета «Здоров’я України 21 сторіччя» № 11-12 (504-505), 2021 р.