29 квітня, 2024
Ефективність і безпека разагіліну та праміпексолу в лікуванні хвороби Паркінсона на ранніх стадіях
Хвороба Паркінсона (ХП) – хронічний неврологічний розлад, для якого характерні неухильно прогресуючі моторні та немоторні симптоми, які чинять суттєвий негативний вплив на якість життя пацієнтів із цим захворюванням. Із віком захворюваність на ХП зростає. Ранній початок лікування цього розладу допомагає призупинити розвиток патології та дає можливість пацієнтам із ХП продовжувати вести повноцінне життя. Сьогодні одним із варіантів вибору лікування пацієнтів із ХП на ранніх стадіях є монотерапія разагіліном або праміпексолом. Пропонуємо до вашої уваги стислий огляд статті P. Seppänen et al. «A Systematic Review and Meta-Analysis of the Efficacy and Safety of Rasagiline or Pramipexole in the Treatment of Early Parkinson’s Disease», опублікованої в онлайн-виданні Hindawi, 2024 (URL: https://doi.org/10.1155/2024/8448584), яка присвячена результатам дослідження клінічної ефективності та безпеки застосування разагіліну та праміпексолу в пацієнтів із ранньою стадією ХП.
Основними клінічними моторними симптомами ХП є брадикінезія, тремор спокою, м’язова ригідність та постуральна нестабільність. До немоторних симптомів належать вегетативна дисфункція, порушення дихання, розлади чутливості та сну, психічні розлади, які часто виникають раніше за моторні на кілька місяців або навіть років (O’Sullivan et al., 2008; Postuma et al., 2012).
На тлі лікування клінічні ознаки ХП можуть значно зменшитися. Сучасні методи терапії допомагають суттєво поліпшити якість життя пацієнтів із ХП та уповільнити прогресування захворювання.
Одним із найпоширеніших нині варіантів лікування ХП вважається монотерапія леводопою, але її тривале застосування часто асоціюється з медикаментозними дискінезіями та феноменами «виснаження ефекту дози» і моторних флуктуацій (періоди «увімкнення / вимкнення» [«on/off»]) (Bloem et al., 2021; Verschuur et al., 2019). Нині ефективною альтернативою леводопи в межах ранньої фармакотерапії ХП є інгібітори моноаміноксидази В та агоністи дофамінових рецепторів (Fox et al., 2018; Keranen, Virta, 2016).
Зокрема, за даними метааналізу Y. Chang et al. (2017), стійкі переваги для пацієнтів із ХП мав разагілін – незворотний інгібітор моноаміноксидази В – як у монотерапії, так і в комбінації з іншим препаратом. Профіль безпеки разагіліну був подібним до такого для плацебо (Solis-Garcia del Pozo et al., 2013).
Також підтверджено ефективність праміпексолу – агоніста дофамінових рецепторів, якому переважно притаманна спорідненість до D3-рецепторів, – для редукції моторних симптомів при ХП (Frampton, 2014). Зокрема, праміпексол у комбінації з леводопою виявився дієвішим за монотерапію леводопою щодо поліпшення клінічного стану пацієнтів із ХП (Wang et al., 2021).
Однак P. Seppдnen et al. зауважують, що більш ранні систематичні огляди були присвячені оцінюванню ефективності й безпеки разагіліну та праміпексолу на всіх стадіях ХП. Автори зосередили увагу на вивченні цих препаратів для лікування пацієнтів із ХП саме на ранніх стадіях захворювання.
Матеріали та методи дослідження
Популяція учасників дослідження
Критерії включення до дослідження розроблено з використанням принципу PICO (пацієнт, втручання, порівняння, результат), а критерії виключення були протилежними до включення.
Популяція досліджуваних охоплювала когорту пацієнтів із ранньою стадією ХП (показник за шкалою Хен та Яра ≤3 балів) та з короткою тривалістю захворювання (зокрема, ≤5 років).
Також вивчали дані досліджень із залученням пацієнтів із ранньою та більш пізньою стадіями ХП, за умови проведення окремого аналізу клінічного стану осіб із ранньою стадією ХП.
До систематичного огляду літератури увійшли дані рандомізованих контрольованих досліджень (РКД), присвячені оцінюванню результатів терапії разагіліном та праміпексолом, зокрема порівняно з плацебо чи леводопою, у пацієнтів із ранньою стадією ХП. Дослідження, у яких вивчали ефект додаткового лікування ХП, розглядали за умови, що пацієнти приймали препарати у стабільних дозах принаймні протягом 4 тижнів до початку спостереження. Пошук матеріалів, опублікованих до вересня 2021 р., здійснювали у базах даних PubMed, Cochrane Library, Scopus, Web of Science, PsycINFO, CINAHL і Medic.
Отримані результати вивчали відповідно до загального показника за уніфікованою рейтинговою шкалою оцінювання хвороби Паркінсона (UPDRS) наприкінці дослідження. Також враховували додаткові бали за шкалою UPDRS II (моторні аспекти щоденного життя або повсякденної активності) та шкалою UPDRS ІІІ (дослідження моторики). Побічні явища аналізували за їх частотою та тяжкістю.
Основні характеристики досліджень
Загалом серед систематичних оглядів, присвячених вивченню застосування разагіліну, одне з них – порівняльне дослідження ефективності лікування разагіліном та праміпексолом (Rascol et al., 2011).
Сумарна кількість учасників досліджень становила 2 тис. 121 пацієнт (середній вік – від 59,3 до 70,2 року, частка осіб чоловічої статі – 42,9‑76,9%), із яких 1 059 – приймали разагілін. Середня тривалість ХП була від 2,5 місяця до 4,8 року. У деяких РКД пацієнти з ХП, окрім разагіліну, приймали інші препарати у стабільних дозах протягом понад 4 тижні до початку дослідження (Barone et al., 2015; Schrempf et al., 2018).
Систематичний огляд також охоплював дані 11 досліджень, присвячених застосуванню праміпексолу. Загалом у дослідженнях взяли участь 2 тис. 848 пацієнтів (середній вік – від 56,2 до 67 років, частка чоловіків – 47,3‑69,8%), із яких 1 тис. 737 отримували праміпексол. Середня тривалість ХП – від 2,5 місяця до 4,5 року.
У більш ніж половині РКД хворі на ХП, окрім праміпексолу, приймали інші препарати у стабільних дозах упродовж понад 4 тижні до початку дослідження (Poewe et al., 2011; Hauser et al., 2010).
Результати дослідження
Ефективність терапії разагіліном та праміпексолом
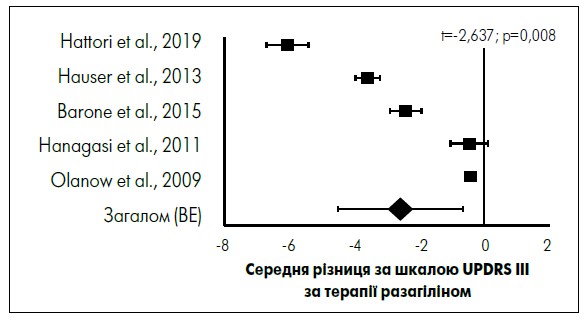
Результати застосування разагіліну, оцінені загалом за шкалою UPDRS ІІ і ІІІ доступні у семи дослідженнях. Зміна загального показника за UPDRS у пацієнтів, які отримували лікування разагіліном, становила від 1,26 до -3,6 бала, у групі плацебо – від 4,27 до -1,2 бала. Зміна показників за шкалою UPDRS ІI у групах застосування разагіліну та плацебо коливалася від 0,78 до -2,17 бала і від 2,32 до -1,64 бала відповідно, а за шкалою UPDRS III – від 0,5 до -4,47 бала та від 2,38 до -2,20 бала відповідно. Ефективність разагіліну (1 мг/добу) порівняно з плацебо за шкалою UPDRS II і III оцінювали у п’яти дослідженнях. Зокрема, було продемонстровано значне поліпшення клінічного стану пацієнтів із ХП, які отримували разагілін, порівняно з тими, хто приймав плацебо, за шкалою UPDRS II і III (табл. 1 і 2, рис. 1 і 2).
|
Таблиця 1. Поліпшення стану пацієнтів із ранніми стадіями ХП за терапії разагіліном (1 мг/добу) за шкалою UPDRS II |
||||||||
|
Дослідження |
ПБО |
РГН |
Загалом |
СРС |
СП |
95% ДІ |
Величина ефекту (%) |
|
|
ФЕ |
ВЕ |
|||||||
|
Hattori et al., 2019 |
110 |
100 |
210 |
-6,32 |
0,338 |
Від -6,986 до -5,654 |
3,14 |
19,7 |
|
Barone et al., 2015 |
53 |
63 |
116 |
-4,253 |
0,335 |
Від -4,917 до -3,589 |
3,19 |
19,71 |
|
Hauser et al., 2013 |
143 |
145 |
288 |
-1,33 |
0,13 |
Від -1,586 до -1,074 |
21,18 |
20,3 |
|
Olanow et al., 2009 |
286 |
588 |
874 |
-0,336 |
0,0725 |
Від -0,479 до -0,194 |
68,08 |
20,38 |
|
Hanagasi et al., 2011 |
25 |
23 |
48 |
-0,138 |
0,285 |
Від -0,711 до 0,435 |
4,42 |
19,9 |
|
Загалом (ВЕ), t=-3,047; р=0,002 |
617 |
919 |
1536 |
-2,449 |
0,804 |
Від -4,026 до -0,873 |
100 |
100 |
|
Примітки: ПБО – кількість учасників досліджень, що приймали плацебо; РГН – кількість учасників досліджень за терапії разагіліном; Загалом – кількість учасників загалом; СРС – середня різниця за шкалою UPDRS II за терапії разагіліном; СП – стандартна похибка показників за шкалою UPDRS ІІ; ДІ – довірчий інтервал, ФЕ – фіксований ефект, ВЕ – випадковий ефект. |
||||||||
Адаптовано за P. Seppänen et al., 2024.
|
Таблиця 2. Поліпшення стану пацієнтів із ранніми стадіями ХП за терапії разагіліном (1 мг/добу) за шкалою UPDRS III |
||||||||
|
Дослідження |
ПБО |
РГН |
Загалом |
СРС |
СП |
95% ДІ |
Величина ефекту (%) |
|
|
ФЕ |
ВЕ |
|||||||
|
Hattori et al., 2019 |
110 |
100 |
210 |
-6,061 |
0,326 |
Від -6,705 до -5,418 |
3,69 |
19,7 |
|
Hauser et al., 2013 |
143 |
145 |
288 |
-3,591 |
0,19 |
Від -3,965 до -3,216 |
10,84 |
19,71 |
|
Barone et al., 2015 |
53 |
63 |
116 |
-2,421 |
0,244 |
Від -2,905 до -1,938 |
6,59 |
20,3 |
|
Hanagasi et al., 2011 |
25 |
23 |
48 |
-0,456 |
0,288 |
Від -1,035 до -0,124 |
4,73 |
20,38 |
|
Olanow et al., 2009 |
286 |
588 |
874 |
-0,423 |
0,0727 |
Від -0,566 до 0,281 |
74,16 |
19,9 |
|
Загалом (ВЕ), t=-2,637; р=0,008 |
617 |
919 |
1536 |
-2,582 |
0,979 |
Від -4,502 до -0,661 |
100 |
100 |
|
Примітки: ПБО – кількість учасників досліджень, що приймали плацебо; РГН – кількість учасників досліджень за терапії разагіліном; Загалом – кількість учасників загалом; СРС – середня різниця за шкалою UPDRS IIІ за терапії разагіліном; СП – стандартна похибка показників за шкалою UPDRS ІІІ; ДІ – довірчий інтервал, ФЕ – фіксований ефект, ВЕ – випадковий ефект. |
||||||||
Адаптовано за P. Seppänen et al., 2024.
Рис. 1. Діаграма показників за шкалою UPDRS II пацієнтів із ранніми стадіями ХП за терапії разагіліном (1 мг/добу)
Адаптовано за P. Seppänen et al., 2024.
Рис. 2. Діаграма показників за шкалою UPDRS III пацієнтів із ранніми стадіями ХП за терапії разагіліном (1 мг/добу)
Адаптовано за P. Seppänen et al., 2024.
Результати ефективності застосування праміпексолу згідно із загальним показником за шкалою UPDRS ІІ і ІІІ були доступні у 10 дослідженнях. Зміна загального показника за шкалою UPDRS у пацієнтів за терапії праміпексолом становила від 4,5 до -7,0 бала, а у групах порівняння – від 9,2 до -0,9 бала. Зміна показників за шкалою UPDRS ІI у групах застосування праміпексолу та порівняння коливалася від 0,4 до -3,2 бала та від 1,5 до -,2 бала, а за шкалою UPDRS III – від 3,4 до -11,5 бала та від 7,3 до -2,2 бала відповідно.
Ефективність терапії праміпексолом порівняно з плацебо згідно з показниками за шкалою UPDRS II та III оцінювали у п’яти дослідженнях. Відповідно до отриманих даних, спостерігалося суттєве поліпшення клінічного стану пацієнтів, які приймали праміпексол, порівняно з тими, хто отримував плацебо (табл. 3 і 4, рис. 3 і 4).
|
Таблиця 3. Поліпшення стану пацієнтів із ранніми стадіями ХП за терапії праміпексолом за шкалою UPDRS II |
||||||||
|
Дослідження |
ПБО |
ППЛ |
Загалом |
СРС |
СП |
95% ДІ |
Величина ефекту (%) |
|
|
ФЕ |
ВЕ |
|||||||
|
Schapira et al., 2013 |
210 |
200 |
410 |
-5,49 |
0,216 |
Від -5,914 до -5,066 |
13,87 |
16,73 |
|
Hauser et al., 2010 (IR) |
101 |
50 |
126 |
-4,247 |
0,348 |
Від -4,936 до 3,559 |
5,33 |
16,51 |
|
Barone et al., 2010 |
139 |
148 |
287 |
-3,989 |
0,204 |
Від -4,391 до 3,588 |
15,49 |
16,75 |
|
Hauser et al., 2010 (ER) |
102 |
50 |
127 |
-3,541 |
0,314 |
Від -4,163 до -2,920 |
6,54 |
16,58 |
|
Poewe et al., 2011 |
420 |
103 |
523 |
-0,671 |
0,112 |
Від -0,890 до -0,451 |
51,63 |
16,83 |
|
Wong et al., 2003 |
21 |
22 |
43 |
-0,233 |
0,301 |
Від -0,840 до -0,374 |
7,14 |
14,21 |
|
Загалом (ВЕ), t=-3,117; р=0,002 |
993 |
523 |
1516 |
-3,027 |
0,971 |
Від -4,931 до -1,122 |
100 |
100 |
|
Примітки: ПБО – кількість учасників досліджень, що приймали плацебо; ППЛ – кількість учасників досліджень за терапії праміпексолом; IR – негайне вивільнення; ER – пролонговане вивільнення; Загалом – кількість учасників загалом; СРС – середня різниця за шкалою UPDRS II за терапії праміпексолом; СП – стандартна похибка показників за шкалою UPDRS ІІ; ДІ – довірчий інтервал; ФЕ – фіксований ефект; ВЕ – випадковий ефект. |
||||||||
Адаптовано за P. Seppänen et al., 2024.
|
Таблиця 4. Поліпшення стану пацієнтів із ранніми стадіями ХП за терапії праміпексолом за шкалою UPDRS III |
||||||||
|
Дослідження |
ПБО |
ППЛ |
Загалом |
СРС |
СП |
95% ДІ |
Величина ефекту (%) |
|
|
ФЕ |
ВЕ |
|||||||
|
Schapira et al., 2013 |
210 |
200 |
410 |
-6,588 |
0,25 |
Від -7,080 до -6,096 |
9,52 |
19,96 |
|
Barone et al., 2010 |
139 |
148 |
287 |
-3,984 |
0,204 |
Від -4,386 до -3,583 |
14,35 |
20,03 |
|
Wong et al., 2003 |
21 |
22 |
43 |
-1,352 |
0,333 |
Від -2,024 до -0,679 |
5,38 |
19,78 |
|
Hauser et al., 2010 |
203 |
50 |
253 |
-0,708 |
0,161 |
Від -1,024 до -0,392 |
23,14 |
20,09 |
|
Poewe et al., 2011 |
420 |
103 |
523 |
-0,698 |
0,112 |
Від -0,917 до -0,478 |
47,62 |
20,14 |
|
Загалом (ВЕ), t=-2,552; р=0,011 |
993 |
523 |
1516 |
-2,663 |
1,044 |
Від -4,710 до -0,616 |
100 |
100 |
|
Примітки: ПБО – кількість учасників досліджень, що приймали плацебо; ППЛ – кількість учасників досліджень за терапії праміпексолом; Загалом – кількість учасників загалом; СРС – середня різниця за шкалою UPDRS IІI за терапії праміпексолом; СП – стандартна похибка показників за шкалою UPDRS ІІІ; ДІ – довірчий інтервал, ФЕ – фіксований ефект, ВЕ – випадковий ефект. |
||||||||
Адаптовано за P. Seppänen et al., 2024.
Рис. 3. Діаграма показників за шкалою UPDRS II пацієнтів із ранніми стадіями ХП за терапії праміпексолом
Адаптовано за P. Seppänen et al., 2024.
Рис. 4. Діаграма показників за шкалою UPDRS III пацієнтів із ранніми стадіями ХП за терапії праміпексолом
Адаптовано за P. Seppänen et al., 2024.
Безпека застосування разагіліну та праміпексолу
Серед найпоширеніших побічних ефектів, пов’язаних із застосуванням разагіліну, були головний біль, запаморочення, нудота, біль у спині та сонливість. У порівняльних дослідженнях на тлі застосування праміпексолу частіше спостерігали нудоту й блювання, порушення сну та сонливість, а за лікування разагіліном – висип (Viallet et al., 2013).
Відносний ризик (ВР) несприятливих реакцій, зокрема серйозних і таких, що призводили до скасування лікування, був зіставним у пацієнтів, які отримували разагілін, праміпексол або плацебо. Загальна частота припинення лікування становила 7,3 і 10,7% за терапії разагіліном порівняно з прийманням плацебо відповідно.
Серед найпоширеніших побічних ефектів, пов’язаних із застосуванням монотерапії праміпексолом, були закреп, запаморочення, швидка стомлюваність, головний біль, безсоння, нудота, сонливість та галюцинації (Poewe et al., 2011).
Дещо вищим був ВР несприятливих реакцій у хворих, які отримували праміпексол, ніж у групі отримання плацебо. Своєю чергою, ВР серйозних побічних ефектів, зокрема тих, що призвели до скасування лікування, у групах терапії праміпексолом та плацебо виявився зіставним. Загальна частота припинення лікування становила 18,9 і 17,4% за терапії праміпексолом порівняно з прийманням плацебо відповідно.
Обговорення
За результатами дослідження P. Seppдnen et al. (2024), зміна показників за шкалою UPDRS II та ІІ свідчить, що лікування разагіліном (1 мг/добу) та праміпексолом ефективно поліпшувало клінічний стан пацієнтів порівняно з прийманням плацебо.
Отримані докази переваги застосування разагіліну подібні до тих, що спостерігали Y. Chang et al. (2017). Так, дані систематичного огляду та метааналізу десяти досліджень засвідчили, що лікування разагіліном суттєво поліпшувало показники за шкалою UPDRS І, ІІ та ІІІ у пацієнтів із ХП на всіх стадіях порівняно з плацебо.
Крім того, R. A. Hauser et al. (2016) виконали метааналіз двох досліджень, у яких оцінювали ефективність застосування разагіліну в пацієнтів на ранніх стадіях ХП. Як зазначають дослідники, при використанні разагіліну поліпшився загальний показник за шкалою UPDRS ІІ та ІІІ.
Результати P. Seppдnen et al. щодо безпеки разагіліну збігаються з даними інших метааналізів, відповідно до яких профілі безпеки разагіліну і плацебо були подібними (Minguez-Minguez et al., 2013; Binde et al., 2018).
Що стосується застосування праміпексолу, то за даними систематичного огляду 23 РКД було підтверджено його ефективність щодо зниження показника за шкалою Гамільтона для оцінювання депресії (HAM-D) у пацієнтів із ХП та тривожним розладом або депресією (Ji et al., 2022). При цьому частота побічних реакцій була нижчою у пацієнтів із ХП, які отримували праміпексол, порівняно з контрольною групою.
Y. Wang et al. (2021) оцінювали ефективність та безпеку застосування праміпексолу в комбінації з леводопою порівняно з монотерапією леводопою в пацієнтів із ХП. Комбіноване лікування праміпексолом і леводопою асоціювалося із поліпшенням моторних функцій, щоденної активності, розумової діяльності та зменшенням частоти ускладнень, оцінених за шкалою UPDRS.
На відміну від застосування лише леводопи, на тлі комбінованої терапії праміпексолом і леводопою продемонстровано зниження частоти будь-яких несприятливих ефектів у пацієнтів із ХП.
Висновки
Результати дослідження P. Seppдnen et al. (2024) підтвердили, що на тлі терапії разагіліном і праміпексолом у пацієнтів із ранніми стадіями ХП спостерігалося суттєве поліпшення показників за шкалою UPDRS II та ІІІ порівняно з прийманням плацебо.
Як зазначають дослідники, застосування разагіліну та праміпексолу порівняно з плацебо не асоціювалося зі зростанням ризику будь-яких побічних ефектів, зокрема серйозних або тих, що могли б призвести до скасування лікування.
UA-PRAM-PUB-042024-044
Підготувала Олена Коробка