31 жовтня, 2021
Світові стандарти керування болем, пов’язаним із раком
Біль – це симптом, який часто виникає в онкологічних пацієнтів, особливо на пізніх стадіях хвороби, коли поширеність процесу оцінюється понад 70% (R.K. Portenoy et al., 2011), і супроводжується погіршенням психічного та фізичного стану. За даними найбільшого систематичного огляду, поширеність болю перевищує 33% у пацієнтів після лікування й досягнення ремісії хвороби, 59% – в осіб, які отримали протиракове лікування, 64% – у хворих із поширеним/метастатичним/термінальним раком (M.H.J. van den Beuken-van Everdingen et al., 2007). Крім того, біль може бути раннім симптомом деяких локалізацій раку: підшлункової залози (44%), голови та шиї (40%; A.W. Burton et al., 2007). Метою цієї статті є ознайомлення онкологів із ключовими положеннями міжнародних клінічних настанов щодо керування болем, зумовленим раком.
Водночас із подовженням виживаності онкологічних пацієнтів збільшується кількість хворих, які страждають від персистуючого болю. Близько 5-10% осіб, які подолали рак, відчувають хронічний біль, що значно знижує якість життя (M.D.R. Brown et al., 2014). Незважаючи на наявність клінічних настанов та доступність опіоїдів (є основою знеболювання при помірному та сильному болю), недостатнє знеболювання є поширеною проблемою. Так, дані європейських досліджень, які збігаються з такими США, показують, що різні типи болю та больового синдрому присутні при всіх стадіях раку, переважна частина пацієнтів (56,0-82,3%) не отримує належного знеболювання (H. Breivik et al., 2009). За опублікованими у 2014 р. даними систематичного огляду, у якому використовували індекс керування болем (Pain Management Index, PMI), близько 1/3 пацієнтів не отримують належного знеболювання, пропорційного інтенсивності болю (M.T. Greco et al., 2014).
Аналіз вітчизняних статистичних даних виявив, що показник споживання морфіну в Україні у 2014 р. на душу населення був майже у 8 разів меншим за середній у світі та у 16 – у Європі. Водночас у нашій країні призначення та введення наркотичних аналгетиків відрізняються від міжнародних рекомендацій щодо здійснення паліативного знеболювання пацієнтам: основну частину призначень становлять ін’єкційні форми (87% пацієнтів поліклінік та 69% пацієнтів виїзних бригад); прийом налбуфіну довготривалий (впродовж 2-53 днів); декілька наркотичних аналгетиків призначають одночасно; режим призначення препаратів морфіну не дотримується; титрація дози відсутня (Н.О. Дацюк, 2017). Отже, в Україні проблема адекватного знеболювання онкологічних пацієнтів стоїть дуже гостро. Окрім вирішення проблем на державному рівні щодо покращення паліативної допомоги населенню існує нагальна потреба у підвищенні рівня знань лікарів, які призначають знеболювальне лікування, ознайомленні з міжнародними клінічними настановами, що систематично оновлюються відповідно до вимог доказової медицини.
Клінічні настанови Європейського товариства медичної онкології (M. Fallon et al., 2018)
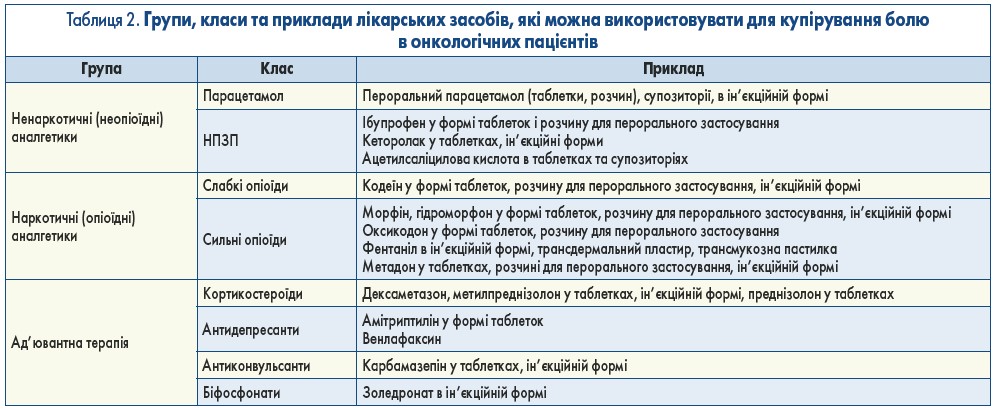
Невід’ємною частиною онкологічної допомоги є поточна та подальша оцінка болю. Самостійна регулярна оцінка інтенсивності болю за допомогою спеціальних шкал є першим кроком на шляху ефективного індивідуалізованого лікування. Найчастіше використовують візуальну аналогову шкалу (Visual Analog Scale, VAS), вербально-рейтингову шкалу (Verbal Rating Scale, VRS), цифрову рейтингову шкалу (Numerical Rating Scale, NRS; рис. 1).
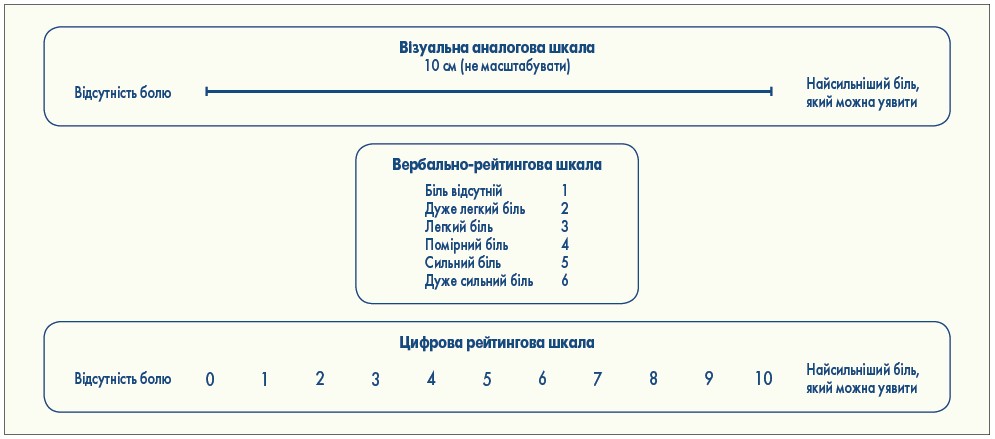 Рис. 1. Перевірені найпоширеніші інструменти оцінки болю
Рис. 1. Перевірені найпоширеніші інструменти оцінки болю
Щодо загальних принципів ведення онкологічних пацієнтів із болем у рекомендаціях ESMO (2018) зазначено:
- пацієнти мають бути поінформовані про біль і можливі методи його лікування; пацієнтів слід заохочувати брати активну участь у процесі керування болем;
- знеболювання має бути цілодобовим, тобто повинні враховуватися період напіввиведення, біодоступність і тривалість дії різних препаратів;
- при хронічному болю аналгетики слід застосовувати регулярно, а не за потреби;
- перевагу слід надавати пероральному способу введення знеболювальних засобів.
Тип знеболювання та доза препарату залежать від інтенсивності болю. Ці параметри мають бути врегульовані залежно від інтенсивності болю для досягнення балансу між оптимальним рівнем знеболювання та мінімальними побічними ефектами.
У рекомендаціях ESMO (2018) описується стратегія триступеневого знеболювання онкологічних пацієнтів: від застосування неопіоїдних аналгетиків до слабких і сильних опіоїдів (залежно від інтенсивності болю). Вона була розроблена Всесвітньою організацією охорони здоров’я ще у 1986 р. Згідно з цією стратегією, ненаркотичні аналгетики можна використовувати на всіх етапах знеболювання, проте вони мають більше значення на перших двох етапах. Крок 1 – це застосування нестероїдних протизапальних препаратів (НПЗП) та парацетамолу. Наркотичні (опіоїдні) аналгетики є основою знеболювання в онкологічних хворих. Їх класифікують за здатністю контролювати біль різної інтенсивності: від легкого помірного (крок 2) до помірного сильного (крок 3).
Запропонована наприкінці ХХ ст. стратегія триступеневого знеболювання розповсюджена в цілому світі. Проте медицина розвивається, з’являються нові методи оцінки болю, лікарські форми, які не були доступні раніше. Триступеневе знеболювання залишається корисним навчальним інструментом, але не є строгим клінічним протоколом для лікування (G. Vargas-Schaffer, 2010).
Незалежно від стратегії, опіоїдні аналгетики є основою знеболювальної терапії у пацієнтів, які страждають від помірно сильного та сильного болю. Згідно з останнім звітом ESMO та Європейської асоціації паліативної допомоги, у Європі використовують морфін, метадон, оксикодон, гідроморфон, фентаніл, альфентаніл, бупренорфін, діаморфін, леворфанол та оксиморфон (N.I. Cherny et al., 2010). У деяких країнах збільшилося використання оксикодону та пластирів фентанілу й бупренорфіну (E. Bandieri et al., 2009). До списку основних лікарських засобів для боротьби з раковим болем Всесвітньої організації охорони здоров’я входять морфін, метадон та фентанілові пластири. В останньому систематичному Кокранівському огляді було проаналізовано дані 62 досліджень за участю 4241 особи (P.J. Wiffen et al., 2016) та підтримано застосування перорального морфіну як ефективного знеболювального засобу при раку з низьким рівнем (6%) зареєстрованих недопустимих побічних ефектів. Трансдермальний фентаніл також характеризується аналогічними показниками знеболювання та вважається ефективним і добре переносимим знеболювальним засобом (P.J. Wiffen et al., 2017).
Рекомендації ESMO (2018) щодо лікування болю від помірного до сильного:
- препаратом вибору для лікування болю від помірної до сильної інтенсивності є морфін (І, А);
- середнє співвідношення відносної ефективності морфіну залежно від шляху введення становить: перорального до внутрішньовенного (в/в) 1:2-1:3 (II, A), перорального до підшкірного (п/ш) 1:2-1:3 (IV, C);
- фентаніл і бупренорфін (при трансдермальному або в/в застосуванні) є найбезпечнішими опіоїдами у пацієнтів із хронічною хворобою нирок 4 або 5 ступеня (швидкість клубочкової фільтрації <30 мл/хв; III, B);
- за відсутності адекватного знеболювання (незважаючи на збільшення дози опіоїдів) або наявності неприйнятних побічних ефектів унаслідок введення опіоїдів слід розглянути можливість застосування іншого опіоїду (III, C);
- п/ш шлях введення морфіну, діаморфіну та гідроморфону є зручним та ефективним і може використовуватися як альтернативний спосіб у пацієнтів, у яких неможливе пероральне або трансдермальне застосування (III, B);
- в/в спосіб введення слід розглянути при неможливості п/ш застосування (периферичний набряк, порушення згортання крові, порушення периферичного кровообігу та потреба у введенні великого об’єму та дози препарату; III, B);
- в/в спосіб застосування є опцією для титрування опіоїдів при потребі швидкого контролю болю (III, B).
Препарати для трансдермального застосування фентаніл та бупренорфін найкраще підходять для пацієнтів, які потребують постійного знеболювання. Однак фентаніл протипоказаний при титруванні опіоїдів, у пацієнтів, які раніше не отримували опіоїдів, та для контролю різкого загострення болю (G.K. Gourlay, 2001). Трансдермальний фентаніл є помічним в осіб з нудотою, блюванням, розладами ковтання, запором, низьким комплаєнсом (S. King et al., 2011).
З часом (інколи раптово) клінічна ефективність призначеного на початку знеболювальної терапії опіоїду може знижуватися, що призводить до потреби підвищення дози. У деяких випадках підвищення дози не супроводжується знеболюванням. Крім того, можливе виникнення побічних ефектів, які неможливо коригувати за допомогою симптоматичної терапії (S. Mercadante et al., 2001). У разі неадекватного знеболювання чи появи побічних ефектів, що не піддаються корекції, слід припинити введення препарату та запропонувати інший опіоїд (N. Cherny et al., 2001).
«Перемикання» (ротація) опіоїдів – це тактика заміни одного опіоїдного аналгетика на інший з метою покращення відповіді на терапію опіоїдами, підвищення знеболювального ефекту, зменшення вираженості побічних ефектів. Незважаючи на відсутність рандомізованих клінічних досліджень щодо заміни опіоїдів, на практиці такий підхід застосовується. Також немає доказів, що одна послідовність опіоїдів є кращою за іншу. Цей підхід вимагає ознайомлення з еквівалентними аналгетичними дозами різних опіоїдів. Перехід з одного опіоїду на інший не має базуватися лише на математичних розрахунках, а має враховувати конкретну клінічну ситуацію: інтенсивність болю та вираженість побічних ефектів, наявність коморбідної патології та прийом інших лікарських препаратів. Крім того, необхідно виключити фармакокінетичні фактори, які можуть вплинути на ефективність препаратів (S. Mercadante et al., 2016). При переході з одного опіоїду на інший рекомендовано використовувати коефіцієнт конверсії дози (мають різний ступінь достовірності; табл. 1).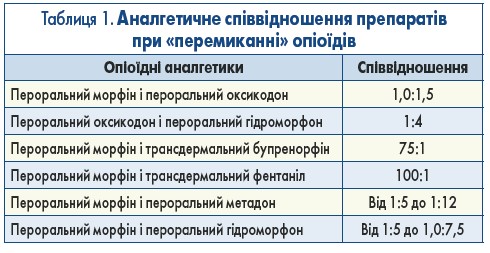
Авторитетні міжнародні організації розробляють спеціальні посібники для пацієнтів щодо лікування різних видів раку, супровідної та паліативної допомоги. Це дозволяє поширювати серед пацієнтів і їх родичів актуальну та достовірну інформацію, яка базується на клінічних настановах для лікарів, у доступному для сприйняття форматі. Посібник ESMO для пацієнтів щодо керування болем також доступний на його офіційному сайті. У ньому зазначено, що для лікування болю від помірної до сильної інтенсивності застосовують морфін, оксикодон, фентаніл, гідроморфон та метадон. Найчастіше для зменшення вираженості болю при раку застосовується морфін. Після досягнення стабільного стану пацієнту можуть бути запропоновані трансдермальні фентанілові або бупренорфінові пластири. Вони забезпечують надходження відповідної дози анелгетика без потреби нагадування про необхідність прийняти ліки.
Клінічні настанови Всесвітньої організації охорони здоров’я щодо знеболювання онкологічних пацієнтів
У 2018 р. були опубліковані оновлені клінічні рекомендації щодо фармакологічного та променевого лікування болю, зумовленого раком, у дорослих (включаючи осіб старше 60 років) і підлітків (віком 10-19 років). Повністю усунути біль у всіх онкологічних пацієнтів неможливо, тому метою керування болем при раку є забезпечення прийнятної якості життя. Користь від знеболювання повинна бути збалансованою з можливими побічними ефектами та передозуванням, які можуть призвести до пригнічення дихання.
Пацієнти з раком можуть потребувати знеболювання на будь-якій стадії раку, а не лише на термінальних стадіях. При ранньому початку паліативної допомоги одночасно з проведенням основного протиракового лікування можна досягти кращих результатів з точки зору контролю симптомів. Однак часто у пацієнтів діагностують рак на запущених стадіях, коли протиракове лікування є неефективним. У таких випадках кращим варіантом лікування є паліативна допомога та, за необхідності, зменшення вираженості болю. На думку експертів і за даними з деяких країн із низьким рівнем доходу, близько 80% хворих, які помирають від раку, відчувають помірний або сильний біль у середньому протягом 90 днів (F.M. Knaul et al., 2018). Основою лікування болю при раку є фармакотерапія, але променева терапія, анестетичні, нейрохірургічні, психологічні, фізіотерапевтичні, духовні та соціальні втручання відіграють істотну роль в адекватному лікуванні болю.
Клінічні настанови ВООЗ стосуються болю, викликаного прямим впливом пухлини: поширення процесу в м’які тканини, ураження внутрішніх органів, кісток, компресія або пошкодження нервів, підвищення внутрішньочерепного тиску або поєднання цих причин. До інших причин болю, зумовленого раком, належать побічні ефекти лікування, однак вони виходять за рамки цих настанов.
Ініціація зменшення вираженості болю
Рекомендація. У дорослих пацієнтів (включаючи осіб похилого віку) та підлітків, які мають біль, спричинений раковим захворюванням, слід застосовувати НПЗП, парацетамол або опіоїди окремо чи в комбінації, залежно від клінічного стану й інтенсивності болю, для швидкого, ефективного та безпечного знеболювання (сильна рекомендація, докази низької якості; табл. 2).
Ремарка. Для початкового знеболювання має використовуватися той лікарський засіб, який відповідає інтенсивності болю. Монотерапію легкими аналгетиками (парацетамол, НПЗП) не слід застосовувати у пацієнтів із помірним і сильним болем. Можливе поєднання НПЗП/парацетамолу з опіоїдами, наприклад, з пероральним морфіном, при відповідній інтенсивності болю, оціненій за VAS або NRS.
Підтримувальна терапія опіоїдами
Рекомендація. У дорослих пацієнтів і підлітків із болем, зумовленим раком, можна розглядати застосування будь-яких опіоїдів (окремо або в комбінації з НПЗП/парацетамолом) для підтримувального знеболювання, залежно від клінічного стану й інтенсивності болю, з метою досягнення постійного, ефективного та безпечного контролю болю (сильна рекомендація, докази низької якості).
Ремарка. Коректна доза опіоїдів – це та доза, яка зменшує вираженість болю у пацієнта до прийнятного рівня. Відповідь пацієнта на таке лікування може бути різною і залежить від самого пацієнта та лікарського засобу, який застосовується.
Рекомендація. При можливості перорального прийому лікарських препаратів для підтримки ефективного та безпечного знеболювання слід постійно використовувати однакову дозу перорального морфіну з негайним вивільненням або дозу морфіну із повільним вивільненням. Морфін для перорального застосування з негайним вивільненням слід використовувати як терапію порятунку (сильна рекомендація, докази середньої якості).
Ремарка. Пероральний морфін з негайним вивільненням має бути доступним для всіх пацієнтів, які його потребують. Пероральний морфін з повільним вивільненням за можливості має бути доступним та використовуватися як доповнення до морфіну з негайним вивільненням, але не замість нього.
Практичне твердження. Якщо пероральний або трансдермальний метод доставки опіоїдного препарату не доступний, слід віддати перевагу підшкірному введенню над внутрішньом’язовим.
Припинення застосування опіоїдів
Практичне твердження. Якщо під час лікування болю у пацієнта розвинулася фізична залежність від опіоїдів, дозу опіоїдів слід знижувати поступово, щоб уникнути симптомів відміни.
Ад’ювантна терапія болю
Рекомендація. Дорослим (включаючи осіб похилого віку) та підліткам, які страждають від болю, спричиненого раком, за показаннями можна призначати ад’ювантну терапію кортикостероїдами для досягнення контролю над болем (сильна рекомендація, докази середньої якості).
Ремарка. Загалом кортикостероїди слід призначати якомога раніше. Оптимальна доза цих препаратів залежить від багатьох клінічних факторів, зокрема локалізації та типу болю, наявності ризику розвитку інфекції, стадії хвороби, наявності цукрового діабету, завдань лікування. Якщо набряк навколо пухлини хоча б частково може бути причиною болю чи ускладнення, слід віддавати перевагу кортикостероїдам з найменшим мінералокортикоїдним ефектом.
Керування болем, зумовленим метастазами в кістках
Рекомендація. Дорослим (включаючи осіб похилого віку) та підліткам, у яких наявні метастази в кістках, з метою профілактики болю в них слід призначати біфосфонати (сильна рекомендація, докази середньої якості).
Рекомендація. У дорослих пацієнтів і підлітків з болем, зумовленим метастазами в кістках, за наявності показань та доступності слід використовувати однофракційну променеву терапію (сильна рекомендація, докази високої якості).
Ремарка. Ця рекомендація стосується хворих з уже наявними болючими кістковими метастазами та не стосується осіб із безболісними метастазами.
Клінічні настанови Національної онкологічної мережі США щодо керування болем у дорослих хворих на рак (версія 2.2021)
За визначенням Міжнародної асоціації з вивчення болю (Association for the Study of Pain, IASP), біль – це неприємний сенсорний та емоційний досвід, що пов’язаний із реальним чи потенційним пошкодженням тканини або ж описується пацієнтом термінами подібного ушкодження. Оптимальне специфічне лікування хвороби має важливе значення у керуванні болем, пов’язаним із пухлиною. Знеболювання є важливою частиною ведення онкологічного пацієнта. Знеболювальну терапію проводять разом із лікуванням численних симптомів або груп симптомів.
Клінічні настанови NCCN включають кілька розділів, які стосуються загальних принципів керування болем (PAIN‑1), універсального скринінгу, оцінки та лікування болю (PAIN‑2), лікування пацієнтів, які раніше отримували/не отримували опіоїди (PAIN‑3, -4; рис. 2, 3), лікування больових кризів (PAIN‑5), постійного догляду (PAIN‑6), оцінки інтенсивності болю (PAIN-А), комплексної оцінки болю (PAIN-В), психосоціальної підтримки (PAIN-С), комплексного втручання (PAIN-D), призначень ненаркотичних аналгетиків (PAIN-E), ад’ювантного знеболювання невропатичного болю (PAIN-F), принципів застосування опіоїдів, титрування (PAIN-G), боротьби з побічними ефектами (PAIN-H), освіти та підтримки пацієнта та його родичів/опікунів (PAIN-I), болю та тривоги, пов’язаних із процедурою (PAIN-J), стратегії керування специфічними больовими синдромами (PAIN-K), спеціальних консультацій з метою покращення контролю болю (PAIN-L), інтервенційної стратегії (PAIN-M), принципів фармакогенетики (PAIN-N).
 Рис. 2. Керування болем у пацієнтів, які раніше не отримували опіоїдиd
Рис. 2. Керування болем у пацієнтів, які раніше не отримували опіоїдиd
 Рис. 3. Керування болем у толерантних до опіоїдів пацієнтів
Рис. 3. Керування болем у толерантних до опіоїдів пацієнтів
Через певні обмеження формату газети пропонуємо ознайомитися з двома ключовими розділами клінічних настанов – PAIN‑3, -4 (рис. 2, 3).
Висновки
Біль – це часта причина істотного зниження якості життя онкологічних пацієнтів на різних стадіях раку. Разом із подовженням тривалості життя хворих на рак в епоху персоналізованої медицини необхідно впроваджувати стратегії для підвищення його якості. Дані світової статистики свідчать про високу частоту помірного та сильного болю в онкохворих, що є неприйнятною практикою у ХХІ ст. На жаль, в Україні поширена практика неадекватного знеболювання онкопацієнтів шляхом призначення препаратів, які не показані при цьому типі болю, через погану доступність опіоїдів, неправильну стратегію знеболювання тощо. Особливо часто для зменшення болю при раку українські лікарі призначають налбуфін, якого немає в жодних наведених вище рекомендаціях. Недооціненим препаратом для знеболювання є фентанілові пластири, які є зручними у використанні, підходять для зменшення помірного та сильного болю, мають високу ефективність та добре переносяться пацієнтами.
За матеріалами:
- Fallon M. et al. Management of cancer pain in adult patients: ESMO. Clinical Practice Guidelines. Annals of Oncology. 2018; 29 (supp. 4): iv166-iv191. doi:10.1093/annonc/mdy152.
- National Comprehensive Cancer Network, Inc. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Adult Cancer Pain (Version 2.2021 – June 3, 2021).
- WHO guidelines for the pharmacological and radiotherapeutic management of cancer pain in adults and adolescents. World Health Organization, 2018. https://www.who.int/ncds/management/palliative-care/Cancer-pain-guidelines-Annex‑7.pdf.
Підготувала Ілона Цюпа
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 4 (71) 2021 р.