10 листопада, 2022
Ендокринотерапія при раку молочної залози: сучасні варіанти лікування та шляхи профілактики побічних ефектів у світлі міжнародних рекомендацій
 На науково-практичній конференції UkraineOncoGlobal-2022 доцент кафедри онкології Національного медичного університету імені О.О. Богомольця (м. Київ), кандидат медичних наук Олексій Сергійович Зотов представив доповідь, у якій детально проаналізував сучасні можливості ендокринотерапії поширеного раку молочної залози (РМЗ) і можливості профілактики побічних ефектів, які виникають на тлі протипухлинної терапії.
На науково-практичній конференції UkraineOncoGlobal-2022 доцент кафедри онкології Національного медичного університету імені О.О. Богомольця (м. Київ), кандидат медичних наук Олексій Сергійович Зотов представив доповідь, у якій детально проаналізував сучасні можливості ендокринотерапії поширеного раку молочної залози (РМЗ) і можливості профілактики побічних ефектів, які виникають на тлі протипухлинної терапії.
Роль інгібіторів ароматази в лікуванні РМЗ
Ароматаза як мішень для терапії з приводу РМЗ відома багато років, і сьогодні загальновизнаний факт, що вона є ключовим ензимом синтезу естрогенів. Відповідно її інгібування призводить до тимчасового/незворотного блокування утворення естрогенів. Створення антиароматазних засобів відкрило нові перспективи як у лікуванні, так і в профілактиці РМЗ за рахунок того, що інгібітори ароматази (ІА) можуть забезпечувати блокаду синтезу естрогенів на клітинному рівні без розвитку побічних ефектів, властивих системній терапії.
Сучасна класифікація ІА налічує кілька поколінь препаратів, які відрізняються за структурою та механізмом дії. Першими були відкриті нестероїдні інгібітори ароматази. Механізм їх дії пов’язаний із тим, що вони конкурентно зв’язуються з молекулою гему, який входить до складу цитохрому Р450, та на деякий час позбавляють ароматазу здатності утилізувати НАДФН(Н+), тим самим забезпечуючи припинення процесу гідроксилювання і, як наслідок, – процесу ароматизації андрогенів. Проте їх дія є зворотною, і через деякий час андрогени можуть витіснити нестероїдний ІА з ароматази, тим самим відновлюючи активність ферменту.
У свою чергу, стероїдні ІА створювалися цілеспрямовано. При їх розробленні дослідники намагалися створити формулу, що відповідає природним мішеням ароматази. Тобто механізм їх дії пов’язаний із тим, що стероїдні ІА виконують роль псевдосубстрату до ароматази з високим рівнем спорідненості. За рахунок цього вони незворотно інактивують фермент шляхом зв’язування андрогенприєднуючого сайту ароматази. Тому їх часто називають суїцидні, тобто ті, що викликають незворотну інактивацію ароматази.
Після відкриття ІА виникло питання щодо доцільності їх застосування при РМЗ. Першочергово ці препарати почали призначати при поширеному метастатичному неоперабельному РМЗ. У 2009 р. було оприлюднено кокранівський огляд 37 контрольованих досліджень, у яких загалом брали участь 14 тис. пацієнток з РМЗ. Результати огляду продемонстрували, що лікування ІА покращувало виживаність без прогресування (ВБП) у цій когорті хворих на 10% [1]. Однак на підставі даних цих досліджень залишалася невизначеною загальна тривалість ВБП і відповідь пухлини. Результати подальших досліджень засвідчили, що застосування ІА у першій/другій лінії терапії мало переваги, які варіювали залежно від різних препаратів. Проте конкретні підгрупи пацієнток, які можуть отримати користь від застосування ІА, залишалися невизначеними.
Подальші клінічні дослідження демонстрували, що на фоні монотерапії ендокринними препаратами, зокрема тамоксифеном, медіана ВБП і часу до прогресування у хворих на поширений РМЗ здебільшого не перевищувала 2 років. Застосування конкурентного антагоніста естрогенових рецепторів – фулвестранту – дозволило подовжити ВБП у цій когорті хворих до 16-24 міс. Проте ці результати стали «фінальною точкою», і довгий час не спостерігалося підвищення ВБП більше 2 років. Відновити прогрес у цій галузі дозволило впровадження комбінацій, зокрема застосування традиційних засобів ендокринної терапії з інгібіторами циклінзалежних кіназ 4 і 6, що і дало змогу перевищити поріг ВБП у 2 роки. Таким чином, було досягнуто істотного прогресу у лікуванні РМЗ, забезпечивши довшу ВБП порівняно зі застосуванням тамоксифену. Різниця медіани ВБП у різних дослідженнях становила близько 4 міс, проте у цієї когорти пацієнток не було досягнуто істотних переваг щодо загальної виживаності (ЗВ). Ефективність монотерапії тамоксифеном та ІА приблизно однакова, обидва режими лікування забезпечують однакову ЗВ.
Наступним етапом прогресу у терапії поширеного РМЗ стало використання комбінованого лікування, зокрема ІА з інгібіторами циклінзалежних кіназ 4 і 6, що дало змогу досягати більшої ВБП (≥2 років). Результати останніх досліджень продемонстрували, що комбінації навіть в ад’ювантному режимі надають певні переваги.
Наразі існують різні варіанти застосування ІА при поширеному РМЗ. Відповідно до сучасних настанов, у першій лінії терапії переважно рекомендовані комбінації, які включають традиційні ендокринні препарати (здебільшого ІА) та інгібітори контрольних точок (з цією метою найчастіше використовують інгібітори циклінзалежних кіназ 4 і 6). Ці рекомендації стосуються насамперед першої лінії терапії. Проте при неефективності першої лінії або появі значної токсичності рекомендовано перейти на другу та подальші лінії терапії.
Ад’ювантна терапія РМЗ
Що стосується ад’ювантної терапії поширеного РМЗ, то відповідно до сучасних рекомендацій наявні три варіанти ендокринної терапії: upfront therapy – безперервна монотерапія ІА або тамоксифеном протягом 5 років; switching therapy – послідовне застосування тамоксифену протягом 2-3 років з наступним прийомом ІА протягом 3 або 2 років; extended therapy – подовжена до 10 років ад’ювантна ендокринотерапія. Ефективність всіх цих варіантів ад’ювантного лікування оцінена в клінічних дослідженнях [2].
Щодо неоад’ювантної ендокринної терапії РМЗ, то наразі це новий напрям, який швидко розвивається, але, на думку більшості міжнародних медичних товариств, не є загальноприйнятим стандартом лікування РМЗ. У клінічних рекомендаціях неоад’ювантна ендокринотерапія розглядається як опція в осіб похилого віку з супутньою патологією. За даними сучасних досліджень, ефективність неоад’ювантної ендокринотерапії зіставна з такою хіміотерапії. Так, у 2016 р. були оприлюднені результати дослідження L.M. Spring та співавт., у якому оцінювали ефективність застосування ІА в неоад’ювантному режимі при РМЗ [3]. Виявлено, що використання ІА як неоад’ювантної моноендокринотерапії за ефективністю зіставне з поліхіміотерапією за частотою клінічної, радіологічної відповіді та проведення органозбережних операцій. Примітно, що застосування ІА асоціювалося з вищими клінічним і радіологічним рівнем відповіді та частотою органозбережних операцій порівняно з використанням тамоксифену.
Профілактика побічних ефектів протипухлинної терапії
Терапія ІА, незважаючи на переваги перед тамоксифеном, також супроводжується розвитком небажаних ефектів [4]. Найтяжчими побічними ефектами, зумовленими лікуванням ІА, є зниження мінеральної щільності кісткової тканини (МЩКТ), вплив на зір, скелетно-м’язовий синдром, когнітивна дисфункція, серцево-судинні ускладнення та шкірна токсичність.
Зі всіх зазначених побічних ефектів, асоційованих із застосуванням ІА, особливої уваги вимагає зниження МЩКТ, викликане протипухлинною терапією (в англомовній літературі відоме як cancer treatment-induced bone loss). Важливо розуміти, що зниження МЩКТ впливає не лише не якість життя хворої, а й на ЗВ, оскільки остеопоротичні зміни супроводжуються такими тяжкими ускладненнями, як виражений больовий синдром, низькоенергетичні переломи променевої кістки, шийки стегнової кістки, компресійні переломи хребта, включно з ураженням спинного мозку. Однак наявні дані про те, що втрата МЩКТ при застосуванні ІА пов’язана з поліморфізмом генів CYP19, це дозволяє припускати частоту найпоширеніших побічних ефектів, у тому числі і зниження МЩКТ.
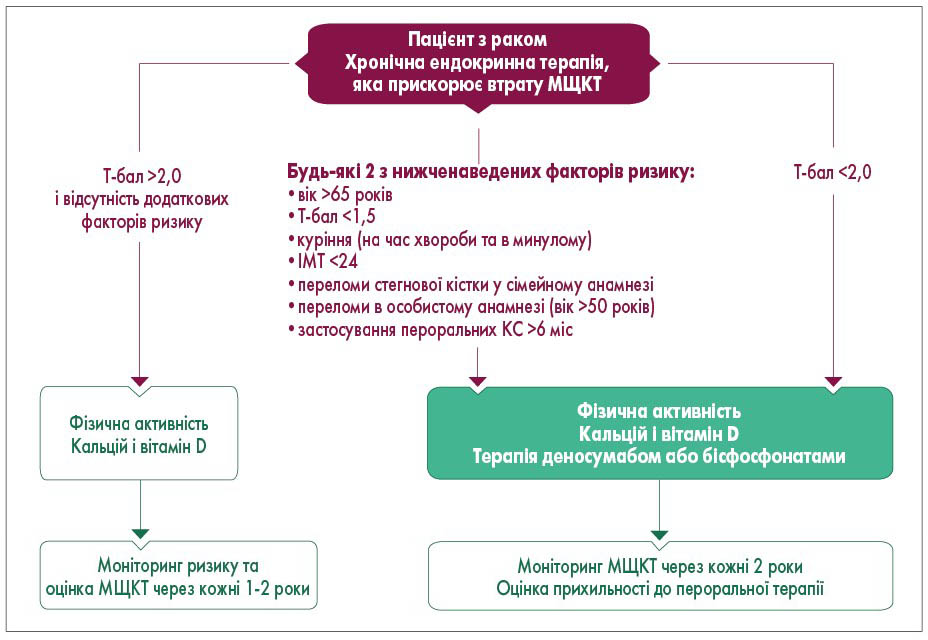
Золотим стандартом виявлення остеопорозу була і залишається подвійна енергетична рентгенівська абсорбціометрія (Dual-energy X-ray absorptiometry), при якій МЩКТ пацієнта порівнюють з МЩКТ здорової молодої дорослої людини. Результатом денситометрії є отримання двох критеріїв: Т-бал – порівняння МЩКТ досліджуваної кісткової тканини з еталонною; Z-бал – порівняння МЩКТ досліджуваних кісток із середнім показником у цій віковій групі. У 2020 р. Європейське товариство медичної онкології (ESMO) у своїй рекомендаціях надало чіткий алгоритм корекції зниження МЩКТ під час протипухлинної терапії, який окрім фізичної активності та вживання добавок кальцію та вітаміну D також передбачає терапію деносумабом або бісфосфонатами (рис.) [5].
Рис. Алгоритм корекції зниження МЩКТ під час протипухлинної терапії
ІМТ – індекс маси тіла; КС – кортикостероїди.
Результати сучасних досліджень також продемонстрували, що застосування бісфосфонатів як ад’ювантної терапії РМЗ також має свої переваги. Зокрема, Австрійська дослідницька група раку молочної залози та колоректального раку (Austrian Breast & Colorectal Cancer Study Group) виявила значне покращення віддалених результатів при додаванні золендронату у жінок з оваріальною супресією при РМЗ. Результати іншого, більш масштабного дослідження AZURE не продемонстрували такого ефекту, проте дали змогу виявити потенційні переваги в підгрупі пацієнток, які перебували в постменопаузі на момент включення у нього [6]. На підставі отриманих даних була висунута гіпотеза про те, що переваги від лікування, ймовірно, може отримати лише підгрупа жінок із низьким рівнем репродуктивних гормонів через фізіологічну/штучну менопаузу внаслідок оваріальної супресії. Ця гіпотеза була перевірена Об’єднаною групою дослідників раннього раку молочної залози (Early Breast Cancer Trialists’ Collaborative Group), яка провела метааналіз наявних даних понад 18 тис. пацієнток із РМЗ. Результати цього аналізу продемонстрували, що ад’ювантне застосування бісфосфонатів зменшує кількість випадків рецидиву та смерті при РМЗ.
У настановах ESMO також рекомендоване використання остеомодифікуючої терапії при ранньому РМЗ. Зокрема, остеомодифікуючі засоби, такі як бісфосфонати, виконують подвійну функцію, що включає інгібування метастазування та запобігання втраті кісткової маси, викликаній протипухлинною терапією [5]. Відповідно до цих рекомендацій, золендронат зазвичай призначають разом з ад’ювантною хіміотерапією і далі вводять через кожні 6 міс або ж використовують ібандронат/клодронат перорально щоденно. Оптимальна тривалість лікування для запобігання розвитку метастазів остаточно не визначена і може складати від 2 до 5 років.
Таким чином, незважаючи на той факт, що протипухлинна терапія супроводжується розвитком побічних ефектів, у тому числі і зниженням МЩКТ, у клініцистів наразі наявні засоби боротьби з цим. Результати сучасних досліджень підтвердили, що остеомодифікуючі агенти, такі як золендронат, ібандронат і клодронат, є ефективними препаратами, які крім запобігання втраті кісткової маси також чинять інгібуючу дію на метастази раку, що в результаті асоціюється зі зменшенням кількості випадків рецидивів і канцерспецифічної смерті у цій групі пацієнтів.
Список літератури знаходиться в редакції.
Підготувала Анна Хиць
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 4 (77) 2022 р