5 січня, 2021
Пухлинне мікрооточення: досягнення у боротьбі з пухлинами
Традиційно лікування раку ґрунтувалося на впливі на неопластичні клітини. Пухлинне мікрооточення може мати предиктивне значення та дає змогу дослідити реакцію ракових клітин на лікування. Пухлинне мікрооточення складається з фібробластів, імунних клітин і клітин кровоносних судин, а також включає білки, що виробляються всіма наявними в пухлині клітинами та підтримують ріст ракових клітин. Моніторинг змін пухлинного мікрооточення за допомогою встановлення його молекулярного та клітинного профілю у міру прогресування злоякісного новоутворення життєво важливий для визначення клітинних або білкових мішеней з метою профілактики та лікування раку.
Пухлинне мікрооточення – це клітинне середовище, в якому пухлина перебуває в організмі людини. Воно включає клітини судин, фібробласти, клітини імунної системи, запальні клітини кісткового мозку, лімфоцити та позаклітинний матрикс. Пухлина може взаємодіяти з навколишнім мікрооточенням, що призводить до різних наслідків. Так, пухлина може взаємодіяти з мікрооточенням, подаючи позаклітинні сигнали, що сприятиме неоангіогенезу й індукуватиме імунну толерантність. Імунні клітини пухлинного мікрооточення також можуть впливати на ріст та еволюцію ракових клітин. Пухлинне мікрооточення сприяє неоднорідності пухлини, воно визнане ключовим фактором, що спричиняє прогресування раку та розвиток стійкості до медикаментозного лікування. Рисунок показує взаємодії різних клітин, які сприяють прогресуванню, інвазивному росту та метастазуванню ракових клітин.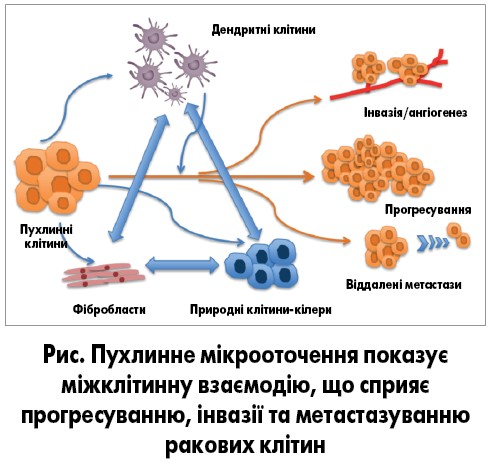
Рак не ізольований у навколишньому середовищі; відбувається взаємодія різних типів клітин, що неконтрольовано ростуть. Ракові клітини також мають характерні особливості, які відрізняються від властивостей здорових тканин, що дозволяє здійснювати прицільний фармакологічний вплив. Ракові клітини – це злоякісні маси клітин, які можуть пошкодити сусідні клітини. Взаємодія між злоякісними та нормальними клітинами створює пухлинне мікрооточення. Незлоякісні клітини пухлинного мікрооточення виконують динамічну функцію та сприяють розвитку пухлини на всіх стадіях канцерогенезу. Пухлинне мікрооточення свідчить про різні рівні метаболічних характеристик пухлин, і це може бути використано для планування лікування. Деякі характеристики пухлинного мікрооточення дозволяють припустити, що непухлинні клітини або медіатори їх взаємодії можуть бути мішенями лікування.
Щоб прогресувати і стати небезпечною для життя, пухлина має розвинути чотири характерні риси:
- здатність до руху;
- здатність деградувати позаклітинний матрикс;
- здатність виживати в крові;
- здатність прижитися в новому тканинному середовищі.
Тканинне мікрооточення має вирішальне значення для вивчення прогресування пухлини та її розвитку в тканинах. Значення мікрооточення під час росту та прогресування пухлини є вирішальним для вивчення та розуміння біології раку, що буде корисним як для діагностики, так і для лікування. Судинна структура пухлин негерметична, і вона накопичує сторонні молекули в крові більшою мірою, ніж нормальні тканини. Мікросередовище пухлини, як правило, гіпоксичне. Оскільки маса пухлини збільшується і вона росте на віддалі від кровоносних судин, це призводить до генетичної неповноцінності. Нестача кисню може також спричинити гліколітичну поведінку в клітинах, викликаючи більшу міграцію клітин in vivo та in vitro. Це також може призвести до деградації позаклітинного матриксу. Реактивні клітини строми карциноми – це сполучнотканинні клітини, розташовані під базальною пластиною, такі як фібробласти, позаклітинний матрикс, клітини, що відповідають за імунітет, та ін. Строма, що оточує пухлину, часто реагує на інтрузію через запалення, подібно до реакції на рани. Запалення може посилити ангіогенез, різко збільшити клітинний цикл, запобігти загибелі клітин і посилити ріст пухлини. Асоційовані з карциномою фібробласти (CAF) – гетерогенна група фібробластів, природна функціональність яких переспрямовується в бік канцерогенезу. CAF виникають із нормальних фібробластів у прилеглій стромі, але також можуть походити з перицитів, фіброцитів, мезенхімальних клітин, клітин гладеньких м’язів, епітеліального або ендотеліального мезенхімального перетворення. CAF in vitro не стримують ріст раку і виконують кілька функцій, що підтримують ріст пухлини. CAF також секретують судинний ендотеліальний фактор росту (VEGF), фактор росту фібробластів (FGF), фактор росту тромбоцитів (PGGF) та інші проангіогенні сигнали, які індукують ангіогенез. CAF також виділяють трансформувальний фактор росту бета (TGF-β), який асоціюється з епітеліальним мезенхімальним перетворенням, і за цим процесом ракові клітини метастазують та інгібують цитотоксичні Т-клітини та природні Т-клітини-кілери. CAF обмежують розподіл клітин, фізично виключаючи клітинним матриксом, а також за допомогою біосинтезу CXXL12.
Останні досягнення в дослідженні пухлинного мікрооточення. Стандартні методи лікування раку ефективні проти ракових клітин, але вони також є причиною пошкодження здорових клітин і тканин. Повільний або швидкий ріст пухлинних клітин призводить до нездатності кровоносних судин забезпечувати оксигенацію та доставку до них поживних речовин, що призводить до дефіциту кисню або появи гіпоксичних ділянок всередині пухлини.
Пухлинне мікрооточення вважається важливим для терапії раку через різний рівень впливу різних методів лікування. Недоліки традиційних методів лікування раку полягають у тому, що судинні структури пухлини є негерметичними та значно дезорієнтованими. Недостатня оксигенація пухлинного ядра призводить до нечутливості до лікування, оскільки клітини, далекі від судин, потребують – і не отримують – поживних речовин, а також і хіміотерапевтичних препаратів.
Сучасні дослідження з лікування пухлин зосереджені на мікрооточенні як окремому асоційованому з раком об’єкті, який може бути мішенню лікування. У хворих на меланому розвивається стійкість як до хіміотерапії, так і до мішеневих препаратів. Хіміотерапія та мішенева терапія, загальноприйняті методи лікування блокуванням імунних контрольних точок не ефективні у всіх хворих на меланому. Низка факторів, таких як генні мутації, функціональна фізіологія клітин і неоднорідність злоякісного новоутворення, сприяють стійкості пухлинних клітин до лікування. Нещодавно проведені дослідження показали роль запального мікрооточення пухлини. Крім того, було доведено, що мультимодальний підхід мішеневої терапії має включати, крім злоякісних клітин, мікрооточення пухлини.
Ангіогенез – утворення нових кровоносних судин, він охоплює міграцію, ріст і диференціювання ендотеліальних клітин, що вистилають внутрішню стінку судин, які контролюються хімічними сигналами в організмі. Контроль ангіогенезу є критичним етапом у прогресуванні раку та його потенційному лікуванні. Роль пухлинного мікрооточення в контролі ангіогенезу та молекулярних взаємодій покращує прогнозування та полегшує мішеневу терапію.
Наше розуміння будови пухлинної строми у поширеному раку покращується за допомогою 3D-систем. Системи доставки ліків, виготовлені із синтетичних і природних біоматеріалів, доправляють ліки для знищення стромальних клітин або перепрограмування мікрооточення з метою інгібування пухлини.
Хіміопрофілактика – це використання фармакологічних або природних засобів, які пригнічують розвиток інвазивного раку, блокуючи пошкодження ДНК, що ініціює канцерогенез, або зупиняючи чи зворотно розвиваючи клітини на стадії передраку. Дослідження первинної дисфункції в пухлинному мікрооточенні та епітеліальної дисфункції мають вирішальне значення для розуміння канцерогенезу, особливо для хіміопрофілактики раку.
Гіпоксичні пухлинні клітини стійкі до лікування, що може бути на поширених стадіях захворювання. Ці клітини пригнічують диференціацію пухлинних клітин і відіграють безпосередню роль у підтримці стовбурових пухлинних клітин. Було виявлено, що вони чинять глибокий вплив на еволюцію пухлинного стромального мікрооточення. Гіпоксія може дозволити створити мікросередовище для диференціації пухлинних і стромальних клітин, тому можна припустити, що націлювання лікування на гіпоксичні стовбурові клітини може бути ключем до його успіху.
У проведених дослідженнях аналізували тимчасові зміни в експресії генів, при яких клітини раку грудної залози виживають і ростуть у головному, кістковому мозку та легеневій тканині, що підтримується в культурі in vivo як моделі метастатичної колонізації цих тканин. Помічено, що тимчасова активація генів, пов’язана з гомеостазом і стресом, пізніше шляхом ускладнення клітинної морфології та клітинного поділу призводить до пристосування та росту клітин у мікросередовищі тканин хазяїна.
При лікуванні раку грудної залози з використанням мікрооточення шляхом генерації вставок ДНК пригнічують топоізомеразу II і перешкоджають реплікації ДНК. Хіміотерапевтичні засоби вбивають ракові клітини, і лікування викликає стромальну реакцію, що призводить до продукування фактора некрозу пухлини ендотеліальними й іншими стромальними клітинами. Мережа мієлоїдних ендотеліально-пухлинних сигнальних взаємодій забезпечує механізм, що пов’язує хіміорезистентність і метастазування з можливістю впливу на них.
Розвиток раку передміхурової залози не обмежується тільки епітеліальними клітинами, а включає також пухлинне мікрооточення. Рак передміхурової залози часто метастазує в кістки, тому проводяться масштабні дослідження з метою аналізу взаємодії між клітинами епітеліального раку передміхурової залози та мікрооточенням кісток. Сигнальні шляхи існують між епітеліальними, стромальними клітинами та позаклітинним матриксом для підтримки прогресування пухлини з первинного місця локалізації до регіонарних лімфатичних вузлів і віддалених органів. Сигнальні шляхи, які беруть участь у нормальному розвитку передміхурової залози та кісток, призводять до порушення регуляції при раку, імітуючи тим самим надмірний ріст клітин і неоваскуляризацію та зумовлюючи інвазивні властивості епітеліальних клітин, ослаблення протипухлинного імунітету та розвиток кастраційно-резистентного захворювання.
Набута стійкість до протипухлинного лікування істотно перешкоджає зменшенню захворюваності та смертності внаслідок злоякісних пухлин. Встановлено, що тканинне мікросередовище впливає на клітинні фенотипи та сприйнятливе до токсичного інсульту. Експресія WNT16B в пухлинному мікрооточенні передміхурової залози послаблювала ефекти цитотоксичної хіміотерапії in vivo, тим самим сприяючи виживанню пухлинних клітин і прогресуванню захворювання. Ці результати окреслюють механізм, за допомогою якого генотоксичне лікування, що проводиться циклічно, може посилити подальшу стійкість до лікування у зв’язку з неавтономними ефектами клітин, яким сприяє пухлинне мікрооточення.
Мікросередовище кісткового мозку забезпечує виживання, диференціацію та проліферацію гемопоетичних клітин, які підтримуються фібробластоподібними стромальними клітинами кісткового мозку, остеобластами й остеокластами. Ці клітини секретують розчинні фактори та білки позаклітинного матриксу, які опосередковують ці функції. Це робить нормальні гемопоетичні клітини та клітини пухлини епітелію, яка метастазує у кістки, захищеними від хіміотерапевтичних засобів. Завдяки цій медикаментозній стійкості клітини пухлини захищені від апоптозу, викликаного як хіміотерапією, так і фізіологічними медіаторами загибелі клітин, це дозволяє їм вижити і спричинити формування мінімальної залишкової хвороби, підвищуючи ймовірність розвитку набутої медикаментозної резистентності.
Рак підшлункової залози є однією з основних причин смерті від раку у світі. Структурні білки пухлинного мікрооточення раку підшлункової залози, включаючи гіалуронан, колаген і секретований білок, багатий цистеїном, можуть бути модифіковані або уражені відповідним лікуванням. Сучасні методи медикаментозного лікування використовують, а не руйнують пухлинне мікрооточення шляхом нормалізації структурних білків, зворотного епітеліально-мезенхімального переходу. Відзначено корисні результати, які можуть бути клінічно оцінені.
Для виявлення тканинної гіпоксії при раку легені зазвичай використовують три методи: 1) вимірювання парціального тиску кисню (pO2) голковими електродами; 2) виявлення індукованих гіпоксією білків у пухлині або крові; 3) візуалізацію гіпоксії та судинної системи пухлини. Сьогодні існує кілька перспективних методів візуалізації гіпоксії та судинної системи пухлини, зокрема динамічна перфузійна візуалізація та позитронно-емісійна томографія із використанням радіомічених нітроімідазолів.
Незважаючи на прогрес у лікуванні раку, більшість злоякісних В-клітинних пухлин залишаються невиліковними. Докази свідчать, що перехресні зв’язки з додатковими стромальними клітинами в спеціалізованих тканинних мікросередовищах, таких як кістковий мозок і вторинні лімфоїдні органи, сприяють прогресуванню захворювання, допомагаючи росту злоякісних В-клітин і їх стійкості до лікарських засобів. При лікуванні окремих В-клітинних злоякісних новоутворень відбувається зміна парадигми до поєднання цитотоксичних препаратів з агентами, які перешкоджають активному впливу пухлинного мікрооточення. Сподіваємось, такі підходи допоможуть усунути залишкові захворювання, тим самим покращуючи наші нинішні терапевтичні зусилля.
Розроблення лікарських препаратів з урахуванням важливості пухлинного мікрооточення. Дослідження мікрооточення пухлини, її клітинних і молекулярних компонентів, а також того, як вони впливають на прогресування пухлини, є новими темами у вивченні раку. Фактори, що виділяють самі пухлинні клітини, зокрема про- чи протизапальні молекули або про- чи антиангіогенні медіатори, сприяють створенню пухлинного середовища. Реакції та молекули, що беруть участь у цих перехресних зв’язках у пухлинному мікрооточенні, стали привабливими мішенями протипухлинного лікування. Строма, що оточує ракові клітини, відіграє важливу роль у вивченні розвитку, прогресування та поведінки пухлини. Повідомлялося, що взаємодія між стромою та новоутвореними клітинами є головним фактором для вивчення росту пухлини та її прогресування. Нове спрямування лікування на пухлинне мікрооточення не лише є перспективним методом, а й допоможе у розробленні препаратів для лікування раку. Мікросередовище пухлини є невід’ємною частиною її фізіології, структури та функціонування, це важливий аспект властивості пухлини, оскільки забезпечує необхідний поживний субстрат для злоякісного процесу. Фундаментальне порушення зв’язків між пухлинними і стромальними клітинами необхідне для росту та прогресування пухлинних метастазів. Стромальні клітини всередині пухлинного мікрооточення є генетично стабільними і можуть служити терапевтичною мішенню при мінімальному ризику будь-яких побічних ефектів або повторного виникнення пухлини. Покращення розуміння цієї взаємодії може забезпечити нові та клінічно цінні мішені лікування раку, а також оцінку ризику та профілактику. Незлоякісні клітини та білки, що секретуються клітинами пухлини та строми, є активними учасниками прогресування раку.
За матеріалами Wang J.-J., Lei K.-F., Han F. Tumor microenvironment: recent advances in various cancer treatments. European Review for Medical and Pharmacological Sciences. 2018; 22: 3855-3864.
Підготував Назар Лукавецький
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 5 (66) 2020 р.



