29 березня, 2023
Мультидисциплінарний підхід у комбінованому лікуванні раку яєчника
Сьогодні циторедуктивна хірургія (CRS) та хіміотерапія (ХТ) залишаються невід’ємними складовими лікування пацієнток із раком яєчника (РЯ). Проте нові досягнення в галузі онкології, зокрема впровадження таргетних препаратів, дали змогу персоналізувати терапію раку, що забезпечило покращення виживаності хворих на РЯ. Веденню пацієнток з РЯ була присвячена Науково-практична конференція з міжнародною участю «Гнатишаківські читання 2022: мультидисциплінарний підхід в комбінованому лікуванні раку яєчників». Провідні вітчизняні й іноземні експерти галузі онкології представили огляд сучасних можливостей лікування хворих на РЯ, фокусуючи увагу на питанні первинної циторедуктивної хірургії (РCS), аспектах лікування пацієнтів поєднанням хірургічних методів і ХТ, а також варіантах підтримуючої терапії при уперше виявленому та рецидивуючому РЯ.
 Про еволюцію поглядів на канцерогенез РЯ розповіла завідувачка кафедри онкології та медичної радіології Львівського національного медичного університету імені Данила Галицького, доктор медичних наук, професор Наталія Антонівна Володько.
Про еволюцію поглядів на канцерогенез РЯ розповіла завідувачка кафедри онкології та медичної радіології Львівського національного медичного університету імені Данила Галицького, доктор медичних наук, професор Наталія Антонівна Володько.
– Сьогодні виділяють п’ять основних патогенетичних варіантів РЯ: серозна карцинома високого ступеня злоякісності, світлоклітинна карцинома, ендометріоїдна карцинома, серозна карцинома низького ступеня злоякісності та муцинозна карцинома. Всі зазначені підтипи характеризуються різним перебігом захворювання та відповідно мають різний прогноз, що також потребує різних підходів до ведення хворих. Таким чином, морфологічна верифікація гістологічного/патогенетичного варіанта РЯ, бажано з проведенням молекулярного профілювання, є обов’язковою до початку терапії РЯ [1]. І хоча сьогодні оцінка гістопатогенетичного типу РЯ критично важлива для визначення подальшої стратегії ведення хворої, й досі значна кількість хірургів-онкологів скептично ставляться до цього дослідження. Це значно ускладнює ведення пацієнток і може призводити до неадекватної терапії. Як відомо, ключовою метою хірургічного лікування РЯ є виконання оптимальної циторедукції з видаленням усіх макроскопічних пухлинних вогнищ [2]. Тому для забезпечення такого результату необхідне проведення повного обсягу всіх діагностичних процедур.
Наразі відомо, що не при всіх типах РЯ можна досягти повного видалення макроскопічних пухлинних вогнищ. Відповідно до сучасних рекомендацій, при обмеженій резектабельності доречне призначення 3-4 циклів неоад’ювантної хіміотерапії (НАХТ) з подальшою циторедукцією та ад’ювантною ХТ. Наразі наявна значна кількість досліджень, результати яких підтверджують, що медіана загальної виживаності (ЗВ) як після CRS, так і після НАХТ із подальшою CRS є однаковою: виживаність без прогресування (ВБП) дорівнює 14-15 міс, а ЗВ – 41-43 міс [3, 4]. При цьому НАХТ асоціюється зі значно меншою кількістю післяопераційних ускладнень.
 Доцент кафедри онкології Національного університету охорони здоров’я України імені П.Л. Шупика, завідувачка відділу малоінвазивної хірургії КНП «Київський міський клінічний онкологічний центр», доктор медичних наук Катерина Володимирівна Харченко у своїй доповіді приділила увагу ключовим аспектам CRS при лікуванні РЯ.
Доцент кафедри онкології Національного університету охорони здоров’я України імені П.Л. Шупика, завідувачка відділу малоінвазивної хірургії КНП «Київський міський клінічний онкологічний центр», доктор медичних наук Катерина Володимирівна Харченко у своїй доповіді приділила увагу ключовим аспектам CRS при лікуванні РЯ.
– Історія CRS бере початок із 1975 р., коли С.Т. Griffiths вперше продемонстрував, що ступінь гістологічної диференціації і розмір найбільшого вогнища залишкової пухлини є незалежними предикторами виживаності хворих при ІІ-ІІІ стадії РЯ. Відтоді минуло вже 47 років, за цей час ведення хворих на РЯ зазнало істотних змін. Сьогодні ключовою метою хірургічного лікування РЯ є повна CRS, яка визначається як відсутність будь-яких макроскопічних залишків пухлини [5, 6]. Якщо проаналізувати результати останніх досліджень щодо виживаності хворих при CRS R0, можна констатувати, що загалом повна CRS (первинна або інтервальна) асоціюється з кращою виживаністю хворих [7-9]. Проте це твердження стосується не всіх груп пацієнток з РЯ. Y.A. Lyons та співавт. (2020) проаналізували дані близько 37 тис. хворих на РЯ, яким проведено РCS в обсязі R0, R1 та НАХТ [10]. Результати цього дослідження продемонстрували, що НАХТ із подальшою інтервальною CRS в обсязі R0 забезпечує таку ж саму виживаність, як і РCS в обсязі R1. Тобто сьогодні найкраща опція – це завжди резекція R0.
За сучасними рекомендаціями, у всіх міжнародних настановах, алгоритм ведення хворих із первинно виявленим РЯ першочергово включає тактику, спрямовану на визначення можливості виконання пацієнтці РCS в обсязі резекції R0. НАХТ показана лише тим хворим, яким неможливе виконання хірургічного втручання в обсязі первинної повної циторедукції. Так, при неможливості проведення РCS пацієнтці з РЯ їй показане призначення НАХТ з подальшою інтервальною CRS [5, 6].
 Головний лікар Лікарні ізраїльської онкології Lisod (м. Київ), доктор медичних наук, професор Алла Борисівна Вінницька присвятила доповідь веденню пацієнток із поширеним РЯ, зокрема у фокусі нових можливостей першої лінії терапії РЯ.
Головний лікар Лікарні ізраїльської онкології Lisod (м. Київ), доктор медичних наук, професор Алла Борисівна Вінницька присвятила доповідь веденню пацієнток із поширеним РЯ, зокрема у фокусі нових можливостей першої лінії терапії РЯ.
– Упродовж багатьох років стандартом першої лінії терапії при РЯ залишається режим карбоплатин + паклітаксел 1 раз через кожні 3 тижні [11, 12]. Останні роки ознаменувалися пошуком більш ефективних стратегій лікування РЯ, оскільки сучасні дані свідчать про недостатню ефективність стандартного режиму терапії [13-16]. За клінічними даними, на фоні застосування режиму карбоплатин + паклітаксел 1 раз через кожні 3 тижні ВБП складає 12-18 міс, 5-річна ЗВ ≤35%. Перебіг РЯ характеризується розвитком рецидивів і зменшенням тривалості безрецидивних періодів після кожного наступного рецидиву [17]. Рецидив, який розвинувся протягом 6 міс після завершення терапії на основі препаратів платини, визначається як платинорезистентний. Якщо рецидив виник через ≥6 міс, його класифікують як платиночутливий. Цей варіант рецидиву характеризується кращим прогнозом для пацієнтки і дає можливість повторити курс лікування препаратами платини. Метааналіз даних пацієнток з РЯ IIB-IV стадії за FIGO у рамках досліджень AGO (AGO Ovar 3, 5, 7), яким було проведено ХТ першої лінії, продемонстрував, що 17,2% пацієнток з РЯ мали платинорезистентний рецидив, 56,2% – платиночутливий, а у 22,6% рецидиву не спостерігалося протягом 5 років [17]. На ефективність наступних ліній ХТ при РЯ впливає тривалість так званого безплатинового періоду. Так, що коротший інтервал між попередньою та наступною лініями терапії, то нижчий рівень загальної відповіді, ВБП і ЗВ [17].
Враховуючи недостатню ефективність сучасних стандартів лікування РЯ, пошук нових терапевтичних можливостей є актуальним питанням сучасної онкогінекології. Проведення повної CRS стало першим кроком в еволюції лікування РЯ, що сьогодні дозволяє істотно підвищувати рівень виживаності пацієнток з РЯ. У 2009 р. A. du Bois та співавт. презентували результати дослідження, згідно з якими проведення повної CRS без макроскопічних ознак пухлини дозволяє збільшити медіану ЗВ на 60,3 міс при IIB-ІІІВ стадії за FIGO, на 46,9 міс – при ІІІС стадії та на 30,0 міс – при IV стадії. З огляду на отримані результати, можна констатувати, що відсутність макроскопічних ознак пухлини має бути основною метою CRS.
Наступним етапом еволюції лікування РЯ стало впровадження підтримуючої терапії, яка наразі включає застосування гормональних і таргетних препаратів [18-20]. Підтримуюча терапія застосовується у разі серозного РЯ високого ступеня злоякісності (HGSOC) у першій лінії та при рецидиві (бевацизумаб, олапариб), а при РЯ низького ступеня злоякісності (LGSOC) – додатково до першої лінії терапії (ендокринна терапія інгібіторами ароматази, тамоксифеном). Сьогодні в арсеналі клініцистів наявні два препарати для підтримуючої терапії у разі HGSOC: бевацизумаб та олапариб. Бевацизумаб – моноклональне антитіло, отримане за допомогою ДНК-технології. Бевацизумаб зв’язується з фактором росту ендотелію судин (VEGF), ключовим фактором васкулогенезу й ангіогенезу, пригнічуючи таким чином зв’язування VEGF з його рецепторами Flt-1 (VEGFR-1) та KDR (VEGFR-2) на поверхні ендотеліальних клітин [21]. Олапариб – потужний інгібітор полі(АДФ-рибози)-полімераз людини (PARP1, PARP2 і PARP3), який пригнічує ріст деяких пухлинних клітин in vitro та ріст пухлин in vivo у разі застосування окремо або в комбінації із традиційними лікарськими засобами ХТ. PARP-ферменти необхідні для ефективної репарації одноланцюгових розривів ДНК [22].
Наразі зібрана значна доказова база щодо ефективності застосування цих двох препаратів при РЯ. У 2018 р. були презентовані результати рандомізованого дослідження GOG0218, в якому оцінювався вплив бевацизумабу у дозі 15 мг/кг маси тіла на тривалість виживаності пацієнток з РЯ ІІІ-IV стадії. Згідно з отриманими результатами, додавання до ХТ бевацизумабу без продовження його прийому у підтримуючому режимі не забезпечує статистично значущого впливу на медіану ВБП. Схема ХТ + бевацизумаб з продовженням його застосування в підтримуючому режимі покращує медіану ВБП на 3,8 міс порівняно з ХТ. Що стосується ЗВ, результати не продемонстрували статистично значущої різниці в пацієнток, які отримували бевацизумаб і лише ХТ, окрім підгрупи жінок з РЯ IV стадії (відношення ризиків – ВР – 0,75; 95% довірчий інтервал – ДІ – 0,59-0,95) та осіб з асцитом (ВР 0,82; 95% ДІ 0,7-0,96; р=0,014) [23].
У 2015 р. оприлюднені результати багатоцентрового рандомізованого дослідження III фази ICON7, які засвідчили, що додавання бевацизумабу (7,5 мг/кг) до ХТ та продовження його прийому в підтримуючому режимі не має статистично значущого впливу на медіану ВБП і ЗВ у загальній групі пацієнток порівняно лише з ХТ. Додавання бевацизумабу статистично значуще покращує медіану ВБП на 5,5 міс, а медіану ЗВ – на 9,4 міс порівняно лише з ХТ у пацієнток із високим ризиком (III стадія з неоптимальною циторедукцією, IV стадія або неоперабельні пацієнтки) [24].
Таким чином, до сьогодні стандартом першої лінії терапії РЯ була комбінація карбоплатин + паклітаксел. За останні 20 років ЗВ пацієнток з РЯ майже не змінилася, а підтримуюча терапія бевацизумабом дозволила незначно подовжити медіану ВБП, тоді як ЗВ у загальній популяції пацієнтів залишилася без змін.
За сучасними міжнародними рекомендаціями (NCCN, SGO, ASCO, ESMО), визначення BRCA-статусу рекомендоване всім жінкам із немуцинозним РЯ під час встановлення діагнозу, незалежно від сімейного анамнезу. Визначення мутації BRCA має значення перед обранням стратегії лікування пацієнтки, зокрема забезпечує оцінку ризику РЯ, вибір тактики лікування, а також є важливою прогностичною ознакою. BRCA-тестування пацієнток із РЯ допомагає виявити жінок із підвищеним ризиком розвитку другого раку (раку молочної залози) і дозволяє оцінити ступінь ризику розвитку злоякісних пухлин у їхніх родичів для ранньої діагностики та своєчасного лікування [25]. У 2018 р. було презентовано дані дослідження B. Norquist та співавт. (2018), згідно з якими додавання бевацизумабу у схему терапії пацієнток з мутаціями BRCA не мало статистично достовірного впливу на ВБП, натомість у хворих без мутації BRCA бевацизумаб статистично значуще покращив ВПБ.
У 2018 р. оприлюднені перші результати міжнародного відкритого рандомізованого дослідження III фази SOLO-1, що дозволили змінити підходи до лікування пацієнток з РЯ та розширити арсенал засобів підтримуючої терапії. У ньому оцінювали ефективність підтримуючої терапії олапарибом у пацієнток з уперше встановленим діагнозом серозний чи ендометріоїдний РЯ високого ступеня злоякісності ІІІ-IV стадії за FIGO, рак маткових труб або первинний перитонеальний рак із мутаціями BRCA1, BRCA2 чи обох генів (BRCA1/2), у яких отримано повну або часткову відповідь на платиновмісну ХТ. Загалом до дослідження було включено 391 пацієнтку, яких рандомізували на дві групи у співвідношенні 2:1: перша група отримувала олапариб (n=260), друга група – плацебо (n=131). Лікування проводили до прогресування хвороби, у разі відсутності ознак хвороби терапію припиняли через 2 роки. Пацієнтки із частковою відповіддю могли отримувати лікування довше ніж 2 роки. Результати дослідження продемонстрували, що за медіани тривалості терапії 2 роки у пацієнток з уперше виявленим поширеним РЯ з мутаціями BRCA олапариб (Лінпарза) забезпечував безпрецедентне збільшення медіани ВБП до 56 міс порівняно із 13,8 міс у пацієнток з контрольної групи. Через 5 років спостереження ефективність 2-річної підтримуючої терапії олапарибом щодо ВБП зберігалася навіть після її закінчення зі зниженням ризику прогресування чи смерті на 67% (рис. 1). Через 5 років від початку дослідження 48% пацієнток у групі олапарибу не мали прогресування захворювання порівняно з 21% пацієнток у групі плацебо [26, 28].
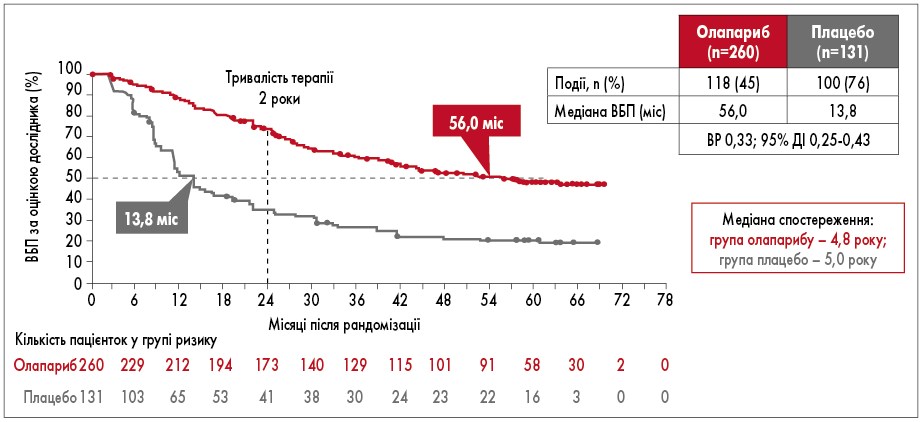 Рис. 1. ВБП у дослідженні SOLO-1
Рис. 1. ВБП у дослідженні SOLO-1
Що стосується впливу виду циторедукції, то за отриманими даними, первинна циторедукція забезпечувала вищу ВБП в обох групах порівняно з інтервальною. Однак у пацієнток з інтервальною циторедукцією в групі олапарибу ВБП була вищою, ніж у пацієнток із первинною циторедукцією в групі плацебо (рис. 2). Застосування олапарибу також асоціювалося з кращими показниками виживаності, незалежно від результатів операції: у пацієнток з групи олапарибу із залишковою резидуальною пухлиною після циторедукції ВБП була більшою, ніж у групі плацебо без залишкової резидуальної пухлини. Пацієнтки з частковою відповіддю після ХТ при застосуванні олапарибу досягали повної відповіді в 2,3 раза частіше, ніж при використанні плацебо [27]. ВБП у пацієнтів з повною клінічною відповіддю після ХТ у групі олапарибу склала 52 проти 22% у групі плацебо через 5 років спостереження [28].
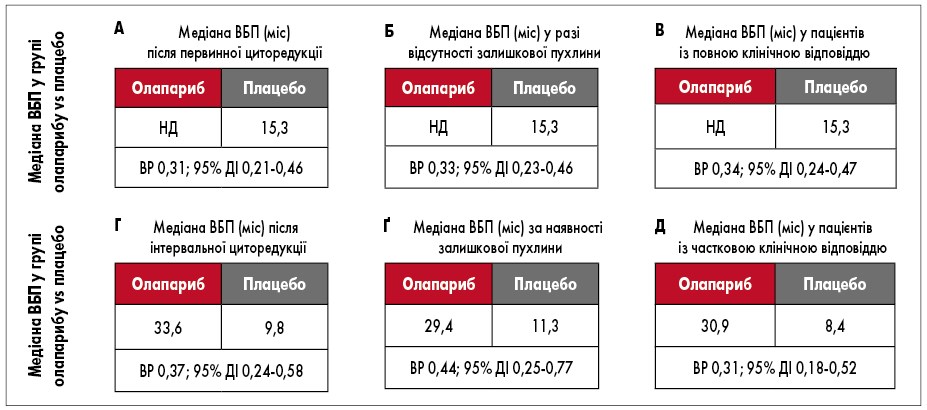 Рис. 2. Підгруповий аналіз ВБП дослідження SOLO-1: залежно від виду циторедукції (А та Г), від результату операції (Б та Ґ), від клінічної відповіді на платиновмісну ХТ (В та Д)
Рис. 2. Підгруповий аналіз ВБП дослідження SOLO-1: залежно від виду циторедукції (А та Г), від результату операції (Б та Ґ), від клінічної відповіді на платиновмісну ХТ (В та Д)
НД – не досягнута.
У 2022 р., через 7 років від початку дослідження SOLO-1, в рамках конгресу ASCO були презентовані результати ЗВ пацієнтів груп олапарибу та плацебо. 67% пацієнтів із групи олапарибу та 46,5% пацієнтів із групи плацебо були живі (рис. 3). Ці результати є додатковим підтвердженням того, що користь від підтримуючої терапії олапарибом (Лінпарза) виходить за межі медіани 2-річного прийому препарату. Перевага олапарибу щодо ЗВ спостерігається незважаючи на те, що понад 40% пацієнтів з групи плацебо отримували подальшу терапію інгібітором PARP [29].
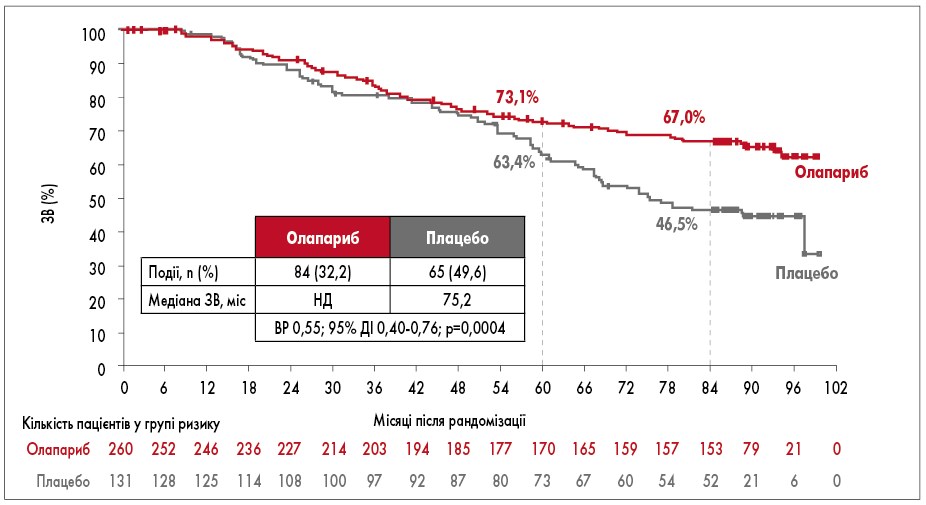 Рис. 3. ЗВ через 7 років від початку дослідження SOLO-1
Рис. 3. ЗВ через 7 років від початку дослідження SOLO-1
Таким чином, дані сучасних досліджень підтверджують ефективність використання олапарибу (Лінпарза) в першій лінії підтримуючої терапії пацієнток з BRCA-асоційованим РЯ. Через 7 років від початку дослідження SOLO-1 продемонстровано клінічно значущу перевагу щодо ЗВ у пацієнток, які отримували олапариб.
У процесі гомологічної рекомбінації крім генів BRCA беруть участь і інші гени, мутації яких можуть призвести до дефіциту гомологічної рекомбінації (HRD). Нещодавно оприлюднені результати рандомізованого дослідження PAOLA-1, в якому оцінювалася ефективність підтримуючої терапії олапарибом у комбінації з бевацизумабом у пацієнток з уперше діагностованим поширеним РЯ. У дослідження були включені пацієнтки з РЯ (серозним або ендометріоїдним) з високим ризиком і ІІІ-IV стадією за FIGO, у яких досягнута відповідь на першу лінію платиновмісної ХТ з бевацизумабом. Попередньо учасницям дослідження визначили BRCA- та HRD-статус: 48% жінок мали HRD-позитивний статус, у 29% була виявлена мутація BRCA. Загалом до дослідження було включено 806 пацієнток, яких рандомізували на дві групи у співвідношенні 2:1: перша група отримувала олапариб у дозі 300 мг 2 р/добу протягом 24 міс, друга контрольна група – плацебо. Усі пацієнтки приймали бевацизумаб у дозі 15 мг/кг через кожні 3 тижні впродовж 15 міс. Результати дослідження продемонстрували, що олапариб у комбінації з бевацизумабом значуще підвищує ВБП порівняно з плацебо + бевацизумаб (22,1 проти 16,6 міс; ВР 0,59; 95% ДІ 0,49-0,72; p<0,0001) у загальній популяції пацієнток. Підгруповий аналіз показав значущу перевагу комбінації олапариб + бевацизумаб у пацієнток з HRD-позитивним статусом (включаючи мутації BRCA) порівняно з плацебо + бевацизумаб: медіана ВБП становила 37,2 та 17,7 міс відповідно (ВР 0,33; 95% ДІ 0,25-0,43) [30]. Підгруповий аналіз ефективності застосування олапарибу з бевацизумабом у пацієнток з HRD-позитивним статусом без tBRCA продемонстрував, що медіана ВБП на фоні застосування олапарибу склала 28,1 порівняно з 16,6 міс у групі плацебо (ВР 0,43; 95% ДІ 0,28-0,66) [30].
У багатьох лікарів виникає практичне питання: чи можна використовувати PARP-інгібітори повторно? У дослідженні OReO оцінювалася ефективність призначення повторного курсу олапарибу у пацієнток з рецидивуючим РЯ після закінчення підтримуючої терапії PARP-інгібітором і відповіддю на подальшу платиновмісну ХТ. Результати дослідження продемонстрували, що подовження ВБП спостерігалося при повторному лікуванні олапарибом, незалежно від BRCA-статусу [31].
Таким чином, дані сучасних досліджень свідчать на користь підтримуючої монотерапії олапарибом у пацієнток з уперше виявленим поширеним РЯ за наявності мутацій у генах BRCA або його використання в комбінації з бевацизумабом у підтримуючому режимі у пацієнток з уперше виявленим поширеним РЯ й підтвердженим BRCA- та/або HRD-позитивним статусом.
 Доцент кафедри онкології Львівського національного медичного університету ім. Данила Галицького, кандидат медичних наук Роман Романович Ярема представив доповідь «Вторинна циторедукція та НІРЕС в комбінованому лікуванні рецидивного РЯ», в якій детально зупинився на персоналізованому лікуванні хворих на РЯ.
Доцент кафедри онкології Львівського національного медичного університету ім. Данила Галицького, кандидат медичних наук Роман Романович Ярема представив доповідь «Вторинна циторедукція та НІРЕС в комбінованому лікуванні рецидивного РЯ», в якій детально зупинився на персоналізованому лікуванні хворих на РЯ.
– Важливим прогностичним чинником та об’єктивним критерієм стадіювання перитонеального канцероматозу є перитонеальний раковий індекс (peritoneal cancer index – РСІ), що використовується як непрямий показник можливості досягнення повної CRS. Чим ефективніше буде проведена CRS, тим кращий прогноз будуть мати хворі цієї групи. РСІ, окрім прогностичного значення, також дає можливість селекції пацієнток, які є кандидатками на агресивне лікування. При цьому ступінь перитонеального канцероматозу за допомогою РСІ можна оцінювати не лише інтраопераційно, а й радіологічно, за допомогою мультиспіральної комп’ютерної томографії [32, 33]. Дані літератури свідчать, що навіть у групі хворих зі сприятливим прогнозом, яким була проведена повна CRS, іноді реєструють інтраперитонеальні рецидиви, що в деяких випадках є ранніми, а отже питання персоналізованого підходу до цієї групи пацієнток залишається актуальним.
У 2017 р. оприлюднені перші результати рандомізованого дослідження AGO-OVAR DESKTOP III, ключовою метою якого було оцінити ефективність CRS у пацієнток із рецидивним РЯ, чутливим до препаратів платини. Результати дослідження продемонстрували, що вторинна CRS може мати високу клінічну ефективність у хворих із платиночутливим серозним рецидивуючим РЯ, у яких прогнозується висока ймовірність повної резекції. Порівняно з неповною повна CRS сприяла збільшенню медіани ЗВ на 33,1 міс та зниженню ризику смерті на 60% [34].
Ключовим висновком дослідження стало те, що вторинна CRS може мати значну клінічну користь у пацієнток із платиночутливим серозним рецидивним РЯ, у яких прогнозується висока ймовірність повної резекції. Враховуючи отримані дані, сьогодні пацієнткам із платиночутливим серозним рецидивним РЯ рекомендовано проходити скринінг відповідності критеріям CRS та консультування з приводу можливих варіантів подальшого ведення [35]. Проте, враховуючи вищенаведені дані, постає питання: чи повнота CRS є єдиним визначальним фактором прогнозу комбінованого лікування рецидивного РЯ? За сучасними відомостями, при досягненні частоти повної CRS (СС-0/1) 87% медіана безрецидивної виживаності складає лише 14,2 міс, а 3-річна безрецидивна виживаність досягає лише 17% [36].
Таким чином, сьогодні стає зрозумілим, що врахування лише клініко-хірургічних критеріїв прогнозу не дає можливості досягнути стабільної ремісії у потенційно сприятливій групі хворих з повною CRS імплантів з очеревини. Це диктує необхідність пошуку нових стратегій персоналізованого підходу.
 Про сучасний алгоритм лікування BRCA-асоційованого поширеного РЯ розповів завідувач відділення хіміотерапії КНП ЛОР «Львівський онкологічний регіональний лікувально-діагностичний центр», кандидат медичних наук Ярослав Васильович Шпарик.
Про сучасний алгоритм лікування BRCA-асоційованого поширеного РЯ розповів завідувач відділення хіміотерапії КНП ЛОР «Львівський онкологічний регіональний лікувально-діагностичний центр», кандидат медичних наук Ярослав Васильович Шпарик.
– У більшості пацієнток з РЯ неможливо досягти повного одужання за допомогою оперативного лікування з подальшою ад’ювантною ХТ. У 70% хворих цієї групи розвивається рецидив. Це вимагає призначення їм повторних курсів ХТ, що, звичайно, асоціюється з накопиченням токсичності, а також обмежує для них варіанти лікування в майбутньому [37]. Відомо, що після кожного наступного циклу терапії рецидивуючого РЯ скорочується період ремісії та розвивається резистентність до препаратів платини. І якщо в першій лінії терапії можна досягнути ВБП 1,5 року, то кожна наступна лінія супроводжується зменшенням цього показника. Враховуючи ці дані, ключовою метою лікування рецидивуючого РЯ є збільшення тривалості ремісії у ранніх лініях терапії [37].
Однією зі стратегій подовження ремісії є концепція підтримуючої терапії. Вона полягає у лікуванні пухлини за допомогою препаратів, що застосовуються зазвичай після початкового етапу ХТ. Підтримуюча терапія рекомендується з метою запобігання рецидиву захворювання, а також для уповільнення росту пухлини при її частковій відповіді після первинного лікування, подовження часу до прогресування і ЗВ. Із цією метою, за рекомендаціями Національної онкологічної мережі США (NCCN, 2022), одним із варіантів, який можна використовувати, є PARP-інгібітори [38]. Одним із представників цієї групи, який зареєстрований в Україні, є олапариб (Лінпарза).
Ефективність використання PARP-інгібіторів (Лінпарза) при РЯ сьогодні підтверджена результатами численних досліджень. Одним із перших досліджень олапарибу в лікарській формі таблеток є дослідження ІІІ фази SOLO‑2 [39]. Загалом до дослідження було включено 295 пацієнток із рецидивуючим серозним або ендометріоїдним РЯ високого ступеня злоякісності, чутливим до препаратів платини, із підтвердженими гермінальними або соматичними мутаціями BRCA 1/2 та із клінічною повною або частковою відповіддю після завершення останнього курсу ХТ на основі препаратів платини (мінімум 4 цикли), статусом за ECOG 0-1. Учасниць рандомізували на дві групи у співвідношенні 2:1: перша група (n=196) отримувала 300 мг олапарибу (2 таблетки по 150 мг), друга група (n=99) – плацебо двічі на добу. Згідно з результатами дослідження, підтримуюча терапія олапарибом значно подовжила ВБП порівняно з плацебо. Так, медіана ВБП у групі олапарибу склала 19,1 міс, у групі плацебо – 5,5 міс (відносний ризик 0,30; 95% довірчий інтервал 0,22-0,41; р<0,0001). Підтримуюча терапія олапарибом також сприяла клінічно значущому збільшенню ЗВ порівняно з плацебо [40, 41].
Наявність статусу HRD виявляють приблизно в половині випадків серозних пухлин яєчників високого ступеня злоякісності. Наявна пряма залежність між порушеннями гомологічної рекомбінації та чутливістю до препаратів платини й олапарибу: що вищий рівень HRD, то більшою є чутливість до впливу цих засобів. У пацієнток із рецидивуючим РЯ чутливість до препаратів платини може використовуватись як сурогатний маркер для визначення HRD. Тому при підтримуючій терапії відповідь на ХТ препаратами платини залишається прогностичним маркером користі від застосування інгібіторів PARP. За наявними даними, клінічний портрет пацієнтки із потенційною чутливістю до PARP-інгібіторів включає переважно серозний епітеліальний РЯ високого ступеня злоякісності, тривалий період ремісії після першої лінії лікування або рецидиву та високу частоту відповіді на препарати платини у першій або наступних лініях терапії [42, 43].
У червні 2022 р. в рамках конгресу Американського товариства клінічної онкології були презентовані результати проспективного відкритого багатоцентрового дослідження IV фази ORZORA із реальної клінічної практики. У ньому брали участь пацієнтки із платиночутливим рецидивуючим РЯ та мутацією BRCA, а також з мутаціями в генах HRR за умови відсутності мутацій у генах BRCA [44]. Пацієнток було рандомізовано у три групи: із соматичними мутаціями в генах BRCA, спадковими мутаціями в генах BRCA та дослідницьку когорту з мутаціями у генах HRR. Всі три групи отримували підтримуючу терапію олапарибом у лікарській формі капсул у дозі 400 мг двічі на добу. Згідно з результатами дослідження, підтримуюча терапія олапарибом продемонструвала клінічну ефективність у пацієнток із платиночутливим рецидивуючим РЯ незалежно від виду (соматична або гермінальна) наявної мутації BRCA або з мутаціями в генах HRR і відсутністю BRCAm. За отриманими даними, медіана ЗВ досягла 3,5 року у всіх трьох групах пацієнток із рецидивуючим РЯ в умовах клінічної практики [44].
У рандомізованому дослідженні STUDY19 оцінювали ефективність застосування олапарибу у лікарській формі капсул у дозі 400 мг двічі на добу при платиночутливих рецидивах РЯ незалежно від статусу BRCA. Згідно з отриманими результатами, застосування олапарибу асоціювалося зі значущим підвищенням ВБП порівняно з плацебо (ВР 0,35; 95% ДІ 0,25-0,49; р<0,001): медіана ВБП склала 8,4 міс у групі олапарибу та 4,8 міс у групі плацебо. Після проведення підгрупового аналізу залежно від наявності мутації BRCA найбільшу користь спостерігали у хворих із позитивним BRCA-статусом, у яких медіана ВБП склала 11,2 порівняно з 4,3 міс у групі плацебо (ВР 0,18; 95% ДІ 0,10-0,31; p<0,0001). Але й у пацієнток без мутації BRCA спостерігалося значуще покращення ВПБ. Медіана ВБП дорівнювала 7,4 проти 5,5 міс (ВР 0,54; 95% ДІ 0,34-0,85; p=0,0075) [42, 43].
Список літератури знаходиться в редакції.
Підготувала Анна Хиць
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 6 (79) 2022 р.



