30 травня, 2023
Рецидивна/рефрактерна мієлома: пошук оптимального клінічного рішення
Рецидивна/рефрактерна (р/р) множинна мієлома (MM) є викликом для медичної спільноти, оскільки при цій хворобі рівень смертності високий, а можливості лікування обмежені. Ведення пацієнтів з р/рММ потребує індивідуального підходу, а також використання ефективних і безпечних методів терапії. 31 березня відбулася Рада експертів, на якій провідні фахівці галузі обговорили найбільш проблемні питання ведення пацієнтів цієї групи.
.jpg) Про захворюваність на ММ, виживаність пацієнтів із цією патологією, клінічну практику та стан забезпечення лікуванням при р/рММ розповіла керівниця відділу хіміотерапії гемобластозів та ад’ювантних методів лікування ДНП «Національний інститут раку» (м. Київ), доктор медичних наук, професор Ірина Анатоліївна Крячок.
Про захворюваність на ММ, виживаність пацієнтів із цією патологією, клінічну практику та стан забезпечення лікуванням при р/рММ розповіла керівниця відділу хіміотерапії гемобластозів та ад’ювантних методів лікування ДНП «Національний інститут раку» (м. Київ), доктор медичних наук, професор Ірина Анатоліївна Крячок.
– За останнє десятиріччя загальна виживаність (ЗВ) пацієнтів з ММ значно покращилася, що пов’язано з розробленням нових лікарських препаратів (S.K. Kumar, 2008; 2014). Світові дані щодо ЗВ при ММ свідчать, що медіана цього показника у пацієнтів із цим захворюванням становить 73 міс, тоді як в Україні значно менша – до 24 міс (Z. Fedorenko, 2022). Такі дані щодо виживаності хворих, звичайно, пов’язані з проблемами діагностики ММ в Україні та обмеженим доступом до відповідних новітніх лікарських засобів.
Відповідно до сучасних рекомендацій, які прийняті у світі та застосовуються в Україні, діагностичні критерії ММ включають:
- наявність ≥10% плазматичних клітин у кістковому мозку або підтвердженої біопсією кісткової чи екстрамедулярної плазмоцитоми;
- будь-який один або більше з таких факторів, що визначають ММ:
- вміст кальцію на 0,25 ммоль/л (>1 мг/дл) перевищує верхню межу норми або >2,75 ммоль/л (>11 мг/дл);
- ниркова недостатність (рівень креатиніну >2 мг/дл або >177 мкмоль/л) чи кліренс креатиніну <40 мл/хв;
- анемія (вміст гемоглобіну <100 г/л або на 20 г/л нижчий за нижню межу норми);
- одне чи більше остеолітичних уражень за даними рентгенографії кісток скелета, комп’ютерної томографії або позитронно-емісійної комп’ютерної томографії із фтордезоксиглюкозою;
- клональні плазматичні клітини у кістковому мозку ≥60%;
- співвідношення вільних легких ланцюгів імуноглобулінів (FLC) сироватки ≥100 та концентрація FLC 100 г/л або вище;
- >1 вогнищевого ураження ≥5 мм за даними магнітно-резонансної томографії (S.V. Rajkumar, 2014).
Зважаючи на ці критерії, можна констатувати, що сьогодні в Україні доступні більшість необхідних процедур для діагностики ММ, в тому числі цитологічне, імуногістохімічне й інструментальні дослідження, які оплачуються за державні кошти. Доступність цитогенетичного дослідження наразі обмежена, що унеможливлює якісну діагностику ММ, стадіювання патологічного процесу, як зазначено в сучасних рекомендаціях Міжнародної робочої групи з мієломи (IMWG; S.V. Rajkumar, 2014; A. Palumbo, 2015). Окрім того, відсутність якісної діагностики також не дає змоги стратифікувати пацієнтів на групи ризику, що відповідно впливає на вибір тактики лікування (A. Dispenzieri, 2007).
За останні 20 років – з 2003 р. і до сьогодні – тактика лікування ММ значно змінилася, що пов’язано із впровадженням нових терапевтичних агентів. Так, поява бортезомібу у 2003 р. стала значним проривом у терапії ММ, відтоді були презентовані й інші препарати, в тому числі карфілзоміб (2012 р.), іксазоміб (2015 р.) та ін. Що стосується сучасних підходів до лікування, протягом тривалого часу загальний підхід до ведення пацієнтів з ММ передбачав оцінку можливості проведення аутологічної трансплантації гемопоетичних стовбурових клітин (ТГСК) з подальшим призначенням три- або чотирикомпонентної терапії зі включенням різних класів препаратів (наприклад, бортезоміб, леналідомід, дексаметазон і даратумумаб або інші; M.A. Dimopoulos, 2021). Ведення пацієнтів з рецидивом ММ складніше та має свої особливості, зокрема вибір тактики лікування базується на індивідуальних характеристиках пацієнта, особливистях пухлини, часом після першої лінії терапії – на відповіді на попереднє лікування та доступності препаратів (M.A. Dimopoulos, 2021).
За останні роки ефективність терапії ММ значно підвищилася завдяки послідовному використанню сучасних лікарських препаратів. Сьогодні в арсеналі лікарів наявна значна кількість новітніх лікарських засобів, вибір яких має ґрунтуватися на характеристиках пацієнта, особливистях пухлини та меті лікування. Враховуючи, що значна частина пацієнтів з ММ не доживають до третьої і наступних ліній терапії, важливим є вибір оптимальної із всіх доступних стратегій першої лінії терапії. Водночас є необхідність розширити арсенал сучасних препаратів для лікування ММ відповідно до стандартів Національної онкологічної мережі США або Європейського товариства медичної онкології (ESMO).
Після доповіді відбулася відкрита дискусія щодо сучасного стану забезпечення лікуванням хворих на р/рMМ. Під час обговорення провідні експерти галузі – Ірина Анатоліївна Крячок, Сергій Вікторович Клименко, доктор медичних наук, професор, керівник Центру гематології, хіміотерапії гемобластозів та трансплантації кісткового мозку Клінічної лікарні «Феофанія» ДУС, завідувач кафедри клінічної лабораторної діагностики Національного університету охорони здоров’я України імені П.Л. Шупика (м. Київ), Ірина Степанівна Коренькова, завідувачка відділення трансплантації кісткового мозку і інтенсивної терапії для дітей та дорослих КНП «Київський центр трансплантації кісткового мозку», Наталія Любомирівна Глушко, кандидат медичних наук, завідувачка відділення гематології Івано-Франківської обласної клінічної лікарні, Тетяна Валеріївна Скрипець, лікар-гематолог відділення гематології Інституту онкології Джованні Паоло II (м. Барі, Італія), Лесь Миронович Лукавецький, кандидат медичних наук, старший науковий співробітник відділення гематології ДУ «Інститут патології крові та трансфузійної медицини НАМН України» (м. Львів), Ірина Борисівна Титоренко, кандидат медичних наук, провідний науковий співробітник науково-дослідного відділення хіміотерапії гемобластозів ДНП «Національний інститут раку» (м. Київ) та Тетяна Вікторівна Каднікова, завідувачка відділення онкогематології ДНП «Національний інститут раку» (м. Київ) – відповіли на найбільш актуальні питання щодо ведення хворих на р/рММ в Україні.
? Яка кількість пацієнтів з р/рММ в Україні?
– За даними бюлетеня Національного канцер-реєстру, в Україні зареєстровано до 60 тис. випадків злоякісних новоутворень крові, з яких на лейкоз припадає 23 031, неходжкінську лімфому – 15 551, лімфому Ходжкіна – 15 415 та ММ – 4096.
? Які фактори обмежують доступ пацієнтів з р/рММ до лікування в Україні?
– Ключовими факторами, які впливають на можливість пацієнта отримати якісну медичну допомогу в нашій країні, є фінансові труднощі й обмежений доступ до новітніх лікарських засобів. Так, Україна є країною з низьким рівнем доходів, що може обмежувати доступність для пацієнтів новітніх дорогих препаратів для лікування р/рММ. Окрім того, в Україні можуть бути недоступні нові методи та препарати для лікування захворювань через відсутність регуляторного схвалення або реєстрації.
? Чи відрізняється практика ведення пацієнтів з р/рММ в Україні від міжнародних клінічних рекомендацій?
– Українські клінічні настанови щодо лікування р/рММ базуються на міжнародних рекомендаціях і включають такі стандартні методи лікування, як хіміотерапія, імунотерапія, аутологічна ТГСК та інші. Клінічна практика в Україні відповідає міжнародним рекомендаціям щодо діагностики та клінічного моніторингу, схем першої лінії терапії, але істотно обмежена у виборі лікувальних опцій для хворих на р/рММ. Тому лікування цієї когорти пацієнтів часто буває ускладнене в плані вибору ефективної комбінації препаратів або профілю безпеки через стан хворого чи його коморбідність.
? Яка схема лікування р/рММ в Україні є оптимальною?
– Оптимальна схема лікування може варіювати залежно від багатьох факторів, таких як вік пацієнта, стадія хвороби, наявність супутніх захворювань, попереднє лікування, а також від доступних лікарських засобів. Особливо гостро ця проблема постає у пацієнтів з кількома лініями лікування.
.jpg) Сергій Вікторович Клименко у своїй доповіді сфокусував увагу на ключових перевагах застосування інгібіторів протеасом (ІП) у лікуванні р/рММ.
Сергій Вікторович Клименко у своїй доповіді сфокусував увагу на ключових перевагах застосування інгібіторів протеасом (ІП) у лікуванні р/рММ.
– ІП для лікування пацієнтів з ММ використовують багато років. Механізм їхньої дії пов’язаний з тим, що клітини ММ особливо сприйнятливі до пригнічення протеасом через їх проліферативну природу, надмірну продукцію дефектних білків і залежність від сигнальних шляхів, які регулюються протеасомами (S. Lub, 2015). Враховуючи патофізіологію ММ, ІП можна розглядати як таргетну терапію захворювання. Інгібування протеасом відбувається за допомогою численних механізмів, що індукують загибель клітин, включно із накопиченням неправильно згорнутих/розгорнутих білків у ендоплазматичному ретикулумі, як наслідок – розвивається апоптоз, зумовлений стресом ендоплазматичного ретикулуму.
Іксазоміб – перший пероральний борвмісний ІП, механізм дії якого зумовлений блокуванням білка шляхом пригнічення каталітичної субодиниці 20S протеасоми 26S (B. Muz, 2016; K. Yong, 2016). Відповідно до сучасних рекомендацій, іксазоміб у комбінації з леналідомідом і дексаметазоном (IRd) затверджений для лікування пацієнтів з ММ, які отримали ≥1 лінії попередньої терапії (M.A. Dimopoulos, 2021). Препарат схвалений до застосування регуляторними органами США (Управлінням з контролю якості харчових продуктів і лікарських препаратів США – FDA, 2022) та Європейського Союзу (Європейським агентством з лікарських засобів – EMA, 2022). Препарат випускається у формі капсул по 4,0; 3,0 і 2,3 мг, рекомендації щодо його використання при ММ можуть різнитися (табл.).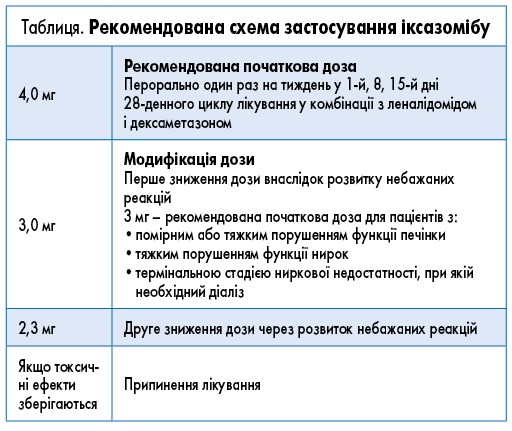
Результати сучасних досліджень підтверджують ефективність застосування іксазомібу для терапії р/рММ. Так, сприятливе співвідношення користь-ризик іксазомібу в дозі 4 мг у складі схеми IRd обґрунтовується даними аналізів експозиція-відповідь у дослідженні TOURMALINE-MM1 (X. Leleu, 2018). Згідно з отриманими даними, експозиція іксазомібу не була предиктором виживаності без прогресування (ВБП) або відповіді на лікування. При цьому ефективність схеми IRd була стабільною у разі щотижневого прийому іксазомібу в дозі 4,0 мг. Підвищення тижневої дози іксазомібу >4,0 мг у складі схеми IRd зумовлювало зростання частоти побічних явищ (ПЯ) та/або ступеня їх тяжкості. Це спричиняло зниження дози леналідоміду та справляло негативний вплив на відносну інтенсивність дози, а отже – ефективність лікування (X. Leleu, 2018).
За результатами рандомізованого багатоцентрового подвійного дослідження III фази TOURMALINE-MM1, у якому оцінювали застосування схем IRd та плацебо + Rd, використання іксазомібу асоціювалося зі значущим покращенням ВБП. Аналіз ВБП за методом Каплана – Маєра продемонстрував, що у групі іксазомібу медіана ВБП склала 20,6 міс, тоді як у групі плацебо + Rd вона не досягла і 15,0 міс, що зумовило подовження медіани на 40%. Остаточний аналіз результатів дослідження TOURMALINE-MM1 визначив незначну тенденцію щодо ЗВ на користь схеми з додаванням іксазомібу порівняно з плацебо: медіана ЗВ у групі IRd становила 53,6 міс, у групі плацебо + Rd – 51,6 міс (P.G. Richardson, 2021).
Що стосується безпеки терапії та ризику розвитку ПЯ, за даними дослідження TOURMALINE-MM1, профіль безпеки схеми IRd загалом був узгодженим у популяціях із цитогенетикою високого та стандартного ризику, а також узгоджувався з даними для загальної популяції (P. Moreau, 2016). Так, у пацієнтів переважно відзначали ПЯ 1 та 2 ступеня тяжкості, що включали діарею, обстипацію, нейтропенію й анемію (H. Avet-Loiseau, 2007).
Таким чином, дані сучасних досліджень свідчать на користь застосування схеми IRd у пацієнтів з р/рММ. Відзначена істотна користь додавання іксазомібу на тлі обмеженої додаткової токсичності у пацієнтів з р/рММ з цитогенетикою високого чи стандартного ризику, а також збільшення ВБП.
Друга панельна дискусія стосувалася сучасних можливостей застосування ІП у пацієнтів з ММ.
? Які сучасні можливості використання іксазомібу при р/рММ у різних лініях лікування?
– Відповідно до сучасних рекомендацій, іксазоміб у комбінації з леналідомідом і дексаметазоном затверджений для лікування пацієнтів з р/рММ, які отримали ≥1 лінії попередньої терапії. Сьогодні українським пацієнтам доступна трикомпонентна схема лікування р/рММ, яка включає бортезоміб, леналідомід і дексаметазон (VRd), що дозволяє ефективно лікувати пацієнтів цієї групи в першій лінії. Тому ключовими проблемами ведення пацієнтів цієї групи є розвиток рецидивів захворювання, що потребує зміни стратегії лікування та застосування інших препаратів. Відповідно до сучасних рекомендацій, у другій лінії можна використовувати такі препарати, як помалідомід і талідомід, які закуповуються за кошти держбюджету та доступні для хворих. Даратумумаб, на жаль, має обмежене застосування, оскільки пацієнти змушені купувати його за власні кошти. Ефективність бендамустину наразі під питанням через наявні клінічні дані. Отже, поява іксазомібу, по-перше, перекриває потребу у лікуванні та збільшує кількість можливих комбінацій при лікуванні р/рММ, а по-друге, забезпечує додаткові роки життя пацієнтам, що важливо, оскільки ММ є хронічним рецидивуючим захворюванням.
? Яким є профіль хворих на р/рММ для застосування IRd відповідно до результатів дослідження TOURMALINE-MM1?
– Згідно з протоколом дослідження TOURMALINE-MM1, включені пацієнти мали діагноз р/рММ і вже отримували один або більше курс терапії, до якого входили бортезоміб, талідомід, леналідомід чи комбінації цих препаратів. Критеріями включення були вік 18 років або старше, наявність моноклонального білка в сироватці крові чи сечі, а також вимірювання рівня хоча б одного моноклонального білка або відхилення від норми співвідношення вільних легких ланцюгів імуноглобулінів. Враховуючи ці дані, можна констатувати, що профіль пацієнтів з р/рММ для застосування схеми IRd є таким: вік 18 років або більше, наявність р/рММ, отримання одного або більше режимів попередньої терапії, вміст моноклонального парапротеїну у сироватці крові чи сечі або відхилення від норми співвідношення FLC.
? Яка ефективність іксазомібу у пацієнтів з р/рММ та цитогенетикою високого ризику?
– Результати сучасних досліджень продемонстрували, що застосування іксазомібу у комбінації з леналідомідом і дексаметазоном є ефективною стратегією лікування р/рММ, у тому числі у пацієнтів із високим цитогенетичним ризиком.
? Які обмеження широкого використання іксазомібу при ММ?
– Іксазоміб призначений для перорального застосування, має добре вивчений профіль безпеки і не має істотних специфічних протипоказань. Найпоширенішими побічними ефектами є діарея, нудота, блювання, анемія, тромбоцитопенія, нейропатія та втома. Проте результати багатьох досліджень загалом свідчать про сприятливий профіль безпеки препарату та нетяжкі і керовані ПЯ. Так, у дослідженні TOURMALINE-MM1 реєстрували ПЯ на фоні застосування іксазомібу, проте вони були легкими або помірними та зазвичай усувалися шляхом симптоматичного лікування.
 Тетяна Валеріївна Скрипець поділилася з учасниками заходу власним досвідом ведення пацієнтів з р/рММ і сучасними рекомендаціями щодо лікування цього захворювання в Італії.
Тетяна Валеріївна Скрипець поділилася з учасниками заходу власним досвідом ведення пацієнтів з р/рММ і сучасними рекомендаціями щодо лікування цього захворювання в Італії.
– В Італії ведення пацієнта з р/рММ здійснюється відповідно до міжнародних настанов, зокрема, останнього документа ESMO (2021), також розроблені національні протоколи на базі ESMO. Згідно з цими настановами алгоритми терапії р/рММ базуються на чутливості або рефрактерності до леналідоміду чи бортезомібу (M.A. Dimopoulos, 2021). Окрім того, підхід до ведення пацієнтів цієї групи обов’язково має ґрунтуватися на стратифікації ризику активної мієломи (поділ пацієнтів на групи високого та стандартного ризику).
Сучасні алгоритми другої лінії терапії р/рММ в Італії збігаються з алгоритмами в інших країнах Європи. Вони включають переважне використання триплетних комбінацій лікарських засобів, вибір яких ґрунтується на рефрактерності до препаратів/класів, а також оцінку можливості проведення пацієнту трансплантації. Зазвичай схема лікування включає щонайменше один препарат з «нерефрактерного» класу. Окрім того, при підборі лікарських засобів в Італії зазвичай оцінюють поточний статус пацієнта, наявність/відсутність у нього супутніх захворювань, попередню/залишкову токсичність препаратів. Найбільш доречним при р/рММ є TRAP – індивідуалізований підхід до лікування, який враховує стадію й особливості хвороби, вік і стан здоров’я пацієнта, а також інші фактори.
Найкращим варіантом лікування пацієнтів цієї групи є застосування препарату іксазоміб, ефективність якого у терапії р/рММ підтверджена. Нещодавно були презентовані результати багатоцентрового рандомізованого дослідження ІІ фази M.A. Dimopoulos та співавт. (2022). У ньому порівнювали ефективність і безпеку двох режимів лікування пацієнтів з ММ, у яких розвинулася резистентність до леналідоміду і які попередньо отримували ІП. Загалом до дослідження було включно 85 пацієнтів з ММ, яких було розподілено на дві групи: перша група перорально отримувала іксазоміб з дексаметазоном, друга – перорально помалідомід з дексаметазоном. За результатами дослідження загальна відповідь на лікування була вищою у групі іксазоміб + дексаметазон, ніж у групі помалідомід + дексаметазон (M.A. Dimopoulos, 2022).
Після доповідей відбулася заключна дискусія щодо сучасних аспектів застосування іксазомібу в Україні.
? Які існують комбінації іксазомібу з іншими препаратами? Чи можлива його комбінація з помалідомідом?
– Згідно з рекомендаціями ESMO, іксазоміб може входити в різноманітні дво- та трикомпонентні схеми терапії з різними імуномодулюючими та хіміотерапевтичними препаратами (в тому числі помалідомідом), застосування яких базується на індивідуальних особливостях пацієнта та враховує попередні лінії терапії. Окрім того, можлива комбінація іксазомібу з таргетним препаратом даратумумабом.
? Які фактори можуть обмежувати доступ пацієнта з р/рММ до лікування іксазомібом?
– Питанню доступності іксазомібу для лікування пацієнтів з р/рММ можна приділити багато уваги, оскільки відомі численні чинники, що обмежують застосування цього препарату. Якщо коротко, одним із ключових факторів доступності терапії є її вартість. Проте якщо порівняти іксазоміб з іншими стратегіями терапії р/рММ, можна констатувати, що вартість препарату є зіставною, при цьому ефективність його значно вища порівняно з доступними в Україні схемами лікування. Привабливим є факт перорального застосування ІП, що може бути зручним для деяких пацієнтів.
? Який клінічний портрет пацієнта для лікування іксазомібом в Україні?
– Згідно з інструкцією до застосування іксазомібу, препарат показаний у комбінації з леналідомідом і дексаметазоном для лікування дорослих пацієнтів із ММ, які отримали щонайменше одну лінію попередньої терапії. Тобто критерії відбору є такими: діагноз р/рММ; вік 18 років або більше; отримання одного і більше режимів лікування, включаючи бортезоміб та імуномодулюючі агенти (наприклад, VRd, талідомід, леналідомід); відповідність показників функції нирок і печінки вимогам інструкції до застосування препарату; відсутність деяких захворювань серцево-судинної системи, які треба моніторувати під час прийому іксазомібу.
Література
- Fedorenko Z., Soumkina O., Gorokh Ye. et al. CANCER IN UKRAINE 2020-2021: Incidence, mortality, prevalence and other relevant statistics. Bulletin of the national cancer registry of Ukraine. 2022; 23.
- Kumar S.K., Rajkumar S.V., Dispenzieri A. et al. Improved survival in multiple myeloma and the impact of novel therapies. Blood. 2008 Mar 1; 111(5): 2516-20. Doi: 10.1182/blood-2007-10-116129.
- Kumar S.K., Dispenzieri A., Lacy M.Q. et al. Continued improvement in survival in multiple myeloma: changes in early mortality and outcomes in older patients. Leukemia. 2014 May; 28(5): 1122-8. Doi: 10.1038/leu.2013.313.
- Rajkumar S.V., Dimopoulos M.A., Palumbo A. et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014 Nov; 15(12): e538-48. Doi: 10.1016/S1470-2045(14)70442-5.
- Palumbo A., Avet-Loiseau H., Oliva S. et al. Revised International Staging System for Multiple Myeloma: A Report From International Myeloma Working Group. J Clin Oncol. 2015 Sep 10; 33(26): 2863-9. Doi: 10.1200/JCO.2015.61.2267.
- Dispenzieri A., Rajkumar S.V., Gertz M.A. et al. Treatment of newly diagnosed multiple myeloma based on Mayo Stratification of Myeloma and Risk-adapted Therapy (mSMART): consensus statement. Mayo Clin Proc. 2007 Mar; 82(3): 323-41. Doi: 10.4065/82.3.323.
- Dimopoulos M.A., Moreau P., Terpos E. et al. Multiple myeloma: EHA-ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol. 2021 Mar; 32(3): 309-322. Doi: 10.1016/j.annonc.2020.11.014.
- Lub S., Maes A., Maes K. et al. Inhibiting the anaphase promoting complex/cyclosome induces a metaphase arrest and cell death in multiple myeloma cells. Oncotarget. 2015 Jan 26; 7(4): 4062-76. Doi: 10.18632/oncotarget.6768.
- Muz B., Ghazarian R.N., Ou M. et al. Spotlight on ixazomib: potential in the treatment of multiple myeloma. Drug Des Devel Ther. 2016 Jan 11; 10: 217-26. Doi: 10.2147/DDDT.S93602
- Yong K., Delforge M., Driessen C. et al. Multiple myeloma: patient outcomes in real-world practice. Br J Haematol. 2016 Oct; 175(2): 252-264. Doi: 10.1111/bjh.14213.
- FDA (2022) Highlights of prescribing information These highlights do not include all the information needed to use NINLARO safely and effectively. See full prescribing information for NINLARO. https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/208462s012s013lbl.pdf.
- EMA (2022) Ninlaro. https://www.ema.europa.eu/en/medicines/human/EPAR/ninlaro.
- Leleu X., Masszi T., Bahlis N.J. et al. Patient-reported health-related quality of life from the phase III TOURMALINE-MM1 study of ixazomib-lenalidomide-dexamethasone versus placebo-lenalidomide-dexamethasone in relapsed/refractory multiple myeloma. Am J Hematol. 2018 May 4. Doi: 10.1002/ajh.25134.
- Richardson P.G., Kumar S.K., Masszi T. et al. Final Overall Survival Analysis of the TOURMALINE-MM1 Phase III Trial of Ixazomib, Lenalidomide, and Dexamethasone in Patients With Relapsed or Refractory Multiple Myeloma. J Clin Oncol. 2021 Aug 1; 39(22): 2430-2442. Doi: 10.1200/JCO.21.00972.
- Avet-Loiseau H., Attal M., Moreau P. et al. Genetic abnormalities and survival in multiple myeloma: the experience of the Intergroupe Francophone du Myelome. Blood. 2007 Apr 15; 109(8): 3489-95. Doi: 10.1182/blood-2006-08-040410.
- Moreau P., Masszi T., Grzasko N. et al. Oral Ixazomib, Lenalidomide, and Dexamethasone for Multiple Myeloma. N Engl J Med. 2016 Apr 28; 374(17): 1621-34. Doi: 10.1056/NEJMoa1516282.
- Dimopoulos M.A., Schjesvold F., Doronin V. et al. Oral ixazomib-dexamethasone vs oral pomalidomide-dexamethasone for lenalidomide-refractory, proteasome inhibitor-exposed multiple myeloma: a randomized Phase 2 trial. Blood Cancer J. 2022 Jan 24; 12(1): 9. Doi: 10.1038/s41408-021-00593-2.
Підготувала Анна Хиць
VV-MEDMAT-86731
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 2 (81) 2023 р.



