30 травня, 2023
Метастатичний недрібноклітинний рак легені: вибір оптимальної стартової терапії
Сучасне лікування метастатичного недрібноклітинного раку легені (НДРЛ) в Україні базується на клініко-діагностичних аспектах та враховує вітчизняні клінічні настанови й протоколи, а також рекомендації зарубіжних і міжнародних медичних спільнот. Основними складовими лікування є системна хіміотерапія (ХТ), імунотерапія й таргетна терапія. У рамках конференції «Клініко-діагностичні аспекти сучасного лікування метастатичного недрібноклітинного раку легені в Україні» провідні вітчизняні фахівці обговорили сучасні підходи до ведення пацієнтів з НДРЛ, фокусуючи увагу на найбільш ефективних варіантах терапії.
 Про міфи та реалії сучасної парадигми патоморфологічної верифікації НДРЛ розповіла лікар-патологоанатом, завідувачка патологоанатомічного відділення Медичної лабораторії CSD (м. Київ), членкиня Європейського товариства патологів (ESP), Американської та Канадської академії патології (USCAP), Міжнародної академії патології (IAP) Олена Олександрівна Кошик.
Про міфи та реалії сучасної парадигми патоморфологічної верифікації НДРЛ розповіла лікар-патологоанатом, завідувачка патологоанатомічного відділення Медичної лабораторії CSD (м. Київ), членкиня Європейського товариства патологів (ESP), Американської та Канадської академії патології (USCAP), Міжнародної академії патології (IAP) Олена Олександрівна Кошик.
– Є чимало міфів щодо патоморфологічної верифікації НДРЛ. Так, одним із перших хибних уявлень про рак легені є його гістологічна класифікація, що включає 3-4 типи пухлин, тоді як насправді існує понад 20 різних гістологічних підтипів лише карциноми легені. Цей факт важливий, оскільки за наявності у пацієнта просунутих стадій захворювання необхідне проведення додаткового імуногістохімічного дослідження з метою визначення гістогенезу. Саме останнє впливає на тактику подальшого ведення хворого.
Лікування пацієнтів з НДРЛ ґрунтується не тільки на гістологічному типі пухлини, а й на молекулярних порушеннях, які в ній відбуваються. Деякі фахівці вважають, що найкращим зразком тканини для молекулярно-генетичного дослідження є первинна пухлина. Проте це уявлення хибне, оскільки для дослідження може бути взята тканина первинної пухлини, уражені лімфатичні вузли, якщо останні більш доступні, або метастази. Вибір зразка для тестування має ґрунтуватися на якості та кількості гістологічного матеріалу, а не на його локалізації.
Наступний міф стосується того, що проведення молекулярно-генетичного дослідження можливе тільки на гістологічному матеріалі. Частково це правда, оскільки саме гістологічний матеріал є переважним через його високу клітинність. Проте не варто забувати, що тестування також може бути виконане на цитологічному матеріалі та плазмі крові.
Що стосується діагностики, ще одним міфом є розмір біоптату. Дехто вважає, що довжина біоптату від 5 до 10 мм достатня для проведення гістологічного, імуногістохімічного та подальшого можливого молекулярно-генетичного дослідження. Іноді цього дійсно достатньо, тому що весь матеріал представлений пухлиною. Але близько 30% біоптатів мають низьку клітинність або поширені ділянки некрозу, що унеможливлює проведення подальших молекулярно-генетичних тестів. Саме тому з метою оцінки придатності зразка для досліджень необхідно використовувати технологію швидкої цитологічної оцінки на місці (ROSE – rapid on-site evaluation), що істотно підвищує придатність матеріалу для подальших досліджень.
Іншим важливим фактором молекулярно-генетичної діагностики є якість матеріалу. Якість значно залежить від типу матеріалу (операційний чи біопсійний), методів фіксації та подальшого процесингу. Особливо на придатність матеріалу для молекулярно-генетичних досліджень впливає суворе дотримання всіх правил фіксації, які включають тип фіксатора, «холодний ішемічний час», об’єм фіксатора та час фіксації.
НДРЛ з транслокацією гена кінази анапластичної лімфоми (ALK) є особливим типом раку легені, що розвивається внаслідок інверсії в короткому плечі 2-ї хромосоми. Така інверсія зазвичай залучає гени, що кодують ALK (2p23P) та EML4 (2p21), проте можуть бути й інші варіації. Пацієнти з таким типом раку легені є кандидатами на лікування інгібіторами тирозинкінази (ІТК). Також уже відомі мутації в гені ALK, які виникають вторинно в процесі лікування, що робить можливим прогресування хвороби. Таким пацієнтам потрібно проводити нове молекулярно-генетичне тестування з метою виявлення цих мутацій і корекції протоколу лікування.
Ще одним міфом стосовно молекулярно-генетичного дослідження є те, що його не потрібно виконувати через високу вартість. Дійсно, генетичні дослідження є дорогими. Проте зараз у пакети ХТ, променевого лікування, що забезпечуються програмою медичних гарантій Національної служби здоров’я України, введено опції гістологічного, імуногістохімічного та молекулярно-генетичного дослідження (при раку легені вони включають найчастіші мутації EGFR, ALK, ROS1 та експресію PD-L1).
 Про зміни в парадигмі лікування НДРЛ поінформував завідувач відділення хіміотерапії КНП ЛОР «Львівський онкологічний регіональний лікувально-діагностичний центр», кандидат медичних наук, доцент Ярослав Васильович Шпарик.
Про зміни в парадигмі лікування НДРЛ поінформував завідувач відділення хіміотерапії КНП ЛОР «Львівський онкологічний регіональний лікувально-діагностичний центр», кандидат медичних наук, доцент Ярослав Васильович Шпарик.
– Загальновідомо, що в загальній структурі захворюваності на рак легені понад 85% припадає саме на НДРЛ. Його найпоширенішим підтипом визнана аденокарцинома, яку діагностують у 40% випадків. Якщо порівнювати парадигми лікування НДРЛ у минулі роки і сьогодні, то, звичайно, підходи значно змінилися. Коли в 1990-ті рр. всі пацієнти отримували приблизно однакову терапію, то зараз в арсеналі клініцистів наявні різні варіанти лікування, представлені як ХТ, так і таргетними препаратами. Окрім того, в останні 10 років також було виявлено, що аденокарцинома є не однорідним захворюванням, а асоціюється з наявністю так званих драйверних мутацій, і це також відобразилося на терапевтичній тактиці. Сучасний розвиток медицини дозволяє ефективно виявляти ці мутації і на підставі цього обирати відповідну стратегію ведення хворого.
Алгоритм ведення пацієнтів цієї групи включає як хірургічну резекцію пухлини, так і застосування інших підходів, включаючи ад’ювантну та неоад’ювантну ХТ, таргетні препарати. Сьогодні ІТК посідають чільне місце у терапії ALK+ НДРЛ. Зараз доступні кілька поколінь ІТК, найбільш відомими з їх представників є бригатиніб та алектиніб (друге покоління) і кризотиніб (перше покоління), які демонструють хорошу ефективність та істотно подовжують виживаність пацієнтів.
Результати дослідження РROFILE 1014, у якому оцінювали ефективність терапії кризотинібом додатково до ХТ при лікуванні ALK+ НДРЛ, продемонстрували, що медіана виживаності на фоні застосування ІТК першого покоління кризотинібу складала 11,3 міс, тоді як у групах стандартної терапії вона не досягала і 6,0 міс. Проте в цьому дослідженні були визначені не лише переваги, а й недоліки кризотинібу. Зокрема, виявлено, що у 60% пацієнтів, що приймали ІТК, розвивалися метастази в центральній нервовій системі (ЦНС). І хоча у пацієнтів з метастазами в ЦНС можна досягти відповіді на лікування кризотинібом, рецидиви неминучі.
У дослідженні ALEX, у якому порівнювали ефективність застосування двох ІТК – кризотинібу й алектинібу, визначено, що хоча кризотиніб і є високоефективним, проте використання новішого препарату з групи ІТК надає вищі переваги для пацієнта, в тому числі відображається на медіані виживаності без прогресування (ВБП): кризотиніб – 10,9 міс, алектиніб – 34,8 міс. Вища ефективність препарату пов’язана в тому числі з впливом на внутрішньомозкові новоутворення.
Дослідження ALTA-1L було проведено з метою оцінювання ефективності та безпеки бригатинібу порівняно з кризотинібом у першій лінії терапії у пацієнтів з ALK+ НДРЛ. Згідно з отриманими даними, бригатиніб мав значно вищу ефективність, ніж кризотиніб, зокрема забезпечував значно довшу медіану ВБП (бригатиніб – 30,8 міс, кризотиніб – 9,2 міс), вищу 3- та 4-річну виживаність – 45 та 36 міс (кризотиніб 18 і 16 міс відповідно), а також меншу частоту побічних ефектів. Важливо також зазначити, що дизайн дослідження ALTA-1L відрізнявся від дизайну дослідження ALEX. Так, у ALTA-1L були включені пацієнти, які попередньо отримували одну лінію терапії з приводу метастатичного раку легені, тоді як у дослідження ALEX – тільки первинні пацієнти.
Відповідно до останнього оновлення настанови Національної онкологічної мережі США (NCCN) 2023 р. щодо ведення пацієнтів з НДРЛ, при наявності у хворих мутації ALK перша лінія терапії має включати застосування трьох препаратів: алектинібу, або бригатинібу, або лорлатинібу (не зареєстрований в Україні). У разі неможливості з певних причин застосовувати препарати першої лінії іншим варіантом терапії є кризотиніб.
 Завідувачка хіміотерапевтичного відділення № 2 КНП «Харківський обласний центр онкології» Наталія Миколаївна Отченаш у своїй доповіді зупинилася на ефективності застосування бригатинібу в лікуванні метастатичного ALK+ НДРЛ.
Завідувачка хіміотерапевтичного відділення № 2 КНП «Харківський обласний центр онкології» Наталія Миколаївна Отченаш у своїй доповіді зупинилася на ефективності застосування бригатинібу в лікуванні метастатичного ALK+ НДРЛ.
– Завдяки впровадженню в клінічну практику нових поколінь ІТК підходи до терапії НДРЛ зазнали значних змін. Сьогодні золотим стандартом лікування ALK+ НДРЛ є бригатиніб – низькомолекулярний ІТК. Механізм його дії пов’язаний зі здатністю зв’язуватися з клітинами, які експресують ALK. Це означає, що бригатиніб має афінність до мутованого ALK, це дозволяє йому взаємодіяти з рецептором ALK на поверхні ракових клітин, які мають цю мутацію. Після зв’язування з ALK бригатиніб блокує активацію ALK та його сигнальний шлях, що призводить до зупинки подальшого росту і метастазування цих ракових клітин (тобто виявляється антипроліферативна дія на ALK+ ракові клітини).
Бригатиніб наразі є єдиним пан-ІТК. Це означає, що препарат інгібує активність не тільки мутованої форми ALK, а й кількох варіантів «дикого» типу ALK. Це робить бригатиніб більш дієвим лікарським засобом порівняно з іншими представниками групи ІТК, такими як кризотиніб. Бригатиніб також може чинити додатковий вплив на інші сигнальні шляхи, які відіграють роль у проліферації клітин (ROS1, FLT3, RET та ін.), що робить його потенційно корисним для лікування пацієнтів з різними видами раку та різними мутаціями в цих генах.
Результати сучасних досліджень підтвердили ефективність застосування бригатинібу при терапії ALK+ НДРЛ. Попередньо були розглянуті загальні показники ВБП пацієнтів у дослідженні ALTA-1L, згідно з якими терапія бригатинібом характеризувалася високою ефективністю порівняно з кризотинібом. Що стосується підгрупового аналізу, ВБП при попередній ХТ (популяція всіх хворих, включаючи тих, що вибули та не отримали повний курс лікування – популяція ІТТ) за оцінкою BIRC (незалежний комітет з оцінки в засліпленому режимі) склала у групі бригатинібу 24 міс, у групі кризотинібу – 11 міс; ВБП у групі пацієнтів, які попередньо не отримували ХТ, становила у групі бригатинібу 24,0 міс, у групі кризотинібу – 10,8 міс.
Важливі дані також були отримані після аналізу підгруп пацієнтів залежно від статусу метастазів у ЦНС: ВБП у пацієнтів із будь-якими метастазами в ЦНС на початку в групі бригатинібу склала 24 міс, тоді як в групі кризотинібу не досягла і 6 міс. При цьому показники 3- і 4-річної виживаності на фоні застосування бригатинібу у цій групі хворих також значно відрізнялися та склали 33 і 28 міс відповідно. Схожі дані були отримані і стосовно пацієнтів без метастазів у ЦНС на початку: у групі бригатинібу ВБП досягла 29,3 міс, у групі кризотинібу – 15,6 міс. Що стосується показників 3- і 4-річної виживаності, у групі бригатинібу вони склали 47 і 40 міс, у групі кризотинібу – 24 і 22 міс відповідно. Внутрішньочерепна ВБП (за оцінкою BIRC) у популяції ІТТ на фоні застосування бригатинібу склала 44,1 міс, у групі кризотинібу – 21,2 міс, у когорті пацієнтів з будь-якими метастазами в ЦНС на початку дослідження у групі бригатинібу – 21,0 міс, у групі кризотинібу – 5,5 міс.
У дослідженні ALTA-1L порівнювали не лише ефективність, а й безпеку оцінюваних препаратів. За даними аналізу використання бригатинібу хоча і зумовлювало певні побічні ефекти, які включали легеневу токсичність, гіпертензію, брадикардію тощо, але все ж характеризувалося кращим профілем безпеки порівняно з кризотинібом. Це також відобразилося й на якості життя хворих. Так, загальна оцінка здоров’я та якості життя пацієнтів з ALK+ НДРЛ на фоні застосування бригатинібу була вищою. Пацієнти мали довшу тривалість покращення за показниками загальної оцінки здоров’я/якості життя з медіаною 26,7 проти 8,31 міс у групі кризотинібу.
 Лікар-онколог, хіміотерапевт, запрошений доцент Онкологічного центру Легоррета, Університет Брауна (Провіденс, США), кандидат медичних наук, доцент Дінара Есенбеківна Риспаєва проаналізувала можливості таргетної терапії при метастазах у ЦНС при ALK+ НДРЛ.
Лікар-онколог, хіміотерапевт, запрошений доцент Онкологічного центру Легоррета, Університет Брауна (Провіденс, США), кандидат медичних наук, доцент Дінара Есенбеківна Риспаєва проаналізувала можливості таргетної терапії при метастазах у ЦНС при ALK+ НДРЛ.
– Розвиток метастазів у ЦНС у хворих на ALK+ НДРЛ має свої «підводні камені», зокрема більша частина випадків метастазів реєструються при аденокарциномі легені. При цьому частота метастазів є однаковою як у молодих осіб, так і в осіб віком 60-65 років. На відміну від церебральних метастазів інших видів раку, де, як правило, має місце латентний період метастазування, метастази в мозку при раку легені часто виникають через місяці або навіть одночасно з діагностикою первинної пухлини.
Результати нещодавнього опитування в Європі, в якому взяли участь 462 пацієнти, продемонстрували, що метастази в головному мозку спостерігаються навіть при первинному виявленні НДРЛ І-ІІ стадії. Відповідно до сучасних даних, найвища частота метастазів у головному мозку реєструється саме при драйверних мутаціях. У ретроспективному огляді T. Patil та співавт. (2018), в який загалом було включено 579 пацієнтів із IV стадією НДРЛ, визначено, що метастази цієї локалізації мають кореляцію з онкогенним статусом, зокрема ROS1+ і ALK+. Узагальнюючи сучасні дані, клінічними і молекулярними факторами, що асоціюються із підвищеним ризиком метастазування в ЦНС, є аденокарцинома легені та наявність драйверних мутацій. Наявність метастазів у головному мозку пов’язана з поганим прогнозом із загальною виживаністю 4-6 міс. Ці дані підтверджують важливість застосування при ALK+ НДРЛ інгібіторів тирозинкінази, ефективних проти внутрішньомозкових метастазів.
На сьогодні наявна значна кількість міжнародних досліджень щодо ефективності використання ІТК різних поколінь при ALK+ НДРЛ. Найцікавіші результати щодо впливу на метастази в ЦНС були отримані у двох дослідженнях – ALEX та ALTA-1L. У них оцінювали ефективність застосування ІТК другого покоління алектинібу (ALEX) та бригатинібу (ALTA-1L) порівняно з кризотинібом. Згідно з отриманими даними, бригатиніб мав вищу ефективність у пацієнтів з метастазами в ЦНС, ніж алектиніб. Під час остаточного аналізу результатів дослідження ALTA-1L внутрішньочерепна ВБП, оцінена BIRC, свідчила про зниження ризику на 71% при використанні бригатинібу порівняно з кризотинібом, підтверджуючи більш виражену загальну ефективність щодо ВБП у пацієнтів із початково наявними метастазами в головному мозку.
У кокранівському систематичному огляді (Cameron L.et al., 2022), визнаному найвищим стандартом у доказовій медицині, проаналізовано дані рандомізованих клінічних досліджень, у яких порівнювалося застосування ІТК та цитотоксичної ХТ або іншого ІТК при терапії НДРЛ. За отриманими даними, алектиніб, бригатиніб і лорлатиніб є кращими варіантами першої лінії терапії при НДРЛ, а якщо врахувати результати дослідження ALTA-1L – бригатиніб характеризується найвищою загальною ефективністю ВБП, яка спостерігалася у пацієнтів із початковими метастазами в головному мозку, серед трьох препаратів цієї групи.
Отже, зараз в арсеналі клініцистів наявно чимало представників групи ІТК різних поколінь, і ключовим питанням для кожного фахівця є вибір найбільш ефективної стратегії терапії хворого на ALK+ НДРЛ з метастазами в головному мозку. Узагальнюючи всі вищенаведені дані, доцільно подати алгоритм прийняття рішення щодо ведення пацієнтів цього профілю, який би був корисним у рутинній клінічній практиці (рис.).
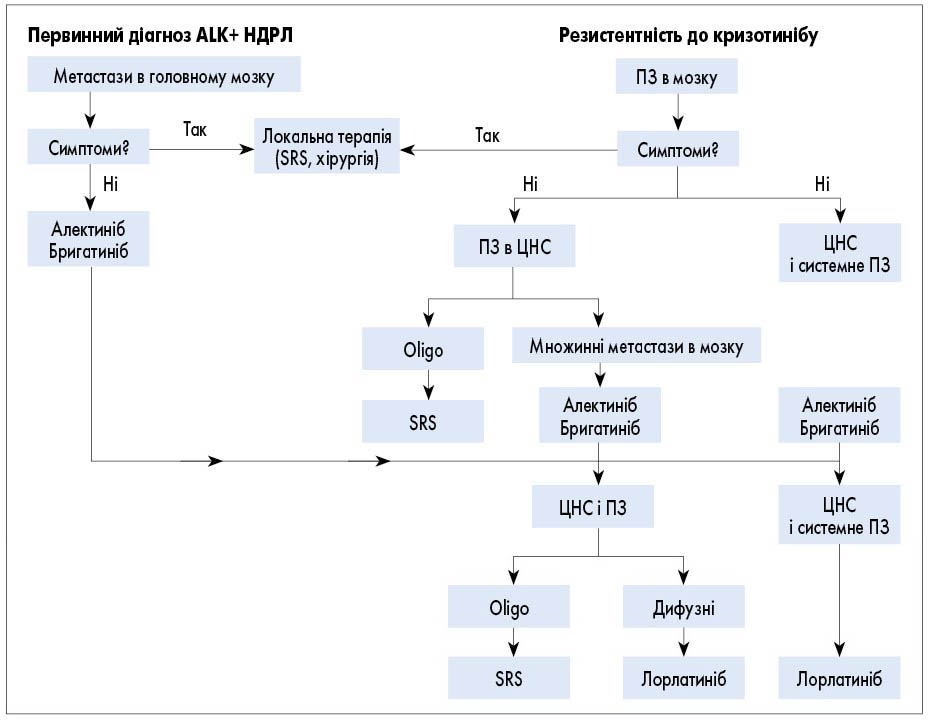 Рис. Алгоритм прийняття рішення при наявності метастазів у ЦНС при ALK+ НДРЛ (за V. Ernani, T. Stinchcombe, 2019)
Рис. Алгоритм прийняття рішення при наявності метастазів у ЦНС при ALK+ НДРЛ (за V. Ernani, T. Stinchcombe, 2019)
Oligo – олігометастази; ПЗ – прогресування захворювання; SRS – стереотаксична радіохірургія.
 Власним досвідом ведення пацієнта з метастатичним ALK+ НДРЛ поділився керівник центру торакальної онкохірургії Клінічної лікарні «Феофанія» ДУС (м. Київ) Володимир Олександрович Войтко.
Власним досвідом ведення пацієнта з метастатичним ALK+ НДРЛ поділився керівник центру торакальної онкохірургії Клінічної лікарні «Феофанія» ДУС (м. Київ) Володимир Олександрович Войтко.
Клінічний випадок
Пацієнт Н., 43 роки, не курець, без хронічної легеневої патології. Під час профілактичного огляду у 2018 р. виявлено новоутворення середньої частки легені розміром 32 мм.
Було виконано біопсію під контролем комп’ютерної томографії, на основі отриманих результатів хворому було встановлено доопераційний діагноз аденокарцинома середньої частки легені T2N1M0, IIB стадія. Виконано позитронно-емісійну комп’ютерну томографію, проведено неоад’ювантну поліхіміотерапію.
У 2019 р. пацієнт був прооперований в об’ємі верхньої білобектомії. За даними післяопераційного гістологічного дослідження визначено уражений одиничний нижній паратрахеальний лімфатичний вузол. Розпочата ад’ювантна терапія.
У березні 2020 р. виявлено прогресування захворювання у вигляді метастазів у головному мозку. Проведено променеву терапію та призначено алектиніб.
У грудні 2022 р. зафіксовано прогресування вогнищ у головному мозку. Відмічалася помірно виражена загальномозкова симптоматика. Призначено бригатиніб. Наразі пацієнт отримує терапію, його загальний стан задовільний.
На фармацевтичному ринку України представлені три ІТК – бригатиніб, кризотиніб та алектиніб. Враховуючи дані сучасних досліджень і власний клінічний досвід, можна констатувати, що найбільш ефективним представником цієї групи є саме бригатиніб. Відповідно до інструкції, бригатиніб рекомендовано застосовувати 1 раз на добу у дозі 180 мг (у перші 7 днів по 90 мг на добу) незалежно від вживання їжі. Так, перевагою бригатинібу є його використання 1 раз на добу, тоді як інші препарати групи ІТК потрібно вживати по 2 рази на добу разом з їжею, що відображається й на якості життя пацієнтів. Важливо також зазначити, що доза, затверджена для ІТК, становить від 1 до 8 таблеток на добу, це, звичайно, значно ускладнює прийом препаратів та асоціюється з ризиком недотримання режиму терапії. Останній фактор є важливим і впливає на результати лікування, оскільки одним з предикторів поганої прихильності хворих до терапії є складність і тривалість лікування.
Таким чином, наразі в арсеналі українських клініцистів наявні кілька представників ІТК, з яких найвищою ефективністю та безпекою характеризується бригатиніб. Згідно з результатами дослідження ALTA-1L, бригатиніб демонструє переваги порівняно з кризотинібом у лікуванні хворих на метастатичний ALK+ НДРЛ. Ще однією важливою перевагою бригатинібу є його ефективність у контролі внутрішньомозкових метастазів у пацієнтів цієї групи. Результати досліджень і клінічний досвід свідчать, що бригатиніб може впливати на метастази в ЦНС, допомагаючи контролювати їх поширення та знижуючи ризик появи нових метастазів.
Підготувала Анна Сочнєва
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 2 (81) 2023 р.



