23 грудня, 2023
Спадковий ангіоневротичний набряк у дітей і підлітків
Спадковий ангіоневротичний набряк (САН) є генетичним захворюванням з аутосомно-домінантним типом передачі, в більшості випадків зумовлений дефіцитом інгібітора C1 (C1-INH). Для пацієнтів характерні рецидивуючі набряки підшкірної клітковини та слизових оболонок зі змінною тяжкістю та віком першої появи симптомів. У понад 50% пацієнтів перші прояви САН спостерігаються до 10 років. Більшість досліджень нових методів лікування САН проводиться серед дорослих, і відповідно нові препарати не схвалюються регуляторними органами для застосування у дітей. В останні роки лікування САН у дітей і підлітків досягло певного прогресу, але й досі існують перешкоди для профілактичної терапії у дітей молодшого віку.
САН є генетичним захворюванням з ізольованими (без кропив’янки) самообмеженими рецидивуючими епізодами набряку глибоких шарів шкіри та слизових оболонок, що найчастіше проявляється набряком кінцівок, обличчя, губ, язика, статевих органів, кишечника та верхніх дихальних шляхів [1]. Транзиторні набряки зазвичай тривають 2-5 днів зі значною варіабельністю за тяжкістю та частотою: від інвалідизуючих щотижневих до легких поодиноких на рік атак, у деяких пацієнтів симптоми відсутні [1]. У більшості хворих підтип САН пов’язаний з дефіцитом C1-INH (HAE-C1INH), дебют захворювання припадає на 10 років [2], проте симптоми можуть з’явитися і в ранньому віці, включаючи пренатальний період [3].
Розроблення нових препаратів для лікування САН сприяло зниженню смертності та захворюваності. Проте, незважаючи на істотний прогрес, вплив нових методів лікування на ведення дітей обмежений [4, 5] з огляду на те, що більшість досліджень проводиться серед дорослих пацієнтів.
При веденні дітей необхідно враховувати потреби як самої дитини, так і її батьків/опікунів. Останні відіграють ключову роль в адаптації дитини до хвороби [6]. Питання невизначеності діагнозу, властиве САН, вважається більш обтяжливим, ніж фізичні прояви захворювання [7, 8]. Відомо, що неприхильність до лікування погіршує якість життя (ЯЖ) дорослих хворих, і можна припустити схожий негативний вплив на ЯЖ дітей.
Патофізіологія та діагностика
Діагноз HAE-C1INH підтверджується наявністю класичних клінічних симптомів, обтяженим сімейним анамнезом і зниженим рівнем C4 і C1-INH у плазмі крові [9, 10]. У більшості (85%) хворих зі зниженим вмістом C1-INH (<50% норми) реалізується 1 тип САЕ-C1INH, зумовлений дефектними мутаціями у гені SERPING1, що кодує C1-INH, які порушують його секрецію [11, 12]. У 15% випадків розвивається 2 тип САЕ-C1INH, за якого функціонально дефектний C1-INH накопичується в плазмі у нормальній або високій концентрації [13]. Незважаючи на аутосомно-домінантний тип успадкування, 5-25% випадків спричинені de novo мутаціями в гені SERPING1. Нормальний вміст C1-INH не виключає доцільності його визначення за наявності клінічних ознак і відповідного сімейного анамнезу.
Згідно з міжнародними рекомендаціями, для верифікації САЕ-C1INH слід двічі (з інтервалом) виміряти рівень C4 і C1-INH у період ремісії [11, 12]. За наявності неузгоджених результатів або у дітей віком до 1 року діагностичну цінність має аналіз гена SERPING1 [2]. У пацієнтів з маніфестацією захворювання після 40 років за відсутності сімейного анамнезу диференційна діагностика має включати набутий дефіцит C1-INH.
У хворих з типовими проявами, але нормальним рівнем C1-INH, встановлюють діагноз САН з нормальним рівнем C1-INH (HAE-nl-C1INH), раніше відомий як САН 3 типу [14-17]. Порівняно з НАЕ-C1INH, при НАЕ-nl-C1INH відзначають пізніший дебют (близько 20 років), неповну пенетрантність у чоловіків і провідну роль естрогенів як тригерного фактора атак у жінок [16, 17]. Найчастіше причиною НАЕ-nl-C1INH є мутації в гені F12, що кодує XII фактор згортання крові (НАЕ-F12) [13]. Верифікація НАЕ-F12 ґрунтується на виявлені патогенних мутацій в 9 екзоні F12, тоді як у плазмі крові цих пацієнтів не встановлено будь-яких аномалій XII фактора. Описані асоціації НАЕ-nl-C1INH з рідкісними мутаціями в інших локусах, зокрема генах ANGPT1 [18], PLG [19], KNG1 [20], MYOF [21] та HS3ST6 [22]. Не рекомендовано рутинно досліджувати ці варіанти [13], за винятком мутацій PLG (р.Lys330Glu), поширених серед багатьох етнічних груп [17]. Відсутність патогенних мутацій в 9 екзоні F12 є підставою для пошуку змін у гені PLG.
Лікування САН
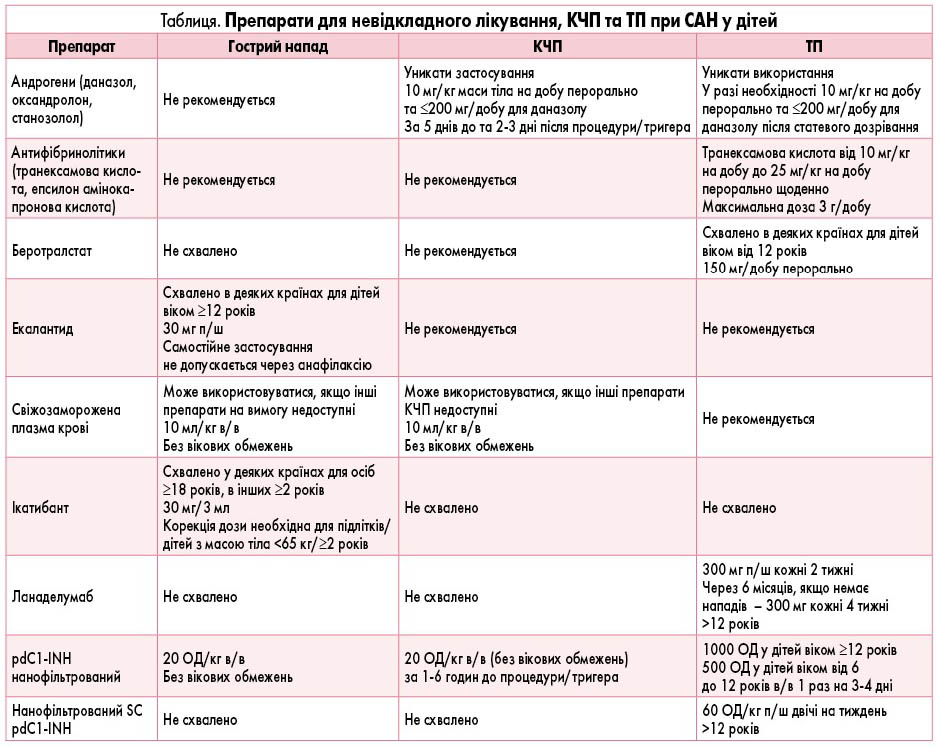
Розуміння патофізіології САН 1 і 2 типів забезпечило розроблення більш специфічних та ефективних методів лікування [1]. Ці методи схвалені у деяких країнах для дорослих, підлітків та, в окремих випадках, дітей (табл.). Втім, дані щодо ефективності та безпеки, а також відповідні рекомендації залишаються обмеженими [2, 23, 24]. Підхід до терапії САН у дітей включає лікування гострих нападів, короткочасну профілактику (КЧП) та тривалу профілактику (ТП).
Лікування нападів САН
Раннє лікування нападів рекомендоване для зменшення їх тяжкості, тривалості, розвитку ускладнень і зниження ризику смерті, а також частоти госпіталізацій [25]. Тому пацієнтам/опікунам слід навчатися самостійно вводити рекомендовані препарати [25]. Перевага надається засобам, схваленим для використання в домашніх умовах, з метою покращення ЯЖ та зменшення тягаря захворювання [1, 26-28].
C1-інгібітор, отриманий з плазми (pdC1-INH), для в/в введення зарекомендував себе як безпечний та ефективний засіб у Європі, зокрема, дозволений до застосування у вагітних і немовлят. Рекомендована доза для пацієнтів усіх вікових груп складає 20 ОД/кг [29-31]. Фіксоване дозування (10 ОД/кг) менш ефективне, деколи потрібне повторне введення при ларингеальних нападах [29, 30, 32].
Рекомбінантний C1-інгібітор (rhC1-INH) для в/в застосування також ефективний, однак має коротший період напіввиведення та потребує вищого дозування (50 ОД/кг) [33]. Слід уникати його використання за наявності алергії на кролів. Вікові обмеження різняться: в одних країнах препарат можна використовувати у пацієнтів ≥12 років, в інших – ≥2 років [32, 33].
Інгібітор калікреїну для п/ш введення екалантид ефективний у підлітків і дорослих, проте через ризик анафілаксії (~3-4%) не рекомендований для самостійного застосування [2, 32].
Антагоніст рецепторів брадикініну для п/ш введення ікатибант схвалений у різних країнах для дітей віком ≥2 років і дорослих. Дозування для дітей становить 0,4 мг/кг [34, 35]. У 10% пацієнтів наявна потреба в повторному введенні через рецидив симптомів. Можливе застосування додаткових доз через 6 годин після попереднього (до 3 доз на добу). Зафіксовано високу ефективність та задовільну переносимість препарату, незважаючи на часті (97%) місцеві реакції. Нещодавнє схвалення генериків знизило вартість терапії та покращило доступ до неї у країнах із низьким рівнем доходів [35, 36].
У крайньому випадку у будь-якому віці альтернативою є в/в вливання свіжозамороженої плазми крові, незважаючи на відсутність доказової бази та теоретичні застереження щодо посилення набряку [28, 37]. Не рекомендоване застосування антифібринолітиків типу транексамової кислоти, ефективність яких є порівнянною з плацебо чи незначною [1].
Короткочасна профілактика САН
Відомо, що будь-які маніпуляції на верхніх дихальних шляхах, включаючи оперативні втручання, стоматологічні процедури й ендоскопію, можуть спровокувати напади САН [38, 39]. З метою зменшення ризику набряку та асфіксії перед подібними процедурами рекомендована КЧП [40]. Використовують свіжозаморожену плазму крові, антифібринолітики, андрогени та C1-INH з неоднозначною ефективністю [41]. На сьогодні золотим стандартом КЧП є внутрішньовенне введення pdC1-INH у дозі 20 ОД/кг приблизно за годину до проведення тригерної процедури [41]. Проте при фіксованому дозуванні (500-1000 ОД незалежно від маси тіла) післяопераційні напади трапляються нерідко [40]. Тому рекомендована доза становить 20 ОД/кг (наприклад, 1500 ОД для пацієнта з масою тіла 80 кг) [1, 11, 41, 42]. Навіть за умови проведення КЧП має бути забезпечений доступ до препаратів невідкладної терапії на випадок проривних нападів [1, 11, 41, 42].
Тривала профілактика САН
Рекомендовані нефармакологічні профілактичні заходи, зокрема уникнення відомих тригерів (фізичні навантаження, травми, стрес, інфекції), хоча їх ефективність обмежена і пов’язана зі зниженням ЯЖ [43, 44]. Тому показана ТП для нормалізації повсякденної активності та соціалізації дітей [1]. Рекомендована актуалізація профілактичних заходів перед вакцинацією та стоматологічними процедурами [1].
Мета ТП у дітей, як і в дорослих, – зменшення частоти, тривалості та тяжкості нападів, покращення ЯЖ [45]. Ефективність ТП не абсолютна, тому має бути постійно забезпечений доступ до препаратів невідкладної терапії. Слід враховувати вікові особливості дії стресових, гормональних та інших тригерних факторів і за потреби коригувати ТП [1, 23, 46]. Андрогени в дитячому віці можуть негативно впливати на ріст та мати інші побічні ефекти (порушення менструальної функції, агресивна поведінка тощо) [23, 24, 47].
pdC1-INH зарекомендував себе як високобезпечний та ефективний засіб для ТП [48]. Рекомендована доза для дітей становить 20 ОД/кг, вища за фіксовані дози 500-1000 ОД [49]. Затверджена ТП для пацієнтів ≥12 років у вигляді підшкірних ін’єкцій pdC1-INH по 60 ОД/кг 2 рази на тиждень, що забезпечує медіанне зниження частоти нападів на ~95% [50]. Зараз ця форма схвалена для дітей ≥6 років [28].
Отже, екстраполяція даних досліджень фармакотерапії САН на дорослих ускладнює розроблення рекомендацій для дитячої популяції. Однак у дітей підтверджено безпеку окремих препаратів, зокрема pdC1-INH.
Список літератури знаходиться в редакції.
Реферативний огляд: Mansour E., Veronez C.L., Craig T. et al. Hereditary angioedema in children and adolescents. Allergol Immunopathol (Madr). 2022 Apr 7; 50 (S Pt 1): 1-6.
DOI: 10.15586/aei.v50iSP1.535.
Підготувала Анна Хиць
Тематичний номер «Педіатрія» № 5 (71) 2023 р.