24 травня, 2023
Настанова з лікування синдрому подразненого кишечнику та функціонального болю в животі у дітей
Функціональний абдомінальний біль (ФАБ) – це розлади вісі «кишечник – мозок», що при синдромі подразненого кишечнику (СПК) характеризується хронічним абдомінальним болем і зміною характеру випорожнень. ФАБ охоплює 4 розлади: функціональну диспепсію, СПК, абдомінальну мігрень і функціональний біль у животі без додаткових уточнень (J.S. Hyams et al., 2016; J.J. Korterink et al., 2015). Також виділяють 4 типи СПК у залежності від клінічних симптомів: із переважанням діареї (СПК-Д), із переважанням запору (СПК-З), зі змішаними ритмами дефекації (СПК-ЗМ) і СПК некласифікований (S. Rajindrajith et al., 2012).
Поширеність ФАБ у дитячій популяції коливається від 1,6 до 41,2%. Незважаючи на значну частоту таких станів, патофізіологія, що лежить в основі ФАБ, вивчена недостатньо. Ймовірно, етіологічний чинник є багатофакторним і охоплює генетичні та психологічні фактори, як, наприклад, жорстоке поводження з дитиною, стрес або депресія, підвищену чутливість до продуктів харчування, зміни кишкової мікробіоти (D.A. Drossman et al., 2016). Хоча останнім часом кількість доступних варіантів лікування зросла, терапія цих розладів може бути складною й безуспішною.
У своєму огляді R. Rexwinkel1 і співавт. прагнули надати актуальний огляд терапевтичних підходів при СПК і ФАБ у педіатричних пацієнтів, а також сформулювали стратегії лікування цих захворювань. Пропонуємо до уваги читачів переклад ключових аспектів рекомендацій. З повною версією документу можна ознайомитися за посиланням https://doi.org/10.1007/s00431–022–04459-y.
Менеджмент СПК і ФАБ
Лікування часто передбачає одну або декілька з таких стратегій: менеджмент 1-ї лінії, що складається з перевірки, обґрунтування та підтвердження діагнозу, немедикаментозне і фармакологічне лікування.
1. Менеджмент 1-ї лінії
Доказовий мультидисциплінарний план терапії має важливе значення для покращення відновлення та довгострокового прогнозу лікування (N.L. Schechter et al., 2021).
- Перевірка, обґрунтування та підтвердження діагнозу. Один із перших кроків – це визнати, що біль є реальним, навіть якщо серйозних ушкоджень органів немає. Для пояснення того, що біль зумовлений надчутливими нервами, може бути корисною метафора: сигнал пожежної тривоги, що триває, хоча пожежі немає (N.L. Schechter et al., 2021). Потрібно виділити достатньо часу, щоб підтвердити діагноз шляхом обговорення всіх доказів, що свідчитимуть на користь СПК або ФАБ. Основною метою лікування не має бути повне усунення больового синдрому, але необхідно прагнути оптимізувати щоденне функціонування, у тому числі навчання у школі, нормальний режим сну та участь у позашкільній діяльності (A. Brusaferro et al., 2018; N .Thapar et al., 2020). Лікар має залишатися на зв’язку з пацієнтами та батьками і планувати контрольні візити кожні 4-12 тижнів для підвищення прихильності до лікування і зменшення відчуття, що пацієнти та їхні сім’ї залишилися без підтримки.
- Реакція батьків на біль у животі в дитини. Мультидисциплінарний сімейний підхід є невід’ємною частиною стратегії лікування. Дослідження L.S. Walker (2006) визначало ефективність батьківської уваги проти відволікання уваги та відсутності інструктажу в дітей із хронічним ФАБ. Абдомінальні скарги зменшилися вдвічі у групі відволікання та майже вдвічі зросли у групі уваги. Дослідження показує, що відволікання батьків є потужною стратегією подолання симптомів ФАБ. Крім того, дослідження K.J. Lindley (2005) показали, що медичні втручання в родині без розуміння проблеми їхньої дитини можуть бути шкідливі для дитини із ФАБ. Прогностично несприятливими індикаторами визначено залучення більше трьох консультантів, відмову від спілкування з психологами та відсутність усвідомлення психосоціального впливу на симптоми захворювання (K.J. Lindley et al., 2005).
- Визначення психологічних та фізичних стресорів, які можуть відігравати вирішальну роль у відчутті дитиною абдомінального болю і, можливо, допоможуть його усуненню. Прийняття батьками біопсихосоціальної моделі захворювання виявилося важливим фактором полегшення симптомів у дітей із ФАБ (E. Crushell et al., 2003).
- Додаткова знеболювальна терапія, наприклад, нестероїдні протизапальні засоби, ацетамінофен і аспірин, іноді використовується лікарями загальної практики для лікування болю. Однак ефективність цих препаратів в лікуванні педіатричного хронічного болю у животі не підтверджена клінічними випробуваннями, і тому ці засоби слід використовувати в клінічній практиці з обережністю (T.E. Cooper, 2017; C. Eccleston, 2017).
2. Нефармакологічні методи лікування
Дієтичні втручання
В останнє десятиліття спостерігається підвищений інтерес до ролі дієти в патогенезі та лікуванні ФАБ. Більше ніж 90% дітей із ФАБ повідомляють, що вживання принаймні одного харчового продукту пов’язане з погіршенням шлунково-кишкових симптомів. Як наслідок, діти часто уникають їжі та дотримуються стратегії дієти (B.P. Chumpitazi, 2018; B.P. Chumpitazi et al., 2016). Часто пацієнти повідомляють про негативний вплив глютену (J.R. Biesiekierski et al., 2011). Однак непереносимість глютену не пов’язана з целіакією – це клінічний стан, який недостатньо вивчений у дітей, але він може сприяти старту або погіршенню шлунково-кишкових симптомів ФАБ (M.R. Barbaro et al., 2020). Цілком ймовірно, що супутні симптоми, асоційовані з харчовими продуктами, є більшою мірою результатом шлунково-кишкового рефлексу, ніж харчової непереносимості (A. Deiteren, 2010; R. Lea, 2005; M. Camilleri, 2008). Дійсно, дослідження продемонстрували мало доказів того, що дієтичні інтервенції є корисними для цієї популяції (N. Thapar, 2020; M.A.L. van Tilburg, 2013; R. Turco, 2018).
Харчові волокна
Кожній дитині рекомендоване нормальне споживання клітковини (R. Korczak, 2017; C.H. Axelrod, 2018). Недостатнє її споживання було визначено фактором ризику розвитку ФАБ у дітей (A.Z. Paulo, 2006; R.C. Huang, 2000). Збільшення споживання харчових волокон рекомендовано як засіб лікування 1-ї лінії для СПК, оскільки волокна потенційно знижують рівень внутрішньокишкового тиску, прискорюють пасаж по кишечнику та, як наслідок, зменшують абдомінальний біль (A.M. Connell, 1978; C. Romano, 2013). Розчинні волокна можуть бути особливо корисними в лікуванні СПК-З, оскільки вони затримують воду в калі, і тому можуть полегшувати симптоми запору (D. Anheyer, 2017; R.J. Shulman, 2018). Однак через бродіння волокон також можливе підвищене газоутворення (S. Eswaran, 2013).
Метааналіз досліджень у дорослих показав більшу користь розчинних волокон, таких як подорожник, на відміну від нерозчинних волокон, таких як висівки (P. Moayyedi, 2014; N. Nagarajan, 2015). Клінічні рекомендації терапії СПК для дорослих підтримують вживання розчинних волокон (S. Eswaran, 2013; B.E. Lacy, 2021). Недавній метааналіз у дітей із ФАБ, що охоплював 5 рандомізованих клінічних досліджень (РКД), виявив деякі позитивні ефекти використання розчинних волокон, зокрема подорожника. Хоча достовірність доказів є дуже низькою, але, враховуючи низьку вартість, відсутність серйозних побічних ефектів і легку доступність, можна розглянути рекомендацію прийому розчинних волокон для щоденного застосування (C.M.A. de Bruijn et al., 2022).
Дієта з низьким вмістом FODMAP
Дослідження серед дорослих показали позитивний ефект дієти з низьким вмістом ферментованих олігосахаридів, дисахаридів, моносахаридів і поліолів (FODMAP) для лікування СПК (H.M. Staudacher et al., 2017). Існує гіпотеза, що один із механізмів дії такої дієти передбачає зменшення газоутворення з наступним розширенням просвіту кишечнику, що забезпечує зменшення больових відчуттів (H.M. Staudacher, 2017; S.J. Shepherd, 2013).
Метааналіз досліджень ефективності дієти з низьким вмістом FODMAP у дорослих показав зменшення симптомів з боку ШКТ і покращення якості життя (A.-S. van Lanen et al., 2021). Однак дотримання такої дієти є важким, передбачає високі економічні витрати та залучення дієтолога для досягнення адекватного балансу поживних речовин і успішного результату лікування (A. Rej, 2021; P.R. Gibson, 2014; L. Alfaro-Cruz, 2020).
Невідомо, коли і як слід знову застосовувати виключені продукти, але дотримання дієти з низьким вмістом FODMAP більше 6 тижнів супроводжується ризиком розвитку мальнутриції (E.P. Halmos, 2014; M. Bellini, 2020). Сьогодні засновані на доказах рекомендації використання такої дієти в педіатричній популяції відсутні. Було проведено лише 2 РКД, які не продемонстрували бажаної ефективності, але необхідно більше даних, щоб зробити остаточні висновки (K.M. Boradyn, 2020; B.P. Chumpitazi, 2015). Аби зробити дієту з низьким вмістом FODMAP доступнішою, у клінічну практику необхідно впроваджувати нові методи. Зокрема, у найближчому майбутньому може відігравати важливу роль використання онлайн-додатків під керівництвом дієтологів (H. Mitchell, 2019; J. Chen, 2018).
Безглютенова дієта
В останнє десятиліття дослідження серед дорослих довели потенційно важливу роль чутливості до глютену як тригера абдомінальних симптомів при СПК (J.R. Biesiekierski, 2011; M.R. Barbaro, 2020; A. Llanos-Chea, 2018). Цей стан відомий як non-celiac gluten sensitivity – чутливість до глютену, не пов’язана з целіакією. Пацієнти із СПК часто повідомляють про чутливість до глютену за відсутності діагнозу целіакії (M.R. Barbaro et al., 2020). Щоб дослідити непереносимість глютену, не пов’язану з целіакією, у дітей із СПК, потрібні дослідження. Наразі тривають випробування у педіатричних пацієнтів із СПК, одне з них вивчає оцінку поширеності чутливості до глютену (NCT02431585), інше оцінює переваги дотримання безглютенової дієти порівняно з дієтою з низьким вмістом FODMAP (NCT03694223).
Пробіотики
Пробіотики визначають як «живі мікроорганізми, які в адекватній кількості приносять користь здоров’ю хазяїна» (C. Hill et al., 2014). Для відновлення мікробіомного складу кишечнику використовують пробіотики, які запобігають надмірному росту потенційно патогенних бактерій та зменшують запалення і проникність кишечнику (E.M.M. Quigley, 2008; C.R. Martin, 2018; F. Cristofori, 2021). Оскільки з’являється все більше доказів ролі мікробіому в патогенезі ФАБ, пробіотики можуть бути перспективним варіантом лікування (L. Rigsbee, 2012; D.M. Saulnier, 2011).
Нещодавно опублікований Кокранівський огляд оцінив ефективність і безпечність застосування пробіотиків у дітей із ФАБ (C. Wallace et al., 2021). За його результатами було виявлено докази середньої та високої якості щодо ефективності Lactobacillus rhamnosus GG і Lactobacillus reuteri DSM у лікуванні СПК і ФАБ у дітей (C. Wallace et al., 2021).
Психологічні втручання
Доведено, що психосоціальні втручання, такі як когнітивно-поведінкова терапія (КПТ) і гіпнотерапія, успішно лікують ФАБ у дітей (N. Thapar et al., 2020).
КПТ спрямована на зміну поведінки, сприйняття та емоцій, які можуть сприяти посиленню СПК або збереженню симптомів (R.A. Abbott, 2017; B. Ree, 2020; H. Person, 2019). Для зменшення вираженості симптомів дітей і батьків навчають застосовувати різні способи подолання та стратегії відволікання, а також техніки релаксації. КПТ може застосовуватися у вигляді різних підходів, як то особиста терапія, з батьками телефоном або шляхом взаємодії з дітьми через Інтернет.
Систематичний огляд і метааналіз у дітей віком 4-18 років із ФАБ охопили 17 досліджень КПТ (M. Gordon et al., 2022). Було виявлено докази помірної якості, що КПТ сприяє значному зниженню інтенсивності болю і зменшує частоту захворювання порівняно з відсутністю втручання. Обмеженням для рекомендації КПТ є доступ до спеціалістів із психічного здоров’я, але телефонні та інтернет-консультації показали свою ефективність, що потенційно зменшує витрати на охорону здоров’я та підвищує доступність лікування (M. Bonnert, 2017; R. Nieto, 2019; L.S. Walker, 2021; F. Sampaio, 2019).
Під час гіпнотерапії пацієнта вводять у гіпнотичний стан, і терапевт направляє пацієнта на зміну його суб’єктивних переживань, сприйняття емоцій, відчуттів, думок чи поведінки (J.P .Green, 2005; P.J. Whorwell, 1992). Вісім РКД за участю дітей віком 6-18 років із СПК або ФАБ продемонстрували результати низької достовірності, що гіпнотерапія може бути ефективним варіантом лікування (M. Gordon et al., 2022). Одним із недоліків рекомендації гіпнотерапії є відсутність достатньої кількості добре підготовлених гіпнотерапевтів.
Йога
Практика йоги з використанням технік медитації та дихання у поєднанні з фізичними позами підвищує тонус організму, зменшує тривожність і підсилює почуття благополуччя (C. Collins, 1998). Три РКД, у тому числі серед 127 дітей із СПК та ФАБ, оцінювали ефективність йога-терапії (S. Evans, 2014; J.J. Korterink, 2016; L. Kuttner, 2006). Відмінностей в ефективності лікування в досліджуваній групі і групі контролю виявлено не було (M. Gordon et al., 2022). Хоча ці дослідження були низької якості через невеликі групи дітей і методичні недоліки, поки що немає доказів, щоб рекомендувати йогу як рутинне втручання в лікуванні педіатричного ФАБ.
Інші форми комплементарної та альтернативної медицини
На сьогодні ефективність додаткових методів лікування, таких як акупунктура, лікування травами, гомеопатія, мануальна терапія або остеопатія, не оцінювалася в педіатрії (M. Gordon et al., 2022). Однак ці напрями альтернативної терапії використовують близько 40% дітей із діагнозом ФАБ (A.S. Day, 2002; A.M. Vlieger, 2008). Серед потенційних причин їх використання, ймовірно, – відсутність видимої користі традиційної терапії та пов’язані з нею побічні ефекти (A.M. Vlieger et al., 2008).
Інші способи лікування
Нейростимуляція
Черезшкірна електрична стимуляція нервового поля (PENFS) використовує переривчасту частотну стимуляцію гілок V, VII, IX і X черепно-мозкових нервів, які іннервують зовнішнє вухо і проєктуються на певні ядра стовбура мозку. При стимуляції ці ядра діють як ретранслятор для інших ділянок мозку, що беруть участь у модуляції болю та вегетативному контролі (K. Kovacic et al., 2017). Ефективність PENFS досліджували у 115 дітей із ФАБ. У порівнянні з контрольною групою, PENFS покращувала самопочуття зі значним зменшенням болю та інвалідності. Більш того, сприятливі ефекти зберігалися в ході подальшого спостереження (K. Kovacic et al., 2017).
Хоча потрібні додаткові докази, ці дані свідчать, що PENFS може бути хорошим і безпечним немедикаментозним засобом лікування педіатричних пацієнтів.
Трансплантація фекальної мікробіоти
Трансплантація фекальної мікробіоти спрямована на мікробіом і може бути майбутньою терапевтичною стратегією для пацієнтів із СПК. Однак результати досліджень у дорослих були суперечливими, а дані в педіатричній популяції відсутні (S.I. Halkjaer, 2018; P.H. Johnsen, 2018). Наразі триває РКД, в якому оцінюють ефективність застосування трансплантації фекальної мікробіоти для рефрактерного СПК у підлітків (NCT03074227).
3. Медикаментозне лікування
На підставі наявних даних неможливо рекомендувати будь-яке конкретне фармакологічне лікування для педіатричних пацієнтів із ФАБ (R. Rexwinkel et al., 2021).
Спазмолітики
Спазмолітики діють безпосередньо на гладенькі м’язи кишечнику і забезпечуть їх розслаблення або діють опосередковано на нерви гладенької мускулатури шляхом блокади рецепторів, зменшуючи скорочення ШКТ, а отже, полегшуючи відчуття болю (M. Hawthorn, 1988; T. Poynard, 2001; A. Annahazi, 2014). Лише 5 РКД вивчали ефективність застосування спазмолітиків у дітей. Два дослідження оцінювали ефект олії перцевої м’яти (M. Asgarshirazi, 2015; R.M. Kline, 2001), і три дослідження – дротаверину (M. Narang et al., 2015), мебеверину (Z. Pourmoghaddas et al., 2015) і тримебутину (G.S. Karabulut et al., 2013).
Нещодавній метааналіз виявив значну різницю в успішності лікування спазмолітиками і плацебо. Проте загальна якість досліджень була дуже низькою, отже, до результатів необхідно ставитися з обережністю. Крім того, ці РКД мали невеликі розміри вибірки, коротку тривалість терапії та обмежене подальше спостереження. Щоб зробити остаточні висновки, потрібні додаткові дані. Зараз триває РКД, в якому досліджують ефективність мебеверину щодо зменшення болю в животі у дітей із СПК та ФАБ (випробування NL7508).
Антидепресанти
Антидепресанти, такі як амітриптилін і циталопрам, є центральними нейромодуляторами, що впливають на вісь «мозок – кишечник». Завдяки антихолінергічному впливу антидепресанти знижують вісцеральну чутливість та моторику ШКТ, покращують настрій і сон (D.A. Drossman, 2018; H. Tornblom, 2015). Недавній Кокранівський огляд, що охоплював 3 РКД, виявив недостатньо доказів на підтримку застосування амітриптиліну і циталопраму в дітей із ФАБ (C.M.A. de Bruijn, 2021; H. Roohafza, 2014; M. Saps, 2009; R.J. Bahar, 2008).
Нині антидепресанти широко використовують у клінічній практиці в дітей, які не реагують на першу лінію лікування (Rome Foundation, 2020). Однак слід враховувати деякі питання щодо безпеки цих засобів. У 2004 р. Управління із санітарного нагляду за якістю харчових продуктів та медикаментів США (FDA) видало попередження щодо застосування антидепресантів через потенційно підвищений ризик суїцидальних тенденцій у дітей (FDA, 2018). До того ж лікар-практик має бути обізнаним про потенційний ризик серцево-судинних побічних ефектів від застосування трициклічних антидепресантів. Проте дослідження не виявили кореляції між серйозними побічними серцевими подіями і використанням низьких доз трициклічних антидепресантів у педіатричних пацієнтів, побічні ризики зазвичай зменшуються з часом (L.J. Klein, 2021; A. Chogle, 2014). Щоб зробити висновки, необхідно більше досліджень цього напряму терапії.
Антибіотики
Вважають, що рифаксимін є антибіотиком для усунення надмірного росту бактерій у тонкій кишці. Оскільки існує гіпотеза, що в пацієнтів із СПК-Д є патологія мікробіому, рифаксимін може бути засобом лікування розладів ШКТ (P. Schoenfeld, 2014; A. Lembo, 2016; A.A. Fodor, 2019). При СПК у дорослих застосування рифаксиміну для лікування симптомів СПК-Д підтвердило свою ефективність і безпечність (B.E. Lacy, 2021; C.J. Black, 2020).
У педіатричній популяції було проведено 2 випробування ефективності рифаксиміну. Одне з досліджень показало, що в 50 дітей із СПК та аномальним лактулозним дихальним водневим тестом рифаксимін сприяв значному зменшенню болю в животі, здуття та ожиріння (E. Scarpellini et al., 2013), тоді як інше РКД оцінювало рифаксимін у 75 дітей із ФАБ і не виявило суттєвої різниці в оцінках болю (B.S. Collins et al., 2011). Сьогодні рифаксимін для лікування СПК у дітей не рекомендований. Існує також довгострокова проблема безпеки використання рифаксиміну, оскільки він може спричинити появу перехресно-резистентних бактеріальних штамів і порушити здоровий мікробіом у дітей (E. Bruzzese et al., 2013).
Засоби від запору
Невелике дослідження вивчало поліетиленгліколь 3350 (PEG) і тегасерод у дітей із СПК-З, за результатами якого було виявлено значне покращення показників болю в групі лікування PEG+тегасерод порівняно з групою, яка отримувала лише PEG (V. Khoshoo et al., 2006). Однак немає жодних доказів того, що PEG зменшує абдомінальний біль у пацієнтів із СПК-З. Зазвичай PEG використовують як засіб 1-ї лінії для лікування запорів, оскільки він ефективний і безпечний, тому може бути рекомендований для лікування симптоматичного запору при СПК-З.
Нові терапевтичні засоби, такі як прукалоприд (агоніст рецептора 5-HT4) і любіпростон (аналог простагландину Е1), а також лінаклотид і плеканатид (обидва селективні агоністи гуанілатциклази С) показали свої переваги в дорослих із СПК-З (E.D. Shah, 2018; A.C. Ford, 2018; C.F. Barish, 2019). Але жоден із цих засобів не підтвердив свою ефективність у педіатричній популяції та наразі не схвалений для лікування дітей. Застосування любіпростону вивчали в дітей із функціональним запором і отримали суперечливі результати (P.E. Hyman, 2014; M.A. Benninga, 2021; M. Benninga, 2018). Ефективність і безпеку різних доз лінаклотиду також оцінювали в дітей із СПК-З та отримали результати з обмеженою ефективністю (NCT02559817). Таким чином, існує потреба у великих РКД для оцінки ефективності нових сполук у дітей із СПК-З, перш ніж можна буде давати будь-які рекомендації щодо їх використання.
Прокінетики
Антагоністи дофаміну, такі як домперидон, мають корисні властивості для дорослих із функціональною диспепсією та СПК (E. Arts, 1979; R. Milo, 1980; L. Van de Mierop, 1979; S.K. Sarin, 1986). Проведено лише одне плацебо-контрольоване дослідження ефективності домперидону в дітей із ФАБ (A. Karunanayake et al., 2018). Істотного успіху лікування після 8 тижнів не було, однак спостерігалося значне зменшення інтенсивності болю в животі у групі домперидону порівняно із плацебо. Про побічні ефекти не повідомляли. Діти з ФАБ часто повідомляють про інші симптоми, зокрема нудоту, що спостерігається приблизно в половини дітей принаймні двічі на тиждень (K. Kovacic, 2013; A.C. Russell, 2017). Тому можна застосовувати домперидон як симптоматичне лікування в дітей із супутніми захворюваннями. Однак потрібна обережність, оскільки домперидон асоціюється з подовженням інтервалу QT, і тому не ліцензований до застосування в дітей віком до 12 років (A.D. Morris, 2016; European Medicines Agency, 2014).
Протидіарейні засоби
Лоперамід – безрецептурний агоніст опіоїдних рецепторів, який зазвичай використовують у клінічній практиці для лікування діареї (D.J. Cangemi, 2019; B.E. Lacy, 2016; I.D. Florez, 2018). Однак інструкції не рекомендують цей засіб як терапію 1-ї лінії для дорослих із СПК-Д, оскільки він малоефективний щодо найнеприємніших симптомів СПК: абдомінального болю та здуття (A.C. Ford, 2018; D.J. Cangemi, 2019). Хоча в жодному РКД не оцінювали ефективність лопераміду в дітей із СПК-Д, його все ще можна розглядати для симптоматичного лікування (B.E. Lacy, 2016).
Секвестранти жовчних кислот
У дорослих і дітей із СПК-Д зібрано певну кількість доказів порушення всмоктування жовчних кислот (P. Vijayvargiya, 2018; M. Saps, 2017; B.C. Beinvogl, 2021). Це свідчить про те, що секвестранти жовчних кислот можуть відігравати певну роль у лікуванні симптомів діареї при СПК. Декілька препаратів справді показали покращення консистенції випорожнень у дорослих із СПК-Д, наприклад, холестирамін, колестипол і колесевелам (P. Vijayvargiya, 2018; M. Camilleri, 2015). Наразі жодні добре сплановані дослідження не оцінювали ефективність цих засобів у дітей із СПК.
Плацебо
У дослідженнях ФАБ у педіатрії відповідь на плацебо є значною. В середньому 41% дітей відмічали покращення стану на плацебо (D.R. Hoekman et al., 2017). На ефект плацебо значною мірою впливають різні чинники, наприклад, природний перебіг хвороби, методологічна упередженість, регресія до середнього значення, ситуативні фактори. Останні, в тому числі очікування та обумовленість, відомі як «справжній плацебо-ефект» (I. Kirsch, 2013; S. Elsenbruch, 2015; M.A. Benninga, 2009). Медичним працівникам слід пам’ятати про «справжній плацебо-ефект», оскільки на нього можуть вплинути активне слухання та тепле ставлення лікаря до пацієнта, що може призвести до позитивних очікувань пацієнта і, отже, до кращої відповіді на лікування (J.М. Kelley, 2009; T.J. Kaptchuk, 2008). Велике відкрите дослідження наразі оцінює ефективність плацебо в дітей із функціональними гастроінтестинальними розладами (NCT02389998). Подібні випробування в дорослих із СПК показали багатообіцяючі результати (T.J. Kaptchuk, 2010; A. Lembo, 2021).
Нові методи лікування дорослих із СПК
У дорослих пацієнтів менеджмент захворювання здебільшого базується на домінуючому симптомі дисфункції кишечнику: запорі/здутті живота або діареї (M. Camilleri, 2021). У дорослих із СПК-З кілька методів лікування знаходяться в розробці (A.C. Ford et al., 2020). Наприклад, мізагліфозин (інгібітор SGLT1) зменшує поглинання іонів натрію з просвіту кишечнику і, як результат, сприяє затримці води в просвіті і розрідженню випорожнень. За результатами плацебо-контрольованого дослідження, мізагліфозин продемонстрував значно вищі показники відповіді й безпеки, ніж плацебо (S. Fukudo et al., 2018). Інший засіб, тенапанор (інгібітор натрій-водневого обміну), виявився так само ефективним і безпечним у випробуваннях у дорослих із СПК-З (W.D. Chey et al., 2017).
Нові підходи у терапії дорослих із СПК-Д охоплюють медіатори опіоїдів, такі як елюксадолін (агоніст μ- і κ-опіоїдних рецепторів і антагоніст d-опіоїдних рецепторів нервової системи кишечнику), який показав свою ефективність і безпеку (C.J. Black, 2020; A.J. Lembo, 2016; K.C. Fragkos, 2017). Однак елюксадолін має обмеження до застосування в пацієнтів із попередньою холецистектомією, оскільки повідомляють про спазми сфінктера Одді та панкреатит (K.C. Fragkos, 2017). Ефективність елюксадоліну наразі оцінюють у підлітків із СПК-Д (NCT03339128).
Сироватковий бичачий імуноглобулін (SBI) модулює сполучні регуляторні білки в кишечнику і тому може бути ефективним у лікуванні СПК (E. Sinagra et al., 2017). Два пілотних РКД у підлітків із СПК-Д досліджували ефект препарату, але результати виявилися суперечливими (A. Rana, 2017; R. Arrouk, 2018).
Ібодутант, селективний антагоніст рецепторів NK2, довів свою ефективність і безпечність у випробуваннях серед дорослих із СПК-Д (J. Tack et al., 2017).
Гетерогенність педіатричних СПК і ФАБ навіть у межах окремих підтипів ускладнює планування алгоритму лікування для всіх дітей. Відомо, що приблизно у 40% дітей симптоми зберігаються, незважаючи на лікування (M.J. Gieteling, 2008; M.J. Gieteling, 2011; S. Horst, 2014). Поетапний підхід, у тому числі діагностична стратегія з мінімальними дослідженнями, залученням пацієнтів і сімей до спільного прийняття рішень, а також індивідуалізований підхід до менеджменту захворювання є основою ведення СПК і ФАБ у педіатричній практиці.
Автори настанови пропонують індивідуалізований підхід до кожного пацієнта, заснований на переконаннях сім’ї, опублікованих доказах, якщо вони доступні, і лікуванні супутніх симптомів, таких як нудота, здуття живота, діарея або запор (рис.). Немедикаментозні і фармакологічні втручання слід обговорювати.
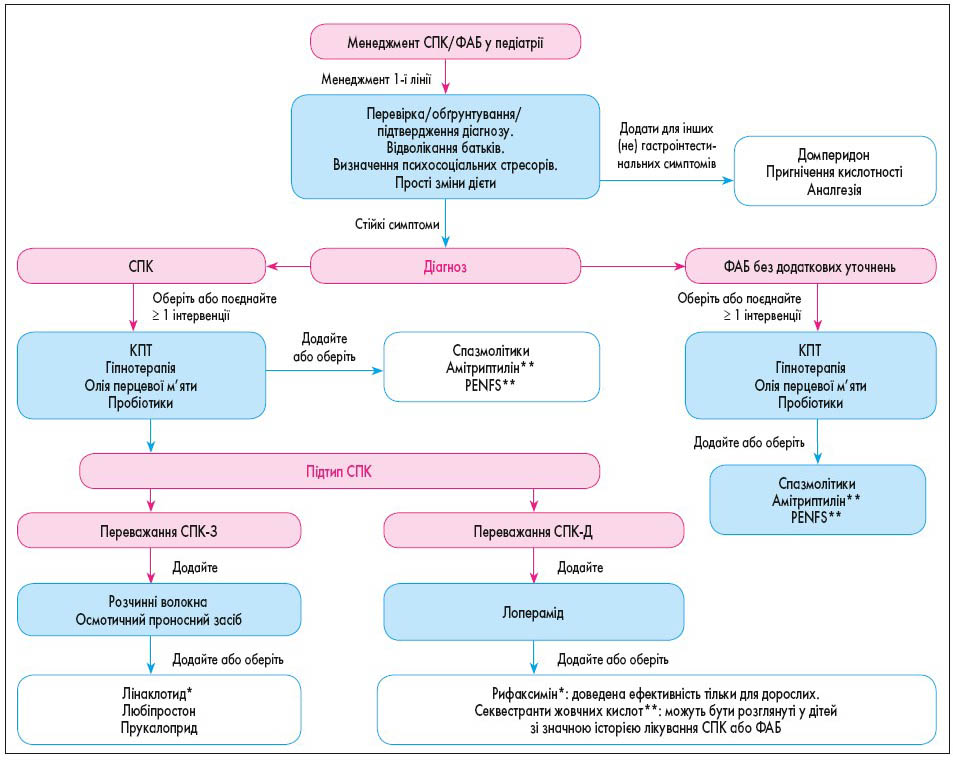 Рис. Менеджмент СПК/ФАБ у педіатрії
Рис. Менеджмент СПК/ФАБ у педіатрії
Перший рекомендований крок у лікуванні СПК і ФАБ – це встановлення діагнозу, навчання, підтвердження діагнозу та виявлення факторів стресу. Початковий етап лікування має охоплювати навчання батьків і прості зміни дієти. Якщо симптоми зберігаються, особливо у пацієнтів із функціональною інвалідністю, може бути запропоноване (онлайн) психологічне лікування, оскільки воно виявилося успішним засобом терапії. Хоча КПТ або гіпнотерапія є прийнятними, деякі пацієнти можуть віддати перевагу фармакологічній терапії або комбінації втручань.
Якщо пацієнти мають СПК-З, автори рекомендують збільшити споживання розчинних волокон або підвищити дозу проносних засобів, таких як PEG. Діарея може бути полегшена за допомогою лопераміду. У дітей із постійними симптомами СПК-Д можуть бути ефективними рифаксимін і секвестранти жовчних кислот.
Особливої уваги заслуговують скарги на неабдомінальні симптоми болю, зокрема головний біль і біль у грудях, спині, суглобах і кінцівках (B.P. Chumpitazi et al., 2021). Ці коморбідні соматичні симптоми спостерігаються майже у 75% дітей і пов’язані з підвищеною частотою та тяжкістю болю в животі, функціональними порушеннями, поганим сном, психосоціальним дистресом і погіршенням здоров’я та якості життя, що може впливати на довгостроковий прогноз (B.P. Chumpitazi, 2021; J.A. Rabbitts, 2016; M. Skrove, 2015; W. Maixner, 2016). Для лікування цих проявів може бути розглянута додаткова терапія аналгетиками, такими як нестероїдні протизапальні засоби або парацетамол. Автори підкреслюють, що більшість пацієнтів відповідають на терапію 1-ї лінії. Однак різні високоефективні втручання (дієтичні і психологічні) не є легкодоступними через брак суміжних медичних працівників.
Нові розробки охоплюють надання психологічної терапії онлайн через аудіозаписи, телефоном або через Інтернет. Направлення до дитячого гастроентеролога необхідне, якщо больові розлади не усуваються за допомогою терапії 1-ї лінії або якщо необхідна терапія трициклічними антидепресантами і PENF, оскільки ці методи лікування зазвичай не використовують у щоденній клінічній практиці.
Ідеальним є мультидисциплінарний підхід до надання підтримки пацієнтам, проте він не завжди можливий.
Висновки
СПК і ФАБ є поширеними станами у дітей, хоча сьогодні немає доказового міжнародного посібника з менеджменту цих захворювань. Найкращим є поетапний індивідуальний підхід до планування стратегії терапії. Якісніші інтервенційні дослідження в цих групах необхідні для адекватного клінічного ведення пацієнтів у майбутньому.
За матеріалами R. Rexwinkel et al. A therapeutic guide on pediatric irritable bowel syndrome and functional abdominal pain-not otherwise specified. Eur J Pediatr. 2022. Jul; 181 (7): 2603-2617. doi:10.1007/s00431-022-04459-y.
Підготувала Ольга Загора
Тематичний номер «Педіатрія» № 2 (68) 2023 р.



