9 листопада, 2020
Антибіотики в лікуванні та профілактиці загострень хронічного обструктивного захворювання легень
Хронічне обструктивне захворювання легень (ХОЗЛ) – одна з провідних причин захворюваності та смертності в усьому світі. Згідно з результатами аналізу масштабних епідеміологічних досліджень станом на 2010 рік у світі налічувалося 384 млн хворих на ХОЗЛ, а рівень захворюваності становив 8,4-15%. Щороку від ХОЗЛ помирає приблизно 3 млн осіб, і, зважаючи на зростання поширеності куріння та забруднення повітря, передбачається, що до 2030 року жертвами цієї хвороби стануть 4,5 млн людей [1].
ХОЗЛ представляє собою поєднання захворювання «малих» дихальних шляхів (ДШ) (обструктивний бронхіоліт) та деструкції легеневої паренхіми (емфізема). Ці дві патології не обов’язково виникають одночасно, але з часом виявляються у всіх хворих на ХОЗЛ.
Етіологія ХОЗЛ мультифакторіальна та включає комбінацію зовнішніх (куріння та забруднення повітря) і внутрішніх факторів, зокрема гіперреактивність ДШ та дефіцит α1-антитрипсину. В основі патогенезу лежить персистуюче запалення бронхіол та легеневої паренхіми під впливом подразнюючих газів і твердих часток у повітрі. Хронічне запалення спричинює структурні зміни ДШ: з одного боку, звуження бронхіол обмежує дихальний потік, з іншого – руйнування альвеол зменшує силу еластичної тяги легень, що обмежує процес видиху [1, 2].
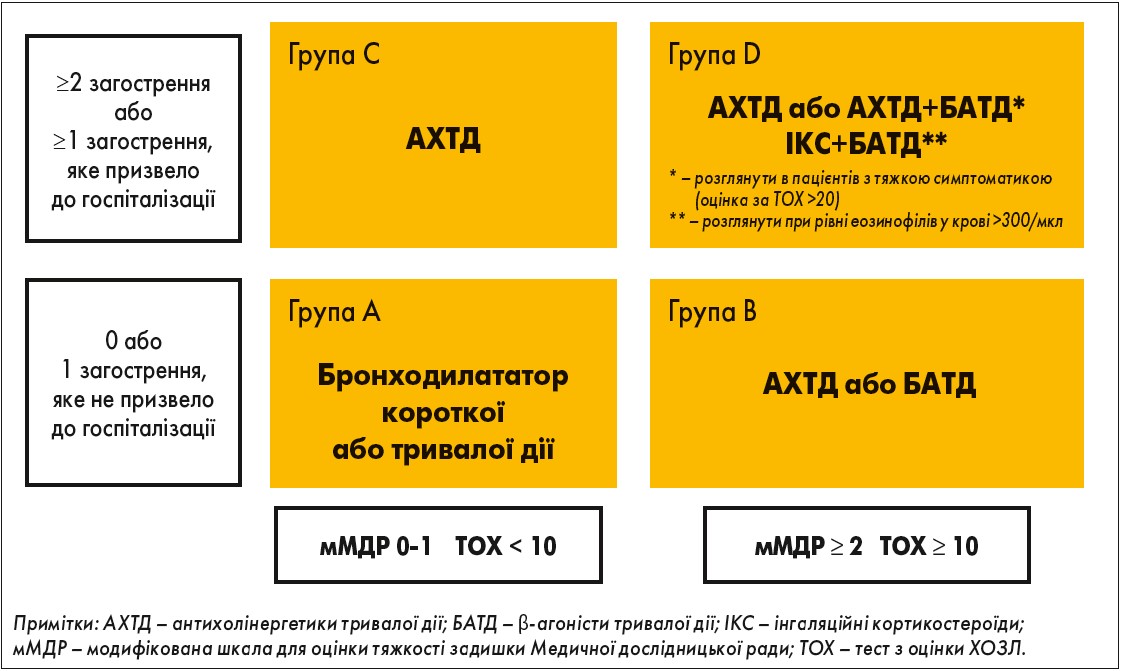
Незважаючи на те що ХОЗЛ є хронічним захворюванням, адекватна базисна терапія дає можливість його лікувати та запобігати його прогресуванню. Лікувальна тактика залежить від тяжкості симптомів, частоти загострень та потреби в госпіталізації, що визначає групу, до якої належить пацієнт із ХОЗЛ (A, B, C, D). Підхід до вибору базисної терапії ХОЗЛ відображений на рисунку [1, 2].
Рис. Базисна терапія ХОЗЛ (GOLD, 2019)
Таким чином, ключовою подією в лікуванні ХОЗЛ є саме загострення, яке негативно впливає на перебіг захворювання і якість життя пацієнтів. Клінічно цей стан проявляється задишкою, збільшенням кількості свистячих хрипів (так званого візингу), частоти кашлю та об’єму і гнійності мокроти. Ці симптоми зумовлені посиленням запалення ДШ, підвищенням продукції слизу та експіраторним закриттям ДШ [1]. При цьому кожен епізод загострення викликає незворотне ремоделювання ДШ. Саме загострення є основною причиною госпіталізації та смерті хворих: рівень смертності в пацієнтів, госпіталізованих із загостренням ХОЗЛ, у разі потреби в штучній вентиляції легень (ШВЛ) становить 40% [3, 4].
Основними етіологічними чинниками загострення є забруднення повітря, куріння, зміна клімату та інфекції. Саме інфекцією спричинені 80% усіх загострень ХОЗЛ, з них 40-50% – бактеріальними збудниками. Тяжкість порушення функції легень може змінюватися залежно від типу патогенних бактерій та ступеня зараження [5].
Лікування загострення має розпочинатися якнайшвидше після встановлення діагнозу та впливати на всі ланки етіопатогенезу. Згідно з GOLD‑2019 основними моментами в терапії загострень ХОЗЛ є [1]:
- β2-агоністи короткої дії в якості монотерапії або в комбінації з антихолінергетиками короткої дії рекомендовані як початкові бронходилататори (ступінь доказовості С).
- Системні стероїди можуть покращити функцію легень (об’єм форсованого видиху за 1-шу с – ОФВ1), оксигенацію та скоротити тривалість госпіталізації. Тривалість терапії не має перевищувати 5-7 днів (ступінь доказовості А).
- Неінвазивна механічна вентиляція має розглядатися в усіх пацієнтів із гострою дихальною недостатністю при загостренні ХОЗЛ за відсутності абсолютних протипоказань, оскільки вона покращує газообмін, зменшує потребу в інтубації, скорочує тривалість госпіталізації та покращує виживання (ступінь доказовості А).
- Метилксантини не рекомендуються через підвищений ризик виникнення побічних реакцій (ступінь доказовості В).
- Антибіотики (АБ), за показаннями, скорочують час одужання, знижують ризик ранніх повторних загострень та тривалість госпіталізації. Тривалість терапії не має перевищувати 5-7 днів (ступінь доказовості В).
Результати низки досліджень підтвердили роль АБ у лікуванні загострень ХОЗЛ. Так, відповідно до результатів Кокранівського систематичного огляду, який включив 11 контрольованих клінічних досліджень (n=917), призначення АБ дало можливість зменшити ризик передчасної смерті на 77%, ризик відмови від лікування – на 53% та ризик появи гнійного мокротиння – на 44% [6].
У ще одному мультицентровому подвійному сліпому рандомізованому дослідженні взяли участь 1056 пацієнтів віком до 60 років, із задокументованою історією ≥2 загострень ХОЗЛ протягом попереднього року, які потребували призначення курсу системних АБ та/або системних кортикостероїдів, палили або були курцями в минулому зі стажем куріння ≥20 пачко-років. На початку дослідження всі пацієнти після застосування бронхіолітика мали ОФВ1 ≤60% передбачуваного, при співвідношенні ОФВ1 / форсована життєва ємність легень (ФЖЄЛ) <70%.
Учасники експерименту отримували курс захищених амінопеніцилінів протягом 7 днів або 5-денний курс фторхінолонів, після чого протягом 8 тиж оцінювали первинні та вторинні кінцеві точки. Первинною кінцевою точкою була неефективність терапії, яку визначили за потреби в додатковому або альтернативному лікуванні системними АБ та/або системними кортикостероїдами (включаючи збільшення дози або тривалості лікування) та/або госпіталізації протягом 8 тиж після прийому одного з курсів АБ. Вторинні кінцеві точки включали клінічну відповідь у пацієнтів із позитивними культурами мокротиння та бактеріологічними результатами. В обох групах пацієнтів спостерігалася нижча частота неефективності терапії та вищий рівень ерадикації бактеріальних збудників і клінічного видужання зі статистично значимою перевагою в групі фторхінолонів [7].
Згідно з результатами систематичного огляду Quon та співавт. АБ при загостренні ХОЗЛ достовірно знижують рівень неуспішності лікування на 46% (95% ДІ 0,32-0,92) та внутрішньолікарняну смертність на 78% (95% ДІ 0,08-0,62) проти плацебо [8].
Оскільки загострення ХОЗЛ швидко прогресує, раннє емпіричне призначення АБ у разі бактеріальної етіології загострення є ключовим для досягнення позитивної відповіді [9].
Численні настанови рекомендують використовувати амоксицилін, триметоприм-сульфаметоксазол та доксициклін у терапії загострень ХОЗЛ. Ці дані ґрунтуються на доказах, але необхідно враховувати той факт, що більшість із них отримані понад 20 років тому і з того часу значуще зросла резистентність до АБ. У США до 1987 року менше 1% пневмококів мали високий рівень стійкості до пеніциліну, тоді як уже в 1997 р. загальна резистентність до пеніциліну досягла 43,8%. Пеніцилінорезистентний Streptococcus pneumoniae також має знижену чутливість до інших класів АБ, зокрема макроліди, цефалоспорини і тетрацикліни. Haemophilus influenzae та Moraxella catarrhalis також характеризуються підвищеною стійкістю до АБ завдяки продукуванню β-лактамаз та іншим механізмам резистентності. Звичайно, є значна географічна різниця, але останнє десятиліття світова тенденція полягає в підвищенні антибіотикорезистентності (АБР). Отже, емпірично обраний АБ має максимально перекривати спектр усіх збудників, що спричиняють загострення ХОЗЛ, та мати низький потенціал до розвитку АБР [10].
Одними з перспективних з цієї точки зору препаратів є фторхінолони. Основною мішенню їхньої активності є бактеріальний фермент ДНК-гіраза, який входить до класу топоізомераз II типу. Бактерії не здатні розвивати резистентність до фторхінолонів через механізми, опосередковані плазмідами або R-фактором. Крім того, представники цього класу АБ виявилися нечутливими до деградації за допомогою механізмів інактивації бактерій. Імовірніше, бактеріальна стійкість до фторхінолонів виникає або через хромосомну мутацію в ДНК-гіразі цільового ферменту, або через мутації, що змінюють проникність лікарського засобу в клітину бактерій. Таким чином, імовірність розвитку резистентності до фторхінолонів нижча, ніж до аміноглікозидів або β-лактамних АБ [11].
В одному з проспективних досліджень вивчалися етіологічні бактеріальні збудники при тяжкому загостренні ХОЗЛ, що потребувало госпіталізації. Вони виявлялися в 47,22% усіх випадків. При цьому частота виявлення бактеріальних збудників зростала з віком (р=0,02) і була асоційована з частими загостреннями (р<0,001), прийомом системних стероїдів (р=0,005) та порушенням функції легень (р=0,02). Найчастіше ідентифікувалися Pseudomonas aeruginosa (38,23%), Klebsiella pneumoniae (29,41%), золотистий стафілокок (23,53%), Streptococcus pneumoniae (5,88%) та Acinetobacter spp. (2,94%). Більш високий парціальний тиск вуглекислого газу (PaCO2) виявився незалежним предиктором виділення Klebsiella pneumoniae (p=0,025) та Pseudomonas aeruginosa (p=0,001). Додатковими незалежними чинниками виявлення Klebsiella pneumoniae були вік >55 років (p=0,017) та системне вживання стероїдів (p=0,017).
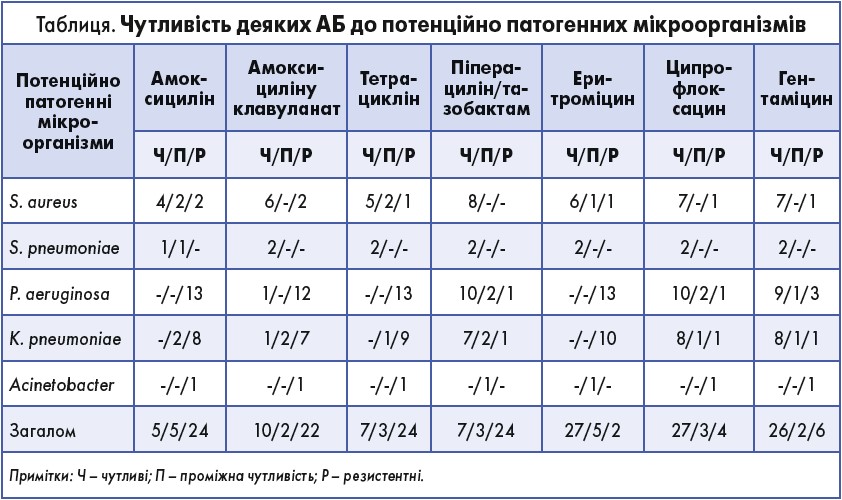
Аналіз структури чутливості різних АБ до потенційно патогенних мікроорганізмів показав, що більшість ізолятів виявляли стійкість до амінопеніцилінів, макролідів і тетрацикліну (табл.).
Ципрофлоксацин і піперацилін/тазобактам виявилися ефективними в 79,41% ізолятів, що робить їх оптимальними препаратами для ерадикації більшості мікроорганізмів, виділених у госпіталізованих хворих із загостренням ХОЗЛ [12].
У ще одному дослідженні, яке включило 1056 амбулаторних пацієнтів із загостренням ХОЗЛ, найпоширенішими виявленими збудниками були Haemophilus influenzae (21,1%), Pseudomonas aeruginosa (16,8%), Klebsiella pneumoniae (12,7%), Streptococcus pneumoniae та Moraxella сatarrhalis [7].
У своєму дослідженні Pettigrew та співавт. оцінювали чутливість до АБ, поширеність генів резистентності, розвиток резистентності до Haemophilus influenzae та ефективність макролідів і фторхінолонів в ерадикації вказаного патогену. Дані були отримані з 15-річного поздовжнього дослідження ХОЗЛ. Для визначення генотипу та ідентифікації генів резистентності використовували геномні послідовністі. Мінімальну інгібуючу концентрацію (MIC) АБ визначали методом мікророзведень у бульйоні. Для оцінки взаємозв’язку між використанням АБ та ерадикацією Haemophilus influenzae застосовували узагальнені лінійні змішані моделі.
Було обстежено 267 ізолятів Haemophilus influenzae від 77 осіб. Усі щойно отримані ізоляти були чутливими до азитроміцину. У 5 з 27 (19%) штамів із часом розвинулося чотириразове збільшення МІС азитроміцину і досягло або перевищило межу сприйнятливості (≤4 мкг/мл) під час впливу. Ізоляти Haemophilus influenzae були рівномірно сприйнятливі до ципрофлоксацину, левофлоксацину та моксифлоксацину (MIC90 0,015; 0,015 та 0,06 відповідно); не було виявлено мутацій, відповідних за резистентність до фторхінолонів. Використання останніх було асоційовано з посиленням ерадикації Haemophilus influenzae порівняно з макролідами (відношення ризиків [ВР] 16,67; 95% ДІ 2,67-104,09). Отже, фторхінолони виявилися ефективними для ерадикації Haemophilus influenzae у хворих на ХОЗЛ [14].
Ще однією важливою характеристикою при виборі ефективного АБ для лікування загострення ХОЗЛ є фармакокінетичний профіль препарату. Знову ж фторхінолони, зокрема їх представник ципрофлоксацин, має низку переваг у цьому аспекті. Всмоктування після перорального прийому препарату доволі швидке: пікових концентрацій ципрофлоксацин у сироватці крові (Cmax) досяг приблизно через 1-2 години. Одночасний прийом їжі не викликає клінічно значущих порушень абсорбції, що може бути корисним для мінімізації шлункових розладів на тлі прийому препарату. Є лінійна залежність між сироватковими концентраціями ципрофлоксацину та дозою, що вводиться перорально або внутрішньовенно. Абсолютна біодоступність ципрофлоксацину становить приблизно 70%. Широкий об’єм розподілу при введенні стандартних пероральних або внутрішньовенних доз варіює від 1,74 до 5,0 л/кг, що відображає проникнення препарату в більшість тканин організму [11].
У дослідженні Kontou та співавт. оцінювався фармакокінетичний профіль ципрофлоксацину у тяжкохворих із ХОЗЛ, які перебувають на ШВЛ. Було продемонстровано, що препарат швидко проникає в бронхіальний секрет, тому вважається хорошим вибором для лікування інфекційних загострень ХОЗЛ [14].
Клінічна ефективність ципрофлоксацину підтверджена результатами нещодавно проведеного метааналізу. Автори дослідили ефективність низки АБ для лікування ХОЗЛ, зокрема амоксициліну, амоксициліну клавуланату, ампіцилін-сульбактаму, азитроміцину, цефаклору, цефуроксиму, ципрофлоксацину, кларитроміцину, діритроміцину, доксицикліну, левофлоксацину, моксифлоксацину, офлоксацину та ін. Було виявлено, що використання ципрофлоксацину забезпечувало високі показники клінічного вилікування із середнім рівнем побічних ефектів, що робить його оптимальним АБ у терапії пацієнтів із загостренням ХОЗЛ [15].
В арсеналі українських спеціалістів є препарат ципрофлоксацину, представлений компанією «Сан Фармасьютикал Індастріз Лімітед» (Індія) під торговою назвою Цифран OD, чиї ефективність і безпека підтверджені часом. Пролонгована форма препарату дає можливість застосовувати його лише 1 раз на добу, що позитивно впливає на комплаєнс. Це особливо актуально для пацієнтів із ХОЗЛ, які зазвичай паралельно отримують значну кількість препаратів у рамках базисної терапії. Ще однією перевагою препарату є його економічна доступність, а це має неабияке значення в сучасних реаліях. Усе зазначене робить Цифран OD препаратом вибору при веденні пацієнтів із загостренням ХОЗЛ.
Використання адекватної антибактеріальної терапії не лише пришвидшить зникнення симптомів та покращить прихильність пацієнтів до лікування, але й допоможе запобігти прогресуванню захворювання, розвитку подальших загострень та незворотного ремоделювання ДШ і супутніх тяжких ускладнень, що загрожують життю.
Література
- Global Initiative for Chronic Obstructive Lung Disease GOLD2019. Режим доступу: https://goldcopd.org/wp-content/uploads/2018/11/GOLD‑2019-v1.7-FINAL‑14Nov2018-WMS.pdf
- Zab Mosenifar. Chronic Obstructive Pulmonary Disease (COPD). Режим доступу: https://emedicine.medscape.com/article/297664-overview#a4
- Suissa S., Dell’Aniello S., Ernst P. Long-term natural history of chronic obstructive pulmonary disease: severe exacerbations and mortality. Thorax. 2012;67(11):957-63. Режим доступу: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3505864/
- Hurst JR. Exacerbation phenotyping in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2011;184(6):625-6. Режим доступу: https://onlinelibrary.wiley.com/doi/full/10.1111/resp.12197
- Hurst J.R. Exacerbation phenotyping in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2011;184(6):625-6. Режим доступу: https://www.atsjournals.org/doi/full/10.1164/rccm.201106-1136ED?url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org&rfr_dat=cr_pub%3Dpubmed&
- Ram F.S., Rodriguez-Roisin R., Granados-Navarrete A, Garcia-Aymerich J., Barnes N.C. WITHDRAWN: Antibiotics for exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2011 Jan 19;(1): CD004403. doi: 10.1002/14651858.CD004403.pub3. Режим доступу: https://www.ncbi.nlm.nih.gov/pubmed/21249661
- Robert Wilson, Antonio Anzueto, Marc Miravitlles, Pierre Arvis, Jeff Alder, Daniel Haverstock, Mila Trajanovic and Sanjay Sethi. Moxifloxacin versus amoxicillin/clavulanic acid in outpatient acute exacerbations of COPD: MAESTRAL results. Eur Respir J. 2012 Jul; 40(1): 17-27. Published online 2011 Dec 1. doi: 10.1183/09031936.00090311. Режим доступу: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3393767/
- Quon B.S., Gan W.Q., Sin D.D. Contemporary management of acute exacerbations of COPD: a systematic review and metaanalysis. Chest. 2008 Mar;133(3):756-66. doi: 10.1378/chest.07-1207. Режим доступу: https://www.ncbi.nlm.nih.gov/pubmed/18321904
- Ashok Kuwal, Vinod Joshi, Naveen Dutt, Surjit Singh, Kailash Chand Agarwal and Gopal Purohit. A Prospective Study of Bacteriological Etiology in Hospitalized Acute Exacerbation of COPD Patients: Relationship with Lung Function and Respiratory Failure. Turk Thorac J. 2018 Jan; 19(1): 19-27. Published online 2017 Nov 29. doi: 10.5152/TurkThoracJ.2017.17035. Режим доступу: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5783049/
- Amit Patel and Robert Wilson. Newer fluoroquinolones in the treatment of acute exacerbations of COPD. Int J Chron Obstruct Pulmon Dis. 2006 Sep; 1(3): 243-250.
- Vance-Bryan K., Guay D.R., Rotschafer J.C. Pharmacokinetics of ciprofloxacin after oral and intravenous administration in healthy volunteers. Eur J Clin Microbiol. 1984 Aug;3(4):355-9. Режим доступу: https://www.ncbi.nlm.nih.gov/pubmed/6489326
- Ouanes I., Ouanes-Besbes L., Ben Abdallah S., Dachraoui F., Abroug F. Trends in use and impact on outcome of empiric antibiotic therapy and noninvasive ventilation in COPD patients with acute exacerbation. Ann Intensive Care. 2015;5(1):30. Режим доступу: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4591222/
- Melinda M. Pettigrew, Brian T. Tsuji, Janneane F. Gent, Yong Kong, Patricia N. Holden, Sanjay Sethi and Timothy F. Murphy. Effect of Fluoroquinolones and Macrolides on Eradication and Resistance of Haemophilus influenzae in Chronic Obstructive Pulmonary Disease. Antimicrob Agents Chemother. 2016 Jul; 60(7): 4151-4158. Published online 2016 Jun 20. Prepublished online 2016 May 2. doi: 10.1128/AAC.00301-16. Режим доступу: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4914697/
- Paschalina Kontou, Kalliopi Chatzika, Georgia Pitsiou, Ioannis Stanopoulos, Paraskevi Argyropoulou-Pataka and Ioannis Kioumis. Pharmacokinetics of Ciprofloxacin and Its Penetration into Bronchial Secretions of Mechanically Ventilated Patients with Chronic Obstructive Pulmonary Disease. Antimicrob Agents Chemother. 2011 Sep; 55(9): 4149-4153. doi: 10.1128/AAC.00566-10. Режим доступу: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3165329/
Підготувала Ганна Кирпач
Тематичний номер «Пульмонологія, Алергологія, Риноларингологія» № 3 (52), 2020 р.