26 березня, 2021
Нові можливості ведення хворих на остеоартрит
 Остеоартрит (ОА) уражає ≈7% усього населення світу, що становить >500 млн людей; щороку цей показник лише зростає. ОА є провідною причиною інвалідності серед осіб похилого віку, а тенденції постаріння населення світу та збільшення поширеності ожиріння сприяють поглибленню цієї несприятливої ситуації. На жаль, і пацієнти, і лікарі нерідко сприймають ОА як неминучу складову процесу старіння та приділяють цьому захворюванню недостатньо уваги (Hunter D. J. et al., 2020).
Остеоартрит (ОА) уражає ≈7% усього населення світу, що становить >500 млн людей; щороку цей показник лише зростає. ОА є провідною причиною інвалідності серед осіб похилого віку, а тенденції постаріння населення світу та збільшення поширеності ожиріння сприяють поглибленню цієї несприятливої ситуації. На жаль, і пацієнти, і лікарі нерідко сприймають ОА як неминучу складову процесу старіння та приділяють цьому захворюванню недостатньо уваги (Hunter D. J. et al., 2020).
Для лікування ОА переважно застосовуються симптоматичні засоби на кшталт парацетамолу та нестероїдних протизапальних препаратів, однак таке лікування супроводжується високим ризиком побічних ефектів і може сприяти прогресуванню дегенерації суглобового хряща (Hause R.A., 2010; Machado G. C. et al., 2015; da Costa B. R. et al., 2016). Це привертає увагу пацієнтів, лікарів і науковців до дієтичних добавок, які наразі приймають ≈69% пацієнтів з ОА (Basedow M. et al., 2014). Дієтичні добавки застосовуються як альтернатива рекомендованим за ОА фізичним навантаженням або в поєднанні з ними. Популярність дієтичних добавок є надзвичайно високою: витрати на альтернативні засоби приблизно дорівнюють витратам на традиційну фармакотерапію (Ramsey S. D. et al., 2001).
У метааналізі X. Liu та співавт. (2018), що включав 69 досліджень, лише 7 із проаналізованих біодобавок продемонстрували достовірний клінічний ефект за ОА, серед яких гідролізат колагену, екстракт босвелії (ЕБ) (Boswellia serrata), екстракт куркуми (Curcuma longa) та куркумін.
Гідролізат колагену складається з низки окремих пептидів. Вважається, що ця добавка зменшує дегенерацію хряща та відтерміновує прогресування ОА за рахунок стимуляції синтезу протеогліканів і колагену ІІ типу (Henrotin Y. et al., 2011). У систематичному огляді J.P. van Vijven (2012) виявлено достовірний знеболювальний ефект колагену порівняно із плацебо (біль оцінювався за шкалою WOMAC – Western Ontario and McMaster Universities Osteoarthritis Index). Деякі із включених до цього метааналізу досліджень навіть продемонстрували перевагу колагену над глюкозаміну сульфатом. Важливо, що колаген вважається безпечною добавкою, а найпоширенішими побічними ефектами є незначні та помірні шлунково-кишкові розлади (Benito-Ruiz P. et al., 2009; van Vijven J. P. et al., 2012). Молекула колагену є досить великою і в процесі травлення розпадається на амінокислоти, які в подальшому використовуються для синтезу ендогенного колагену в хондроцитах. Цей колаген становить основу позаклітинного матриксу суглобового хряща (Яременко О. Б. і співавт., 2020). Під час прийому гідролізованих форм колагену його абсорбція зростає до 95% (Oesser S. et al., 1999).
Крім колагену, важливим компонентом хрящової тканини є гіалуронова кислота та її похідні. Пероральне застосування гіалуронатів полегшує патологічні стани та симптоми, асоційовані з синовітом, зокрема біль у колінному суглобі, суглобовий випіт і запалення, зменшення м’язової сили мускулатури, що оточує суглоб (Oe M. et al., 2016).
У час поліпрагмазії та широкого застосування синтетичних медикаментів все більшу увагу привертають засоби природного походження, перевагою яких є досить висока ефективність на тлі низької кількості побічних ефектів. Хоча механізми їхньої дії не до кінця зрозумілі, доведений вплив на протизапальні медіатори обґрунтовує доцільність застосування деяких із цих несинтетичних лікарських засобів у лікуванні ОА (Яременко О.Б., 2017). Так, експериментальні дослідження на тваринах і пілотні клінічні випробування доводять, що ЕБ може успішно застосовуватися для лікування запальних захворювань, у т. ч. ОА та ревматоїдного артриту (Abdel-Tawab M. et al., 2011). Такий висновок підтвердило й узагальнення двох Кокранівських метааналізів (Trifunovic-Konig M. et al., 2016).
Донедавна вважалося, що фармакологічні ефекти ЕБ насамперед опосередковані пригніченням утворення лейкотрієнів унаслідок інгібування 5-ліпооксигенази двома босвелієвими кислотами: 11-кето-β-босвелієвою та ацетил‑11-кето-β-босвелієвою. Однак виявилося, що ще одним важливим складником ЕБ є β-босвелієва кислота, яка інгібує мікросомальну простагландин-Е‑синтазу, а також серинову протеазу під назвою катепсин G. Отже, протизапальний ефект ЕБ може бути обумовлений кількома різними механізмами (Abdel-Tawab M. et al., 2011).
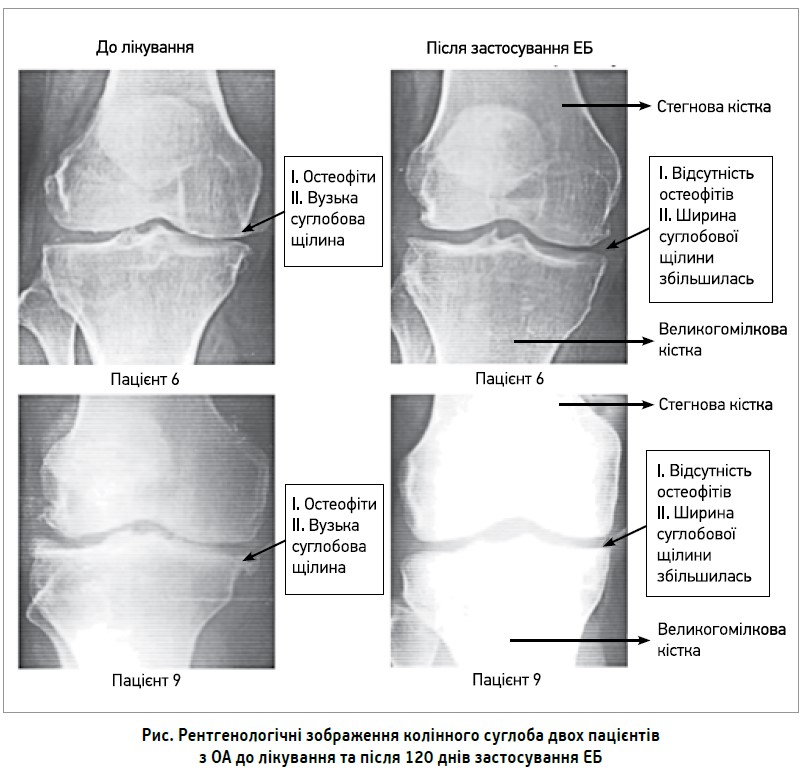
ЕБ має виражені протизапальні, антиартритичні й аналгетичні властивості, зменшує кількість лейкоцитів у синовіальній рідині, сприяє відновленню прохідності судин, отже, й покращенню кровопостачання суглобів (Kulkarni R. R. et al., 1991). Крім того, застосування ЕБ упродовж 120 днів запобігає звуженню суглобової щілини й утворенню остеофітів, що є свідченням сповільнення прогресування структурних змін за ОА (рис.) (Majeed M. et al., 2019).
Кумулятивний аналіз 11 неопублікованих досліджень, проведений R. Etzel (1996), виявив, що застосування ЕБ може зменшувати набряк суглобів і відчуття скутості. Доказова база ефективності ЕБ за ОА є потужнішою, ніж за ревматоїдного артриту. Так, у дослідженні K. Sengupta та співавт. (2008) засіб на основі ЕБ знижував уміст матриксної металопротеази‑3 (ферменту, який руйнує хрящ і сприяє утворенню ерозій) у синовіальній рідині пацієнтів з ОА. Внаслідок цього достовірно зменшувався біль та покращувалася функція суглоба (за опитувальником WOMAC і візуально-аналоговою шкалою). Крім того, зменшення ферментної деградації суглобового хряща здатне чинити довгостроковий вплив на стан суглоба, запобігаючи його руйнуванню. Цікаво, що покращення клінічного стану спостерігалося вже через 7 днів після початку лікування.
У 8-тижневому рандомізованому подвійному сліпому перехресному дослідженні застосування ЕБ у пацієнтів з ОА колінного суглоба зумовлювало достовірне зменшення болю, покращення згинання в ураженому суглобі та збільшення відстані безбольової ходьби порівняно із плацебо. Пацієнти, котрі приймали ЕБ, також відзначили зменшення болю при різноманітних рухах – підйомі сходами, присіданнях, вставанні на коліна. На думку авторів дослідження, застосування ЕБ доцільне не лише при ОА, а й при ревматоїдному артриті, анкілозивному спондиліті, дегенеративних захворюваннях хребта (Kimmatkar N. et al., 2003). Порівняння ЕБ із НПЗП вальдекоксибом виявило, що через 7 міс лікування в групі ЕБ оцінка за усіма 3 субдоменами шкали WOMAC (біль, скутість, функціональний стан) була достовірно кращою, ніж у групі вальдекоксибу (Sontakke S. et al., 2007). Інше порівняння також підтвердило зіставну ефективність ЕБ і НПЗП еторикоксибу, однак було з’ясовано, що вживання ЕБ не супроводжується побічними ефектами, а застосування еторикоксибу в частині випадків зумовлює шлунково-кишкові розлади, неврологічні й дерматологічні побічні явища. На думку авторів, ЕБ є високоефективною та безпечною альтернативою НПЗП (Raj S. P., Bajpai M., 2013).
Ще одним класом природних сполук з доведеними протизапальними властивостями є куркумін – куркуміноїд, який міститься в екстракті куркуми (Curcuma domestica – жовтий імбир, один з основних компонентів каррі). Саме завдяки куркуміноїдам корінь куркуми має характерний жовтий колір. Куркуміну присвячено >3000 доклінічних досліджень, що робить його одним з найвивченіших агентів рослинного походження в біологічно-медичній літературі (Aggarwal B., Sung B., 2009). Ці дослідження довели, що куркумін зупиняє запальні процеси на рівні прозапальних ферментів (циклооксигенази та ліпооксигенази) й запальних факторів транскрипції (ядерний фактор κВ), а також їхньої геномної експресії. Дослідження W. Zhang і співавт. (2008) виявило, що застосування куркуміну в пацієнтів з ОА впродовж 3 міс зменшувало вираженість симптомів артриту та покращувало функцію суглобів за шкалою WOMAC, а також сприяло поліпшенню показників ходьби на тредмілі. В іншому випробуванні взяли участь 100 пацієнтів з ОА одного чи обох колінних суглобів, підтвердженим рентгенографічно. Цих пацієнтів було рандомізовано в групи добавки на основі куркуміну та плацебо. Через 3 міс сумарна оцінка за шкалою WOMAC у групі куркуміну зменшилася із 16,6 до 7,3 бала; в групі контролю змін виявлено не було. Оцінка скутості також достовірно зменшилася (із 7,4 до 3,2 бала); контрольна група продемонструвала відсутність позитивних зрушень. Після застосування куркуміну було також зафіксовано достовірне покращення функції уражених суглобів, зменшення негативного впливу ОА на соціальні функції, покращення емоційного стану пацієнтів, збільшення дистанції ходьби на тредмілі (на 345% у групі куркуміну та на 89% у групі контролю; р<0,05). Крім того, автори відзначили зниження низки запальних маркерів, зокрема ШОЕ й інтерлейкіну‑1β. Учасники групи куркуміну змогли знизити вживання НПЗП і знеболювальних засобів на 63,4%, що забезпечило зменшення шлунково-кишкових ускладнень лікування на 66,7%, а також зменшити сумарні витрати на лікування на 63,5% (Belcatro G. et al., 2010). У подвійному сліпому плацебо-контрольованому випробуванні Y. Panahі та співавт. (2014) пацієнтів з ОА колінного суглоба незначної та помірної тяжкості було рандомізовано в групи куркуміноїдів і плацебо. Вживання куркуміноїдів асоціювалося з достовірно вираженішим покращенням за шкалою WOMAC, оцінкою симптоматики за візуально-аналоговою шкалою та індексом Лекена. Метааналіз R. R. Bannuru та співавт. (2014), який включав 9 досліджень за участю 857 пацієнтів, виявив, що за своїм знеболювальним ефектом куркумін не лише перевищував плацебо, а й був зіставним з ібупрофеном. Автори пояснюють таку високу ефективність цієї речовини потужним впливом на провідні ферменти запалення: циклооксигеназу, ліпооксигеназу, фосфоліпазу, колагеназу та гіалуронідазу.
Відносно низька біодоступність куркуміну внаслідок порівняно низького всмоктування в кишечнику, швидкого метаболізму в печінці й елімінації через стінку жовчного міхура обмежує застосування цієї сполуки (Wahlstrom B., Blennow G., 1978; Shoba G. et al., 1998; Yang K. Y. et al., 2007), однак дослідження L. Khorsandi та співавт. (2014) продемонструвало, що додавання піперину (складника чорного перцю) до куркуміну дає змогу покращити біодоступність останнього. В експерименті цих авторів щурам з модельованим артритом вводився куркумін, піперин або комбінація цих інгредієнтів. З’ясувалося, що сам піперин (на відміну від куркуміну) майже не чинить захисного впливу на суглоб, але підсилює сприятливі хондропротекторні ефекти куркуміну. Характерною ознакою хряща, ураженого ОА, є гіпоцелюлярність. Додавання піперину до куркуміну сприяло вираженішому зростанню вмісту клітин хряща, ніж монотерапія куркуміном. Збереження щонайбільшої кількості клітин є надзвичайно важливим аспектом лікування ОА, оскільки лише хондроцити здатні підтримувати життєздатність та функції суглобового хряща. Крім того, в дослідженні з’ясувалося, що комбінація куркуміну та піперину достовірно зменшувала вміст матриксної металопротеїнази‑13. G. Shoba та співавт. (1997) також провели дослідження біодоступності куркуміну за умов додавання піперину. Оскільки піперин є інгібітором глюкуронізації у печінці та кишечнику, він здатен сповільнювати метаболізм інших речовин, зокрема куркуміну. Так, у здорових добровольців додавання 20 мг піперину до 2 г куркуміну підвищувало біодоступність останнього на 2000%.
Безсумнівно, комбінації різних рослинних компонентів мають перевагу над застосуванням окремих складників у вигляді монотерапії. У дослідженні A. Haroyan і співавт. (2018) взяли участь пацієнти віком 40-77 років з дегенеративно-гіпертрофічним ОА колінних суглобів, які протягом 12 тиж приймали куркуміноїди, їхню комбінацію з ЕБ або плацебо. При проведенні оцінки за шкалою WOMAC було виявлено достовірну відмінність між групою комбінованої терапії та групою плацебо. Оскільки хімічна структура куркуміну та босвелієвої кислоти є абсолютно різною, їхні молекулярні мішені також відрізняються. Саме тому застосування цих біологічних молекул дає змогу досягти синергетичної дії та багатофакторного ефекту (Efferth T., Koch E., 2011; Panossian A. et al., 2015; Comblain F. et al., 2015). Поєднання декількох рослинних екстрактів з колагеном забезпечує ще більшу різноспрямованість мультитаргетної терапії: усунення запалення, ліквідацію болю та підтримку життєздатності суглобового хряща.
Таке поєднання на фармацевтичному ринку України представлено дієтичною добавкою Двісустав (Dr. Reddy’s). В одному саше міститься 10 г пептидів колагену, 125 мг куркуміну (95% куркуміноїдів), 100 мг ЕБ (30% ацетил‑11-кето-β-босвелієвої кислоти), 12,5 мг гіалуронату натрію та 2,5 мг чорного перцю. Така формула дозволяє Двісуставу поповнювати запас колагену, необхідний для підтримання архітектури суглобового хряща, а також за рахунок рослинних складників створювати оптимальні дієтологічні умови функціонування опорно-рухового апарату при порушеннях функцій суглобів, спричинених тривалим впливом шкідливих факторів на суглобовий хрящ. Для зменшення суглобової симптоматики Двісустав доцільно застосовувати щонайменше протягом 4-6 тиж, а максимальний позитивний ефект спостерігається після 8-12 тиж вживання.
В подальшому курс можна повторювати.
Медична газета «Здоров’я України 21 сторіччя» № 5 (498), 2021 р.