24 квітня, 2021
Діабетична нейропатія: складна патологія, що потребує комплексного лікування
Периферична нейропатія – комплексна й дуже поширена патологія, присутня у 8% загальної популяції та в 15% людей віком ≥40 років [1]. У Європі та США найчастішими причинами периферичної нейропатії є предіабет і цукровий діабет (ЦД) 2 типу. У країнах Західного світу ці захворювання набули характеру неінфекційної епідемії: кожен третій дорослий страждає на предіабет, кожен десятий – на ЦД 2 типу [2, 3]. Дистальна сенсорна полінейропатія (ДСПН), яка є найчастішим ускладненням діабету та становить 75% усіх діабетичних нейропатій (ДН), на момент установлення діагнозу присутня в 10-15% хворих на ЦД 2 типу, а після 10 років захворювання розвивається в 50% пацієнтів [4, 5]. Пізніми ускладненням ДСПН є виразки стопи та нейроартропатія Шарко, що часто призводять до ампутацій і також є предикторами смертності [6, 7].
Діагностика та клінічні прояви ДН
Ранні прояви ДН зазвичай зумовлені ураженням сенсорних нервів і включають позитивні симптоми – біль, парастезії й дизестезії (неприємні відчуття печіння, поколювання, посмикування, дискомфорту) в дистальних відділах кінцівок, а також негативні симптоми, як-от оніміння; порушена обробка сенсорних сигналів може призводити до гіпералгезії й алодинії (болю у відповідь на стимули, котрі в нормі його не спричиняють). Часто першим симптомом є характерний нейропатичний біль – пекучий, колючий, стріляючий, як при ураженні електричним струмом. У міру прогресування захворювання з’являється м’язова слабкість – ознака ураження моторних нервів [8].
Діабетичне ураження симпатичних і парасимпатичних нервів (автономна ДН) може проявлятися загальною слабкістю, зниженою толерантністю до фізичних навантажень, запамороченням, порушенням судомоторної функції (знижене чи підвищене потовиділення), іншими симптомами з боку різних систем організму – кардіоваскулярної (знижена варіабельність серцевого ритму, тахікардія в спокої, ортостатична гіпотензія), гастроінтестинальної (гастропарез, діарея, запор), сечостатевої (нейрогенний сечовий міхур, еректильна дисфункція, жіноча сексуальна дисфункція). Крім того, внаслідок автономної ДН пацієнти можуть не усвідомлювати епізодів гіпоглікемії [9].
За рекомендаціями Американської діабетичної асоціації (ADA), на наявність ДСПН слід обстежувати всіх пацієнтів на момент установлення діагнозу ЦД 2 типу й через 5 років після діагностування ЦД 1 типу, а потім принаймні щорічно. Скринінг ДСПН також необхідний у пацієнтів із предіабетом, які мають симптоми периферичної нейропатії. Обстеження має включати збір анамнезу, оцінку температурної, больової та вібраційної чутливості, а також тест із 10-грамовим монофіламентом для оцінки ризику виразкування й ампутації. Електрофізіологічні дослідження чи направлення до невролога необхідні лише в разі атипової клінічної картини, сумнівного діагнозу чи за підозри на іншу етіологію нейропатії [9].
Диференційна діагностика ДН включає метаболічні захворювання (дисфункцію щитоподібної залози, хворобу нирок), системні хвороби (парапротеїнемію, васкуліти, амілоїдоз), інфекції (ВІЛ, гепатит В, хворобу Лайма), дефіцит нутрієнтів (вітамінів E, В1, В6, В12), хронічні інтоксикації. Периферична нейропатія також може бути пов’язана з хронічним уживанням алкоголю, певними ліками (аміодарон, хіміопрепарати) чи мати спадковий характер [9].
Патогенез діабетичної нейропатії
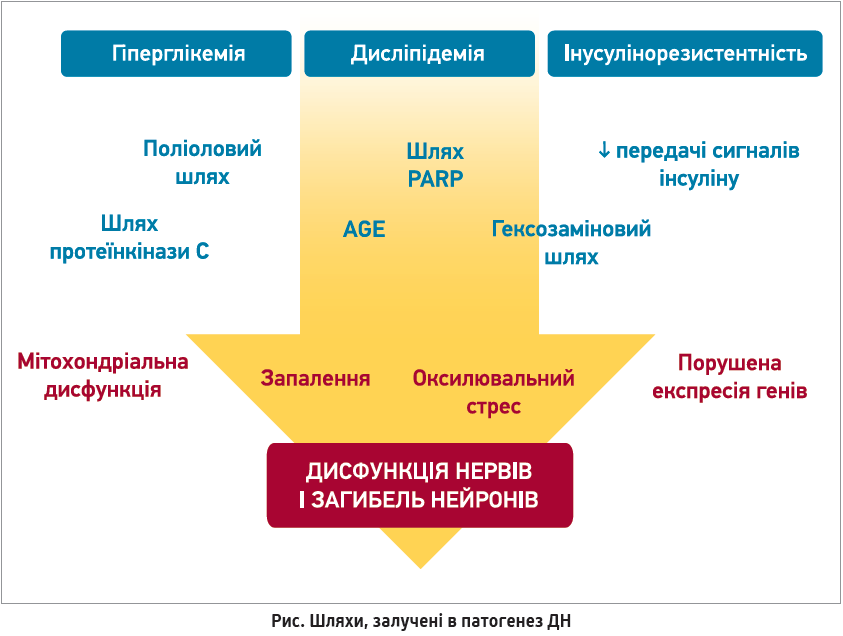
Патогенетичні механізми розвитку ДН є складними та включають низку сигнальних шляхів, накопичення продуктів кінцевого глікування (AGE), окислювальний стрес, запалення й мітохондріальну дисфункцію (рис.) [10].
Найвивченішим механізмом патогенезу ДН є поліоловий шлях – двоетапний процес, у якому глюкоза під дією альдозоредуктази відновлюється до сорбітолу, а потім окислюється до фруктози. У разі предіабету чи ЦД через надлишок глюкози утворюються підвищені рівні сорбітолу, котрі зумовлюють осмотичний дисбаланс у клітині з подальшим компенсаторним ефлюксом міоінозитолу й таурину. Втрата міоінозитолу, котрий є есенціальним компонентом натрій-калієвої АТФази, порушує фізіологію нервів. Підвищена активність альдозоредуктази також виснажує внутрішньоклітинні запаси нікотинаміддинуклеотидфосфату (НАДФН), необхідного для синтезу оксиду азоту та регенерації антиоксиданту глутатіону. У результаті в клітині підвищуються рівні активних форм кисню (АФК) і розвивається окислювальний стрес із пошкодженням структур і порушенням функцій клітини [10].
Підвищений гліколіз у відповідь на надлишок глюкози порушує низку метаболічних шляхів, що спричиняє ураження нейронів. Проміжний продукт гліколізу фруктозо‑6-фосфат входить у гексозаміновий шлях і перетворюється на 5-дисфосфат-N-ацетилглюкозамін, який зв’язується з транскрипційними факторами, залученими в порушення гомеостазу, запалення й пошкодження чутливих тканин, зокрема периферичних нервів. Гліколіз також призводить до накопичення ще одного проміжного продукту – дигідроксиацетонфосфату, що перетворюється на діацилгліцерол. Останній у нейронах активує протеїнкіназу С (PKC), що спричиняє низку метаболічних порушень – від інсулінорезистентності й дисфункції Na-K-АТФази до порушення експресії генів судинного фактора росту (VEGF) і трансформувального фактора росту-β (TGF-β) із подальшими вазоконстрикцією, гіпоксією та пошкодженням нервів [10-13].
У реакції Маяра глюкоза реагує з аміногрупами білків з утворенням продуктів Амадорі, з яких із часом утворюються незворотні продукти глікування, відомі як AGE. AGE «зшивають» есенціальні білки, порушуючи їхню функцію та спричиняючи пошкодження клітин. AGE також зв’язуються з рецепторами на поверхні клітин (RAGE), що активує сигнальний каскад із розвитком вазоконстрикції, запалення та втратою нейротрофічної підтримки [10, 14-17].
Останніми роками активно вивчається мітохондріальна дисфункція як головний етіологічний фактор ДН й інших ускладнень діабету [18-21]. Мітохондрії – клітинні органели, головною функцією котрих є вироблення енергії (у вигляді АТФ) шляхом окисного фосфорилювання. Мітохондрії також забезпечують біосинтез амінокислот, окислення жирних кислот, метаболізм стероїдних гормонів, гомеостаз кальцію, продукцію та знешкодження АФК. У синапсах мітохондрії відіграють провідну роль у нервовій провідності шляхом зменшення внутрішньоклітинних рівнів Ca2+ [18]. При ЦД надлишок субстрату для синтезу енергії (глюкози й жирних кислот) у мітохондріях призводить до порушення окисного фосфорилювання, зниження продукції АТФ і водночас значного підвищення рівнів АФК. У підсумку пошкоджуються ультраструктури мітохондрій, пригнічується дихальний ланцюг, виникають делеції мітохондріальної ДНК, втрачаються ефект кальцієвого буфера та мембранний потенціал. Мітохондріальна дисфункція призводить до неефективного функціонування всієї клітини аж до її загибелі [19].
Ведення діабетичної нейропатії
У дослідженнях DPP, Steno‑2, IGNT, Italian Supervised Treadmill Study та University of Utah Type 2 Diabetes Study було продемонстровано, що зміна способу життя, котра передбачає фізичні навантаження та дієту, може сприяти регенерації нервових волокон, зменшувати прояви ДСПН і кардіоваскулярної автономної нейропатії в пацієнтів із предіабетом і ЦД 2 типу [9, 20-24]. Суворий контроль глікемії може значно зменшити ймовірність ДН при ЦД 1 типу, але практично не впливає на ризик розвитку ДН при ЦД 2 типу навіть за підтримки цільових рівнів глюкози протягом 10 років [25].
Ураження нервових волокон, характерні для пацієнтів із ЦД 1 та 2 типів, спостерігаються також в осіб із предіабетом; отже, ДН є континуумом від нормоглікемії до різних ступенів гіперглікемії [10]. Саме тому патогенетичне лікування слід починати якомога раніше, ще до появи виражених симптомів. З огляду на складний патогенез захворювання терапія має впливати на різні механізми діабетичного ураження нервів, чого можна досягти за одночасного використання молекул із синергічною дією. Докази, отримані в численних експериментальних і клінічних дослідженнях, обґрунтовують застосування з профілактичною й лікувальною метою тіоктової (альфа-ліпоєвої) кислоти, L-карнітину та коензиму Q10.
Тіоктова кислота – це вітаміноподібна сполука ендогенного походження, що виконує функцію коферменту в окисному декарбоксилюванні кетокислот, бере участь у синтезі ацетил-коферменту А (ацетил-КоА), зменшує рівні AGE й діє як потужний антиоксидант [26, 27]. У великих контрольованих дослідженнях (ALADIN I-III, OPRIL, SYDNEY I-II, NATHAN I-II та ін.) було продемонстровано здатність тіоктової кислоти зменшувати симптоми ДН і покращувати неврологічну функцію [28-37]. У нещодавньому дослідженні Elbadawy та співавт. (2021) у пацієнтів із ЦД 2 та ДН типу пероральна терапія тіоктовою кислотою протягом 3 міс поряд зі зменшенням симптомів нейропатії значно покращувала нервову провідність, сприяла зниженню індексу маси тіла та рівнів глікованого гемоглобіну (HbA1c), покращувала ліпідний профіль [38].
Карнітин – четвертинна амонієва сполука, залучена в енергетичний метаболізм більшості ссавців, рослин і деяких бактерій; в організмі людини міститься майже в кожній клітині [39]. Карнітин існує у двох стереоізомерних формах – D- та L-карнітин. Для людини та тварин лише L-форма є природною, натомість D-форма є токсичною та пригнічує активність L-форми [40]. У клітинах L-карнітин транспортує довголанцюгові жирні кислоти в мітохондрії, де вони перетворюються на енергію. Крім того, L-карнітин разом із тіоктовою кислотою бере участь у синтезі ацетил-КоА, сприяє елімінації продуктів метаболізму з клітин [41, 42].
У двох метааналізах за 2015 та 2017 рр. було підтверджено, що в пацієнтів із ДН застосування ацетил-L-карнітину зменшує біль унаслідок периферичної нейропатії без будь-яких побічних ефектів [43, 44]. У метааналізі 2017 р. також була доведена здатність ацетил-L-карнітину покращувати електроміографічні параметри хворих на ДН [44]. Нещодавній систематичний огляд досліджень за участю пацієнтів із периферичною нейропатією різної етіології показав, що ацетил-L-карнітин значно зменшує біль, покращує нервову провідність і регенерацію нервових волокон і має сприятливий профіль безпеки [45].
Коензим Q10 (убіхінон) – жиророзчинна вітаміноподібна сполука, що входить до складу всіх клітинних мембран людського організму [46, 47]. Коензим Q10 є необхідним для переносу електронів в окисному дихальному ланцюгу мітохондрій і синтезу АТФ. Крім того, коензим Q10 підвищує продукцію ключових антиоксидантів, зменшує перекисне окислення ліпідів, захищає мітохондріальну ДНК від пошкодження [47, 48]. В експериментальному дослідженні на моделі ДН було встановлено, що поєднане застосування коензиму Q10 і тіоктової кислоти синергічно зменшує маркери окислювального стресу та підвищує рівні потужного природного антиоксиданту глутатіону в нейронах дорсальних гангліїв спинного мозку, а також запобігає апоптозу та дегенерації нейронів, імовірно, шляхом покращення синтезу АТФ, регуляції експресії каспази‑3 і білків UCP2 [49].
Слід зазначити, що, хоча тіоктова кислота, карнітин і коензим Q10 синтезуються в організмі людини й частково надходять з їжею, у хворих на ЦД спостерігається дефіцит усіх трьох молекул унаслідок порушеного синтезу, зменшеної абсорбції в кишечнику та/або підвищеної елімінації [50-52]. При цьому позбутися дефіциту за рахунок підвищеного споживання продуктів, багатих на ці речовини, дуже важко. Приміром, 500 мг ацетил-L-карнітину (найнижча добова доза, котра продемонструвала ефективність у клінічних дослідженнях у пацієнтів із периферичною нейропатією) міститься приблизно в 0,4 кг червоного м’яса (приготованого) чи 10 л цільного молока [39]. Щоденне надходження коензиму Q10 при звичайному харчуванні становить лише 3-6 мг (здебільшого з м’ясом і рибою) [53], що на порядок менше клінічно застосовуваних доз. Уміст тіоктової кислоти в раціоні вивчався мало, але відомо, що в продуктах із найвищим умістом (печінка, серце) її концентрація становить лише 1-3 мкг/г сухої речовини [54] (тоді як у клінічних дослідженнях застосовувалися дози >600 мг/добу). Відтак, для відновлення рівнів цих речовин, а також із метою впливу на основні патогенетичні механізми периферичної нейропатії доцільно використовувати відповідні засоби.
Для пацієнтів із ДН спеціально розроблено засіб Тіокт Q10® (Acino, Швейцарія) – фіксована комбінація тіоктової кислоти (800 мг), ацетил-L-карнітину (500 мг) і коензиму Q10 (25 мг) [55]. Тіокт Q10® має зручну форму випуску (саше) та виготовлений за інноваційною технологією M.A.T.R.I.S®, яка забезпечує контрольоване вивільнення, високу біодоступність і тривале збереження концентрацій активних речовин у крові протягом 8 год [56]. Рекомендована доза Тіокту Q10 у дорослих становить 1 саше на добу (вміст саше слід розчини в склянці рідини), тривалість уживання визначається лікарем індивідуально [55].
Cписок літератури знаходиться в редакції.
Підготував Олексій Терещенко
UA-TIOK-PUB-042021-033
Медична газета «Здоров’я України 21 сторіччя» № 6 (499), 2021 р.