24 лютого, 2021
Холіну альфосцерат: сучасне підтвердження ефективності традиційної терапії
Терапія холінергічними попередниками є традиційним підходом до лікування холінергічної дисфункції та когнітивного дефіциту при розвитку деменції. Це стосується, зокрема, й холіну альфосцерату. До вашої уваги представлено огляд статті F. De Negri, опублікованої у виданні Rivista Società Italiana di Medicina Generale (2020; 5 (27): 64‑69), в якій проаналізовано отримані нещодавно дані на підтримку клінічної ефективності та сприятливої переносимості ГФХ.
На рівні мозку холінергічна система бере участь у критичних фізіологічних процесах, таких як увага, навчання, пам’ять, реакція на стрес, ритм сну і неспання та сенсорна інформація (Ferreira-Vieira et al., 2016). Зміни холінергічної функції пов’язані з патогенезом мозкових змін, які виникають при багатьох формах деменції, зокрема хворобі Альцгеймера (ХА) (Bartus et al., 1982; Muir, 1997; Stanciu et al., 2019). Дослідження головного мозку пацієнтів із ХА показали помітну втрату ферменту холін-ацетилтрансферази, що залучена у синтез ацетилхоліну, і нікотинових холінергічних рецепторів (Ferreira-Vieira et al., 2016; Bartus et al., 1982; Muir, 1997; Stanciu et al., 2019).
Анатомічним підґрунтям холінергічного дефіциту є атрофія та дегенерація підкіркових холінергічних нейронів, зокрема тих, що лежать в основній лобовій частці (крупноклітинне базальне ядро Мейнерта) та забезпечують холінергічну іннервацію кори. Отже, селективний дефіцит ацетилхоліну за ХА та спостереження, що центральні холіноблокатори, такі як атропін, можуть призвести до сплутаності свідомості, схожої на прояви деменції при ХА, сприяли появі холінергічної гіпотези про те, що дефіцит ацетилхоліну є критично важливим для розвитку ХА та інших форм деменції (Ferreira-Vieira et al., 2016; Bartus et al., 1982; Muir, 1997; Stanciu et al., 2019).
Холін і холін-вмісний фосфоліпід фосфатидилхолін є важливими для підтримання цілісності та структури клітинної мембрани. Холін також необхідний для транспортування жирів у/з клітини і є попередником ацетилхоліну. Вважається, що холін є однією з основних поживних речовин, необхідних для оптимальної когнітивної функції (Traini et al., 2013; Bekdash, 2019).
На фармацевтичному ринку доступний L-α-гліцерофосфорилхолін (ГФХ) (рис. 1), ефективність якого було нещодавно оцінено як у доклінічних, так і клінічних випробуваннях (Traini et al., 2013; Scapicchio 2013; Carotenuto et al., 2017; Traini et al., 2020; Salvadori et al., 2020).
За деякими доказами, накопиченими останніми роками, ГФХ може підвищувати біодоступність холіну, а отже, синтезу ацетилхоліну на нейрональному рівні. Це сприяє поліпшенню фізичної форми людини, збереженню швидкості реакції після фізичних вправ та підвищенню пікової сили м’язів під час ізометричних вправ (Bellar et al., 2015). Наразі не з’ясовано, чи може це бути корисним для протидії саркопенії та зниженню фізичної сили, зумовленої старінням, що значною мірою зумовлює слабкість осіб похилого віку.
Результати нещодавніх досліджень на тваринах також дозволяють припустити, що ГФХ може зменшувати інтенсивність процесів старіння через:
- захисний ефект щодо судин головного мозку, зокрема завдяки впливу на запальні явища, пов’язані з процесом ішемії/реперфузії (Tayebati et al., 2015; Tоkés et al., 2015);
- сприяння нейрогенезу гіпокампа, що забезпечує захист від спричиненої судомами загибелі нейронів та подальших когнітивних порушень (Lee et al., 2017);
- ефект зменшення відкладення в мозку транстиретину – амілоїдогенного білка, здатного активувати мікроглію та викликати нейрозапалення (Matsubara et al., 2018);
- гальмування розвитку остеоартриту (Matsubara et al., 2018);
- збереження експресії в мозку деяких генів, пов’язаних з явищами тривалого потенціювання, що необхідні для розвитку пам’яті та здатності до навчання (Narukawa et al., 2020).
Ці результати доповнюють доклінічні дослідження 90-х та пізніших років, які показали, що ГФХ здатний полегшити запам’ятовування й навчання, позитивно впливати на механізми трансдукції в мозку та зменшувати вікові структурні зміни в лобовій корі й гіпокампі (Traini et al., 2013; Scapicchio 2013).
Фармакокінетика
Кінетику та метаболізм ГФХ оцінювали в дослідженнях на тваринах та випробуваннях за участю пацієнтів. Щурам вводили ГФХ, мічений 14C, внутрішньовенно та перорально, який гідролізується фосфодіестеразою слизової оболонки кишечника. Концентрація ГФХ вища у печінці, нирках, легенях та селезінці, ніж у крові; в мозку вона така сама або трохи нижча. Після перфузії головного мозку ГФХ метаболізується до холіну (та двох інших метаболітів), який включається до складу фосфоліпідів мозку (Abbiati et al., 1993).
У людей при внутрішньом’язовому введенні ГФХ у дозі 1 г рівень холіну в плазмі сягає Cmax 35,1 мкМ через 30 хв, а потім зменшується з періодом напіввиведення близько 2 год і повертається до вихідних значень через 6‑8 год (Fossati et al., 1994). При пероральному прийманні ГФХ гідролізується в кишківнику до холіну, який повністю всмоктується (Tmax становить приблизно 3,5‑4 год, період напіввиведення – орієнтовно 5‑7 год) (Kang et al., 2010; Min et al., 2019).
Із додатковими даними щод кінетики холіну та його метаболітів в організмі людини можна ознайомитися в останній роботі MoÖdinger et al. (2019).
Дослідження за участю пацієнтів
Як уже зазначалося, ацетилхолін відіграє важливу роль у когнітивних процесах, а холінергічна система є важливим фактором за багатьох форм деменції, включно із ХА (Ferreira-Vieira et al., 2016; Muir 1997; Stanciu et al., 2019; Amenta, Tayebati, 2008). Тому препарати, що діють на холінергічну систему, є перспективним терапевтичним варіантом для лікування пацієнтів із ХА.
Першими холінергічними препаратами були холінергічні попередники, такі як холін (або цитиколін) та ГФХ (Traini et al., 2013; Scapicchio 2013). Також це інгібітори холінестерази (донепезил, галантамін, ривастигмін) (Marucci et al., 2020) та агоністи рецепторів ацетилхоліну М1 (наприклад, ксаномелін) (Scarpa et al., 2020). Нещодавно було висунуто гіпотезу про користь ліків, дія яких спрямована на транспортер високоафінного холіну CHT1 (Ferreira-Vieira et al., 2016), і мемантину, неконкурентного антагоніста N-метил-D-аспартатних рецепторів, що здатний захищати холінергічні нейрони від ексайтотоксичної деструкції (Kabir et al., 2019).
Попри наявність нових препаратів, що діють на холінергічну систему, останніми роками науковий світ приділяє значну увагу застосуванню ГФХ для лікування ХА та інших форм деменції, зокрема судинного походження. Автор зазначає, що ГФХ як холінергічний попередник здатний гарантувати більшу концентрацію холіну в плазмі крові (Gatti et al., 1992) та підвищену активність щодо пам’яті й когнітивних параметрів (Muratorio et al., 1992) порівняно з цитиколіном.
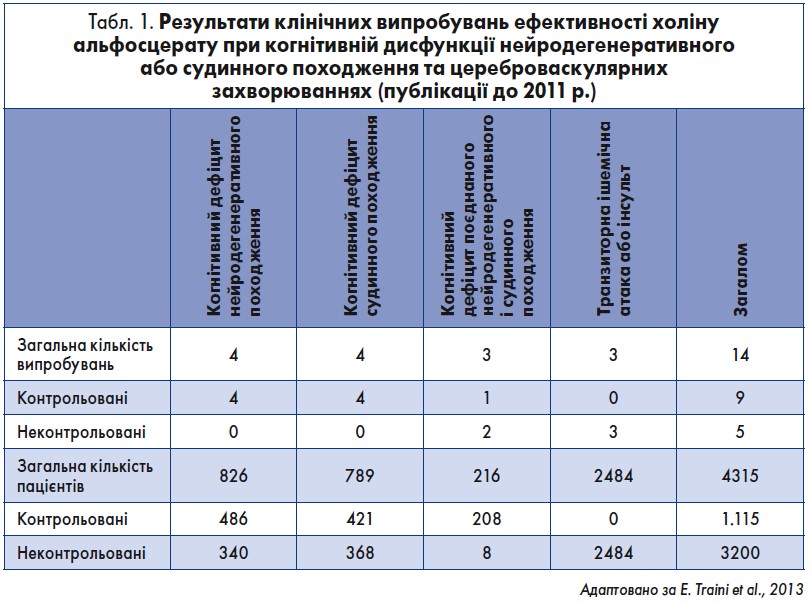
Дані численних клінічних досліджень продемонстрували ефективність ГФХ при деменції. У випробуваннях, результати яких опубліковані до 2001 р., було обстежено 1570 пацієнтів, 854 з яких брали участь у контрольованих дослідженнях (табл. 1) (Traini et al., 2013; Pametti et al., 2001). Хворі страждали на деменцію дегенеративного, судинного або комбінованого походження (деменція типу Альцгеймера, судинна деменція та гострі цереброваскулярні захворювання – транзиторна ішемічна атака чи інсульт).
Загалом було проаналізовано дані 565 пацієнтів із когнітивними порушеннями дегенеративного походження легкого та середнього ступеня. У трьох однорідних клінічних дослідженнях оцінювали 186 хворих, тоді як у трьох комбінованих – 379 пацієнтів із дегенеративною деменцією. У чотирьох випробуваннях ГФХ застосовували перорально у дозі 1200 мг/добу (466 осіб отримували лікування протягом 6 місяців та 39 – 3 місяців). В інших дослідженнях препарат вводили внутрішньом’язово у дозі 1000 мг/добу. Тривалість лікування становила 3 або 6 місяців для перорального приймання та 3 місяці для парентерального введення. Отримані результати підтвердили, що ГФХ поліпшував клінічний стан пацієнтів, зокрема пам’ять та увагу.
Ефективність ГФХ також вивчали у 789 пацієнтів із когнітивними порушеннями судинного ґенезу. У трьох однорідних та трьох об’єднаних клінічних дослідженнях оцінювали 408 і 381 хворого на судинну деменцію. У чотирьох випробуваннях ГФХ використовували перорально у дозі 1200 мг/добу протягом 3 або 6 місяців, тоді як в інших трьох – внутрішньом’язово в дозі 1000 мг/добу впродовж 3 місяців.
Подібно до результатів, що спостерігалися при дегенеративних розладах, у всіх дослідженнях когнітивних порушень судинного походження лікування ГФХ сприяло поліпшенню пам’яті й уваги, зменшувало прояви афективних та соматичних розладів (стомлюваність, запаморочення). Ефекти ГФХ були значуще більшими, ніж плацебо, а також подібними до ефектів референтних препаратів (або перевершували їх).
Що стосується клінічних випробувань за останні 10 років, то в одному дослідженні оцінювали стан 261 пацієнта (132 осіб, що протягом 180 днів отримували ГФХ у дозі 1200 мг/добу, і 129 – групи плацебо) з деменцією Альцгеймера легкого та середнього ступеня тяжкості (De Jesus Moreno, 2003). У хворих, які отримували активне лікування, середнє зниження показників за шкалою оцінки хвороби Альцгеймера (ADAS), підшкалою пізнання (Cog) становило 2,42 бала впродовж 90 днів терапії та 3,2 бала наприкінці дослідження (180-й день). У пацієнтів групи плацебо спостерігали помітне середнє збільшення оцінки за ADAS-Cog на 0,36 бала через 90 днів та на 2,90 бала через 180 днів (p<0,001 порівняно з вихідним рівнем). Інші оцінені параметри, як-от показники за короткою шкалою оцінки психічного статусу (MMSE), шкалою погіршення загального стану (GDS), підшкалою поведінки ADAS (Behav), загальні бали за ADAS і шкалою загального клінічного враження (CGI), поліпшилися через 90 та 180 днів від вихідного рівня, тоді як у групі плацебо вони залишалися незмінними або погіршувались.
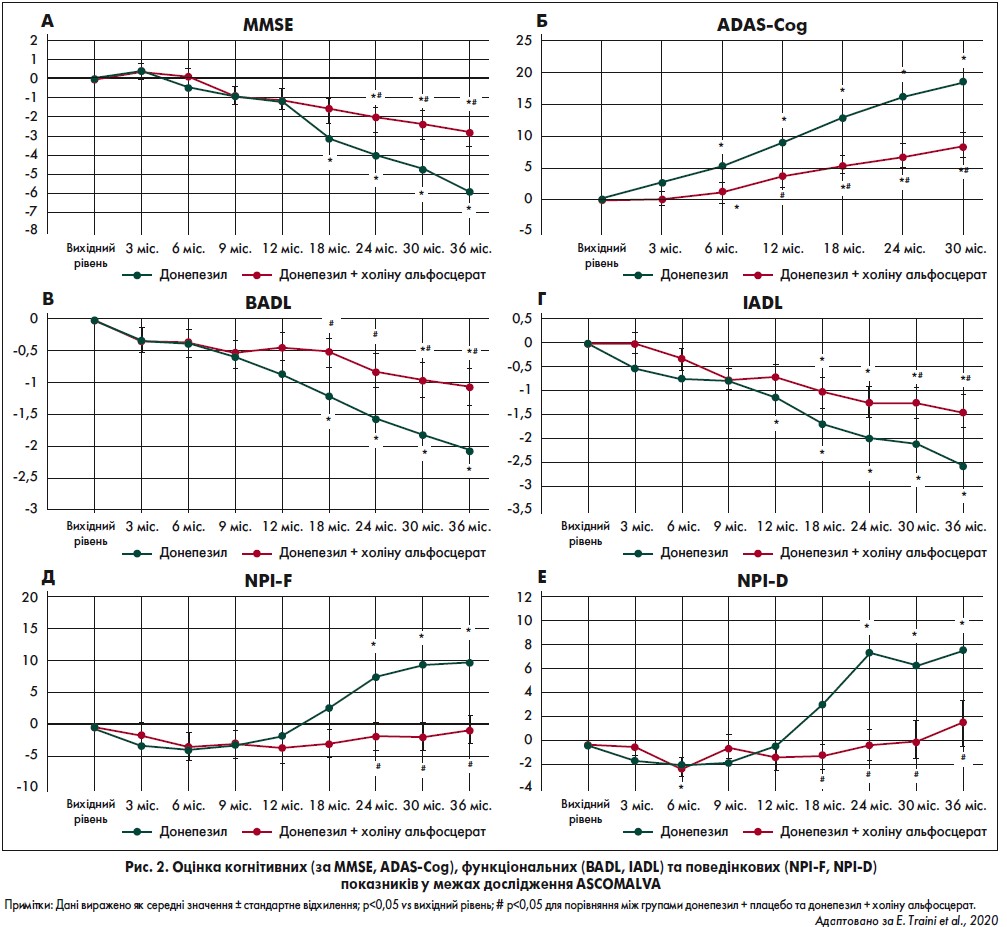
Нещодавно було проведене багатоцентрове рандомізоване подвійне сліпе контрольоване дослідження ASCOMALVA для оцінки зв’язку між ефектом донепезилу в дозі 10 мг/добу та ГФХ по 1200 мг/добу в пацієнтів із ХА легкої та середньої тяжкості. Результати аналізували за показниками MMSE, ADAS-Cog, шкал для оцінки основних видів щоденної активності (BADL) та інструментальної щоденної активності (IADL), а також опитувальника для оцінки нейропсихіатричного стану (NPI) (Amenta et al., 2014; Traini et al., 2020).
Початковий протокол передбачав лікування пацієнтів донепезилом + ГФХ (група терапії Д + ГФХ) або донепезилом + плацебо (контрольна група Д + П) протягом 24 місяців. На основі обнадійливих результатів, отриманих у результаті проміжного аналізу, дослідження було продовжене ще на два роки (Amenta et al., 2014). Наразі доступні попередні дані за три роки (Traini et al., 2020) (рис. 2).
Оцінка когнітивної функції показала значущу різницю між двома досліджуваними стратегіями терапії (Д + ГФХ та Д + П). Зокрема, пацієнти групи Д + П продемонстрували значне погіршення глобальних когнітивних функцій, виміряних за допомогою MMSE та ADAS-Cog порівняно із групою Д + ГФХ, починаючи з 24-го місяця спостереження і до трьох років лікування. Функціональна оцінка показала значущу різницю між двома методами терапії. Зокрема, у групі Д + П мало місце значуще погіршення показників за BADL та IADL, відповідно з 18-го та 30-го місяців спостереження до трьох років лікування, порівняно із групою Д + ГФХ. Результати поведінкової оцінки за шкалою NPI показали значне зниження ступеня тяжкості (NPI-F) та дистресу в доглядальників (NPI-D) для пацієнтів групи Д + ГФХ порівняно із групою Д + П з 24-го місяця спостереження до трьох років лікування.
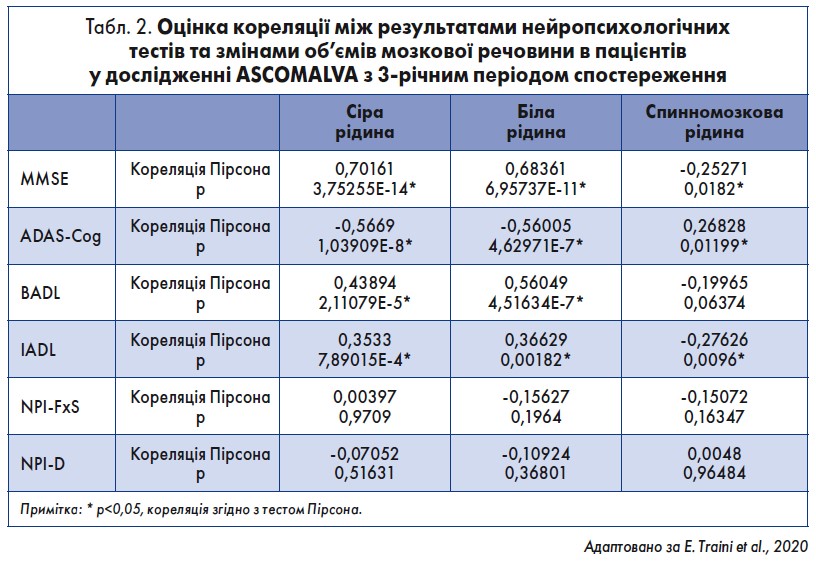
Оцінка об’ємів мозкової речовини за допомогою магнітно-резонансної томографії була доступна у деяких суб’єктів: у 29 пацієнтів групи Д + ГФХ атрофія сірої речовини була менш вираженою, ніж у членів групи Д + П на рівні лобової та скроневої часток, в гіпокампі та мигдалині. Ці морфологічні дані узгоджуються з результатами нейропсихологічних тестів (табл. 2).
Нині триває пілотне одноцентрове подвійне сліпе рандомізоване клінічне випробування CONIVaD, спрямоване на оцінку того, чи є поєднання ГФХ та німодипіну ефективнішим, ніж лише німодипін для зменшення когнітивного зниження у пацієнтів з ішемічною енцефалопатією та когнітивними порушеннями легкого й середнього ступеня (Salvadori et al., 2020).
Що стосується профілю безпеки, доклінічні дослідження вказують на низький рівень токсичності ГФХ (Brownawell et al., 2011). У клінічних умовах було показано, що ГФХ є безпечним лікарським засобом, про побічні ефекти якого повідомлялося рідко протягом близько 30 років клінічного досвіду. Навіть у контрольованих клінічних випробуваннях аналіз побічних реакцій виявив частоту випадків лише трохи вищу, ніж для плацебо: ці явища були легкими та ніколи не потребували переривання лікування. Порівняння безпеки ГФХ та інгібіторів холінестерази виявило більш сприятливий профіль ГФХ (Traini et al., 2013).
Висновки
Як підсумовують автори, з часом було продемонстровано значущу ефективність і хорошу переносимість ГФХ при лікуванні ХА та інших форм деменції, особливо судинного походження. Поновлений останніми роками інтерес і результати поточних та нещодавно завершених досліджень підтверджують, що ГФХ – як у монотерапії, так і в комбінації з іншими препаратами, може являти собою важливий ресурс для лікування клінічних станів, значущість яких зростає зі старінням населення та підвищенням частоти захворюваності.
Підготувала Наталія Купко
Спецвипуск «Інсульт», Додаток до № 1 (56), 2021 р.